Method Article
マウスペイヤーパッチからの胚芽センターB細胞のJH4イントロンにおける体細胞ハイパー突然変異の解析
要約
ここで提示されるアッセイは、マウスペイヤーのパッチから胚中心B細胞を用いた免疫グロブリン重鎖遺伝子遺伝子軌跡内の体細胞過突然変異を定量化するアッセイである。
要約
リンパ器官の胚中心内では、成熟したB細胞は、Ig重鎖および軽鎖遺伝子遺伝子座の可変コードエキソンに未テンプレートの突然変異を導入することによって、発現した免疫グロブリン(Ig)を変化させる。体細胞過突然変異(SHM)のこのプロセスは、デオキシシチジン(C)をデオキシウリジン(U)に変換する酵素活性化誘導シチジンデアミネーアーゼ(AID)を必要とする。AIDによって生成されたU:Gの不一致を塩基切除および不一致修復経路によって突然変異に処理すると、より高い親和性Igを生成する可能性のある新しいIgコード配列が導入されます。 AID またはDNA修復遺伝子の変異は、Ig遺伝子で観察される突然変異の種類をブロックまたは有意に変化させることができる。蛍光活性化細胞分類(FACS)、PCR、およびサンガーシーケンシングを用いたJH4イントロン突然変異を定量化するプロトコルについて説明する。このアッセイはIg親和性成熟を直接測定するわけではないが、Ig可変コード配列における変異を示すものである。さらに、これらの方法は、複数のB細胞クローンのIg配列の変異を分析する一般的な分子生物学技術を利用する。したがって、このアッセイは、SHMおよびIg多様化の研究において非常に貴重なツールである。
概要
B細胞は、適応免疫系のメンバー、免疫グロブリン(Ig)としても知られる抗体を産生することによって抗原を認識および排除する。各Igは、2つの重い(IgH)および2つの軽い(IgL)鎖ポリペプチドから構成され、ジスルフィド結合によって一緒に保持され、Ig1の特徴的な「Y」形状構造を形成する。IgHおよびIgLのN末語は、各ポリペプチドの可変(V)領域を含み、Igの抗原結合部位を形成する一方、IgHの定常領域はIgのエフェクター機能を付与する。骨髄におけるB細胞の開発は、V(D)J組換え2、3、4と呼ばれるプロセスでIgHとIgLのVコードエキソンを再配置する。再結合されたVエキソンの転写は、それぞれの定常領域エキソンと結合して、Igに翻訳されるmRNAを形成する。
膜結合Igを発現する成熟B細胞は、B細胞受容体(BCR)とも呼ばれ、脾臓、リンパ節、またはペイアーのパッチなどの二次リンパ器官に循環し、そこで抗原の環境を調査し、免疫系の他の細胞と相互作用する。二次リンパ管の発芽中心(GC)内では、BCRを介して抗原を認識するB細胞が活性化する。卵胞性樹状細胞および濾胞ヘルパーT細胞によって助けられ、活性化されたB細胞は増殖し、血漿および記憶細胞に分化することができ、これは、堅牢な免疫応答5、6、7、8、9の重要なエフェクターである。さらに、これらの活性化されたB細胞は、二次的Ig遺伝子分散プロセス-クラススイッチ組換え(CSR)および体細胞ハイパー突然変異(SHM)を受けることができる。CSRの間、B細胞はDNA欠失分解反応を通じてIgHポリペプチドのデフォルトμ定常領域(γ、α、ε)を別の定常領域と交換する(図1)。これにより、異なる定数エキソンの発現と新しいIgの翻訳が可能になります。BセルはIgMの発現から別のアイソタイプ(IgG、IgA、IgE)に切り替わります。CSRは、その抗原特異性10、11、12を変化させることなく、Igのエフェクター機能を変化させる。しかし、SHMの間、B細胞はIgHおよびIgLのVコード領域を変異させ、より高い親和性Igsの産生および選択を可能にし、これはより効果的に抗原13、14、15を排除することができる(図1)。重要なことに、CSRとSHMの両方が1つの酵素の機能に依存する:活性化誘導シチジンデアミネーアーゼ(AID)16、17、18。AIDに欠乏するヒトおよびマウスは、CSRまたはSHMを完了できず、IgM血清の上昇または高いIgM17,19と存在する。
CSRでは、AIDは、各定数コーディングエキソンに先行する繰り返しスイッチ領域のデオキシシチジン(C)をデオキシウリジン(U)20、21に変換し、デオキシウリジンとデオキシグアノシン(U:G)の間に不一致の塩基対を生み出します。 DNAの組み換えのために必要とされる、塩基切除修復(BER)またはミスマッチ修復(MMR)経路22、23、24、25、26、27、28、29のいずれかによって。SHMでは、AIDはVコーディングエキソン内でCをデサミする。U:Gミスマッチをまたぐ複製はC:GからT:Aへの遷移変異を生成し、一方、BERタンパク質によるウラシル塩基の除去、ウラシルDNAグリコシラーゼ(UNG)、DNA複製前に、転移および転座突然変異の両方を生成する。UNGのヌル突然変異は、C:G から T:A 遷移変異21,22に有意に増加します。CSR と同様に、SHM は MMR と BER の補完的な役割を必要とします。SHMの間に、MMRはA:T塩基対で突然変異を発生させる。MutS相モロジー2(MSH2)またはDNAポリメラーゼη(Polη)における変異を不活性化すると、MSH2およびPolηにおけるA:T塩基および化合物突然変異における突然変異が有意に減少し、A:T塩基21、30、31の変異が事実上廃止される。AID生成Uを転移または転座突然変異に変換する際のBERおよびMMRの重要な役割と一致して、MSH2およびUNG(MSH2-/-UNG--)の両方に欠損したマウスは、U:Gミスマッチ21全体の複製に起因するC:GからT:Aへの遷移突然変異のみを表示する。
Vコード領域におけるSHMの分析は、B細胞の開発がIgHおよびIgL loci 1、2、4のエキソンをコーディングするV(D)Jのいずれかを再結合することができるので、依然として複雑なままである。これらの一意に再結合および体細胞的に変異したV領域の正確な分析は、B細胞またはIg mRNA11,13のクローンの同定および単離を必要とする。IgH遺伝子座における最後のJコードエキソンの3'であるJH4イントロンは、Vプロモーター32、33、34の突然変異3'の広がりに起因する体細胞突然変異を抱えており、V領域31、35(図1)におけるSHMの代理マーカーとして頻繁に使用される。特定の遺伝子または遺伝子変異がSHMパターンまたは速度をどのように変化させるかを実験的に解明するために、JH4イントロンは、SHM36、37、38の高率を受けるペイアーのパッチ(PP)胚中心B細胞(GCBC)から配列決定することができる。GCBCは、細胞表面マーカー(B220+PNAHI)17,39に対する蛍光結合抗体で容易に同定および単離することができる。
FACS(蛍光活性化細胞分類)、PCR、およびサンガーシーケンシングの組み合わせを用いてマウスからPP GCBCのJH4イントロン突然変異を特徴付ける詳細なプロトコルが提示される(図2)。
プロトコル
全ての変異マウスをC57BL/6バックグラウンドで維持した。年齢一致(生後2〜5ヶ月)の雄マウスと雌マウスを全ての実験に使用した。ニューヨーク市立動物保護使用委員会が承認したプロトコルに従って、マウスの夫と実験を行った。
1. ペイヤーのパッチの解剖
- マウスを3 L/minで100%CO2で5分間安楽死させ、続いて子宮頸部脱臼して死亡を確認する。70%エタノールで解剖ツール(はさみ、鉗子、細かい鉗子)と手袋をした手を殺菌します。
- 腹部を露出した状態で解剖パッドの上にマウスを置きます。切開を行う前に、マウスの本体に70%エタノールを惜しみなくスプレーして、解剖領域を殺菌します。
- 腹部を横切って皮膚に切開し、鉗子(または殺菌された手袋をした手)を使用して頭と尾に向かって切開の両側を同時に引っ張ることによって腹部から皮膚を取り除きます。
- マウスの前部および後肢を固定します。
- 腹腔をはさみで切り、内臓を露出させます。
- 胃とcaecumの間の小腸を見つける (「J」は結腸の近くの形の構造)。胃の下とケカムの上に切断することによって小腸を除去します。
- 小腸のひだを結ぶ結合組織と脂肪を取り除きます。
注:脂肪は小腸のピンク色とは異なり、特徴的な白色になります。 - 半透明の上皮細胞の薄い層の下に白く見える小さな(約1mm)の楕円形の構造であるペイヤーのパッチ(PP)について、小腸の外表面を調べます。
- 注意深くはさみですべての目に見えるPPを切除します。
注: 1 つの C57BL/6 ワイルド タイプ(WT)マウスは 4~8 個の P を生成できますが、AID-/-マウスには 6~10 個の PP があります。 - 氷上のFACSバッファーの1 mLを含む1.5 mLマイクロ遠心チューブにPを収集します。
注:PPは沈む必要がありますが、脂肪は表面に浮かんで取り除くことができます。
2. FACS のセル分離
- 40 μm フィルターを、1 mL のコールド(4 °C)FACS バッファーを備えた 6 ウェル皿に入れます。
- 1.5 mLチューブからフィルターにPPを注ぎます。
- 1 mLのコールド FACS バッファで PP を洗浄し、常に液体と氷の上に置いてください。
- 1 mL シリンジからのプランジャーの平らな端を、フィルターに結合組織が残るまでフィルターの PP を押しつぶす害虫として使用します。
- フィルターとプランジャーを1 mLのコールドFACSバッファーで洗浄し、細胞を6ウェルディッシュに放出します。
- 冷たいFACSバッファー内の細胞の〜4 mLを収集し、40 μmストレーナーキャップFACSチューブを介してそれらをフィルタリングします。
- 1 mLの冷たいFACSバッファーでストレーナーキャップを洗います。
- 4 °Cで 600xg の細胞を5分間振るバケツ遠心分離機でペレット。
- 上清をデカントします。
- 冷たいFACSバッファの0.4 mLで細胞を再中断します。
- セルカウント用に10 μLを取り外して収量を確認します(期待〜5 x 106 セル/マウス、 図3Aを参照)
- 残りの細胞を40 μmのストレーナーキャップを通してFACSチューブにフィルターし、FACSの染色に進みます。
3. FACS 用の GCB を染色する
- 400 μL のセルサスペンションに 1 μL Fc ブロック(ラベルなしのアンチマウス CD16/CD32)を加え、細胞を氷の上に15分間置きます。
- 細胞を洗浄するために2 mLの冷たいFACSバッファーを加えます。
- ペレット細胞は4°Cで 600xg で5分間、上清を捨てます。
- 80 μL のコールド FACS バッファでセルを再サスペンドします。
- 各染色コントロール(3つの単染色コントロールと1つの未染色コントロールを含む合計4)のWT PPから細胞の10 μLを取り除きます。次のステップのためにWT PPの40 μLを残して下さ。または、染色コントロールに補償ビーズを使用します。
- 2.5 μLのピーナッツ凝集剤(PNA)-ビオチンを氷上で15分間、500 μLの冷たいFACSバッファーに、各実験サンプル(WTおよびAID-/--)を染色します。
- 細胞を洗浄するために2 mLの冷たいFACSバッファーを加えます。
- ペレット細胞は4°Cで 600xg で5分間、上清を捨てます。
- 各実験サンプルを暗い中で500μLのカクテルを、氷の上で、15分間染色 する(表1)。 染色カクテルで細胞が完全に再懸濁されていることを確認します。
- 報酬マトリックス用の単一の汚れコントロールを準備します。
- 表2に指定した希釈液を用いて、500μLの冷たいFACSバッファで細胞を染色する。
- 暗闇の中で、氷の上で15分間染色コントロールをインキュベートします。
- ステップ3.7および3.8の全ての管に2mL冷たいFACSバッファーを加え、細胞をペレットにし、上清を捨てて非結合抗体またはDAPIを洗い流す。
- 500 μL のコールド FACS バッファーで細胞を再懸濁し、氷の上に置きます。
- 細胞選別機を用いて、染色された実験試料のそれぞれからB220+PNAHIを採取する。図 3Bは、WT およびAID-/- PP から取得した B220+ PNAHIの典型的なパーセンテージを示しています。
4. GCBCからのDNA抽出
- ペレットは4°Cで 600xg で細胞を5分間並べ替え、上清を捨てます。
- 1 mLのコールドFACSバッファーで細胞を再懸濁し、細胞を1.5 mLマイクロ遠心分離チューブに移します。
- 細胞を4°Cで 600xg で5分間ペレットし、上清を捨てます。
- DNA抽出バッファー 500 μL、20 mg/mL プロテイナーゼ K 5 μL で細胞を再懸濁します。
- 一晩で56°Cでインキュベートする。
- 500 μL イソプロパノールと 20 mg/mL グリコーゲンの 1 μL を用いて DNA を沈殿させます。5-6倍を反転してチューブを完全に混ぜます。
- 室温で10分間インキュベートします。
- 21,000 x gで25°Cで15分間、マイクロ遠心分離機に遠心分離機.
- 上清を捨てて、沈殿したDNAとグリコーゲンを含むペレットを保持します。
- 70%エタノールの1 mLでDNAペレットを洗浄します。
- 21,000 x gで25°Cで10分間マイクロ遠心分離機中のDNAをペレット にした。
- 70%エタノールを取り除き、5〜10分間DNAペレットを空気乾燥させます。
注:DNAが完全に水分補給されない可能性があるため、過度に乾燥しないようにしてください。
- 30 μL の TE バッファーで DNA を再懸濁し、56 °C で一晩インキュベートします。
5. JH4イントロン配列増幅・解析
- 波長260nm(A260)で吸光度を測定してDNAを定量化します。
注:C57BL/6マウスのソートされたB220+PNAHI GCBから回収されたDNAの典型的な濃度は20-40 ng/μLです。 - JH4イントロンのネストされたPCRを実行する(表3、表4)。最初の PCR で使用されるゲノム DNA の総量を最小濃度のサンプルに正規化します。(例えば、最も濃縮されていないサンプルが5 ng/μLの場合、PCR#1の最大水量(11.75 μL)内のすべてのサンプルに58.75 ngのDNAを使用します)。
- 200 Vで1.5%アガロースゲルでPCR産物を20分間解決します。期待されるアンプリコンサイズは580 bpです。
- アンプリコンをゲルから切り出し、メーカーの指示に従ってゲル抽出キットを使用してDNAを抽出します( 補足図1を参照)。
- 30μLの水でDNAを溶出し、A260を測定してDNAの量を定量化します。
注:精製PCR産物の典型的な濃度は3-10 ng/μLです。
- 30μLの水でDNAを溶出し、A260を測定してDNAの量を定量化します。
- 精製した PCR 産物を鈍い端を持つプラスミドにリゲートします。すべてのライゲーション反応に使用されるPCR産物の総量を標準化する(表5)。
- 16°Cで5分間または一晩室温でライゲーション反応をインキュベートする。
- 2 μLのライゲーション反応で、電気コンピテント細菌細胞を変換します。
- 1.65 kVで電気ポレート。
- 225 rpmで揺れインキュベーターで37°Cで1時間、SOC培地600μLで救助を行います。
- 100 μLの形質転換菌をLBにアンピシリン(100 μg/mL)寒天プレートを加え、37°Cで一晩インキュベートします。
- T7フォワードプライマーを使用してサンガーシーケンシングのための細菌コロニーのプレートを提出します。あるいは、各細菌コロニーの一晩培養物を増殖し、プラスミド精製を行う。
- 必要に応じて、PCR、ライゲーション、および/または変換を繰り返して細菌コロニーの収率を最適化します。
注:各プレートから最低30個のコロニーを選ぶべきです。
- 必要に応じて、PCR、ライゲーション、および/または変換を繰り返して細菌コロニーの収率を最適化します。
- .txt ファイル内のシーケンス データを標準化する
- プラスミドシーケンスを削除します。
- JH4 intronのリファレンスシーケンス(NG_005838)に従って、すべてのシーケンスが5'から3'に向かっていることを確認してください。必要に応じて、任意のシーケンスの逆補を生成します。
- Clustal Ω ソフトウェアを使用して、各 PCR について得られた配列を JH4 イントロン参照シーケンス (NG_005838) に合わせます (図 4A)。
- 参照シーケンスとの違いを突然変異として識別する
- サンガーシーケンシングの電解を調べることにより、すべての突然変異が真の点突然変異であることを確認します。必要に応じて、シーケンスを繰り返します。(図4B,C)。
- JH4イントロンの遺伝子型ごとに、ユニークな変異を表並図および定量化する(図5)。
- 同一の変異を持つシーケンスを 1 回だけカウントする
注: PCR 中に同一のシーケンスが生成されたのか、異なる B 細胞の同一の SHM イベントが生成されたのかを判断することはできません。 - WT生殖細胞系列JH4イントロン配列(すなわち、変異を持たないもの)の全てのインスタンスを、ユニークな配列として数える。
- 同一の変異を持つシーケンスを 1 回だけカウントする
結果
フローサイトメトリー
成熟したB細胞は、彼らが親和性成熟、クローン拡張、および血漿または記憶細胞40、41、42、43、44への分化を受ける発芽中心に循環する。これらのGCBCは、CD45R/B220受容体の高発現およびピーナッツ凝集(PNA)45、46の結合を含む多数の細胞表面マーカーによって同定することができる。活性化されたGCBCを単離するために、PP細胞をフィコエリスリン(PE)およびビオチン化PNAに結合した抗B220抗体で染色し、続いてAPC-eFluor780に結合したストレプトアビジンを染色した。死細胞は、蛍光4',6-ディアミディノ-2-フェニリンドール(DAPI)色素を用いて除去し、これは死細胞または死細胞47、48の核酸を染色する。染色された細胞を、その後、フローサイトメトリーを介して分析し、選別した。P は、約 80% B220+セル49,50から構成されていました。WT P には、マウスあたり平均 4 x 106 個のセルが含まれています (図 3A)。WT PP細胞の約8%がB220+PNAHIであり、これはAID-/ - (図3B)で観察された数の半分である。したがって、0.3-0.6 x 106 B220+PNAHI GCBCsは、JH4イントロンの変異を分析するのに十分であった分類後に得られた。
JH4シーケンス解析
JH4イントロンは、一般的なVHJ558ファミリープライマー(J558FR3FwおよびVHJ558.2)を用いたネストPCRによって増幅され、次いでプライマーVHJ558.3およびVHJJ558.35,37に及ぶJH4イントロンが続いた。WT GCBCから得られた105個のユニーク配列のうち、合計226個の変異が見つかった(図5A)。WTマウスにおけるGCBC突然変異スペクトルの分析は、4 x10-3突然変異/bpの割合で遷移および転換の範囲を示し、これは突然変異塩基の総数を配列32、36、37、38の塩基の総数で割って計算した。さらに、WT GCBCsの各JH4 PCR産物には1〜25個の変異が含まれていた(図5B)、1つの配列33、36に複数の突然変異が頻繁に見つかった。113AID-/-配列で同定された変異は2つだけである(図5A)。AID-/- B細胞は、WT B細胞(p<0.05)36より有意に低かった1.66 x10-5突然変異/bpを示し、高忠実度ポリメラーゼ(5.3 x 10-7サブ/ベース/倍増)51,52の誤差率と比較する。従って、AID-/-B細胞は、このアッセイに有用な陰性対照として役立った。
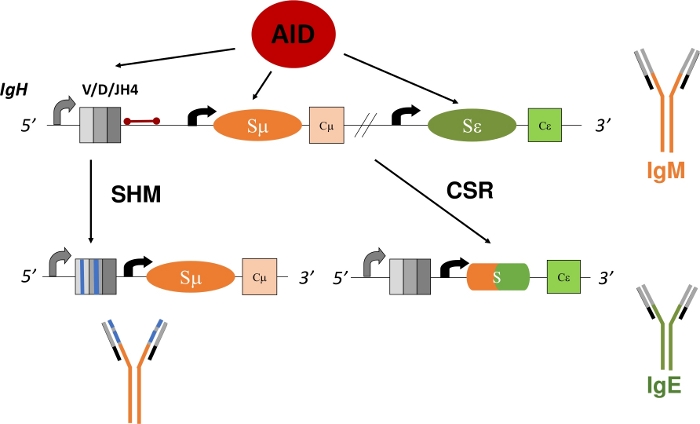
図1:CSRおよびSHM中の IgH 遺伝子遺伝子座及びAIDが標的とする領域の概略図赤色のバーは、VDJH4の3'の580 bp JH4イントロンを示し、このプロトコルで分析されます。CSRにおいて、イントロニックスイッチ領域(SμおよびSε)のAID依存的脱アミノ化は、欠失組換えおよび新しい抗体アイソタイプ(IgM〜IgE)の発現を可能にするDSB形成を促進する。SHMの間に、V領域(灰色の箱)は、より高い親和性Igにつながる可能性のある突然変異(青い線)を蓄積する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
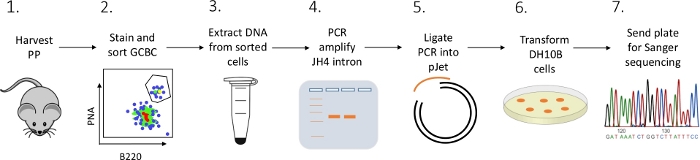
図2:Pから分離されたGCBCにおけるJH4イントロンのSHMを解析するワークフローこの図の大きなバージョンを表示するには、ここをクリックしてください。
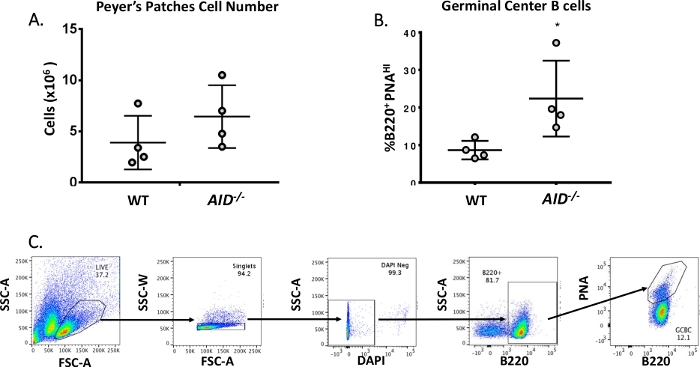
図 3: PP GCBCs の特性(A) WTおよびAID-/-マウスからのPP細胞の総数 (n = 遺伝子型あたり 4)。 誤差範囲は平均からの標準偏差を表します。(B) WTおよびAID--マウスのPから得られたB220+PNAHI GCBCの割合(n =遺伝子型あたり4)36. エラー バーは、学生の t 検定を使用した平均 *p<0.05 からの標準偏差を表します。(C) 代表的な FACS プロットは、PPs から B220+PNAHI GCBCs を並べ替える.こちらをクリックして、この図の大きなバージョンを表示してください。
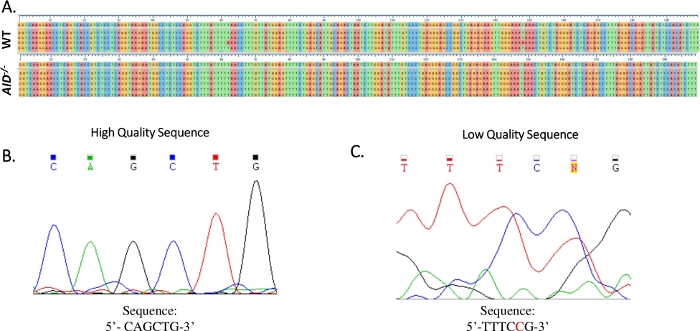
図4:JH4サンガーシーケンスデータの解析(A)WT(上)およびAID-/-(下部)GCBCから参照ゲノムシーケンス(NG_005838)までのJH4 PCR産物のサンガー配列データのサンプル配列アライメント(NG_005838)は、番号付きティックマークのすぐ下のシーケンスである。 アライメントは、クルースカルオメガを使用して生成されました。(B)各ベースの異なるピークを表示した高品質のサンガーシーケンスデータのエレクトロフェログラム。(C)低品質のシーケンスデータの電解電解、曖昧なピークと不特定の塩基(N)を示した。赤で示されるヌクレオチドは、シーケンステキストファイル内で手動でアコード化する必要があります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
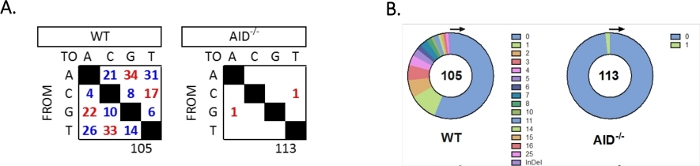
図5:WTおよびAID-/-GCBCsにおけるJH4イントロンにおける突然変異の解析(A)各遺伝子型のA、C、G、およびT塩基における遷移(赤)および転移(青)突然変異の総数を表に要約する。分析されたシーケンスの総数は、表の下に示されています。(B) 各遺伝子型のPCRアンプリコンあたりの突然変異数は円グラフに示されている。この図は、36著作権2020から変更されています。米国免疫学者協会は、この図のより大きなバージョンを表示するには、ここをクリックしてください。
| GCBCのための染色カクテル | 容積:500 μL | ||
| 抗体または色素 | フルオロフォア | 希釈 | μL |
| B220 | PE | 1000 | 0.5 |
| ストレプトアビジン | APC-eFluor780 | 500 | 1 |
| ダピス | 該当する | 500 | 1 |
表1:GCBC用の染色カクテル 指定された希釈液で示された抗体または色素(イタリック体で示される)のカクテルを、フローサイトメトリー用に500μLのPP細胞を染色するために使用した。
| 補償のための単一の汚れ | 容積:500 μL | ||
| 抗体または色素 | フルオロフォア | 希釈 | μL |
| B220 | PE | 1000 | 0.5 |
| B220 | APC-eFluor780 | 750 | 0.67 |
| ダピス | 該当する | 500 | 1 |
表2:補償のための単一の汚れコントロール。 示されたフルオロフォアに結合したB220抗体は、スペクトルの重複を補償するために単染色制御に使用した。
| PCR #1 | ||||
| 試薬 | 容積 | サーモサイクラー条件 | ||
| 5x バッファ | 4 μL | 1 | 95°C | 3分 |
| 10 mM dNTP | 2 μL | 2 | 94°C | 30秒 |
| 10 μM J558FR3Fw | 1 μL | 3 | 55°C | 30秒 |
| 10 μM VHJ558.2 | 1 μL | 4 | 72°C | 1:30分 |
| 高忠実度DNAポリメラーゼ | 0.25 μL | サイクル 2-4 9x | ||
| デオキシリボ核酸 | x (最も少ない濃縮サンプルに標準化) | |||
| H2O | 20 μLに | 5 | 72°C | 5分 |
| PCR #2に進む前に、希薄PCR産物1:5 in H2O | ||||
表3:JH4イントロンのネストPCR 第1増幅反応に対するPCR成分およびサーモサイクラー条件。最初のPCR産物1:5を水で希釈し、この希釈液を1μLで2回目のPCRに使用します。
| PCR #2 | ||||
| 試薬 | 容積 | サーモサイクラーの条件#2 | ||
| 5x バッファ | 4 μL | 1 | 94°C | 3分 |
| 10 mM dNTP | 2 μL | 2 | 94°C | 30秒 |
| 10 μM VHJ558.3 | 1 μL | 3 | 55°C | 30秒 |
| 10 μM VHJ558.4 | 1 μL | 4 | 72°C | 30秒 |
| 高忠実度DNAポリメラーゼ | 0.25 μL | サイクル 2-4 21x | ||
| 希釈 PCR#1 | 1 μL | |||
| H2O | 20 μLに | 5 | 72°C | 5分 |
表4:第2PCRのPCR成分およびサーモサイクラー条件
| 試薬 | 容積 |
| 2x バッファ | 10 μL |
| 精製 PCR | x (最も少ない濃縮サンプルに標準化) |
| 鈍い端を持つプラスミド | 1 μL |
| T4 DNAリガーゼ | 1 μL |
| H2O | 20 μLに |
| 16ºCで5分間または一晩部屋の温度でインキュベート | |
表5:ライゲーション反応。 精製されたJH4イントロンPCR産物をプラスミドに結紮するための成分。
| FACS バッファ |
| 56°Cで使用前に1時間熱不活性化したFBS。サプリメントPBS、pH 7.4(ギブコ、#10010049)と熱不活化FBSの2.5%(v/v)4°Cで保管する。 |
| DNA抽出バッファー (100 mM トリス pH 8.0, 0.1 M EDTA, 0.5% (w/v) SDS) |
| 1 MトリスpH 8.0の50 mL、0.5 M EDTAの100mL、20%SDSの12.5 mLを加えます。蒸留水を500mLに加えます。室温で保管してください。 |
| TE バッファ (10 mM トリス pH 8.0、1 mM EDTA) |
| 1 M トリス pH 8.0 の 2.5 mL、0.5 M EDTA の 500 mL を加えます。蒸留水を250mLに加えます。室温で保管してください。 |
表 6: バッファレシピ
| オリゴヌクレオチド一覧 | ||
| J558FR3Fw | 5'-GCCTGACATCTGAGGACTCTCTGC-3' | |
| VHJ558.2 | 5'-CTGGACTTCGGTTGGG-3' | |
| VHJ558.3 | 5'-GGTCAAGGAACCTCAGTCA-3' | |
| VHJ558.4 | 5'-TCTCTAGACAGCAACTAC-3' | |
表7:アッセイに用いられるオリゴヌクレオチド。
補足図1:ステップ5.4の完了後の代表的なアガロースゲル像。JH4イントロンネストPCR産物を1.5%アガロースゲルで分解し、580bpアンプリコンを切除した。WT PPは、WT PP GCBCゲノムDNAが最初のPCRの鋳型として使用されたことを示し、AID--PP GCBCゲノムDNAが最初のPCRの鋳型として使用されたことを示している。ɸは、PCRコントロールがないテンプレートを示し、-アガロースゲルのウェルに何もロードされなくなったを示します。最後の車線は100 bp DNAの梯子を示す。こちらをダウンロードしてください。
ディスカッション
異種B細胞集団のIgHおよびIgLV符号化配列内でSHMを特徴付けるは、各B細胞がV(D)Jの組換え34中にV符号化セグメントを一意に再編成することを考えると、課題を提示する。本論文では、GCBCのJH4イントロンにおける変異を同定する方法について述べている。IgH遺伝子座の最後のJコードセグメントの3'に位置するJH4イントロンは、V領域のSHMの代理として使用される(図1)31、33、34、35。これらのJH4イントロン突然変異をカタログ化し、特定の遺伝子が突然変異の産生またはパターンにどのような影響を与えるかを評価するために、PP GCBCを特異的に分析する。これらの細胞は、腸内微生物叢53による慢性刺激の結果としてJH4イントロン突然変異を蓄積する。さらに、単発マウスのPPsからB220+PNAHI GCBCsは、免疫動物54,55から脾臓GCBCと比較する変異スペクトルを有する。しかし、JH4イントロンの変異は、これらの変異が非コードであるためIg親和性成熟と相関することはできません。
SHMがIgアフィニティーを変化させるかどうかを判断するために、マウスは、CGG(鶏ガンマグロブリン)またはKLH(キーホールリンペットヘモシアニン)56にコンジュゲートNP(4-ヒドロキシ-3-ニトロフェニルアセチル)などの抗原で腹腔内免疫されるべきである。続いて、mRNAを脾臓B220+PNAHI GCBCsから精製して、VH186.2内でSHMを調べることができ、NP-CGGまたはNP-KLH免疫31、57、58、59、60に続いて最も頻繁にNPを認識し、変異するVコーディングエキソンを用いることができる。VH186.2におけるロイシンへのトリプトファン-33の変異は、Ig親和性を最大10倍59,60まで増加させることを特徴としており、したがって、SHMおよびクローン選択が高い親和性Igを生成した1つの指標である。ELISAによるNP7およびNP20特異的血清Ig力素を測定し、免疫の経過過程でIg特異的NP7/NP20比を算出し、V領域17、21、36のSHMから生じるIg親和性成熟も文書化する。これらのアッセイはいずれも、VH186.2コード配列内のSHMをNP特異的Ig親和性成熟の変化と相関させるために使用することができる。
免疫化動物または単免疫動物がVH 186.2またはJH4イントロンのSHMを分析するために使用されるかどうか、GCBCを正確に同定する必要があります。我々は、B220+ PNAHI GCBCsを単離するためのFACSベースのアプローチを提示する。 GL7発現は、リンパ節64、65、66の活性化されたGCBCにおけるPNAを密接に反映している。GCBCsに特異的な抗体マーカーを使用することに加えて、染色カクテルは蛍光の励起を最大化し、蛍光発光のスペクトルオーバーラップを最小限に抑えながらバイオマーカーの検出を行う必要があります。低レベルで発現する抗原は、ロバストな発光蛍光67を有する蛍光体に結合する抗体で検出されるべきである。推奨染色プロトコルは、4つのレーザー(405nm、488nm、561nm、633nm)および12のフィルターを搭載した細胞ソーター上の分析用に最適化されました。ただし、フィルター構成とレーザーの可用性は、サイトメーター間で異なります。試薬と機器の可用性に応じてプロトコルを修正するために、読者は、追加のリソース、オンラインスペクトルビューアと出版された文献67、68、69、70、71、72、73に参照されます。本明細書に記載されているマルチカラー染色プロトコルでは、並べ替えられた細胞集団が蛍光発光の不正確な検出ではなくGCBCであることを保証するために、スペクトル重複の補償が必要です。B220は、PPが特徴的なB220陰性および正の集団(図3C)を有するため、説明されたFACS(表1B)の染色制御として有用な染色制御として機能し、スペクトル重複の適切な補償を可能にする。図 3Cに示す格言戦略をガイドラインとして使用する必要があります。フローサイトメトリープロットは、染色条件やサイトメーターの設定によって異なる場合があります。それにもかかわらず、生細胞の4-10%はB220+PNAHI 35、52でなければなりません。
PP GCBCsのJH4イントロン内のすべての突然変異は、観察された突然変異がPCRまたはシーケンシングのアーティファクトではなく、SHMを真に反映していることを確認するために検証されなければならない。 AID-/- B細胞は、SHM17,19を完了できないため、他の変異型マウスモデルでSHM表現型を調べる際に有用な陰性制御として機能する。 AID-/- GCBCにおけるJH4イントロン突然変異率(1.66x10-5突然変異/bp)20、21、36、37、38、50、74は、高忠実度ポリメラーゼ(5.3x10 -7サブ/ベース/倍増)51、52の誤差率に匹敵する。AID-/-マウスが利用できない場合は、観察された突然変異パターンおよび頻度を公開文献と比較する。IgV領域は、塩基対分裂ごとに10-3-10-4突然変異を蓄積し、これは他の遺伝子遺伝子座遺伝子73、75の突然変異率より約106-倍高い。 結果は、動物76の年齢によって異なる場合があります。あるいは、非GCBCsを示すB220+PNALO細胞は、AID-/-マウス52の不在時に陰性対照として使用され得る。WT GCBCsにおける突然変異頻度が予想よりも低い場合、WT生殖細胞系列JH4イントロニック配列は不釣り合いに表現され得る。この場合、GCBCが適切に染色およびソートされ、PDRがWT生殖細胞系列JH4イントロン汚染から解放されていることを確認してください。さらに、エレクトロフェロググラムの生のシーケンシングデータを十分に分析して、シーケンステキストデータの変異がシーケンシングエラーのアーティファクトではないことを確認する必要があります。たとえば、Sanger シーケンシングの結果が不十分な場合、シーケンス データの信頼性が低下する可能性があります (図 4)。このサンガー配列データの品質管理により、JH4イントロン変異解析の精度と再現性が向上します。
開示事項
著者らは開示するものは何もない。
謝辞
本庄泰樹さんにAID-/-マウスに感謝します。この研究は、国立少数民族健康と健康格差研究所(5G12MD007603)、国立がん研究所(2U54CA132378)、国立総合医学研究所(1SC1GM132035-01)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR 8-tube FLEX-FREE strip, attached clear flat caps, mixed | USA Scientific | 1402-4708 | |
| Ampicillin sodium salt | Fisher | BP1760-5 | |
| APC-eFluor780 anti-CD45R/B220 | eBioscience | 47-0452-80 | clone RA3-6B2 |
| BD FACSAria II | BD | 643186 | four lasers (405nm, 488nm, 561nm, 633nm) and 12 filters (PacBlue (450/50), AmCyan (502LP; 530/30), SSC (488/10), FITC (502LP; 530/30), PerCP-Cy5.5 (655LP; 695/40), PE (585/15), PE-Texas Red (600LP; 610/20), PE-Cy5 (630LP; 670/14), PE-Cy7 (735LP; 780/60), APC (660/20), Alexa700 (710LP; 730/45), APC-Cy7 (755LP; 780/60)) |
| BD slip tip 1mL syringe | Fisher | 14-823-434 | sterile |
| Biotinylated peanut agglutinin (PNA) | Vector Labs | B-1075-5 | |
| C57BL/6J mice | Jackson Laboratories | 664 | |
| Corning Falcon test tube with cell strainer snap cap | Fisher | 08-771-23 | |
| DAPI (4',6-Diamidino-2-Phenylindole, dihydrochloride) | Fisher | D1306 | 0.5 mg/ml |
| dNTP | NEB | N0447L | 10 mM |
| ElectroMAX DH10B competent cells | Fisher | 18-290-015 | |
| Falcon cell strainer 40mm | Fisher | 08-771-1 | |
| Falcon round-bottom polystyrene tubes (FACS tubes) | Fisher | 14-959-5 | |
| Falcon round-bottom polystyrene tubes (capped) | Fisher | 149591A | |
| Fetal bovine serum | R&D Systems (Atlanta Biologicals) | S11150 | |
| Gibco phosphate buffered saline PBS pH 7.4 | Fisher | 10-010-049 | |
| Glycogen | Sigma | 10901393001 | |
| Lasergene Molecular Biology (MegAlign Pro) | DNA Star | version 15 | |
| PE anti-CD45R/B220 | BD | 553090 | clone RA3-6B2 |
| Proteinase K | Fisher | BP1700-100 | |
| Q5 High-Fidelity DNA Polymerase | NEB | M0491L | |
| QIAquick Gel Extraction Kit | Qiagen | 28706 | |
| Seal-Rite 1.5mL microcentrifuge tubes | USA Scientific | 1615-5500 | |
| Streptavidin APC-eFluor 780 Conjugate | eBioscience | 47-4317-82 | |
| T4 DNA ligase | NEB | M020L | |
| Thermo Scientific CloneJET PCR Cloning Kit | ThermoFisher | FERK1231 | |
| Tissue culture plate 6 well | Fisher | 08-772-1B | sterile |
| Unlabeled anti-mouse CD16/CD32 (Fc block), BD | Fisher | BDB553142 | Clone 2.4G2 |
参考文献
- Murphy, K., Weaver, C. . Janeyway's Immunobiology. , (2016).
- Alt, F. W., et al. VDJ recombination. Immunology Today. 13 (8), 306-314 (1992).
- Schatz, D. G., Ji, Y. Recombination centres and the orchestration of V (D) J recombination. Nature Reviews Immunology. 11 (4), 251-263 (2011).
- Oettinger, M. A., Schatz, D. G., Gorka, C., Baltimore, D. RAG-1 and RAG-2, adjacent genes that synergistically activate V (D) J recombination. Science. 248 (4962), 1517-1523 (1990).
- Berek, C., Berger, A., Apel, M. Maturation of the immune response in germinal centers. Cell. 67 (6), 1121-1129 (1991).
- Linterman, M. A., et al. Foxp3+ follicular regulatory T cells control the germinal center response. Nature Medicine. 17 (8), 975 (2011).
- Shulman, Z., et al. T follicular helper cell dynamics in germinal centers. Science. 341 (6146), 673-677 (2013).
- Good-Jacobson, K. L., et al. PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells. Nature Immunology. 11 (6), 535 (2010).
- Kerfoot, S. M., et al. Germinal center B cell and T follicular helper cell development initiates in the interfollicular zone. Immunity. 34 (6), 947-960 (2011).
- Chaudhuri, J., Alt, F. W. Class-switch recombination: interplay of transcription, DNA deamination and DNA repair. Nature Reviews Immunology. 4 (7), 541-552 (2004).
- Alt, F. W., Zhang, Y., Meng, F. L., Guo, C., Schwer, B. Mechanisms of programmed DNA lesions and genomic instability in the immune system. Cell. 152 (3), 417-429 (2013).
- Xu, Z., Zan, H., Pone, E. J., Mai, T., Casali, P. Immunoglobulin class-switch DNA recombination: induction, targeting and beyond. Nature Reviews Immunology. 12 (7), 517-531 (2012).
- Di Noia, J. M., Neuberger, M. S. Molecular mechanisms of antibody somatic hypermutation. Annual Reviews of Biochemistry. 76, 1-22 (2007).
- Peled, J. U., et al. The biochemistry of somatic hypermutation. Annual Review of Immunology. 26, 481-511 (2008).
- Liu, M., Schatz, D. G. Balancing AID and DNA repair during somatic hypermutation. Trends in Immunology. 30 (4), 173-181 (2009).
- Methot, S., Di Noia, J. Molecular Mechanisms of Somatic Hypermutation and Class Switch Recombination. Advances in Immunology. 133, 37-87 (2017).
- Muramatsu, M., et al. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102 (5), 553-563 (2000).
- Petersen-Mahrt, S. K., Harris, R. S., Neuberger, M. S. AID mutates E. coli suggesting a DNA deamination mechanism for antibody diversification. Nature. 418 (6893), 99 (2002).
- Revy, P., et al. Activation-induced cytidine deaminase (AID) deficiency causes the autosomal recessive form of the Hyper-IgM syndrome (HIGM2). Cell. 102 (5), 565-575 (2000).
- Petersen-Mahrt, S. DNA deamination in immunity. Immunological Reviews. 203 (1), 80-97 (2005).
- Rada, C., Di Noia, J. M., Neuberger, M. S. Mismatch recognition and uracil excision provide complementary paths to both Ig switching and the A/T-focused phase of somatic mutation. Molecular Cell. 16 (2), 163-171 (2004).
- Rada, C., et al. Immunoglobulin isotype switching is inhibited and somatic hypermutation perturbed in UNG-deficient mice. Current Biology. 12 (20), 1748-1755 (2002).
- Schrader, C. E., Vardo, J., Stavnezer, J. Role for mismatch repair proteins Msh2, Mlh1, and Pms2 in immunoglobulin class switching shown by sequence analysis of recombination junctions. The Journal of Experimental Medicine. 195 (3), 367-373 (2002).
- Martin, A., et al. Msh2 ATPase activity is essential for somatic hypermutation at AT basepairs and for efficient class switch recombination. The Journal of Experimental Medicine. 198 (8), 1171-1178 (2003).
- Imai, K., et al. Human uracil-DNA glycosylase deficiency associated with profoundly impaired immunoglobulin class-switch recombination. Nature Immunology. 4 (10), 1023-1028 (2003).
- Masani, S., Han, L., Yu, K. Apurinic/apyrimidinic endonuclease 1 is the essential nuclease during immunoglobulin class switch recombination. Molecular and Cellular Biology. 33 (7), 1468-1473 (2013).
- Guikema, J. E., et al. APE1-and APE2-dependent DNA breaks in immunoglobulin class switch recombination. The Journal of Experimental Medicine. 204 (12), 3017-3026 (2007).
- Schrader, C. E., Guikema, J. E., Wu, X., Stavnezer, J. The roles of APE1, APE2, DNA polymerase β and mismatch repair in creating S region DNA breaks during antibody class switch. Philosophical Transactions of the Royal Society B: Biological Sciences. 364 (1517), 645-652 (2009).
- Roa, S., et al. MSH2/MSH6 complex promotes error-free repair of AID-induced dU: G mispairs as well as error-prone hypermutation of A: T sites. PLoS One. 5 (6), 11182 (2010).
- Delbos, F., Aoufouchi, S., Faili, A., Weill, J. C., Reynaud, C. A. DNA polymerase η is the sole contributor of A/T modifications during immunoglobulin gene hypermutation in the mouse. The Journal of Experimental Medicine. 204 (1), 17-23 (2007).
- Maul, R. W., Gearhart, P. J. AID and somatic hypermutation. Advances in Immunology. 105, 159-191 (2010).
- Shen, H. M., Tanaka, A., Bozek, G., Nicolae, D., Storb, U. Somatic hypermutation and class switch recombination in Msh6-/- Ung-/- double-knockout mice. The Journal of Immunology. 177 (8), 5386-5392 (2006).
- Cheng, H. L., et al. Integrity of the AID serine-38 phosphorylation site is critical for class switch recombination and somatic hypermutation in mice. Proceedings of the National Academy of Sciences. 106 (8), 2717-2722 (2009).
- Lebecque, S. G., Gearhart, P. J. Boundaries of somatic mutation in rearranged immunoglobulin genes: 5'boundary is near the promoter, and 3'boundary is approximately 1 kb from V (D) J gene. The Journal of Experimental Medicine. 172 (6), 1717-1727 (1990).
- Jolly, C. J., Klix, N., Neuberger, M. S. Rapid methods for the analysis of immunoglobulin gene hypermutation: application to transgenic and gene targeted mice. Nucleic Acids Research. 25 (10), 1913-1919 (1997).
- Choi, J. E., Matthews, A. J., Michel, G., Vuong, B. Q. AID Phosphorylation Regulates Mismatch Repair-Dependent Class Switch Recombination and Affinity Maturation. The Journal of Immunology. 204 (1), 13-22 (2020).
- McBride, K. M., et al. Regulation of class switch recombination and somatic mutation by AID phosphorylation. The Journal of Experimental Medicine. 205 (11), 2585-2594 (2008).
- Liu, M., et al. Two levels of protection for the B cell genome during somatic hypermutation. Nature. 451 (7180), 841-845 (2008).
- Ross, M., Birbeck, M., Wills, V., Forrester, J., Davis, A. Peanut lectin binding properties of germinal centers of mouse lymphoid tissues. Nature. 284, 364-366 (1980).
- Zhang, J., MacLennan, I. C., Liu, Y. J., Lane, P. J. Is rapid proliferation in B centroblasts linked to somatic mutation in memory B cell clones. Immunology Letters. 18 (4), 297-299 (1988).
- Nieuwenhuis, P., Opstelten, D. Functional anatomy of germinal centers. American Journal of Anatomy. 170 (3), 421-435 (1984).
- Lau, A. W., Brink, R. Selection in the germinal center. Current Opinion in Immunology. 63, 29-34 (2020).
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 30, 429-457 (2012).
- Mesin, L., Ersching, J., Victora, G. D. Germinal center B cell dynamics. Immunity. 45 (3), 471-482 (2016).
- Reichert, R. A., Gallatin, W. M., Weissman, I. L., Butcher, E. C. Germinal center B cells lack homing receptors necessary for normal lymphocyte recirculation. The Journal of Experimental Medicine. 157 (3), 813-827 (1983).
- Rose, M., Birbeck, M., Wills, V., Forrester, J., Davis, A. Peanut lectin binding properties of germinal centers of mouse lymphoid tissues. Nature. 284, 364-366 (1980).
- Hamada, S., Fujita, S. DAPI staining improved for quantitative cytofluorometry. Histochemistry. 79 (2), 219-226 (1983).
- Otto, F. DAPI staining of fixed cells for high-resolution flow cytometry of nuclear DNA. Methods in Cell Biology. 33, 105-110 (1990).
- Butcher, E., et al. Surface phenotype of Peyer's patch germinal center cells: implications for the role of germinal centers in B cell differentiation. The Journal of Immunology. 129 (6), 2698-2707 (1982).
- Rogerson, B. J., Harris, D. P., Swain, S. L., Burgess, D. O. Germinal center B cells in Peyer's patches of aged mice exhibit a normal activation phenotype and highly mutated IgM genes. Mechanisms of Ageing and Development. 124 (2), 155-165 (2003).
- Potapov, V., Ong, J. L. Examining sources of error in PCR by single-molecule sequencing. PloS One. 12 (1), 0169774 (2017).
- Gonzalez-Fernandez, A., Milstein, C. Analysis of somatic hypermutation in mouse Peyer's patches using immunoglobulin kappa light-chain transgenes. Proceedings of the National Academy of Sciences. 90 (21), 9862-9866 (1993).
- Reboldi, A., Cyster, J. G. Peyer's patches: organizing B-cell responses at the intestinal frontier. Immunological Reviews. 271 (1), 230-245 (2016).
- Betz, A. G., Rada, C., Pannell, R., Milstein, C., Neuberger, M. S. Passenger transgenes reveal intrinsic specificity of the antibody hypermutation mechanism: clustering, polarity, and specific hot spots. Proceedings of the National Academy of Sciences. 90 (6), 2385-2388 (1993).
- Rada, C., Gupta, S. K., Gherardi, E., Milstein, C. Mutation and selection during the secondary response to 2-phenyloxazolone. Proceedings of the National Academy of Sciences. 88 (13), 5508-5512 (1991).
- Heise, N., Klein, U. Somatic Hypermutation and Affinity Maturation Analysis Using the 4-Hydroxy-3-Nitrophenyl-Acetyl (NP) System. Methods in Molecular Biology. 1623, 191-208 (2017).
- Smith, F., Cumano, A., Licht, A., Pecht, I., Rajewsky, K. Low affinity of kappa chain bearing (4-hydroxy-3-nitrophenyl) acetyl (NP)-specific antibodies in the primary antibody repertoire of C57BL/6 mice may explain lambda chain dominance in primary anti-NP responses. Molecular Immunology. 22 (10), 1209-1216 (1985).
- Takahashi, Y., Dutta, P. R., Cerasoli, D. M., Kelsoe, G. In situ studies of the primary immune response to (4-hydroxy-3-nitrophenyl) acetyl. V. Affinity maturation develops in two stages of clonal selection. The Journal of Experimental Medicine. 187 (6), 885-895 (1998).
- Allen, D., Simon, T., Sablitzky, F., Rajewsky, K., Cumano, A. Antibody engineering for the analysis of affinity maturation of an anti-hapten response. The EMBO Journal. 7 (7), 1995-2001 (1988).
- Cumano, A., Rajewsky, K. Clonal recruitment and somatic mutation in the generation of immunological memory to the hapten NP. The EMBO Journal. 5 (10), 2459-2468 (1986).
- Smith, K., Nossal, G., Tarlinton, D. M. FAS is highly expressed in the germinal center but is not required for regulation of the B-cell response to antigen. Proceedings of the National Academy of Sciences. 92 (25), 11628-11632 (1995).
- Hao, Z., et al. Fas receptor expression in germinal-center B cells is essential for T and B lymphocyte homeostasis. Immunity. 29 (4), 615-627 (2008).
- Cervenak, L., Magyar, A., Boja, R., László, G. Differential expression of GL7 activation antigen on bone marrow B cell subpopulations and peripheral B cells. Immunology Letters. 78 (2), 89-96 (2001).
- Naito, Y., et al. Germinal center marker GL7 probes activation-dependent repression of N-glycolylneuraminic acid, a sialic acid species involved in the negative modulation of B-cell activation. Molecular and Cellular Biology. 27 (8), 3008-3022 (2007).
- Olson, W. J., et al. Orphan Nuclear Receptor NR2F6 Suppresses T Follicular Helper Cell Accumulation through Regulation of IL-21. Cell Reports. 28 (11), 2878-2891 (2019).
- Dorsett, Y., et al. MicroRNA-155 suppresses activation-induced cytidine deaminase-mediated Myc-Igh translocation. Immunity. 28 (5), 630-638 (2008).
- Goetz, C., Hammerbeck, C., Bonnevier, J. . Flow Cytometry Basics for the Non-Expert. , (2018).
- Hawley, T. S., Herbert, D. J., Eaker, S. S., Hawley, R. G. . Flow Cytometry Protocols. , (2004).
- Costa, E., et al. A new automated flow cytometry data analysis approach for the diagnostic screening of neoplastic B-cell disorders in peripheral blood samples with absolute lymphocytosis. Leukemia. 20 (7), 1221-1230 (2006).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Methods in Molecular Biology. , 139-150 (2018).
- Lucchesi, S., et al. Computational Analysis of Multiparametric Flow Cytometric Data to Dissect B Cell Subsets in Vaccine Studies. Cytometry Part A. 97, 259-267 (2019).
- Longerich, S., Tanaka, A., Bozek, G., Nicolae, D., Storb, U. The very 5' end and the constant region of Ig genes are spared from somatic mutation because AID does not access these regions. The Journal of Experimental Medicine. 202 (10), 1443-1454 (2005).
- Retter, I., et al. Sequence and characterization of the Ig heavy chain constant and partial variable region of the mouse strain 129S1. The Journal of Immunology. 179 (4), 2419-2427 (2007).
- Shen, H. M., Peters, A., Baron, B., Zhu, X., Storb, U. Mutation of BCL-6 gene in normal B cells by the process of somatic hypermutation of Ig genes. Science. 280 (5370), 1750-1752 (1998).
- Richter, K., et al. Altered pattern of immunoglobulin hypermutation in mice deficient in Slip-GC protein. Journal of Biological Chemistry. 287 (38), 31856-31865 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved