Method Article
Analisi dell'ipermutazione somatica nell'introne JH4 delle cellule del Centro Germinale B dalle patch di Mouse Peyer
In questo articolo
Riepilogo
Qui viene presentato un saggio per quantificare l'ipermutazione somatica all'interno del locus genico a catena pesante dell'immunoglobulina usando cellule B centro germinali dalle macchie del peyer del topo.
Abstract
All'interno dei centri germinali degli organi linfoidi, le cellule B mature alterano la loro immunoglobulina espressa (Ig) introducendo mutazioni nontemplate negli esoni codificanti variabili dei loci genici della catena pesante e leggera Ig. Questo processo di ipermutazione somatica (SHM) richiede la deaminasi citodina indotta dall'attivazione enzimatica (AID), che converte le deossicitidine (C), in deossiuridine (U). L'elaborazione delle disallineamenti U:G generate da AID in mutazioni da parte delle vie di riparazione dell'escissione di base e della mancata corrispondenza introduce nuove sequenze di codifica Ig che possono produrre una maggiore affinità Ig. Le mutazioni nei geni aid o di riparazione del DNA possono bloccare o alterare significativamente i tipi di mutazioni osservate negli Ig loci. Descriviamo un protocollo per quantificare le mutazioni dell'introne JH4 che utilizza lo smistamento delle cellule attivate a fluorescenza (FACS), pcr e sequenziamento Sanger. Sebbene questo saggio non misuri direttamente la maturazione dell'affinità Ig, è indicativo di mutazioni nelle sequenze di codifica variabile Ig. Inoltre, questi metodi utilizzano tecniche comuni di biologia molecolare che analizzano mutazioni in sequenze Ig di cloni di cellule B multiple. Pertanto, questo saggio è uno strumento inestimabile nello studio della diversificazione SHM e Ig.
Introduzione
Le cellule B, membri del sistema immunitario adattivo, riconoscono ed eliminano gli antigeni producendo anticorpi, noti anche come immunoglobuline (Ig). Ogni Ig è composto da due polipeptidi a catena pesanti (IgH) e due leggeri (IgL), che sono tenuti insieme da legami disolfuro per formare la caratteristica struttura della forma "Y" dell'Ig1. Gli N-termini di IgH e IgL comprendono la regione variabile (V) di ogni polipeptide e insieme formano il sito di legame dell'antigene dell'Ig, mentre la regione costante di IgH conferisce la funzione di effettore dell'Ig. Lo sviluppo di cellule B nel midollo osseo ridispone gli esoni codificanti V di IgH e IgL in un processo noto come ricombinazione V(D)J2,3,4. La trascrizione degli esoni V ricombinati, insieme ai rispettivi esoni della regione costante, forma l'mRNA che viene tradotto nell'Ig.
Le cellule B mature che esprimono un Ig legato alla membrana, noto anche come recettore delle cellule B (BCR), circolano agli organi linfoidi secondari, come la milza, il linfonodo o le macchie di Peyer, dove rilevano l'ambiente per gli antigeni e interagiscono con altre cellule del sistema immunitario1. All'interno dei centri germinali (GC) degli organi linfoidi secondari, le cellule B che riconoscono l'antigene attraverso il BCR vengono attivate. Aiutate da cellule dendritiche follicolari e cellule T di supporto follicolare, le cellule B attivate possono quindi proliferare e differenziarsi in cellule plasmatiche e di memoria, che sono importanti effettori di una robusta rispostaimmunitaria 5,6,7,8,9. Inoltre, queste cellule B attivate possono subire processi secondari di diversificazione genica Ig - ricombinazione dell'interruttore di classe (CSR) e ipermutazione somatica (SHM). Durante la RSI, le cellule B scambiano la regione costante di μ predefinita del polipeptide IgH con un'altra regione costante (γ, α, ε) attraverso una reazione di ricombinazione del DNA (Figura 1). Ciò consente l'espressione di un diverso esone costante e la traduzione di un nuovo Ig. La cella B passa dall'esprimere IgM a un altro isotipo (IgG, IgA, IgE). Csr modifica la funzione dell'effettore dell'Ig senza alterarne la specificità dell'antigene10,11,12. Tuttavia, durante shm, le cellule B mutano le regioni di codifica V di IgH e IgL per consentire la produzione e la selezione di Igs di affinità più elevata, che possono eliminare in modo più efficace un antigene13,14,15 ( Figura1). È importante sottolineare che sia la RSI che l'SHM dipendono dalla funzione di un enzima: la citidina deaminasi indotta dall'attivazione (AID)16,17,18. Gli esseri umani e i topi carenti di AID non possono completare la RSI o l'SHM e presentano elevata mente siere IgM o Hyper-IgM17,19.
Nella RSI, AID deamina le deossicitidine (C) nelle regioni di commutazione ripetitive che precedono ogni costante esone di codifica, convertendoli in deossiuridine (U)20,21, che crea un accoppiamento di base non corrispondente tra deossiuridine e deossiguanosine (U:G). Questi disallineamenti U:G vengono convertiti nelle rotture di DNA a doppio filamento, che sono necessari per la ricombinazione del DNA, dalla riparazione dell'escissione di base (BER) o dalla via di riparazione della mancata corrispondenza (MMR)22,23,24,25,26,27,28,29. In SHM, AID deamina C all'interno degli esoni di codifica V. La replicazione attraverso la mancata corrispondenza U:G genera mutazioni di transizione da C:G a T:A, mentre la rimozione della base dell'uracile da parte della proteina BER, la glicosilasi del DNA uracil (UNG), prima della replicazione del DNA produce sia mutazioni di transizione che di trasversione16. Mutazioni nulle in UNG aumentano significativamente da C:G a T:Amutazioni di transizione 21,22. Analogamente alla RSI, SHM richiede i ruoli complementari di MMR e BER. Durante l'SHM, MMR genera mutazioni alle coppie di basi A:T. L'inattivazione delle mutazioni nell'omologia MutS 2 (MSH2) o nella DNA polimerasi η (Polη) riduce significativamente le mutazioni alle basi A:T e le mutazioni composte in MSH2 e Polη abolisce virtualmente le mutazioni alle basi A:T21,30,31. Coerentemente con il ruolo critico di BER e MMR nella conversione dell'U generato da AID in mutazioni di transizione o trasversione, i topi carenti sia per MSH2 che per UNG (MSH2-/-UNG-/-) visualizzano solo mutazioni di transizione da C:G a T:A risultanti dalla replicazione attraverso il mismatch U:G21.
L'analisi dell'SHM nelle regioni di codifica V rimane complicata perché lo sviluppo di cellule B può ricombinare qualsiasi esone di codifica V(D)J nei loci IgH e IgL 1,2,4. Un'analisi accurata di queste regioni V ricombinate e mutate in modo univoco richiede l'identificazione e l'isolamento di cloni di cellule B o dell'Ig mRNA11,13. L'introne JH4, che è 3' dell'ultimo esone codificante J nel locus IgH, ospita mutazioni somatiche dovute alla diffusione di mutazioni 3' del promotore V32,33,34 e quindi è frequentemente usato come marcatore surrogato per SHM nelle regioni V31,35 ( Figura1). Per chiarire sperimentalmente come geni specifici o mutazioni genetiche alterino i modelli o i tassi SHM, l'introne JH4 può essere sequenziato dalle cellule B del centro germinale (GCBC) di Peyer ( PP), che subiscono alti tassi di SHM36,37,38. I CFC possono essere facilmente identificati e isolati con anticorpi coniugati fluorescentmente contro marcatori di superficie cellulare (B220+PNAHI)17,39.
Viene presentato un protocollo dettagliato per caratterizzare le mutazioni dell'introne JH4 nei GCC PP dei topi utilizzando una combinazione di FACS (fluorescenza attivata smistamento delle cellule), PCR e sequenziamento Sanger (Figura 2).
Protocollo
Tutti i topi mutanti sono stati mantenuti su uno sfondo C57BL/6. Topi maschi e femmine abbinati all'età (2-5 mesi) sono stati utilizzati per tutti gli esperimenti. L'allevamento e gli esperimenti con i topi sono stati condotti secondo protocolli approvati dal City College of New York Institutional Animal Care and Use Committee.
1. Dissezione delle patch di Peyer
- Eutanasia del topo con 100% CO2 a 3 L/min per 5 min seguita da lussazione cervicale per confermare la morte. Sterilizzare gli strumenti di dissezione (forbici, forcep, forcep fini) e le mani guantate con il 70% di etanolo.
- Posare il mouse sulla pastiglia di dissezione con l'addome esposto. Spruzzare generosamente il corpo del topo con il 70% di etanolo prima di effettuare eventuali incisioni per sterilizzare l'area di dissezione.
- Fai un'incisione nella pelle attraverso l'addome e rimuovi la pelle dall'addome tirando contemporaneamente su entrambi i lati dell'incisione verso la testa e la coda usando le flessione (o le mani sterilizzate guantate).
- Fissare gli arti anteriori e posteriori del mouse.
- Tagliare la cavità peritoneale con le forbici per esporre gli organi interni.
- Individuare l'intestino tenue tra lo stomaco e il caecum ("struttura a forma di J" vicino al colon). Rimuovere l'intestino tenue tagliando sotto lo stomaco e sopra il caecum.
- Rimuovere qualsiasi tessuto connettivo e grasso che colleghi le pieghe dell'intestino tenue insieme.
NOTA: Il grasso avrà un colore bianco distintivo, a differenza del colore rosa dell'intestino tenue. - Esaminare la superficie esterna dell'intestino tenue per le macchie del Peyer (PP), che sono piccole (~1 mm), strutture di forma ovale che appaiono bianche sotto un sottile strato di cellule epiteliali traslucide.
- Asporta con cura tutto il PP visibile con le forbici.
NOTA: un mouse di tipo jolly C57BL/6 (WT) può produrre 4-8 PP, mentre unmouse AID-/- avrà 6-10 PP. - Raccogliere i PC in un tubo di microcentrifugo da 1,5 ml contenente 1 ml di tampone FACS sul ghiaccio.
NOTA: Il PP dovrebbe affondare, mentre il grasso galleggerà sulla superficie e può essere rimosso.
2. Isolamento cellulare per FACS
- Posizionare un filtro da 40 μm in un piatto da 6 po', con 1 mL di tampone FACS freddo (4 °C).
- Versare i PC dal tubo da 1,5 ml sul filtro.
- Lavare i PC con 1 mL di tampone FACS freddo, assicurandosi che siano sempre in liquido e sul ghiaccio.
- Utilizzare l'estremità piatta dello stantuffo da una siringa da 1 ml come pestello per schiacciare i PC sul filtro fino a quando non rimane solo il tessuto connettivo sul filtro.
- Lavare il filtro e lo stantuffo con 1 mL di tampone FACS freddo per rilasciare le cellule nel piatto a 6 po '.
- Raccogliere i ~4 ml di cellule in tampone FACS freddo e filtrarle attraverso un tappo filtrante da 40 μm tubo FACS.
- Lavare il tappo del filtro con 1 mL di tampone FACS freddo.
- Pellettizzare le cellule a 600 x g a 4 °C per 5 minuti in una centrifuga a secchio oscillante.
- Decantare il supernatante.
- Resuspend le cellule in 0,4 mL di tampone FACS freddo.
- Rimuovere 10 μL affinché il conteggio delle celle verifichi la resa (prevedere ~5 x 106 celle/mouse, vedere la figura 3A)
- Filtrare le celle rimanenti attraverso un tappo filtrante da 40 μm in un tubo FACS e procedere alla colorazione per FACS.
3. Colorazione di CFC per FACS
- Aggiungere 1 blocco Fc μL (CD16/CD32 anti-mouse senza etichetta) alla sospensione cellulare da 400 μL e posizionare le cellule sul ghiaccio per 15 minuti.
- Aggiungere 2 mL di tampone FACS freddo per lavare le cellule.
- Celle a pellet a 600 x g a 4 °C per 5 min e scartare il supernatante.
- Resuspend le cellule in 80 μL di tampone FACS freddo.
- Rimuovere 10 μL di cellule dal PP WT per ogni controllo di colorazione (4 in totale, inclusi 3 controlli a macchia singola e 1 controllo non macchiato). Lasciare 40 μL del PP WT per il passaggio successivo. In alternativa, utilizzare perline di compensazione per i controlli di colorazione.
- Macchiare ciascuno dei campioni sperimentali (ad esempio, WT e AID-/-) in 500 μL di tampone FACS freddo con 2,5 μL di agglutinina di arachidi (PNA)-biotina per 15 minuti sul ghiaccio.
- Aggiungere 2 mL di tampone FACS freddo per lavare le cellule.
- Celle a pellet a 600 x g a 4 °C per 5 min e scartare il supernatante.
- Macchiare ogni campione sperimentale con 500 μL del cocktail al buio, sul ghiaccio, per 15 minuti (tabella 1). Assicurarsi che le cellule siano completamente rimorsi nel cocktail di colorazione.
- Preparare controlli a macchia singola per la matrice di compensazione.
- Usare le cellule in 500 μL di tampone FACS freddo utilizzando le diluizioni specificate nella tabella 2.
- Incubare i controlli di colorazione al buio, sul ghiaccio, per 15 minuti.
- Aggiungere il tampone FACS freddo da 2 ml a tutti i tubi nei passaggi 3.7 e 3.8, pelletare le cellule e scartare il supernatante per lavare via anticorpi non vincolati o DAPI.
- Rimorsiva le cellule in 500 μL di tampone FACS freddo e posto sul ghiaccio.
- Utilizzando uno smistatore di celle, raccogliere B220+PNAHI da ogni campione sperimentale macchiato. La figura 3B mostra le percentuali tipiche di B220+ PNAHI ottenute da PC WT e AID-/- .
4. Estrazione di DNA da BCC
- Celle selezionate a pellet a 600 x g a 4 °C per 5 minuti e scartare il supernatante.
- Rimescolare le cellule in 1 ml di tampone FACS freddo e trasferire le cellule in un tubo di microcentrifugo da 1,5 ml.
- Pellettizzare le cellule a 600 x g a 4 °C per 5 minuti e scartare il supernatante.
- Rimescolare le cellule in 500 μL di tampone di estrazione del DNA e 5 μL di 20 mg/mL proteinasi K.
- Incubare a 56 °C durante la notte.
- Precipitare il DNA con isopropanolo 500 μL e 1 μL di glicogeno da 20 mg/mL. Mescolare accuratamente il tubo invertendo 5-6x.
- Incubare a temperatura ambiente per 10 minuti.
- Centrifuga in microcentrifugo per 15 min a 25 °C a 21.000 x g.
- Scartare il supernatante e conservare il pellet, che contiene il DNA precipitato e il glicogeno.
- Lavare il pellet di DNA con 1 mL di 70% di etanolo.
- Pellettizzare il DNA in un microcentrifugo per 10 min a 25 °C a 21.000 x g.
- Rimuovere il 70% di etanolo e asciugare all'aria il pellet di DNA per 5-10 minuti.
NOTA: Evitare un'asciugatura estroppo in quanto il DNA potrebbe non reidratarsi completamente.
- Resuspend il DNA in tampone TE da 30 μL e incubare durante la notte a 56 °C.
5. Amplificazione e analisi della sequenza di introne JH4
- Quantificare il DNA misurando l'assorbanza a una lunghezza d'onda di 260 nm (A260).
NOTA: La concentrazione tipica di DNA recuperata da GCCC B220+PNAHI ordinati di un topo C57BL/6 è di 20-40 ng/μL. - Eseguire la PCR nidificata per l'introne JH4 (Tabella 3, Tabella 4). Normalizzare la quantità totale di DNA genomico utilizzato nella prima PCR al campione meno concentrato. (ad esempio, se il campione meno concentrato è di 5 ng/μL, utilizzare 58,75 ng di DNA per tutti i campioni nel volume massimo di acqua (11,75 μL) in PCR #1).
- Risolvere il prodotto PCR su un gel di agarosio all'1,5% a 200 V per 20 minuti. La dimensione prevista dell'amplicon è di 580 bp.
- Asportare l'amplicon dal gel ed estrarre il DNA utilizzando un kit di estrazione del gel secondo le istruzioni del produttore (vedere figura complementare 1).
- Elute il DNA con 30 μL di acqua e quantificare la quantità di DNA misurando l'A260.
NOTA: La concentrazione tipica del prodotto PCR purificato è di 3-10 ng/μL.
- Elute il DNA con 30 μL di acqua e quantificare la quantità di DNA misurando l'A260.
- Ligate il prodotto PCR purificato in un plasmide con estremità smussate. Standardizzare la quantità totale di prodotto PCR utilizzato in ogni reazione di legatura (tabella 5).
- Incubare la reazione di legatura a temperatura ambiente per 5 minuti o durante la notte a 16 °C.
- Trasforma le cellule batteriche elettrocompetenti con 2 μL della reazione di legatura.
- Elettroporato a 1,65 kV.
- Salvataggio in 600 μL di supporti SOC per 1 h a 37 °C in un incubatore di scuotimento a 225 giri/min.
- Piastra 100 μL di batteri trasformati su LB integrata con piastre di agar di ampicillina (100 μg/mL) e incubare durante la notte a 37 °C.
- Inviare la piastra delle colonie batteriche per il sequenziamento sanger utilizzando il primer anteriore T7. In alternativa, coltivare colture notturne di ogni colonia batterica ed eseguire una purificazione plasmide.
- Se necessario, ripetere la PCR, la legatura e/o la trasformazione per ottimizzare la resa delle colonie batteriche
NOTA: Un minimo di 30 colonie devono essere raccolte da ogni piatto.
- Se necessario, ripetere la PCR, la legatura e/o la trasformazione per ottimizzare la resa delle colonie batteriche
- Standardizzare i dati di sequenza nei .txt file
- Eliminare la sequenza plasmide.
- Assicurarsi che ogni sequenza sia orientata da 5' a 3' secondo la sequenza di riferimento dell'introne JH4 (NG_005838). Generare il complemento inverso di qualsiasi sequenza, se necessario.
- Allineare le sequenze ottenute per ogni PCR alla sequenza di riferimento dell'introne JH4 (NG_005838) utilizzando un software Clustal Omega (Figura 4A).
- Identificare le differenze dalla sequenza di riferimento come mutazioni
- Verificare che tutte le mutazioni siano vere mutazioni puntino esaminando l'elettroferogramma del sequenziamento di Sanger. Ripetere il sequenziamento, se necessario. (Figura 4B,C).
- Tabulare e quantificare mutazioni uniche nell'introne JH4 per ogni genotipo (Figura 5).
- Contare sequenze con mutazioni identiche una sola volta
NOTA: Non è possibile determinare se le sequenze identiche sono state generate durante il PCR o eventi SHM identici in diverse celle B. - Contare ogni istanza delle sequenze di introne JH4 della linea germinale WT (cioè quelle senza mutazioni) come una sequenza unica.
- Contare sequenze con mutazioni identiche una sola volta
Risultati
Citometria a flusso
Le cellule B mature circolano nei centri germinali dove subiscono maturazione di affinità, espansione clonale e differenziazione in plasma o cellule dimemoria 40,41,42,43,44. Questi CFC possono essere identificati da numerosi marcatori di superficie cellulare, tra cui l'alta espressione del recettore CD45R/B220 e il legame dell'agglutinina di arachidi (PNA)45,46. Per isolare i GCBC attivati, le cellule PP sono state macchiate con anticorpi anti-B220 coniugati alla ficoertropina (PE) e alla biotinylated-PNA, seguite da streptavidina coniugata ad APC-eFluor780. Le cellule morte sono state eliminate usando il colorante fluorescente 4',6-Diamidino-2-Phenylindole (DAPI), che macchia l'acido nucleico delle cellule morte omorenti 47,48. Le celle macchiate sono state successivamente analizzate e ordinate tramite citometria a flusso. I PP erano costituiti da ~80% B220+ celle49,50. I PP WT contengono in media 4 x 106 celle per mouse (Figura 3A). Circa l'8% delle cellule WT PP era B220+PNAHI, che è la metà del numero osservato in AID-/ - ( Figura3B). Così, 0,3-0,6 x 106 B220+PNAHI GCCC sono stati ottenuti dopo lo smistamento, che sono stati sufficienti per analizzare le mutazioni nell'introne JH4.
Analisi della sequenza JH4
L'introne JH4 è stato amplificato da un PCR annidato utilizzando i comuni primer della famiglia VHJ558 (J558FR3Fw e VHJ558.2) seguiti dai primir della gamma di introni JH4 VHJ558.3 e VHJ558.435,37. Delle 105 sequenze uniche ottenute da GCCC WT, sono state trovate complessivamente 226 mutazioni (Figura 5A). L'analisi dello spettro di mutazione GCBC nei topi WT ha mostrato una gamma di transizioni e trasversioni ad una velocità di 4 x10 -3 mutazioni/bp, che è stata calcolata dividendo il numero totale di basi mutate per il numero totale di basi sequenziate32,36,37,38. Inoltre, ogni prodotto PCR JH4 di GCBC WT conteneva 1-25 mutazioni (Figura 5B), in cui sono state frequentemente trovate mutazioni multiple su unasequenza 33,36. Solo due mutazioni sono state identificate in 113 sequenze AID-/- (Figura 5A). Lecellule AID-/- B presentavano 1,66 x 10-5 mutazioni/bp, che era significativamente inferiore alle cellule WT B (p <0,05)36 e si confronta con il tasso di errore della polimerasi ad alta fedeltà (5,3 x 10-7 sub/base/raddoppio)51,52. Pertanto, le cellule AID-/- B servivano come utile controllo negativo per questo saggio.
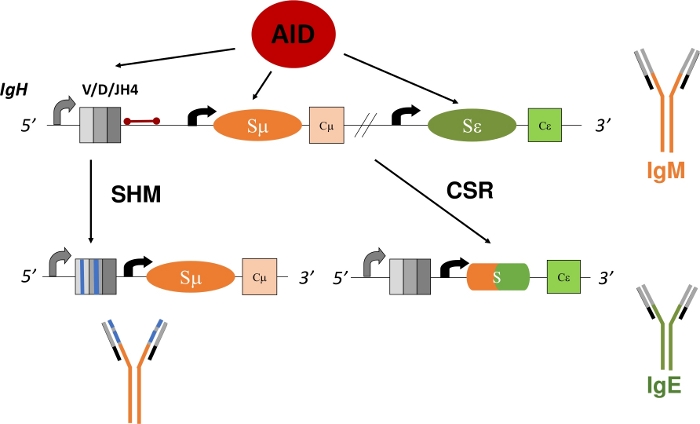
Figura 1: Schema del locus genico IgH e delle regioni interessate da AID durante la RSI e l'SHM. La barra rossa indica l'introne JH4 da 580 bp che è 3' di riarrangiamenti VDJH4 e viene analizzato in questo protocollo. Nella RSI, la deaminazione dipendente da AID delle regioni di commutazione intronica (Sμ e Sε) promuove la formazione di DSB che consente la ricombinazione del deletional e l'espressione di un nuovo isotipo anticorpale (da IgM a IgE). Durante l'SHM, le regioni V (scatole grigie) accumulano mutazioni (linee blu) che possono portare a una maggiore affinità Ig. Clicca qui per visualizzare una versione più grande di questa figura.
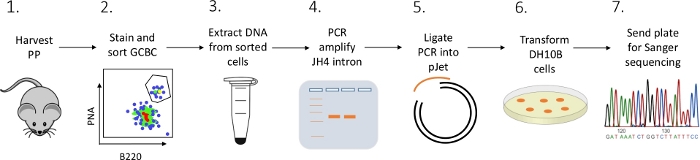
Figura 2: Flusso di lavoro per analizzare l'SHM dell'introne JH4 nei GCBC isolati dai PC. Clicca qui per visualizzare una versione più grande di questa figura.
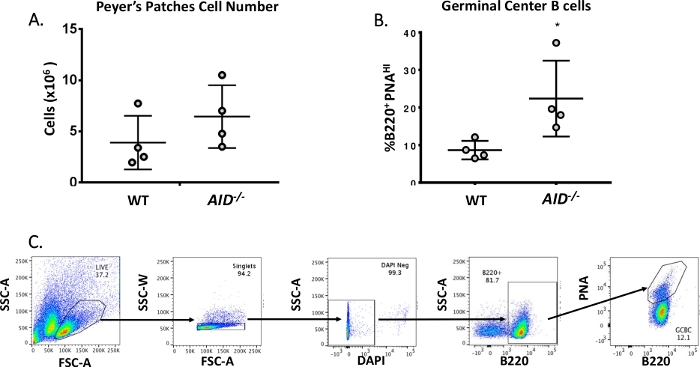
Figura 3: Caratterizzazione dei CGBC PP. (A) Numero totale di cellule PP provenienti da topi WT e AID-/- (n = 4 per genotipo). Le barre di errore rappresentano una deviazione standard dalla media. (B) Percentuale di B220+BBC PNAHI ottenuti da PC di topi WT e AID-/- (n = 4 per genotipo)36. Le barre di errore rappresentano una deviazione standard dalla media, *p<0.05 utilizzando il test t dello studente. (C) Grafici FACS rappresentativi per ordinare I GCBC B220+PNAHI dai PC. Fare clic qui per visualizzare una versione più ampia di questa figura.
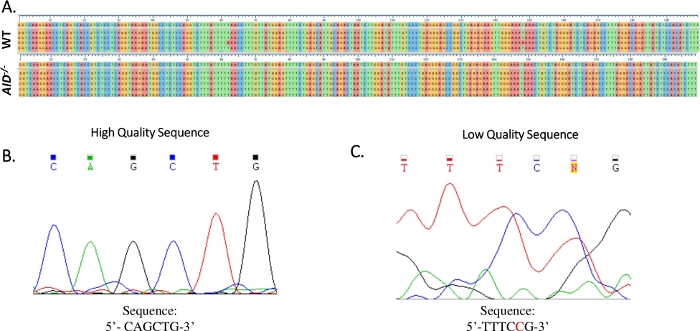
Figura 4: Analisi dei dati della sequenza JH4 Sanger. (A) Allineamenti di sequenza campione dei dati della sequenza Sanger del prodotto PCR JH4 da GCCC WT (in alto) e AID-/- (in basso) alla sequenza genomica di riferimento (NG_005838), che è la sequenza immediatamente al di sotto dei segni di graduazione numerati. Gli allineamenti sono stati generati utilizzando Clustal Omega. (B) Elettroferogramma di dati di sequenza Sanger di alta qualità, che mostrava picchi distinti per ogni base. (C) Elettroferogramma di dati di sequenza di bassa qualità, che hanno mostrato picchi ambigui e basi non specificate (N). Il nucleotide mostrato in rosso deve essere annotato manualmente nel file di testo della sequenza. Clicca qui per visualizzare una versione più grande di questa figura.
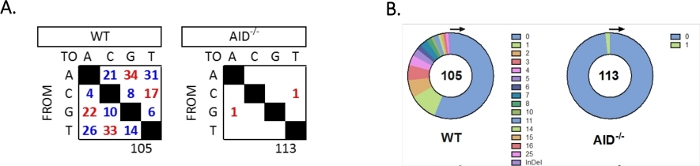
Figura 5: Analisi delle mutazioni nell'introne JH4 in WT e AID-/- GCCC. (A) Il numero totale di mutazioni di transizione (rosso) e di trasversione (blu) nelle basi A, C, G e T per ciascun genotipo è riassunto nelle tabelle. Il numero totale di sequenze analizzate è indicato sotto la tabella. (B) Il numero di mutazioni per amplicon PCR per ogni genotipo è rappresentato nei grafici a torta. Questa cifra è stata modificata da Choi etal. L'American Association of Immunologists, Inc.
| Cocktail di colorazione per GCBC | Volume: 500 μL | ||
| Anticorpo o colorante | Fluorofo | diluizione | μL |
| B220 B220 | Pe | 1000 | 0.5 |
| Streptavidina | APC-eFluor780 | 500 | 1 |
| DAPI | N/D | 500 | 1 |
Tabella 1: Colorazione dei cocktail per I CFC. Cocktail degli anticorpi o coloranti indicati (indicati in corsivo) alle diluizioni specificate sono stati utilizzati per macchiare le cellule PP in 500 μL per la citometria a flusso.
| Macchie singole per il risarcimento | Volume: 500 μL | ||
| Anticorpo o colorante | Fluorofo | diluizione | μL |
| B220 B220 | Pe | 1000 | 0.5 |
| B220 B220 | APC-eFluor780 | 750 | 0.67 |
| DAPI | N/D | 500 | 1 |
Tabella 2: Controlli delle macchie singole per la compensazione. Gli anticorpi B220 coniugati con i fluorofori indicati sono stati utilizzati per controlli a macchia singola per compensare la sovrapposizione spettrale.
| Pcr #1 | ||||
| Reagente | volume | Condizioni termociclotrici | ||
| 5x Buffer | 4 μL | 1 | 95 °C | 3 min |
| 10 mM dNTP | 2 μL | 2 | 94 °C | 30 secondi |
| 10 μM J558FR3Fw | 1 μL | 3 | 55 °C | 30 secondi |
| 10 μM VHJ558,2 | 1 μL | 4 | 72 °C | 1:30 min |
| DNA polimerasi ad alta fedeltà | 0,25 μL | Ciclo 2-4 9x | ||
| DNA | x (standardizzare il campione meno concentrato) | |||
| H2O | a 20 μL | 5 | 72 °C | 5 min |
| Diluire il prodotto PCR 1:5 in H2O prima di procedere a PCR #2 | ||||
Tabella 3: PCR nidificata dell'introne JH4. Componenti PCR e condizioni termociclotrici per la prima reazione di amplificazione. Diluire il primo prodotto PCR 1:5 con acqua e utilizzare 1 μL di questa diluizione per la seconda PCR.
| Pcr #2 | ||||
| Reagente | volume | Condizioni termociclo #2 | ||
| 5x Buffer | 4 μL | 1 | 94 °C | 3 min |
| 10 mM dNTP | 2 μL | 2 | 94 °C | 30 secondi |
| 10 μM VHJ558,3 | 1 μL | 3 | 55 °C | 30 secondi |
| 10 μM VHJ558,4 | 1 μL | 4 | 72 °C | 30 secondi |
| DNA polimerasi ad alta fedeltà | 0,25 μL | Ciclo 2-4 21x | ||
| PCR diluito#1 | 1 μL | |||
| H2O | a 20 μL | 5 | 72 °C | 5 min |
Tabella 4: Componenti PCR e condizioni termociclotrici per la seconda PCR.
| Reagente | volume |
| 2x Buffer | 10 μL |
| PCR purificato | x (standardizzare il campione meno concentrato) |
| Plasmide con estremità smussate | 1 μL |
| T4 DNA Ligasi | 1 μL |
| H2O | a 20 μL |
| Incubare alla temperatura della stanza per 5 minuti o durante la notte a 16ºC | |
Tabella 5: Reazione di ligation. Componenti per la legatura del prodotto PCR dell'introne JH4 purificato nel plasmide.
| FACS Buffer |
| Il calore inattiva FBS a 56 °C per un'ora prima dell'uso. Integrare PBS, pH 7.4 (Gibco, #10010049) con 2.5% (v/v) di FBS inattivato dal calore. Conservare a 4°C. |
| Tampone di estrazione del DNA (100 mM Tris pH 8.0, 0.1 M EDTA, 0.5% (w/v) SDS) |
| Aggiungere 50 mL di 1 M Tris pH 8.0, 100mL di 0.5 M EDTA e 12.5 mL di 20% SDS. Aggiungere acqua distillata a 500 mL. Conservare a temperatura ambiente. |
| TE Buffer (10 mM Tris pH 8.0, 1 mM EDTA) |
| Aggiungere 2,5 mL di 1 M Tris pH 8.0 e 500 mL di 0,5 M EDTA. Aggiungere acqua distillata a 250 mL. Conservare a temperatura ambiente. |
Tabella 6: Ricette tampone.
| Lista oligonucleotidi | ||
| J558FR3Fw | 5'-GCCTGACATCTGAGGACTCTGC-3' | |
| VHJ558.2 | 5'-CTGGACTTTCGGTTTGGTG-3' | |
| VHJ558.3 | 5«-GGTCAAGGAACCTCAGTCA-3» | |
| VHJ558.4 | 5'-TCTCTAGACAGCAACTAC-3' | |
Tabella 7: Oligonucleotidi utilizzati nel saggio.
Figura complementare 1: Immagine rappresentativa del gel di agarosio dopo il completamento del passaggio 5.4. Il prodotto PCR annidato con introne JH4 è stato risolto con un gel di agarosio dell'1,5% e l'amplicon da 580 bp è stato asportato. WT PP indica che il DNA genomico WT PP GCBC è stato utilizzato come modello per il primo PCR e AID PP indica che AID-/- PP GCBC DNA genomico è stato utilizzato come modello per il primo PCR. ɸ indica il controllo PCR senza modello e - indica che non è stato caricato nulla nel pozzo del gel di agarosio. L'ultima corsia mostra una scala del DNA da 100 bp. Clicca qui per scaricare questa cifra.
Discussione
Caratterizzare SHM all'interno delle sequenze di codifica IgH e IgL V di una popolazione di cellule B eterogenee rappresenta una sfida, dato che ogni cella B riorganizza in modo univoco i segmenti di codifica V durante la ricombinazione V(D)J34. In questo articolo, descriviamo un metodo per identificare le mutazioni nell'introne JH4 dei GCCC. L'introne JH4, che si trova 3' dell'ultimo segmento di codifica J nel locus IgH, viene utilizzato come surrogato per SHM delle regioni V (Figura 1)31,33,34,35. Per catalogare queste mutazioni dell'introne JH4 e valutare come geni specifici influenzano la produzione o il modello di mutazioni, i GCCCC PP vengono analizzati in modo specifico. Queste cellule accumulano mutazioni dell'introne JH4 a seguito della stimolazione cronica da parte del microbiotaintestinale 53. Inoltre, i GCC B220+PNAHI dei PC di topi non immunizzati hanno uno spettro di mutazione che si confronta con i CBC splenici degli animaliimmunizzati 54,55. Tuttavia, le mutazioni nell'introne JH4 non possono essere correlate alla maturazione dell'affinità Ig perché queste mutazioni non sono codificanti.
Per determinare se SHM altera l'affinità Ig, i topi devono essere immunizzati per via intraperitoneale con un antigene, come NP (4-idrossi-3-nitrofenilacetil) coniugato a CGG (globulina gamma di pollo) o KLH (emocianina del buco della serratura)56. Successivamente, l'mRNA può essere purificato da Splenic B220+PNAHI GCBC per esaminare SHM all'interno di VH186.2, l'esone di codifica V che riconosce più frequentemente NP ed è mutato a seguito dell'immunizzazione NP-CGG o NP-KLH31,57,58,59,60. La mutazione del triptofano-33 in una leucina in VH186.2 è stata caratterizzata per aumentare l'affinità Ig fino a 10 volte59,60 ed è, quindi, un indicatore che SHM e selezione clonale hanno generato alta affinità Ig. La misurazione del siero specifico NP7 e NP20 da parte di ELISA e il calcolo del rapporto NP7/NP20 specifico di Ig nel corso dell'immunizzazione documentano anche la maturazione dell'affinità Ig risultante dall'SHM delle regioni V17,21,36. Entrambi questi test possono essere usati per correlare SHM all'interno delle sequenzedi codificaV H 186.2 con cambiamenti nella maturazione dell'affinità Ig specifica di NP.
Sia che gli animali immunizzati o non immunizzati siano utilizzati per analizzare l'SHM di VH186.2 o l'introne JH4, i CTC devono essere identificati con precisione. Presentiamo un approccio basato su FACS per isolare i GCBC B220+PNAHI. In alternativa, l'antigene Fas e non solfato α2-6-sialyl-LacNAc, riconosciuto dall'anticorpo GL761,62,63,64, può essere utilizzato anche per isolare i CFC, identificati come B220+Fas+GL7+65 o CD19+Fas+GL7+37. L'espressione GL7 rispecchia da vicino la PNA nei GCC attivati dei linfonodi64,65,66. Oltre all'uso di marcatori anticorpali specifici per i CFC, i cocktail di colorazione dovrebbero massimizzare l'eccitazione di un fluorofoforo e il rilevamento di un biomarcatore riducendo al minimo la sovrapposizione spettrale dell'emissione di fluorescenza. Gli antigeni espressi a bassi livelli devono essere rilevati con un anticorpo coniugato a un fluorofore con una robusta fluorescenza ad emissione67. Il protocollo di colorazione consigliato è stato ottimizzato per l'analisi su uno smistatore di celle dotato di quattro laser (405nm, 488nm, 561nm, 633nm) e 12 filtri; tuttavia, le configurazioni dei filtri e la disponibilità del laser variano tra i citometri. Per modificare il protocollo in base al reagente e alla disponibilità delle apparecchiature, il lettore è riferito a risorse aggiuntive, visualizzatori di spettro online e letteraturapubblicata 67,68,69,70,71,72,73. Il protocollo di colorazione multicolore descritto nel presente documento richiede una compensazione della sovrapposizione spettrale per garantire che le popolazioni di cellule smistate siano CFC piuttosto che un rilevamento impreciso dell'emissione di fluorescenza. B220 funge da utile controllo di colorazione per il FACS descritto (tabella 1B) perché i PC avranno popolazioni distintive B220 negative e positive (Figura 3C), il che consente un'adeguata compensazione della sovrapposizione spettrale. La strategia di gating presentata nella figura 3C dovrebbe essere utilizzata come linea guida. I grafici di citometria del flusso possono variare a seconda delle condizioni di colorazione e delle impostazioni del citometro. Tuttavia, il 4-10% delle cellule vive dovrebbe essere B220+PNAHI 35, 52.
Tutte le mutazioni all'interno dell'introne JH4 dei CTC PP devono essere convalidate per garantire che le mutazioni osservate siano realmente riflettenti dell'SHM e non un manufatto di PCR o sequenziamento. Lecellule AID-/- B possono fungere da utile controllo negativo quando si esamina il fenotipo SHM in altri modelli di mouse mutanti perché queste celle non possono completare SHM17,19. Il tasso di mutazione dell'introne JH4 nel di AID-/- GCCC (1,66x10-5 mutazioni/bp)20,21,36,37,38,50,74 è paragonabile al tasso di errore della polimerasi ad alta fedeltà (5,3x10-7 sub/base/raddoppio)51,52 che viene utilizzata per amplificare il DNA nella PCR nidificata. Se i topi AID-/- non sono disponibili, confrontare il modello di mutazione osservato e la frequenza con la letteratura pubblicata. Le regioni Ig V accumulano 10-3 -10-4 mutazioni per divisione di coppia di basi, che è circa 10 6 volte superiore al tasso dimutazionedi altri loci genetici73,75. I risultati possono variare con l'età dell'animale76. In alternativa, le cellule B220+PNALO, che contrassegnano i non CBC, possono essere utilizzate come controllo negativo in assenza di topi AID-/- 52. Se la frequenza di mutazione nei CFC WT è inferiore al previsto, la sequenza intronica JH4 della linea germinale WT può essere rappresentata in modo sproporzionato. In questo caso, assicurarsi che i CFC siano stati macchiati e ordinati in modo appropriato e che i PCR siano liberi dalla contaminazione da introne JH4 della linea germinale WT. Inoltre, i dati di sequenziamento grezzi negli elettroferogrammi devono essere analizzati accuratamente per garantire che le mutazioni nei dati di testo della sequenza non siano artefatti di errori di sequenziamento. Ad esempio, risultati di sequenziamento Sanger scadenti possono ridurre l'affidabilità dei dati di sequenza (Figura 4). Questo controllo di qualità dei dati della sequenza Sanger aumenterà l'accuratezza e la riproducibilità dell'analisi della mutazione dell'introne JH4.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Tasuku Honjo per i topi AID-/-. Questo lavoro è stato supportato da The National Institute on Minority Health and Health Disparities (5G12MD007603), The National Cancer Institute (2U54CA132378) e The National Institute of General Medical Sciences (1SC1GM132035-01).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR 8-tube FLEX-FREE strip, attached clear flat caps, mixed | USA Scientific | 1402-4708 | |
| Ampicillin sodium salt | Fisher | BP1760-5 | |
| APC-eFluor780 anti-CD45R/B220 | eBioscience | 47-0452-80 | clone RA3-6B2 |
| BD FACSAria II | BD | 643186 | four lasers (405nm, 488nm, 561nm, 633nm) and 12 filters (PacBlue (450/50), AmCyan (502LP; 530/30), SSC (488/10), FITC (502LP; 530/30), PerCP-Cy5.5 (655LP; 695/40), PE (585/15), PE-Texas Red (600LP; 610/20), PE-Cy5 (630LP; 670/14), PE-Cy7 (735LP; 780/60), APC (660/20), Alexa700 (710LP; 730/45), APC-Cy7 (755LP; 780/60)) |
| BD slip tip 1mL syringe | Fisher | 14-823-434 | sterile |
| Biotinylated peanut agglutinin (PNA) | Vector Labs | B-1075-5 | |
| C57BL/6J mice | Jackson Laboratories | 664 | |
| Corning Falcon test tube with cell strainer snap cap | Fisher | 08-771-23 | |
| DAPI (4',6-Diamidino-2-Phenylindole, dihydrochloride) | Fisher | D1306 | 0.5 mg/ml |
| dNTP | NEB | N0447L | 10 mM |
| ElectroMAX DH10B competent cells | Fisher | 18-290-015 | |
| Falcon cell strainer 40mm | Fisher | 08-771-1 | |
| Falcon round-bottom polystyrene tubes (FACS tubes) | Fisher | 14-959-5 | |
| Falcon round-bottom polystyrene tubes (capped) | Fisher | 149591A | |
| Fetal bovine serum | R&D Systems (Atlanta Biologicals) | S11150 | |
| Gibco phosphate buffered saline PBS pH 7.4 | Fisher | 10-010-049 | |
| Glycogen | Sigma | 10901393001 | |
| Lasergene Molecular Biology (MegAlign Pro) | DNA Star | version 15 | |
| PE anti-CD45R/B220 | BD | 553090 | clone RA3-6B2 |
| Proteinase K | Fisher | BP1700-100 | |
| Q5 High-Fidelity DNA Polymerase | NEB | M0491L | |
| QIAquick Gel Extraction Kit | Qiagen | 28706 | |
| Seal-Rite 1.5mL microcentrifuge tubes | USA Scientific | 1615-5500 | |
| Streptavidin APC-eFluor 780 Conjugate | eBioscience | 47-4317-82 | |
| T4 DNA ligase | NEB | M020L | |
| Thermo Scientific CloneJET PCR Cloning Kit | ThermoFisher | FERK1231 | |
| Tissue culture plate 6 well | Fisher | 08-772-1B | sterile |
| Unlabeled anti-mouse CD16/CD32 (Fc block), BD | Fisher | BDB553142 | Clone 2.4G2 |
Riferimenti
- Murphy, K., Weaver, C. Janeyway's Immunobiology. , Garland science. (2016).
- Alt, F. W., et al. VDJ recombination. Immunology Today. 13 (8), 306-314 (1992).
- Schatz, D. G., Ji, Y. Recombination centres and the orchestration of V (D) J recombination. Nature Reviews Immunology. 11 (4), 251-263 (2011).
- Oettinger, M. A., Schatz, D. G., Gorka, C., Baltimore, D. RAG-1 and RAG-2, adjacent genes that synergistically activate V (D) J recombination. Science. 248 (4962), 1517-1523 (1990).
- Berek, C., Berger, A., Apel, M. Maturation of the immune response in germinal centers. Cell. 67 (6), 1121-1129 (1991).
- Linterman, M. A., et al. Foxp3+ follicular regulatory T cells control the germinal center response. Nature Medicine. 17 (8), 975(2011).
- Shulman, Z., et al. T follicular helper cell dynamics in germinal centers. Science. 341 (6146), 673-677 (2013).
- Good-Jacobson, K. L., et al. PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells. Nature Immunology. 11 (6), 535(2010).
- Kerfoot, S. M., et al. Germinal center B cell and T follicular helper cell development initiates in the interfollicular zone. Immunity. 34 (6), 947-960 (2011).
- Chaudhuri, J., Alt, F. W. Class-switch recombination: interplay of transcription, DNA deamination and DNA repair. Nature Reviews Immunology. 4 (7), 541-552 (2004).
- Alt, F. W., Zhang, Y., Meng, F. L., Guo, C., Schwer, B. Mechanisms of programmed DNA lesions and genomic instability in the immune system. Cell. 152 (3), 417-429 (2013).
- Xu, Z., Zan, H., Pone, E. J., Mai, T., Casali, P. Immunoglobulin class-switch DNA recombination: induction, targeting and beyond. Nature Reviews Immunology. 12 (7), 517-531 (2012).
- Di Noia, J. M., Neuberger, M. S. Molecular mechanisms of antibody somatic hypermutation. Annual Reviews of Biochemistry. 76, 1-22 (2007).
- Peled, J. U., et al. The biochemistry of somatic hypermutation. Annual Review of Immunology. 26, 481-511 (2008).
- Liu, M., Schatz, D. G. Balancing AID and DNA repair during somatic hypermutation. Trends in Immunology. 30 (4), 173-181 (2009).
- Methot, S., Di Noia, J. Molecular Mechanisms of Somatic Hypermutation and Class Switch Recombination. Advances in Immunology. 133, 37-87 (2017).
- Muramatsu, M., et al. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102 (5), 553-563 (2000).
- Petersen-Mahrt, S. K., Harris, R. S., Neuberger, M. S. AID mutates E. coli suggesting a DNA deamination mechanism for antibody diversification. Nature. 418 (6893), 99(2002).
- Revy, P., et al. Activation-induced cytidine deaminase (AID) deficiency causes the autosomal recessive form of the Hyper-IgM syndrome (HIGM2). Cell. 102 (5), 565-575 (2000).
- Petersen-Mahrt, S. DNA deamination in immunity. Immunological Reviews. 203 (1), 80-97 (2005).
- Rada, C., Di Noia, J. M., Neuberger, M. S. Mismatch recognition and uracil excision provide complementary paths to both Ig switching and the A/T-focused phase of somatic mutation. Molecular Cell. 16 (2), 163-171 (2004).
- Rada, C., et al. Immunoglobulin isotype switching is inhibited and somatic hypermutation perturbed in UNG-deficient mice. Current Biology. 12 (20), 1748-1755 (2002).
- Schrader, C. E., Vardo, J., Stavnezer, J. Role for mismatch repair proteins Msh2, Mlh1, and Pms2 in immunoglobulin class switching shown by sequence analysis of recombination junctions. The Journal of Experimental Medicine. 195 (3), 367-373 (2002).
- Martin, A., et al. Msh2 ATPase activity is essential for somatic hypermutation at AT basepairs and for efficient class switch recombination. The Journal of Experimental Medicine. 198 (8), 1171-1178 (2003).
- Imai, K., et al. Human uracil-DNA glycosylase deficiency associated with profoundly impaired immunoglobulin class-switch recombination. Nature Immunology. 4 (10), 1023-1028 (2003).
- Masani, S., Han, L., Yu, K. Apurinic/apyrimidinic endonuclease 1 is the essential nuclease during immunoglobulin class switch recombination. Molecular and Cellular Biology. 33 (7), 1468-1473 (2013).
- Guikema, J. E., et al. APE1-and APE2-dependent DNA breaks in immunoglobulin class switch recombination. The Journal of Experimental Medicine. 204 (12), 3017-3026 (2007).
- Schrader, C. E., Guikema, J. E., Wu, X., Stavnezer, J. The roles of APE1, APE2, DNA polymerase β and mismatch repair in creating S region DNA breaks during antibody class switch. Philosophical Transactions of the Royal Society B: Biological Sciences. 364 (1517), 645-652 (2009).
- Roa, S., et al. MSH2/MSH6 complex promotes error-free repair of AID-induced dU: G mispairs as well as error-prone hypermutation of A: T sites. PLoS One. 5 (6), 11182(2010).
- Delbos, F., Aoufouchi, S., Faili, A., Weill, J. C., Reynaud, C. A. DNA polymerase η is the sole contributor of A/T modifications during immunoglobulin gene hypermutation in the mouse. The Journal of Experimental Medicine. 204 (1), 17-23 (2007).
- Maul, R. W., Gearhart, P. J. AID and somatic hypermutation. Advances in Immunology. 105, 159-191 (2010).
- Shen, H. M., Tanaka, A., Bozek, G., Nicolae, D., Storb, U. Somatic hypermutation and class switch recombination in Msh6-/- Ung-/- double-knockout mice. The Journal of Immunology. 177 (8), 5386-5392 (2006).
- Cheng, H. L., et al. Integrity of the AID serine-38 phosphorylation site is critical for class switch recombination and somatic hypermutation in mice. Proceedings of the National Academy of Sciences. 106 (8), 2717-2722 (2009).
- Lebecque, S. G., Gearhart, P. J. Boundaries of somatic mutation in rearranged immunoglobulin genes: 5'boundary is near the promoter, and 3'boundary is approximately 1 kb from V (D) J gene. The Journal of Experimental Medicine. 172 (6), 1717-1727 (1990).
- Jolly, C. J., Klix, N., Neuberger, M. S. Rapid methods for the analysis of immunoglobulin gene hypermutation: application to transgenic and gene targeted mice. Nucleic Acids Research. 25 (10), 1913-1919 (1997).
- Choi, J. E., Matthews, A. J., Michel, G., Vuong, B. Q. AID Phosphorylation Regulates Mismatch Repair-Dependent Class Switch Recombination and Affinity Maturation. The Journal of Immunology. 204 (1), 13-22 (2020).
- McBride, K. M., et al. Regulation of class switch recombination and somatic mutation by AID phosphorylation. The Journal of Experimental Medicine. 205 (11), 2585-2594 (2008).
- Liu, M., et al. Two levels of protection for the B cell genome during somatic hypermutation. Nature. 451 (7180), 841-845 (2008).
- Ross, M., Birbeck, M., Wills, V., Forrester, J., Davis, A. Peanut lectin binding properties of germinal centers of mouse lymphoid tissues. Nature. 284, 364-366 (1980).
- Zhang, J., MacLennan, I. C., Liu, Y. J., Lane, P. J. Is rapid proliferation in B centroblasts linked to somatic mutation in memory B cell clones. Immunology Letters. 18 (4), 297-299 (1988).
- Nieuwenhuis, P., Opstelten, D. Functional anatomy of germinal centers. American Journal of Anatomy. 170 (3), 421-435 (1984).
- Lau, A. W., Brink, R. Selection in the germinal center. Current Opinion in Immunology. 63, 29-34 (2020).
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 30, 429-457 (2012).
- Mesin, L., Ersching, J., Victora, G. D. Germinal center B cell dynamics. Immunity. 45 (3), 471-482 (2016).
- Reichert, R. A., Gallatin, W. M., Weissman, I. L., Butcher, E. C. Germinal center B cells lack homing receptors necessary for normal lymphocyte recirculation. The Journal of Experimental Medicine. 157 (3), 813-827 (1983).
- Rose, M., Birbeck, M., Wills, V., Forrester, J., Davis, A. Peanut lectin binding properties of germinal centers of mouse lymphoid tissues. Nature. 284, 364-366 (1980).
- Hamada, S., Fujita, S. DAPI staining improved for quantitative cytofluorometry. Histochemistry. 79 (2), 219-226 (1983).
- Otto, F. DAPI staining of fixed cells for high-resolution flow cytometry of nuclear DNA. Methods in Cell Biology. 33, 105-110 (1990).
- Butcher, E., et al. Surface phenotype of Peyer's patch germinal center cells: implications for the role of germinal centers in B cell differentiation. The Journal of Immunology. 129 (6), 2698-2707 (1982).
- Rogerson, B. J., Harris, D. P., Swain, S. L., Burgess, D. O. Germinal center B cells in Peyer's patches of aged mice exhibit a normal activation phenotype and highly mutated IgM genes. Mechanisms of Ageing and Development. 124 (2), 155-165 (2003).
- Potapov, V., Ong, J. L. Examining sources of error in PCR by single-molecule sequencing. PloS One. 12 (1), 0169774(2017).
- Gonzalez-Fernandez, A., Milstein, C. Analysis of somatic hypermutation in mouse Peyer's patches using immunoglobulin kappa light-chain transgenes. Proceedings of the National Academy of Sciences. 90 (21), 9862-9866 (1993).
- Reboldi, A., Cyster, J. G. Peyer's patches: organizing B-cell responses at the intestinal frontier. Immunological Reviews. 271 (1), 230-245 (2016).
- Betz, A. G., Rada, C., Pannell, R., Milstein, C., Neuberger, M. S. Passenger transgenes reveal intrinsic specificity of the antibody hypermutation mechanism: clustering, polarity, and specific hot spots. Proceedings of the National Academy of Sciences. 90 (6), 2385-2388 (1993).
- Rada, C., Gupta, S. K., Gherardi, E., Milstein, C. Mutation and selection during the secondary response to 2-phenyloxazolone. Proceedings of the National Academy of Sciences. 88 (13), 5508-5512 (1991).
- Heise, N., Klein, U. Somatic Hypermutation and Affinity Maturation Analysis Using the 4-Hydroxy-3-Nitrophenyl-Acetyl (NP) System. Methods in Molecular Biology. 1623, 191-208 (2017).
- Smith, F., Cumano, A., Licht, A., Pecht, I., Rajewsky, K. Low affinity of kappa chain bearing (4-hydroxy-3-nitrophenyl) acetyl (NP)-specific antibodies in the primary antibody repertoire of C57BL/6 mice may explain lambda chain dominance in primary anti-NP responses. Molecular Immunology. 22 (10), 1209-1216 (1985).
- Takahashi, Y., Dutta, P. R., Cerasoli, D. M., Kelsoe, G. In situ studies of the primary immune response to (4-hydroxy-3-nitrophenyl) acetyl. V. Affinity maturation develops in two stages of clonal selection. The Journal of Experimental Medicine. 187 (6), 885-895 (1998).
- Allen, D., Simon, T., Sablitzky, F., Rajewsky, K., Cumano, A. Antibody engineering for the analysis of affinity maturation of an anti-hapten response. The EMBO Journal. 7 (7), 1995-2001 (1988).
- Cumano, A., Rajewsky, K. Clonal recruitment and somatic mutation in the generation of immunological memory to the hapten NP. The EMBO Journal. 5 (10), 2459-2468 (1986).
- Smith, K., Nossal, G., Tarlinton, D. M. FAS is highly expressed in the germinal center but is not required for regulation of the B-cell response to antigen. Proceedings of the National Academy of Sciences. 92 (25), 11628-11632 (1995).
- Hao, Z., et al. Fas receptor expression in germinal-center B cells is essential for T and B lymphocyte homeostasis. Immunity. 29 (4), 615-627 (2008).
- Cervenak, L., Magyar, A., Boja, R., László, G. Differential expression of GL7 activation antigen on bone marrow B cell subpopulations and peripheral B cells. Immunology Letters. 78 (2), 89-96 (2001).
- Naito, Y., et al. Germinal center marker GL7 probes activation-dependent repression of N-glycolylneuraminic acid, a sialic acid species involved in the negative modulation of B-cell activation. Molecular and Cellular Biology. 27 (8), 3008-3022 (2007).
- Olson, W. J., et al. Orphan Nuclear Receptor NR2F6 Suppresses T Follicular Helper Cell Accumulation through Regulation of IL-21. Cell Reports. 28 (11), 2878-2891 (2019).
- Dorsett, Y., et al. MicroRNA-155 suppresses activation-induced cytidine deaminase-mediated Myc-Igh translocation. Immunity. 28 (5), 630-638 (2008).
- Goetz, C., Hammerbeck, C., Bonnevier, J. Flow Cytometry Basics for the Non-Expert. , Springer. (2018).
- Hawley, T. S., Herbert, D. J., Eaker, S. S., Hawley, R. G. Flow Cytometry Protocols. , Springer. (2004).
- Costa, E., et al. A new automated flow cytometry data analysis approach for the diagnostic screening of neoplastic B-cell disorders in peripheral blood samples with absolute lymphocytosis. Leukemia. 20 (7), 1221-1230 (2006).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Methods in Molecular Biology. , 139-150 (2018).
- Lucchesi, S., et al. Computational Analysis of Multiparametric Flow Cytometric Data to Dissect B Cell Subsets in Vaccine Studies. Cytometry Part A. 97, 259-267 (2019).
- Longerich, S., Tanaka, A., Bozek, G., Nicolae, D., Storb, U. The very 5' end and the constant region of Ig genes are spared from somatic mutation because AID does not access these regions. The Journal of Experimental Medicine. 202 (10), 1443-1454 (2005).
- Retter, I., et al. Sequence and characterization of the Ig heavy chain constant and partial variable region of the mouse strain 129S1. The Journal of Immunology. 179 (4), 2419-2427 (2007).
- Shen, H. M., Peters, A., Baron, B., Zhu, X., Storb, U. Mutation of BCL-6 gene in normal B cells by the process of somatic hypermutation of Ig genes. Science. 280 (5370), 1750-1752 (1998).
- Richter, K., et al. Altered pattern of immunoglobulin hypermutation in mice deficient in Slip-GC protein. Journal of Biological Chemistry. 287 (38), 31856-31865 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon