Method Article
オドナタにおけるエレクトロポレーション媒介性RNA干渉法
要約
私たちは、青い尾のダムを使用して、オーダーオドナタ(トンボとダムリー)の昆虫に対するエレクトロポレーション媒介性RNA干渉(イシュヌラ・セネガルシス:コエナゴロ科:ツィゴプテラ)とパイドスキマートンボ(プセミソナタ:リベルリドエ:アネリスラプテ)を使用して詳細なプロトコルを提供します。
要約
トンボとダムナタ(オーダー・オドナタ)は、生息地、形態、行動を水生幼虫からパパルステージのない陸上/空中成人に劇的に変える、変態を伴う最も先祖の昆虫の1つを表しています。オドナタの成人は、よく発達した色覚を持っており、男女、段階、および種全体の体の色とパターンの顕著な多様性を示しています。オドナタに関する生態学的・行動的研究は多く行われてきましたが、主に遺伝子機能解析をオドナタに応用することが困難なため、分子遺伝学的研究は乏しい。例えば、RNA干渉(RNAi)は、鱗翅目で報告されているように、オドナタではあまり効果がありません。この問題を克服するために、生体内エレクトロポレーションと組み合わせたRNAi法の確立に成功しました。ここでは、幼虫の調製、種同定、dsRNA/siRNA溶液および注射針の調製、幼虫の氷冷麻酔、dsRNA/siRNA注射、生体内エレクトロポレーション、および成人までの個別飼育のビデオを含む詳細なプロトコルを提供する。エレクトロポレーション媒介RNAi法は、ダムリー(サブオーダーZygoptera)とトンボ(サブオーダーアニソプテラ)の両方に適用できます。このプロトコルでは、青い尾のダム自身イ シュヌラセネガルンシス (コエナグリオニダエ)の方法を、ダム種の例として、そしてパイドスキマートンボ シュードテムゾナータ (Libellulidae)をトンボ種の別の例として紹介します。代表的な例として、マルチ 銅オキシダーゼ2のメラニン合成遺伝子を標的とするRNAiの結果を示す。このRNAi法は、変態、形態形成、色パターン形成、およびオドナタの他の生物学的特徴に関与する様々な遺伝子機能の理解を促進する。さらに、このプロトコルは、一般に、RNAiが非効率および低い浸透性による遺伝子抑制にあまり効果がない非モデル生物に適用できる。
概要
トンボとダムリー(オーダー・オドナタ)は、「変態」1、2を示す昆虫の最も祖先のグループの一つです。変態によって、彼らは生息地、形態、行動を水生幼虫から陸生/空中成人3に大幅に変える。オドナタの成人は、よく発達した色覚を持っており、男女、段階、および種3、4、5の間で体の色やパターンの顕著な多様性を表しています。オドナタに関する生態学的・行動学的研究は6,7回行われてきましたが、主に遺伝子機能解析の難しさから、分子遺伝学的研究が妨げられています。
従来のRNA干渉(RNAi)法では、目的遺伝子8の機能を抑制するためにRNA(dsRNA)を二本鎖で注入し、オドナタ昆虫9において効果がないことが判明した、鱗翅目昆虫10に報告された。一方、以前の報告では、エレクトロポレーション媒介RNAiが鱗翅目の種、特に表皮組織11、12、13において有効であることを示唆している。我々は最近、エレクトロポレーション媒介RNAiが小さなトンボナンノフィアピグマエア(リベルリダエ:アニソプテラ)9で効果的に働くことを発見したが、N.ピグマエアは比較的希少種であり、したがって分子遺伝学的研究には適していない。
ほとんどのオドナタ種は、2つのサブオーダー、ザイゴプテラ(ダムリー)またはアニソプテラ(真のトンボ)3のいずれかに分類されます。ここでは、青い尾のダム自身イ シュヌラセネガルンシス (コエナグリオンリダエ;コエナグリオンリダエ;. 図 1A)代表的なザイゴプテラン種とパイドスキマートンボ シュードヘティスゾナタ (リベルリダエ; 図 1B)代表的なアニセプテラン種として。2種は、筑波市を含む日本の自然・都市池で最も一般的なオドナタ種の一種であり、我々はフィールド内の2つの種の多くの幼虫を収集することができます。最近、 私たちは、I.セネガルの個々の幼虫のための実験室の飼育システムを確立し、オドナタ幼虫の発達と形態形成の継続的なモニタリングを詳細14に可能にした。
本レポートでは、エレクトロポレーション媒介RNAiのI. セネガルおよびP. ゾナタの洗練された方法とビデオプロトコルを提供します。日本では、遺伝的に近いI.セネガルとイシュヌラアジアティカは、しばしば、15の間に交感的に見られ、幼虫16では区別が難しい。また、制限フラグメント長多型(RFLP)により、2種のイシュヌラ種を区別する方法についても説明する。
エレクトロポレーション媒介RNAiの有効性を評価するために、遺伝子発現のノックダウン時の淡性キューティクル色の可視表現型に基づき、マルチ銅オキシダーゼ2遺伝子(MCO2;別名ラクケース2)を代表的な標的遺伝子として選択する。MCO2は、様々な昆虫種17、18の表皮の黒ずみには欠かせないものとして知られている。
プロトコル
注: プロトコルの全体的なスキームは図 1に示されています。
トンボやダムリーの幼虫の準備。
- ハンドネットを使用して現場で幼虫を収集します。
注:私はセネガルの幼虫はしばしば水面に浮かぶ水の植物にしがみついているが、P.ゾナタ幼虫はしばしば底部の葉のごみの中にとどまる。筑波市では、3月から6月まで、そして5月から6月までは、I.セネガルの最終インスター幼虫が見つかっています。I. セネガルの幼虫は、実験室14の卵から飼育することができるが、現場で採取された幼虫は明らかに成人の出現の成功率が高い。 - PCR増幅産物の制限フラグメント長多型(RFLP)による種同定。
注:このステップは、種が幼虫の出現から識別することが困難である場合にのみ必要です , 私.- 鉗子を使用して幼虫の尾子のエラの1つを保持します。その後、幼虫は尾大エラ自体から落ちる(オートトミーを引き起こす)。
注:ザイゴプテランダムの幼虫は、通常、3つのコーダルエラを持っています(図1A)。彼らは捕食者に攻撃されたとき、彼らは脱出するために自分の尾のエラを脱ぐことができます。尾大のギルが利用できない場合、脚の一部が解剖される。 - PBS溶液の100 μLに1つのコーダルギルを入れて [0.8% NaCl, 0.02% KCl, 0.115% Na2HPO4, 0.02% KH2PO4 (w/v)、 デポジットペスタを使用してミキサーハンドで均質化します。
- 混合物を5,000xgで10秒間スピンダウンし、上清の0.5μLをDNAポリメラーゼおよびプライマーを用いてPCR増幅し、核DNAの内部転写スペーサー1(ITS1)領域を増幅する。
注: 製造元のプロトコルに従って PCR を実行します。ITS-F0(5'-GGA AAG ATGGCC AAA CTT GA -3')と5.8S-AS1(5'-GCC GGC CCT CAG CCA G-3')プライマーの組み合わせは、ほぼすべてのオドナタ種19でITS1領域を増幅することができる。 - PCR増幅産物1μL、10x Mバッファー0.3μL、DraI制限酵素0.1μL、37°Cで1.6μLの水を1時間インキュベートします。
注:種の組み合わせに応じて、最適な制限酵素を選択します。種同定に適した制限酵素がない場合は、DNAシーケンシングにより確認する。 - 2%アガロースゲルに染料を積み込んで2μLの製品をロードし、電気泳動を実行します。
注:1%または1.5%アガロースゲルを使用する場合、種を同定することは困難です。 - 電気泳動パターンを調べて、種を特定します(図2)。
注: RFLP パターンは、種依存および人口依存です。筑波人口では 、I.asiatica は400-500 bpの主要バンドを有するが、 一方、I.セネガル 人は、約200bpの主要バンドと100bp未満の追加バンドを有する( 図2の矢印頭)。ITS1領域はゲノム中の複数のコピーに存在し、 イシュヌラ 種では、ITS1領域内のマイクロサテライト多型が同じ個体に存在することが多く、RFLPSのパターンに影響を与える。
- 鉗子を使用して幼虫の尾子のエラの1つを保持します。その後、幼虫は尾大エラ自体から落ちる(オートトミーを引き起こす)。
- RNAiに使用するまで、実験室で収集した幼虫を後ろに下ろします。
- 各幼虫を約3mLの水で12ウェルプレートの各ウェルに別々に入れます。
注: 私はセネガルの 幼虫は頻繁に互いにカニバリゼーションするので個別に飼わなければならないが 、P.ゾナタ 幼虫はめったにカニバライズしないのでグループに入れておくことができる。 - 毎日アルテミア塩水エビを含むセネテンシス幼虫と、RNAiに適した発達段階に成長するまで、少なくとも週に2回、血虫および/またはTubifexワームを含むP.ゾナタ幼虫を供給する。
注:頻繁な給餌は、大人の出現の成功率を高めるために重要です。 - 水は、フェスや残り物で汚れるとすぐに交換します。
注:頻繁な水の変化は、大人の出現の成功率を高めるためにも重要です。 - RNAiの適切な発達段階を判断する。
注意:I.セネガルの最後のインスター幼虫は、5つの発達段階14、20に分類することができます。第1段階(ステージA、翼が膨張し始める前)または最終段階(ステージB)は、成人出現後のRNAiの明確な表現型を考慮した場合に、RNAi実験に適している(議論参照)。P.ゾナタでは、翼拡張前の最終インスター幼虫(I.セネガルのステージAに対応)がこの研究で使用された。
- 各幼虫を約3mLの水で12ウェルプレートの各ウェルに別々に入れます。
2. RNAi用のdsRNA/siRNA溶液および注射針の調製
注: RNAi の溶液として、小さな干渉RNA (siRNA) (ステップ 2.1) または二本鎖 RNA (dsRNA) (ステップ 2.2) のいずれかを選択します。
- siRNA溶液の調製
- siDirectプログラムバージョン2.0(http://sidirect2.rnai.jp/)21を使用してsiRNAを設計し、以前に報告されたガイドラインに従って、鱗翅目昆虫22.
- 市販の siRNA を得る。
注:この研究で使用されたI.セネガルンシスのSiRNAの配列は、センスストランドの5'-GCA CUU UCC GUU AUC AAU AUA -3'、アンチセンス鎖に対する5'-UAU UGA UAA CGG AAAGUG CUC -3'でした。陰性対照として、siRNA標的の配列は、増強された緑色蛍光タンパク質(EGFP)遺伝子である:5'-GCA UCA AGG UGA ACU UcA AGA -3'センス鎖および5'-UUG AAG UUC ACC UUG AUG CCG-3'アンチセンス11に対する。 - 注射バッファー[100 mM CH3COOK、2 mM Mg(CH3COO)2、30mM HEPES-KOH、pH 7.4]22でsiRNAを100 μMに希釈します。
- 使用するまで-80°Cで保管してください。
- dsRNA溶液の調製
- primer3 プログラム バージョン 4.1.0 (http://bioinfo.ut.ee/primer3/)23を使用して dsRNA の 300-400 bp 領域を選択し、プライマー セットを設計します。
- 市販の合成プライマーセットを得る。
注:dsRNA合成用のテンプレートを作成するために、この研究で使用されるプライマーセットは、フォワードプライマー用の(5'-GCC TGT CAG CTT TGT CTT CC-3'および5'-GGT GTC TGG CGG ACA ACT AT AT -3'逆プライマー)のMCO2遺伝子(IsMCO2、アクセロン)の次の通りでした。LC589180)および(5'-CCG CAC AGC TGC TCA CTA TTC AA -3'フォワードプライマー用、および5'-GGA GGA TTC CTT CAT CGA CA-3'リバースプライマー)(PzMCO2,加盟番号. LC589179)。陰性対照として、クローニングベクター上のβラクタマーゼ(bla)遺伝子を標的とするdsRNA用プライマーセットは、フォワードプライマーに対してCTA TGT GGC GCG GTA TTA T-3'および5'-CAG AAG AAG TGG TCC TGC AAC T-3'を逆プライマー用に設定した。 - 市販のRNA抽出キットを用いてオドナタ幼虫からRNAを抽出し、製造者のプロトコルに従って逆転写酵素を用いてcDNA合成を行います。
注:RNAシーケンシング解析用に用意したcDNAライブラリも使用できます。 - 合成されたcDNAと設計されたプライマーセットを使用してターゲット配列を増幅し、製造業者のプロトコルに従って市販のリガーゼを使用してクローニングベクターにクローン化します。
- プラスミドを 大腸菌 の有能な細胞に変換し、一晩のインキュベーション後に単一のコロニーを拾う。
- PCR-ベクター上のプライマーを使用して挿入領域を増幅する。
- サンガーシーケンスによってクローン化されたシーケンスを確認します。
- PCR-増幅は、T7ポリメラーゼプロモーター配列24,25を含むベクタープライマーを用いてインサートを増幅する。
注:この研究では、T7-F(5' - TAA TAC GAC TCA CTAタグGGAタグGGAタグGGA T - 3')およびT7-R(5'-TAA TAC GAC TCA CTAタグGGA GAC CCG GGG ATC CGA T - 3') 25. - メーカーのプロトコルに従ってPCR精製キットを使用してPCR製品を精製し、蒸留水を50μLでDNAを溶出し、遠心エバポレーターを使用して溶出したDNA溶液を約10μLに濃縮します。
- メーカーのプロトコルに従ってインビトロ転写によってdsRNAを合成する。100 μLの溶出バッファーを持つ合計 1000 ng テンプレート DNA および溶出合成 dsRNA を使用します。
- 分光光度計を用いてdsRNAの濃度を測定し、1.5%アガロースゲル上の電気泳動によりdsRNAの品質を確認します。
注: dsRNA 合成が成功すると、単一バンドが見られます。 - 溶出バッファーでdsRNAを1000 ng/μLに希釈し、使用するまで-20 °Cで保存します。
- 注射針の準備
- ガラスの針の引き手を使用して、ガラスの毛細血管を引っ張ります。
- 引っ張られた毛細管の先端を両面粘着テープの上に置き、鉗子で毛細管の先端を壊します。
- 毛細管をインジェクタに設定します。
注意:ニトリル手袋を着用すると毛細血管の扱い方が簡単です。 - siRNA/dsRNA溶液を調製したキャピラリーにロードします。
注:注入された毛細血管の先端が泥の中に住んでいたために汚れで詰まる可能性があるので、毛細血管を繰り返し使用しないでください。
3. siRNA/dsRNA注射
注意:手順は、ダムリー(ステップ3.1)とトンボ(ステップ3.2)のためにわずかに異なります。
- ジゴプテラン(ダムリー)幼虫への注射(例えば、セネガル人)。
- 砕氷上の湿った紙で覆われた幼虫を50~70秒間麻酔します(図3A-C)。
注:氷冷麻酔の持続時間は、幼虫の状態に依存します。幼虫が氷冷麻酔の70秒後に動き始めると、さらに70秒間の氷冷麻酔が加えられる。めったに動かない幼虫(例えば 、P.ゾナタ)では、この手順は必須ではありません。 - プロソラックスの両側に2本のピンを取り付け、幼虫を固定スタンド(発泡スチロールの一部など)に固定します(図3D)。
注: インジェクションの場所に応じて、ピンの位置と数を調整します。 - 腹部のRNAiの7番目と8番目の腹部セグメントの間、または手と鉗子を使用して胸郭のRNAiの前胸とシンソラックス(融合メソトルクとメタソラックス)の間のセグメント間膜を伸ばします。
- セグメント間膜を手で伸ばしたままにします。
- 準備した毛細管の先端を伸ばされたセグメント間膜に挿入する(図3D、3F)。
- 1 μLのsiRNA/dsRNA溶液を注入します。
- 砕氷上の湿った紙で覆われた幼虫を50~70秒間麻酔します(図3A-C)。
- アニソプテラン(トンボ)幼虫(例えば 、P.ゾナータ)への注射。
- 幼虫の表面から水をペーパータオルで拭き取ります。
- 必要に応じて、プロソラックスの両側に2本のピンを取り付け、幼虫を固定スタンド(発泡スチロールの一部など)に固定します(図3H)。
注: インジェクションの場所に応じて、ピンの位置と数を調整します。 P. ゾナタの場合、このステップで幼虫をピンで固定することは必須ではありません。 - 4番目と5番目の腹部セグメントの間のセグメント間膜を手で伸ばします。
- 第4と第5の腹部セグメント間のセグメント間膜に細かい針で小さな穴を作ります。
注:この手順は、多くのアニソプテラン(トンボ)種に必要です。なぜなら、セグメント間膜はガラスの毛細管を直接挿入するのが難しすぎるからである。 - 準備された毛細管の先端を準備された穴に挿入します(図3I)。
注: 図3Hに示すように、幼虫の背側の部分は成体の腹側に対応するため、図 3H-Jのように処理すると表現型が腹腹に現れます。 - 1 μLのsiRNA/dsRNA溶液を注入します。
4. 生体内エレクトロポレーション
- 必要に応じて、固定スタンド(発泡スチロールの一部など)に幼虫を固定するために、より多くのピンを追加します。
- siRNA/dsRNA溶液の注入に続いて、鉗子を使用して幼虫表面に超音波ゲルの2つの液滴を適用する。
- 超音波ゲルに電極を置き、反対側にsiRNA/dsRNA溶液を注入した側に正極を、負極を反対側に置く(図3E、3G、3J)。
メモ:エレクトロポレーションの燃焼効果を避けるために、幼虫の表皮に直接触れないでください。 - エレクトロポレーターを使用して10回のエレクトロポレーションパルス(それぞれ280 ms/s)を生成します。
注:種、ステージ、組織に応じて、エレクトロポレーションの電圧を調整してください。本研究では、25 Vが I.セネガルに 適用され、45 V からP.ゾナタに適用された。 - 表面の残りのゲルをペーパータオルで拭き取ります。
- 治療した幼虫を濡れたペーパータオルの上に約1日置いて回復し、翌日に飼育ケースに移します。
5. サイト固有のフェノールチ分析
- 約10mLの水とペーパータオルを含むペトリ皿(直径5cm)に個別にI.セネガルを保管し、使い捨ての不織布メッシュ(エクロセンケージ14)を備えたプラスチックケージにP.ゾナタを入れておく。
- 私のセネガル人の場合、幼虫が食べるのをやめた後、使い捨ての不織布メッシュを持つプラスチックケージに個別に移動します。
注意:同じケージに2匹以上の幼虫を入れないでください。そうでなければ、彼らは大人になった直後に互いにカニバリゼーションします。 - 成人の出現後、正極がエレクトロポレーションのために配置された領域の周りの表現型を観察し、撮影する。
注: 表現型はパッチにのみ表示されます。多くの場合、未完了の色素沈着により、発覚直後に認識することは困難です。 - RNAiの効率(例えば、定量的RT-PCR)を調べるために、表現型が目に見える場合は、領域を解剖し、表現型のない領域と比較します。
注: RNAi表現型のレベル、すなわちキューティクル脱色のサイズと位置は、多くの場合、個人間でかなりの変動を示します( 図4参照)。 - 将来の分析のために100%EtOHで新興の成人を保ちます。
注:オドナタ種のボディカラーは死後すぐに消えてしまうので、死ぬ前にエタノールに保存することが重要です。エタノールは時々昆虫を色分けし、そのような場合には昆虫が死ぬ前に凍結する。
結果
上記のプロトコルを、Pゾンタの腹部におけるMCO2遺伝子および陰性対照遺伝子(siRNA用EGFPおよびdsRNA用ブラ)(i)の腹部に、I.セネガル科の腹部(図4)、(ii)を用いたエレクトロポレーション媒介RNAiを適用した。 RNAi実験の結果を表1にまとめた。負に帯電したsiRNA/dsRNAは正に荷電した細胞にのみ組み込まれるため、正極がエレクトロポレーションのために配置された領域の周りにRNAiのフェノタイプが観察された。
I. セネガルとP. ゾナタの両方で、正極が配置された領域(白い矢印と点線の図4、図5、および図6)にメラニン色素沈着の阻害(すなわち、黒、茶色、赤褐色)が現れた( 対照的に、コントロール遺伝子を注入した場合、エレクトロポレーション部位の周囲にフェノミスティック効果は認められなかった(EGFP siRNAまたはbla dsRNA)(図4、図5、 図6、表1)。また、エレクトロポレーションを伴わずにMCO2遺伝子を注入しても、成人の色素沈着には影響を及ぼさなかった(図4、表1)、オドナタのRNAiにエレクトロポレーションが不可欠であることを示す。青、緑、黄色の着色は、キューティクルにおけるメラニン合成に関与するMCO2遺伝子のRNAiの影響を受けず、これらの身体の色が透明なキューティクル26を通して見える表皮細胞に存在する色素顆粒に起因するという事実を反映している。図4に示すように、siRNA処理とdsRNA処理を行った個体間では顕著な表現型の違いは認められなかったが、RNAi表現型のサイズと位置のかなりの変動は、同じRNAi処置を施した異なる個体間で認められた(図4のIsMCO2 dsRNAの2つの例を比較する)。
RNAi治療に最も適した発達段階を決定するために、私は、I.セネガルの最終幼虫インスターの5つの形態学的段階(ステージA-E)におけるRNAi治療の表向きの結果を比較した(図7A)。MCO2 RNAiによるメラニン色素沈着の阻害は、AおよびBの段階で注入された場合に出現したすべての成人において観察された(図7C)。CおよびDの段階で注入すると、一部の成人ではメラニン色素沈着の抑制が確かに認められたが、他の成人は創傷による異常な着色を示した(図7B)。
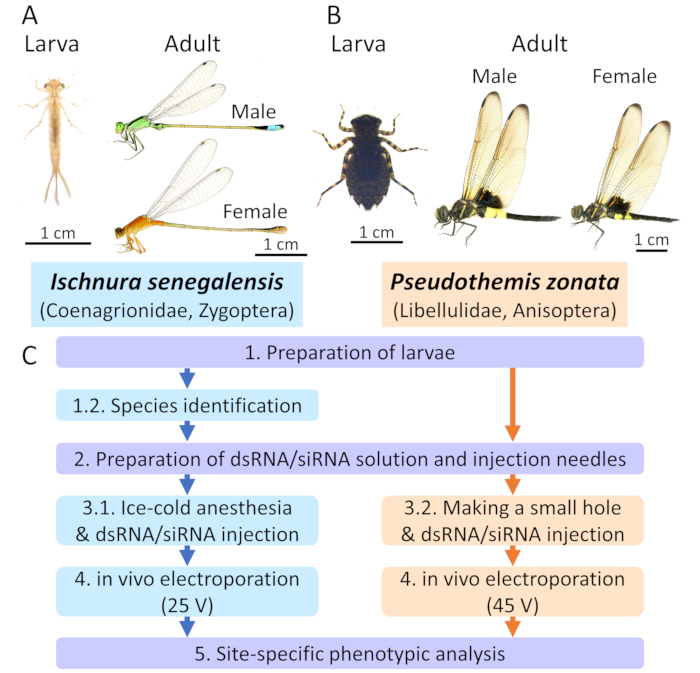
図1:オドナタにおけるエレクトロポレーション媒介性RNAi法A.代表的なダムナリー種としてのイシュヌラ・セネガルンシス(コエナギロニダエ)。B.トンボ種の代表的な擬似テムゾナタ(リベルリダエ)。C.プロトコルの全体的なスキーム。青とオレンジのボックスは、それぞれ、I. セネガルと P. ゾナタのプロトコルを示します。紫色のボックスは、両方の種に適用される一般的なプロトコルを示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
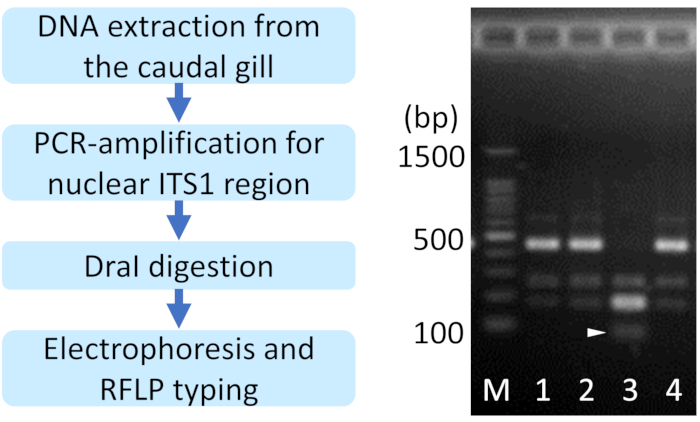
図2:イシュヌラ種に対する制限フラグメント長多型(RFLP)ベースの種同定の代表的な結果。アローヘッドは、I.セネガルシス特異的なバンドを示しています。1, 2, 4: I. アジアチカ, 3: I. セネガル人症, M: 100ベースペアラダーマーカー.この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:オドナタにおけるエレクトロポレーション媒介性RNAi法A-C.I. セネガルの氷冷麻酔 .矢印は幼虫を示す。A.濡れた紙で砕いた氷の上に幼虫を置く。B.氷上の幼虫の拡大図。C.氷の上に濡れた紙で覆われた幼虫。D-G.I. セネガル人のための RNAi メソッド .D.胸郭への注入。E.胸郭のエレクトロポレーション。F.腹部への注射。G.腹部のエレクトロポレーション。H-J.P. ゾナータのための RNAi メソッド 。H.腹部に小さな穴を開ける。私は。腹部への注射。J.腹部のエレクトロポレーション。矢印は穴や注入をするポイントを示します。+, -: 正/負の側電極。数字は腹部のセグメントを示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
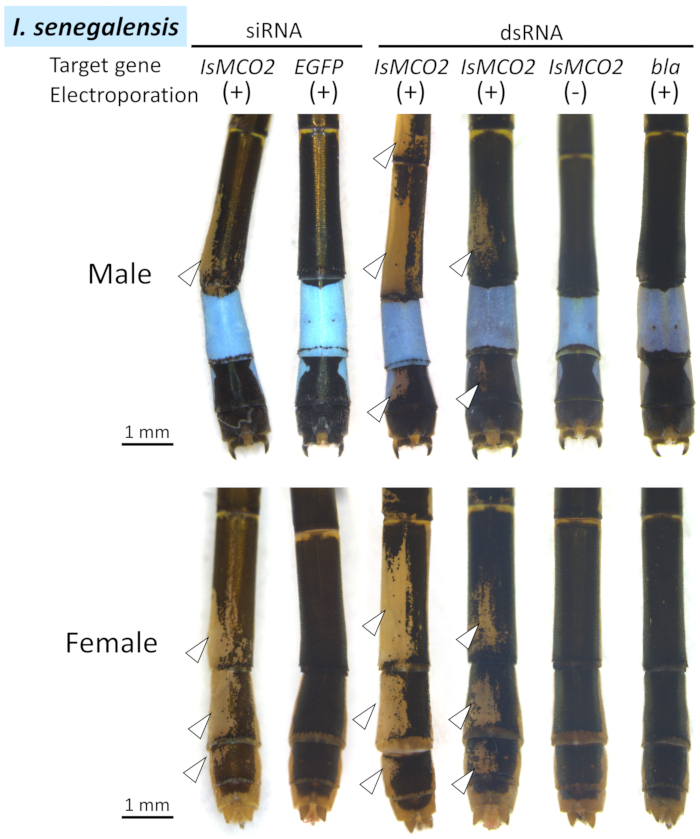
図4: I. セネガルの腹部に対する RNAi の表型のドーサル図。白い矢印は、抑制されたメラニンゼーションの領域を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
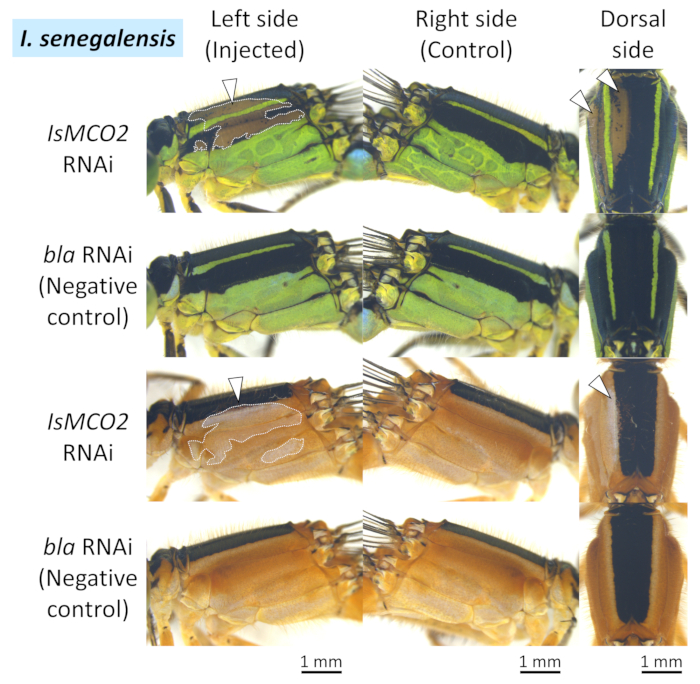
図5: I. セネガルの胸郭におけるRNAiの表型の側面と後ろ方向の図.白い矢印と点線は、抑制された色素沈着の領域を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
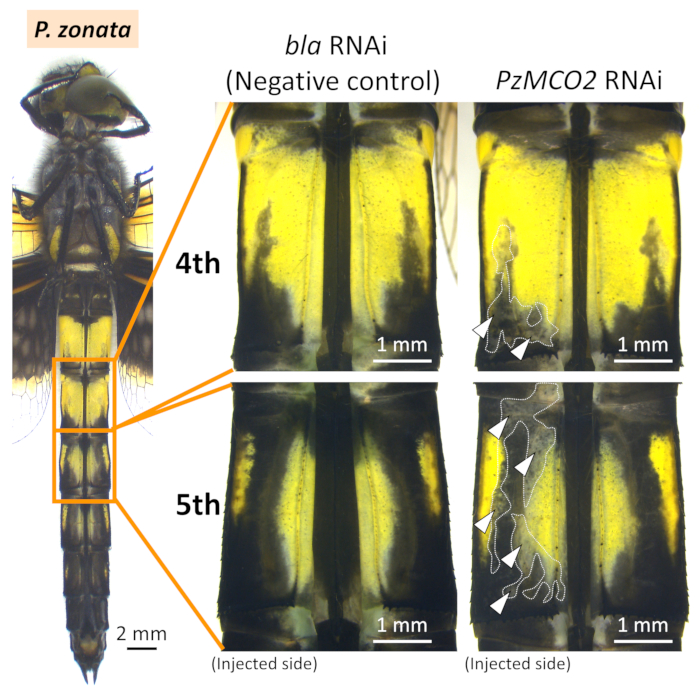
図6: P. ゾナータの腹部におけるRNAi型の腹側図白い矢印と点線は、抑制されたメラニンゼーションの領域を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
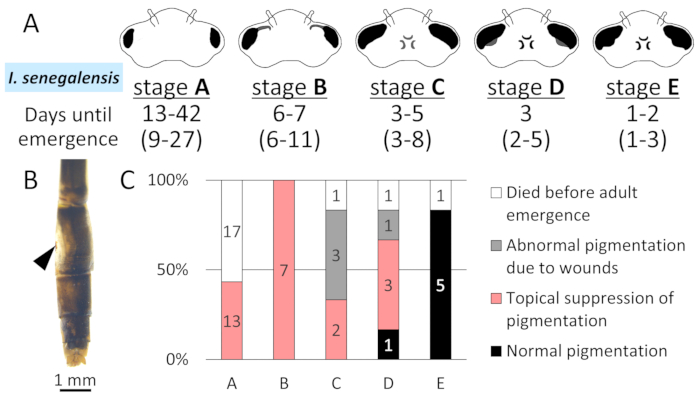
図7: ステージ依存 IsMCO2 RNAi 作用の最終幼虫インスター中 I.セネガルシス.A.この研究では、5つの形態学的段階(ステージA-E)における複合眼の形態学的変化および成人までの出現日数。括弧内の数字は、前のレポート14からです。B.創傷による異常な色素沈着。矢印はエレクトロポレーション部位を示す。C.5つの形態学的段階におけるRNAiが、I.セネガルにおける成人色素沈着に及ぼす影響バーの数字は個人の数を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 種 | I.セネガル人 | P.ゾナタ | |||||||||
| 注入された領域 | 腹部 | 胸部 | 腹部 | ||||||||
| シラナ/dsRNA | Sirna | Dsrna | Dsrna | Dsrna | |||||||
| 標的遺伝子 | イスムコ2 | エグFP | イスムコ2 | イスムコ2 | Bla | イスムコ2 | Bla | プシュムコ2 | プシュムコ2 | Bla | |
| エレクトロポレーション | + | + | + | - | + | + | + | + | - | + | |
| 注射された幼虫 | 22 | 25 | 30 | 6 | 53 | 12 | 20 | 17 | 5 | 9 | |
| 新興成人 | 7 | 6 | 13 | 4 | 40 | 11 | 14 | 11 | 2 | 5 | |
| 色素領域が少ない成人(比) | 7 (100%) | 0 (0%) | 13 (100%) | 0 (0%) | 0 (0%) | 10 (91%) | 0 (0%) | 11 (100%) | 0 (0%) | 0 (0%) | |
表 1.I. セネガルの成人色素沈着に対する RNAi の効果と P. ゾナータ.ステージAの結果は、I.セネガルで示されています。IsMCO2:マルチ銅オキシダーゼ 2遺伝子I. セネガルの, EGFP:強化された緑色蛍光タンパク質遺伝子, bla: pGEM-T簡単ベクターからのベータラクタマーゼ遺伝子, PzMCO2: P. ゾナータのマルチ銅オキシダーゼ 2遺伝子.対照遺伝子の結果は、著者がこれまでに行った実験の総数を表しています。
ディスカッション
RNAi治療の致死性
RNAi治療の致死性は、オイナータ幼虫の飼育履歴と状態に強く依存することがわかりました。現場で採取した直後の幼虫は一般的に健康で、エレクトロポレーション媒介RNAi治療後の死亡率が低い。対照的に、長期間(例えば、1ヶ月)実験室で飼育された幼虫は、成人の出現の低い成功率に苦しむ傾向がある。 私は、セネガルでは、畑で採取した幼虫の代わりに、卵から実験室で飼育された幼虫を14個使用することができるが、実験室で飼育された幼虫を用いたRNAiの成功率は、フィールド採取された幼虫を使用する幼虫を使用する幼虫よりもかなり低い傾向がある(多くの個体が変態中に死亡した)。さらに、頻繁な幼虫の摂食およびきれいな水の飼育は、成人の出現の成功率を高め、RNAi治療の致死性を低下させるために重要である。
RNAi治療の効率
上述したように、RNAi表現型のレベル、すなわちキューティクル脱色の大きさと位置は、同じRNAi処置を施した個体(例えば図4)の間でかなりの変動を示すことが多いが、表現型の浸透のレベルは、オイドナタ種間で著しく異なるように見える。観察されたフェロチ領域は、P.ゾナタ(図6)およびN.ピグマエ9よりも、I.セネガル人(図4-5)においてより大きく、より顕著であった。この違いは、I.セネガルのキューティクルがP.ゾナータおよびN.ピグマエアのキューティクルよりも薄いことを考慮して、幼虫表面のキューティクルの厚さによる可能性があります。我々が調べた限り、siRNAとdsRNAの効果との間に明確な違いは認められていない(図4、表1)。
RNAiの適切な開発段階
RNAiを効率的に行う上で適切な幼虫のステージングが重要であることを留意すべきである。成人色素沈着の阻害は、ステージD(成人出現の約3日前)前のMCO2 RNAiによって引き起こされたが、これはN.ピグマエ9に関する前回の報告と一致している。CおよびDの段階で注入されたRNAi表現型は、ステージAおよびBで治療されたものよりも目立たず、これは、CおよびDの段階が遺伝子発現を十分に抑制するには遅すぎる可能性があることを示している。RNAi治療の適切なタイミングは、遺伝子発現のタイミングに依存し、MCO2遺伝子は、他の昆虫17、18のように、成人の出現9の間に一過性高い発現を示す。臭いバグプラウティアスタリでは、MCO2遺伝子のRNAiノックダウンが注射27の4日目以降に観察され、これは現在の結果と一致している。
I. セネガルに関する我々の以前の研究は、ステージBの後、成人への出現が最終的なインスター幼虫の大部分の間で比較的小さな変動を示すことを示し、ステージBが成人の出現に向けたプロセスの開始に対応し、その後、変態の発達プロセスは接頭辞と協調的な方法で進む可能性を示唆した。創傷によって引き起こされる形態異常は、幼虫がCおよびDの段階でRNAi処置されたときしばしば観察された(図7B、7C)。 これは、これらの段階における変態の劇的な進行に関連している可能性が高く、RNAi治療はステージCから避けるべきであることを示唆している。要約すると、ステージAまたはBの最終インスター幼虫(または幼虫の翼が大幅に拡大する前の段階)をRNAi実験に使用することをお勧めします。
エレクトロポレーション媒介RNAi法の有用性と優位性
従来のRNAiは単純で強力な実験方法ですが、蝶10、アブラムシ28、 トンボ9 のような昆虫系統の中には、遺伝子機能解析の確立が大きな課題である低RNAi効率を示すものもあります。本研究では、エレクトロポレーション媒介RNAiが、少なくとも表皮において、適切な発達段階で治療すれば、ほぼ100%の効率でトンボの局所的な遺伝子抑制を誘導できることを発見した(表1)。最近、CRISPR/Cas9ベースの遺伝子ノックアウトは、様々な昆虫にうまく適用され、非モデル生物29に強力な分子遺伝学的ツールを提供している。しかし、ここではCRISPR/Cas9は確かに素晴らしいと指摘していますが、エレクトロポレーションを介したRNAi法はCRISPR/Cas9よりいくつかの点で優れている可能性があります。
まず、エレクトロポレーション媒介RNAi法において、RNAiの表型が現れる身体領域は、エレクトロポレーション時の正極の位置によって実験的に容易に制御することができる。また、遺伝子発現が抑制される領域は正極が配置された領域の周りに限られているため、RNAi表現型は同じ個体中の対照表現型と並んで容易に比較することができる。第二に、卵を注入してノックアウトフェノタイプを観察するために成人期まで飼育しなければならないCRISPR/Cas9法と比較して、エレクトロポレーション媒介RNAiは、遺伝子ノックダウン型が通常はるかに短い時間で観察される点で優れている。例えば、私セネガル人は3~4ヶ月、P.ゾナタは卵から大人14、30まで1~2年かかります。しかし、成体表皮内のRNAi表現型を観察するために、ステージBでの最終インスター幼虫へのdsRNA注入から、I.セネガルおよびP.ゾナータの両方の成人出現まで1ヶ月未満で要する(図7)。第三に、エレクトロポレーション媒介RNAi法は、CRISPR/ Cas9法に必要な小さな卵へのマイクロインジェクションよりも簡単な大きな幼虫へのdsRNA注入を伴う。さらに、エレクトロポレーション媒介RNAiは、新たに産卵した卵を採取することが困難な昆虫種にも適用可能である。例えば、P.ゾナタの雌は飛行中に水面上の浮遊植物に卵を産み、したがって、フィールドと研究室の両方で卵を収集することは困難です。したがって、このプロトコルは、一般的に、従来のRNAi法が効率的に機能しない非モデル生物に適用できると期待しています。
開示事項
著者らは開示するものは何もない。
謝辞
森山実氏は、技術的なアドバイスとサポート、小豆田幼虫を集めたビン・ヒロタと鈴木龍太郎、原稿に対する有用なコメントに感謝します。この作業は、JSPS KAKENHIグラント番号JP18J21561からGO、JP18H02491、JP18H04893、JP19H03287、およびJP20H04936からRFにサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 12-well plate | Violamo | VTC-P12 | For rearing larvae before injection |
| Brine shrimp eggs | JAPAN PET DESIGN | 4975677012396 | |
| Calibrated micropipette (1-5 µL) | Drummond | 2-000-001-90 | |
| Deposit pestle 1.5 mL | Thermo Fisher Scientific | K749520-0090 | |
| Digital high defenition microscope camera | Leica Microsystems | MC170HD | |
| Disposable non-woven mesh | HAKUGEN EARTH | DSC-105A | |
| DNA Ligation Kit Ver.2.1 | Takara Bio | 6022 | |
| DraI | Takara Bio | 1037A | |
| Electrode (1mmφ) | NEPAGENE | CUY650P1 | |
| Electroporator | CellProduce | Cure-gene | |
| Forceps | KOWA Forceps Industry | K-10 No1 | |
| Glass needle puller | NARISHIGE | PN-3 | |
| Hand mixer | AS ONE | 1-229-02 | |
| Hand net | HOGA | IS33-3B | |
| HEPES | FUJIFILM Wako Pure Chemical Corporation | 346-01373 | For injection buffer |
| Insect pin capitate No. 3 | Shiga Konchu Fukyusha | N230 | For fixing larvae |
| KCl | FUJIFILM Wako Pure Chemical Corporation | 163-03545 | For PBS |
| KH2PO4 | FUJIFILM Wako Pure Chemical Corporation | 169-04245 | For PBS |
| KOAc | FUJIFILM Wako Pure Chemical Corporation | 160-03175 | For injection buffer |
| KOH | FUJIFILM Wako Pure Chemical Corporation | 168-21815 | For injection buffer |
| Laboratory Jack (150x150) | AS ONE | 1-4642-11 | For adjusting the position of the manipulator |
| LOGIQLEAN Gel for Ultrasound Hard type | GE Healthcare | 2369385 | |
| Manipulator | Muromachi Kikai Co., Ltd. | SJ-1 | For adjusting the position of the injector and the capillary |
| MEGAscript RNAi kit | Thermo Fisher Scientific | AM1626 | |
| Mg(OAc)2 | FUJIFILM Wako Pure Chemical Corporation | 130-00095 | For injection buffer |
| Na2HPO4 | FUJIFILM Wako Pure Chemical Corporation | 197-02865 | For PBS |
| NaCl | FUJIFILM Wako Pure Chemical Corporation | 191-01665 | For PBS |
| Petri dish (5 cm diameter) | Iwaki | 1010-060 | For rearing injected larvae |
| Pneumatic Injector | NARISHIGE | IM-12 | |
| pT7Blue T-Vector | Novagen | 69820 | |
| QIAquick PCR Purification Kit | QIAGEN | 28106 | |
| RNAiso Plus | FUJIFILM Wako Pure Chemical Corporation | 9109 | |
| RNeasy Mini Kit | QIAGEN | 74106 | |
| Shiga micro insect pin with stainless headless | Shiga Konchu Fukyusha | N251 | For making a small hole |
| Stereoscopic microscope | Leica Microsystems | S8APO | |
| SuperScript IV Reverse Transcriptase | Thermo Fisher Scientific | 18090010 | |
| TaKaRa Ex Taq | Takara Bio | RR001B | For PCR-amplification from plasmid |
| Tks Gflex DNA Polymerase | Takara Bio | R060B | For PCR-amplification from caudal gill |
参考文献
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Wipfler, B., et al. Evolutionary history of Polyneoptera and its implications for our understanding of early winged insects. Proceedings of the National Academy of Sciences of the United States of America. 116 (8), 3024-3029 (2019).
- Corbet, P. S. . Dragonflies Behavior and Ecology of Odonata. , (1999).
- Futahashi, R. Color vision and color formation in dragonflies. Current Opinion in Insect Science. 17, 32-39 (2016).
- Futahashi, R. Diversity of UV reflection patterns in Odonata. Frontiers in Ecology and Evolution. 8 (201), (2020).
- Córdoba-Aguilar, A. . Dragonflies and damselflies. Model organisms for ecological and evolutionary research. , (2008).
- Bybee, S., et al. Odonata (dragonflies and damselflies) as a bridge between ecology and evolutionary genomics. Frontiers in Zoology. 13 (46), (2016).
- Linz, D. M., Clark-Hachtel, C. M., Borràs-Castelles, F., Tomoyasu, Y. Larval RNA interference the red flour beetle, Tribolium castaneum. Journal of Visualized Experiments. 92, 52059 (2014).
- Okude, G., et al. Electroporation-mediated RNA interference reveals a role of multicopper oxidase 2 gene in dragonfly’s cuticular pigmentation. Applied Entomology and Zoology. 53 (3), 379-387 (2017).
- Terenius, O., et al. RNA interference in Lepidoptera: An overview of successful and unsuccessful studies and implications for experimental design. Journal of Insect Physiology. 57, 231-245 (2011).
- Ando, T., Fujiwara, H. Electroporation-mediated somatic transgenesis for rapid functional analysis in insects. Development. 140, 454-458 (2013).
- Nishikawa, H., et al. A genetic mechanism for female-limited Batesian mimicry in Papilio butterfly. Nature Genetics. 47 (4), 405-409 (2015).
- Osanai-Futahashi, M., et al. Positional cloning of a Bombyx pink-eyed white egg locus reveals the major role of cardinal in ommochrome synthesis. Heredity. 116 (2), 135-145 (2016).
- Okude, G., Futahashi, R., Tanahashi, M., Fukatsu, T. Laboratory rearing system for Ischnura senegalensis (Insecta: Odonata) enables detailed description of dragonfly’s larval development and morphogenesis. Zoological Science. 34 (5), 386-397 (2017).
- Ozono, A., Kawashima, I., Futahashi, R. . Dragonflies of Japan (3rd edition). , (2017).
- Ozono, A., Kawashima, I., Futahashi, R. . The Handbook of Japanese Aquatic Insects. Volume 3: Dragonfly larvae. , (2019).
- Arakane, Y., Noh, M. Y., Asano, T., Kramer, K. J. Tyrosine metabolism for insect cuticle pigmentation and sclerotization. Extracellular Composite Matrices in Arthropods. , 165-220 (2016).
- Asano, T., et al. Mini-review an insect-specific system for terrestrialization: Laccase-mediated cuticle formation. Insect Biochemistry and Molecular Biology. 108, 61-70 (2019).
- Futahashi, R., Okude, G., Sugimura, M., Ugai, S. Interspecific hybrids in Japanese Odonata. Tombo. 60, 1-49 (2018).
- Okude, G., Fukatsu, T., Futahashi, R. Interspecific crossing between blue-tailed damselflies Ischnura elegans and I. senegalensis in the laboratory. Entomological Science. 23 (2), 165-172 (2020).
- Naito, Y., Yoshimura, J., Morishita, S., Ui-Tei, K. siDirect 2.0: updated software for designing functional siRNA with reduced seed-dependent off-target effect. BMC Bioinformatics. 10, 392 (2009).
- Yamaguchi, J., Mizoguchi, T., Fujiwara, H. siRNAs induce efficient RNAi response in Bombyx mori embryos. PLoS ONE. 6 (9), e25469 (2011).
- Untergasser, A., et al. Primer3--new capabilities and interfaces. Nucleic Acids Research. 40 (15), e115 (2012).
- Futahashi, R. Whole-mount in situ hybridization of sectioned tissues of species hybrids to detect cis-regulatory changes in gene expression pattern. Methods in Molecular Biology. 772, 319-328 (2011).
- Matsuura, Y., Kikuchi, Y., Miura, T., Fukatsu, T. Ultrabithorax is essential for bacteriocyte development. Proceedings of the National Academy of Sciences of the United States of America. 112 (30), 9376-9381 (2015).
- Henze, M. J., Lind, O., Wilts, B. D., Kelber, A. Pterin-pigmented nanospheres create the colours of the polymorphiic damselfly Ischnura elegans. Journal of The Royal Society Interface. 16, 20180785 (2019).
- Nishide, Y., et al. Diversity and function of multicopper oxidase genes in the stinkbug Plautia stali. Scientific Reports. 10 (1), 3464 (2020).
- Christiaens, O., Swevers, L., Smagghe, G. DsRNA degradation in the pea aphid (Acyrthosiphon pisum) associated with lack of response in RNAi feeding and injection assay. Peptides. 53, 307-314 (2014).
- Sun, D., Guo, Z., Liu, Y., Zhang, Y. Progress and prospects of CRISPR/Cas systems in insects and other arthropods. Frontiers in Physiology. 8, 608 (2017).
- Miyakawa, K. A study of the life-history of Pseudothemis zonata (Burm.) (Odonata, Libellulidae) II. Immature stage. Kontyû. 37 (4), 409-422 (1969).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved