Method Article
ライブイメージングを用いたショウジョウバエ卵チャンバに対する酸化損傷の効果の可視化
要約
このプロトコルの目的は、ショ ウジョウバエ 卵巣の細胞下構造の局在およびダイナミクスに対する酸化損傷の影響を可視化するために、ライブ画像を使用することです。
要約
ショウジョウバエメラノガスター卵巣の生画像化は、リボヌクレオタンパク質粒子運動、mRNA局在、オルガネラ運動、細胞骨格動態など、開発中のさまざまな基本的な細胞プロセスを理解するのに役立っています。ライブイメージングには、開発されたいくつかの方法があります。各方法は、培地やハロカーボンオイルに入れられた個々の卵巣を解剖することを含むという事実のために、低酸素症および/または物理的操作による細胞損傷は必然的に時間の経過とともに起こる。低酸素症の下流の効果の1つは、細胞内の酸化的損傷を増加させることである。このプロトコルの目的は、制御された細胞損傷の誘導後のショウジョウバエ卵巣における細胞下構造の局在およびダイナミクスに対する酸化損傷の影響を可視化するために、ライブ画像を使用することである。ここでは、過酸化水素を用いて細胞酸化損傷を誘導し、このような損傷がミトコンドリアとClu至福粒子の2つの細胞下構造に及ぼす影響の例を挙げる。しかし、この方法は、細胞内構造に適用可能である。制限は、過酸化水素は水性媒体にのみ添加でき、ハロカーボン油を使用するイメージングには機能しないことです。利点は、過酸化水素が容易に入手でき、安価であり、迅速に作用し、その濃度を変調することができ、酸化的損傷は、低酸素症および操作による一般的な組織損傷によって引き起こされる損傷の良好な近似である。
概要
複数の異なる細胞ストレッサーは、実験培養中に発生し、組織の操作の際に発生する可能性があります ex vivo, 熱ショックを含みます, 酸化ストレス, 浸透ストレス, 栄養ストレス, および毒性条件.ライブイメージングは、実験的な処理と操作後のex vivo組織のリアルタイム変化を視覚化するために使用される強力なツールです。微細な組織解剖と操作は練習を行い、解剖からイメージングまでの時間は経験によって異なる場合があります。この方法を開発するための根拠は、組織をライブイメージング用に準備すると、解剖およびイメージング調製中に細胞ストレスを引き起こす可能性があるという懸念に基づいています。これは、細胞代謝の変化や利用可能な酸素レベルに敏感なプロセスのために特に問題になる可能性があります, ミトコンドリア機能など.野生型のサンプルを並行して持つことは重要なコントロールですが、細胞下構造の一部または全部が解剖による損傷や細胞ストレスによるもので、通常の生理学や治療や突然変異を反映していない可能性があります。
この潜在的な問題に対処するために、我々は細胞の酸化損傷を誘導するために、ライブイメージング中に過酸化水素添加を使用する。この方法の目的は、細胞内構造への影響を監視するために組織に損傷を誘発することにある。このプロトコルは、2つの目的に有用である:1)対象の構造の細胞内局在化の変化が未経験の解剖によって引き起こされるストレスによるものであるかどうかを判断し、2)研究者が制御されたストレスが目的の構造に及ぼす影響を監視するために説明された解剖技術に自信を持っていった。ここでは、酸化損傷の増加が、ミトコンドリアとClu至福粒子の2つの細胞内構造の変化を引き起こす方法の2つの例を示す。これを行うために、我々は生画像研究のための一般的なモデルであるショウジョウバエ卵巣を使用する。最初の例では、ミトコンドリアの局在を調べます。私たちの経験では、女性生殖細胞における正常なミトコンドリア局在化は摂動に対して非常に敏感であり、細胞ストレスの先駆者として作用することができる。ショウジョウバエ雌胚芽細胞におけるミトコンドリアは、通常、細胞質2中に均一に分散している。過酸化水素添加は、オルガネラを原因に、様々な突然変異3、4、5と同様の方法でオルガネラを迅速に誤局化し、クラスター化する。2番目の例は、クルーレス(Clu)によって形成された至福の粒子です。Cluは細胞質全体に拡散するリボヌクレオタンパク質である;しかし、それはまた、最適な細胞条件5の下でミトコンドリア関連粒子を形成する。Clu粒子の存在は健康な細胞状態に依存するため、我々はそれらを「至福」粒子3、5、6と呼んでいる。過酸化水素を添加すると、これらの粒子は細胞質5に迅速に分散し均一になる。我々の研究の過程で、我々はこれらの細胞下構造の両方の局在化の変化を観察したが、ライブイメージング研究を行った後にのみ、細胞のストレスと酸化損傷がミトコンドリアおよび至福の粒子の局在化およびダイナミクスに及ぼす影響を十分に理解することができた。
既に確立されている方法または代替方法への追加として、このプロトコルの有用性は、いくつかの要因に依存します。まず、画像化プロトコルは薬物添加に適している必要があります。サンプルがカバースリップの下とハロカーボンオイルに取り付けられている場合、この方法は可能ではありません 7 .H2O2添加は酸化損傷の急激な上昇を引き起こし、したがって、このタイムスケールは適切でない場合がある。酸化的損傷は低酸素症の代理とみなされ得る。しかし、特定の細胞部成分の損傷に対する適切な制御として機能するには、あまりにも過酷または一般化しすぎる可能性があります。最後に、発達過程に続くもののような長時間の撮像実験では、H2O2添加が強すぎる場合がある(例えば8)。濃度曲線をテストすると、この制限を克服できます。
プロトコル
1. 解剖・画像化媒体の作成
注:このライブイメージング実験に最も適したメディアには、15%の熱不活化牛胎児血清、0.6xペンストレップ、および200 μg/mLウシインスリンを含むシュナイダーのショウジョウバエ培地が含まれています。
- 滅菌条件下で媒体調製を行い、汚染されないようにします。メディアは、ショ ウジョウバエの 卵巣を長期間にわたってサポートするために開発されました9.
- シュナイダーの培地に、15%の加熱不活化牛胎児血清、0.6xペンストレップ、200 μg/mLウシインスリンを加えます。
- 内容をよく混ぜ、一晩4°Cで保存してください。
注:インスリンは完全シュナイダーのメディアに完全に溶解しません、そしてあなたは、チューブの底に沈殿物が落ち着くのに気づくでしょう。 - それはイメージングを妨げるので沈殿物を残すことを確認して、メディアのアリコートを作ります。
注:このソリューションは、4°Cでアリコートに保存されている場合、1ヶ月以内に使用することができます。
解剖のための ショウジョウバエ のコレクション
注:詳細な ショウジョウバエ のコレクションと解剖手順は、Weil et al.10 およびParkerら11にも記載されています。
- 最適な雌の生殖細胞イメージングのために、まず、標準的なコーンミールフライ食品を含むバイアルとピーナッツバターの一貫性である湿った酵母ペーストのダブを準備します。これにより、雌のハエが十分に供給され、イメージング用のすべての卵胞発生段階が生成されます。
- 最適に健康なハエのために、0-1日齢のメスを収集し、濡れた酵母ペーストを含むフライフードバイアルに男性と一緒に移動します。
注:睡眠ハエは、彼らがそれに固執することができるように酵母ペーストに接触しないことを確認してください。 - ハエを3〜7日供給し、バイアルと酵母ペーストを毎日変更します。
注:イーストペーストがフライフードに接触し、乾燥しないようにしてください。
3. ショウジョウバエ 卵巣解剖
注:過酸化水素は酸化の影響を受けやすく、TMREは時間の経過とともに劣化するため、メディア溶液を新鮮に調製することが重要です。
- 解剖の直前に、完全シュナイダーのメディアで、2μM H2O2 溶液の新鮮なアリコート、46 nMテトラメチルローダミンの新鮮なアリコート、エチルエステル(TMRE)、および2μMH2O2を含む46 nM TMRE溶液の新鮮なアリコートを調製する。
- 卵巣解剖の場合、2組の細かい鉗子と電解的に研がれたタングステン針12を使用する。卵巣を解剖するには、ガラス底の解剖皿(時計ガラス)の2〜3個の井戸を室温まで温めたコンプリートシュナイダーで満たします。
- 二酸化炭素で肥育ハエのバイアルを麻酔し、解剖される雌のハエの所望の数を分離する。鉗子を使用してメディアに単一のフライを置きます。
- 解剖顕微鏡の下で、細かい鉗子の1組を使用して胸郭によってハエをそっと握ります。他の鉗子で後部をつかみ、穏やかに引っ張って卵巣を取り除く。
注:この方法を用いて卵巣がスムーズに出てこない場合、腹部全体もハエから取り除かれ、鉗子を使って腹部の両端からゆっくりと絞り出すことができます。 - 余分なキューティクルや組織を取り除き、新鮮な培地を含む新しい井戸に卵巣を移します。卵巣はまだ周囲の筋肉鞘から移動する必要があります。
4. 画像処理のための卵巣子を準備する
- 鋭利なタングステン針を使用して、周囲の筋鞘を取り除くように注意して、卵巣を優しくいじめる(図1)。
- 孤立した卵巣に付着した筋鞘や神経線維を軽くいじめる(図2)。
注:筋鞘が取り除かれていない場合、ovarioleはぴくぴくして動き、画像取得に問題を引き起こします(ビデオ1)。 - 目的の細胞下構造が内因的に標識されている場合は、ステップ 4.4 に進みます。目的の構造が蛍光色素で標識される場合は、セクション5に進みます。
- 卵巣をきれいに解剖したら、マイクロピペットを使用して、コンプリートシュナイダーのイメージングメディアの100 μLドロップでガラス底皿のガラスのくぼみに移します。個々の卵巣は液滴の底に沈みます。
- イメージングのセクション 6 に進みます。
注:ミトコンドリアとClu至福の粒子をイメージングする場合、解剖の開始からイメージングまで5〜10分以下で経過するはずです。
5. ミトコンドリアをTMREで染色する
注:蛍光色素を用いたミトコンドリアの生染色に関する詳細な手順は、Parkerら 2017で見つけることができます。
- ステップ4.3の後、46 nM TMRE培地の100 μLの低下で分離された卵巣をガラス底皿のガラスのくぼみに移します。個々の卵巣は液滴の底に沈みます。
- 室温で20分間インキュベートします。蓋をガラス底皿に置き、実験の間、皿を覆われた箱に入れ、光から守ります。
注:インキュベーション後、サンプルは、無く、直接イメージすることができます。 - ステップ 5.1~5.2 を繰り返して、TMRE ラベル付き卵巣子の料理を少なくとも 2 つ用意し、1 つは実験グループとして、もう 1 つはコントロールとして機能します。
6. ライブ画像の取得
- ovarioles を取り付けたら、ガラス底皿の 1 つを顕微鏡に置き、必要に応じてイメージング パラメータを設定します。ここで使用されるTMREの最適な励起/発光波長は549 nm/574 nmである。
- 所望の視野を見つけ出した後、治療前の状態の記録として、所望の1つ以上の卵巣子の静止画または短いビデオを取得する。
7. イメージング時の過酸化水素の添加
- ライブイメージングを一時停止し、ガラス底皿から蓋を取り出し、内因的にラベル付けされた構造をイメージングする場合は、マイクロピペットを使用して皿に100 μLの2μM H2O2溶液を慎重に追加します。ミトコンドリアをイメージングする場合、マイクロピペットを使用して皿に2μM H2O2溶液を用いた46 nM TMREの100μLを慎重に加える(ビデオ2)。
- 既存のメディアの液滴の表面を壊したり、皿の底に置き換える卵巣を置き換えないように、あまりにも速く溶液を追加することは避けてください(ビデオ2)。
- 皿の蓋(皿カバー)を交換し、必要に応じて目的の視野を再配置して再び焦点を合わせ、イメージングを再開します(ビデオ3、ビデオ4、図3、図4)。
- 実験処理が時間に敏感であるので、H2O2添加後できるだけ早くイメージングを再開するように注意してください(ビデオ5)。
- 必要に応じて、1 つまたは複数の卵巣子の静止画または短いビデオを取得します。これは、後処理状態の記録として機能します。
- コントロールのために、2番目のガラス底皿を顕微鏡に置き、セクション6を繰り返します。
- ステップ7.1を繰り返し、今度は100μLのTMRE専用メディアを皿に加えます。内因的にラベル付けされた構造をイメージングする場合は、完全シュナイダーのメディア専用ソリューションを100 μL追加します。
- ステップ 7.2 と 7.3 を繰り返して、制御グループのデータを取得します。
注:ミトコンドリアおよびClu至福の粒子をイメージングする場合、過酸化水素のイメージングへの添加から3〜5分以下で経過する必要があります。
結果
記載されたプロトコルは、ショウジョウバエ卵巣の生画像化中の過酸化水素の効果を研究するために使用することができる。図3、図4、ビデオ3、ビデオ4に示すように、この手順は、実験処理後の組織の変化とダイナミクスをリアルタイムで可視化する有効な手段を提供する。重要なことに、このプロトコルは、イメージング中にオバリオルにH2O2を追加する場合に固有のものです。しかし、他の薬剤または目的の試薬の外因性添加に適応してもよい。また、毛包は、画像化の前に、目的の任意の蛍光色素(例えば、テトラメチルローダミン(TMRE)、LysoTracker)で標識されてもよい(ビデオ3)。鮮明な画像化結果を得る最も重要なステップは、1)すべての収縮元素を除去した単一の卵巣体の適切な解剖および単離(図1および図2)および2)過酸化水素添加後のイメージングが再開される速度である。ビデオ4は、画像化中に視界から出る解剖不良の卵胞を示すビデオ1と比較して、イメージング期間を通して安定した状態を保つ適切に解剖された卵胞の図である。ビデオ5は、TMRE標識ミトコンドリアに対するH2O2効果が、経過時間が長すぎる結果としてイメージング開始前に既に進行している図である。過酸化水素添加直後(時間0)と無傷でイメージングが再開されたビデオ3と比較すると、分散したミトコンドリアはまだ見えるが、ビデオ5のミトコンドリアはすでに目に見えて凝集し始めており、イメージングの再開時に膜の電位を失っている。この問題は、主にH2O2添加中のサンプル位置の中断に起因し、イメージングメディアとサンプル位置をそのまま維持する技術に従うことによって軽減することができる(ビデオ2)。なお、培地にH2O2を添加せずに行われた制御実験では、卵胞中のミトコンドリアは適切に分散したままであり、TMRE色素はミトコンドリアに隔離されたままである。
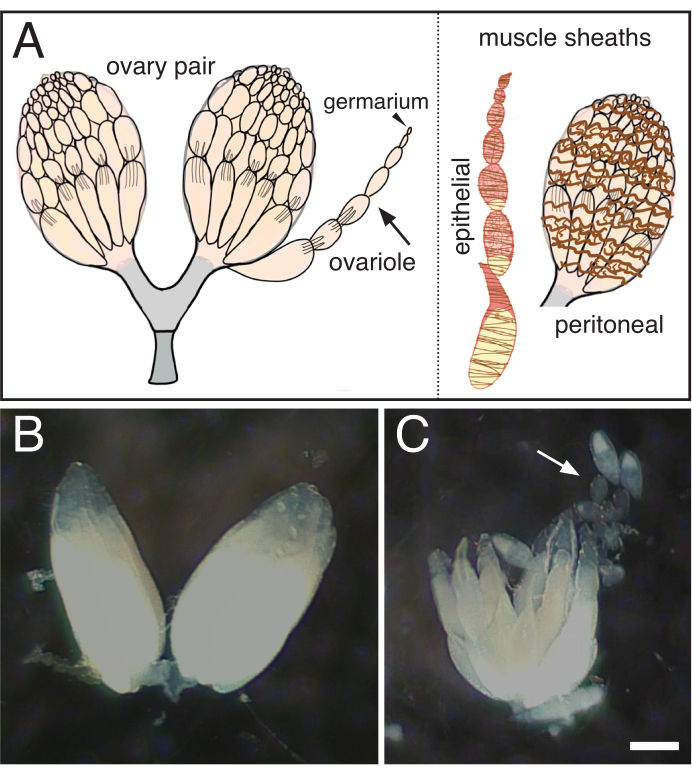
図1:ショウジョウバエ卵巣からの単一卵巣の単一の卵巣の分離; (A) 卵巣のペアを示す漫画, 先端にゲルマリウムを持つ単一の卵巣 (矢) (矢印) と卵巣(茶色,上皮)と卵巣(茶色,上皮)を囲む2つの筋鞘。(B) 脱剖ショウジョウバエ卵巣.(C) その後、個々の卵巣にからかった卵巣を分離する(矢印)。スケールバー = 100 um.この図の大きなバージョンを表示するには、ここをクリックしてください。
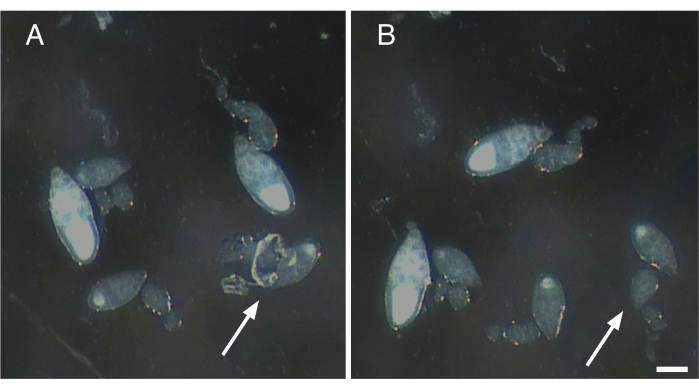
図2:単一の卵巣から神経線維および収縮要素の除去(A)神経組織の残骸と筋鞘がまだ付着している単一の卵巣(矢印)。(B) A(矢印)にオバゾールに付着した残りの組織をすべて穏やかに除去する。スケールバー= 100 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
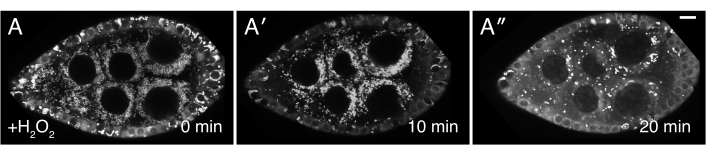
図3:H2O2はミトコンドリアの誤局在化を引き起こす。H2O2を添加すると、ミトコンドリアがイメージングの間に凝集する。ミトコンドリアのTMRE標識は、ミトコンドリアが最初に時間0(A)に分散し、ミトコンドリアがH2O2添加後に凝集し始めることを示す(A)後の時点で、TMRE標識は、ミトコンドリアが膜電位を失い、したがって色素を隔離する能力のために斑点となる。ホワイト = TMRE (A-A" )スケールバー: A-A"5の場合は10 μm(A )この図の大きなバージョンを表示するには、ここをクリックしてください。
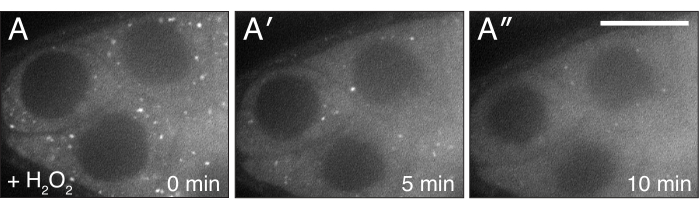
図4:H2O2はCluを分散する。(A-A")よく供給されたcluCA06604卵胞のライブイメージ静止画。H2O2を添加すると、粒子が細胞質内で分散し、イメージングの持続時間にわたって均質になる。白 = クルー::GFP (A-A" )スケールバー :A-A"5の場合は40 μmの( A )この図の大きなバージョンを表示するには、ここをクリックしてください。
ビデオ 1:cluCA06604女性からの卵胞。図2に記載されているように、単一の卵巣から神経線維収縮要素を除去しないと、イメージング中に卵巣の著しい漂流と動きが生じ、その後の画像データを分析できなくなる。白 = クルー::GFP。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:サンプルディッシュにH2O2を適切に添加する。過酸化水素は、適当なサイズのマイクロピペットを用いてサンプル皿に添加されるべきである。メディア表面を壊すことなくH2O2を分配する。過酸化水素添加時のサンプルドリフトを最小限に抑えるために、イメージングメディアの表面を破壊しないように注意してください。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ3:TMRE標識卵胞のイメージング中のH2O2付加。Clu CA06604女性からの卵胞はTMREで染色された。H2O2はショウジョウバエの卵胞におけるミトコンドリアの誤局在化を引き起こす。白 = TMRE 染料。15秒あたり1フレームを20分間画像化し、ビデオは毎秒10フレーム5です。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ 4: Cluのイメージング中に H2O2 追加::GFP 卵胞。cluCA06604女性からの卵胞。H2O2は、図4に記載されているようにClu粒子を分散させる。白 = クルー::GFP。15 分間 15 秒あたり 1 フレームのイメージを作成し、ビデオは 10 フレーム/秒です。5こちらをクリックして、このビデオをダウンロードしてください。
ビデオ5:H2O2添加後の遅延撮像。cluCA06604女性からの卵胞。卵胞への過酸化水素の添加は、時間に敏感な治療です。イメージングの再開は、H2 O2添加中のサンプル変位の結果として、このビデオで遅れました。ミトコンドリアは、時間0(ビデオ3の時間0と比較して)時間0でイメージングの再開時に、すでに目に見えて凝集し、膜の可能性を失い始めています。治療後に短時間でイメージングを再開しないと、初期の実験効果が撮像前に見逃されるため、不正確で使用できない結果が生じます。白 = TMRE。15秒あたり1フレームを20分間画像化し、ビデオは毎秒10フレームです。このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、生画像実験のための卵巣解離および組織インキュベーションによるアーチファクトの制御として有用な付加である可能性がある。重要な手順は、他のライブ イメージング プロトコルで見られる手順と似ています。ショ ウジョウバエ の卵巣全体を解剖する方法を学ぶには練習が必要です。しかし、通常、このスキルは、適切な解剖ツールを使用してかなり迅速に学習することができます。より習得が難しいのは、卵巣と各卵巣13を包む筋肉を取り除くことである。これは、筋肉の収縮が画像の取得を妨げないようにするために行う必要があります。これを行うために鋭利なタングステン針を使用しても成功しない場合、オバモールの先端にあるゲルマリウムは鉗子と筋鞘から引っ張られた卵巣で把握することができます。しかし、この技術は、損傷を受ける可能性があるため、初期の発達段階を調べる場合には問題となります。もう一つの重要なステップは、H2O 2を追加するときに皿の底に置かれている卵巣子を取り除かないようにすることです。さらに重要な側面は、すべてのライブイメージングによって共有されています:研究者は、治療前に目的の構造が蛍光的に十分に標識されていることを確認する必要があります。ここで使用される料理 (材料表) は、ライブイメージングに一般的に使用されます。しかし、底面にガラスカバースリップや大きなガラスカバースリップを持つ皿やスライドは、メディアの蒸発を防ぐためにメディアの落下をカバーできる限り機能するはずです。特定の顕微鏡を使用する一方で、問題の細胞内構造を見るのに十分な倍率を持つ反転顕微鏡と、十分な解像度と画像キャプチャレートを持つカメラが動作するはずです。
当研究室ではミトコンドリア機能に関心を持っていますが、核、細胞骨格、小胞体など、細胞下の構造や小器官の動態や局在を調べるのに役立ちます。ただし、この方法には制限があります。過酸化水素を添加するためには、組織は水性媒体に入っている必要があります。ライブイメージングの代替方法は、モデル生物7,14におけるGFPの動的移動の最初の例を含むショウジョウバエの卵巣細胞における多くの重要なプロセスを記述するのに役立ったハロカーボンオイルを使用するものである。さらに、過酸化水素を培地に添加すると、広域的な酸化損傷を引き起こし、特に開発を調べる長い実験のために、関心のある細胞プロセスに有益である組織に対する侮辱が過度に一般的である可能性があります。この急速で広範で不可逆的な酸化損傷のために長期間にわたって細胞を視覚化する必要がある実験を行うことは不可能かもしれませんが、我々が述べた急性過酸化水素治療は、イメージング期間内のほとんどの段階で同じ効果を見ることができるので、ほとんどの段階でoogenesisに適用可能であることがわかります。プロトコルの低コストと容易さを考えると、損傷のコントロールが有用であり、固定および抗体標識の前の治療としても使用できます。
我々の手では、H2O2処理は、様々なショウジョウバエ変異体に見えるミトコンドリアの誤局在化およびClu至福粒子分散の変化を模倣する。また、研究室の解剖技術の新しい研究者のために見る結果を模倣します。したがって、この方法は、サンプル調製および一般的な細胞ストレスがミトコンドリアの誤局在化および至福の粒子の存在に予期せぬ、以前は原因不明の変化を引き起こす可能性があることを明確に明らかにした。この技術を前進させると、過酸化水素濃度がより高い濃度または低濃度を用いて変調され得る。より低濃度を用いて細胞効果が見られる場合、メディアをコンプリートシュナイダーの物に置き換えることでストレス表現型が可逆的である可能性がある。シアン化カルボニルm-クロロフェニルヒドラゾン(CCCP)、アルセイン酸または単純な熱ショックなどの異なる細胞ストレッサーは、他の細胞下構造の一般的な細胞ストレスに有用であることが証明される可能性があります。ex vivo組織のライブイメージングでは、異なる媒体での手動操作とインキュベーションが必要であるため、この制御は、観察が可能な限り正常な生理学に近いものであることを保証するために有用な追加である必要があります。
開示事項
著者らは開示するものは何もない。
謝辞
ジェレミー・スミス博士のイメージングサポート、アン・C・シェンクのイラスト、制作、ビデオ撮影に感謝します。この研究は、国立衛生研究所(1R01GM127938からR.T..C)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Active dry yeast | Red Star® | ||
| CO2 gas | 99.9% purity | ||
| CO2 pad | |||
| Dissecting microscope, Nikon SMZ645 model | Nikon | ||
| Dissecting needles - PrecisionGlide needles | BD | 305165 | B-D 21G1 size |
| Dissecting needles - PrecisionGlide syringes | BD | 309657 | Luer-Lok tip, 3 mL size |
| Dissecting needles - tungsten wire | Electron Microscopy Sciences | 73800 | |
| Dumont #5 forceps (2 pairs) | Fine Science Tools | 11251-10 | |
| NI-150 High Intensity Illuminator | Nikon Instruments Inc. | ||
| Gibco Fetal Bovine Serum, Heat Inactivated | Fisher Scientific | 10082-147 | |
| Gibco Schneider's Drosophila Media | Sigma-Aldrich | 21720-024 | |
| Hydrogen peroxide solution, 30% (w/w) in H2O | Sigma-Aldrich | H1009 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| Spinning disk microscope | Nikon | Equivalent scopes may also be used | |
| Lonza BioWhittaker Antibiotics: Penicillin-Streptomycin mixtures | Fisher Scientific | 17-602E | |
| MatTek Corporation Glass Bottom Dishes, 35 mm | Fisher Scientific | NC9344527 | |
| Micropipettes and tips of appropiate size | Eppendorf | ||
| Microcentrifuge tubes, 1.7 mL | VWR | 87003-294 | |
| Tetramethylrhodamine, Ethyl Ester, Perchlorate (TMRE) | AnaSpec | AS-88061 | |
| w[1118] | Bloomington Drosophila Stock Center | 5905 | Wild-type flies |
| y w; clu[CA06604] | Available upon request. | Clu::GFP trap flies |
参考文献
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: the Fenton reaction. Toxicology Letters. 82-83, 969-974 (1995).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Cox, R. T., Spradling, A. C. Clueless, a conserved Drosophila gene required for mitochondrial subcellular localization, interacts genetically with parkin. Disease Models & Mechanisms. 2 (9-10), 490-499 (2009).
- Sen, A., Kalvakuri, S., Bodmer, R., Cox, R. T. Clueless, a protein required for mitochondrial function, interacts with the PINK1-Parkin complex in Drosophila. Disease Models & Mechanisms. 8 (6), 577-589 (2015).
- Sheard, K. M., Thibault-Sennett, S. A., Sen, A., Shewmaker, F., Cox, R. T. Clueless forms dynamic, insulin-responsive bliss particles sensitive to stress. Developmental Biology. 459 (2), 149-160 (2020).
- Sen, A., Cox, R. T. Clueless is a conserved ribonucleoprotein that binds the ribosome at the mitochondrial outer membrane. Biology Open. 5 (2), 195-203 (2016).
- Parton, R. M., Valles, A. M., Dobbie, I. M., Davis, I. Isolation of Drosophila egg chambers for imaging. Cold Spring Harbor Protocols. 2010 (4), 5402 (2010).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
- Prasad, M., Montell, D. J. Cellular and molecular mechanisms of border cell migration analyzed using time-lapse live-cell imaging. Developmental Cell. 12 (6), 997-1005 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments. (60), e3679 (2012).
- Parker, D. J., Moran, A., Mitra, K. Studying Mitochondrial Structure and Function in Drosophila Ovaries. Journal of Visualized Experiments. (119), e54989 (2017).
- Brady, J. A simple technique for making fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314 (2), 329-340 (2008).
- Wang, S., Hazelrigg, T. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature. 369 (6479), 400-403 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved