Method Article
Visualisierung der Auswirkungen oxidativer Schäden auf Drosophila-Eierkammern mit Live Imaging
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, live Bildgebung zu verwenden, um die Auswirkungen von oxidativen Schäden auf die Lokalisierung und Dynamik subzellulärer Strukturen in Drosophila-Ovarien zu visualisieren.
Zusammenfassung
Die Live-Bildgebung von Drosophila melanogaster Eierstöcken war entscheidend für das Verständnis einer Vielzahl grundlegender zellulärer Prozesse während der Entwicklung, einschließlich Ribonukleoprotein-Partikelbewegung, mRNA-Lokalisierung, Organelle-Bewegung und Zytoskelettdynamik. Es gibt mehrere Methoden für Live-Bildgebung, die entwickelt wurden. Aufgrund der Tatsache, dass jede Methode beinhaltet die Sezieren einzelner Eizellen in Medien oder Halocarbonöl platziert, Zellschäden durch Hypoxie und / oder physikalische Manipulation wird unweigerlich im Laufe der Zeit auftreten. Eine nachgelagerte Wirkung von Hypoxie ist die Erhöhung der oxidativen Schäden in den Zellen. Der Zweck dieses Protokolls ist es, Live-Bildgebung zu verwenden, um die Auswirkungen von oxidativen Schäden auf die Lokalisierung und Dynamik von subzellulären Strukturen in Drosophila Eierstöcke naden nach der Induktion von kontrollierten Zellschäden zu visualisieren. Hier verwenden wir Wasserstoffperoxid, um zelluläre oxidative Schäden zu induzieren und geben Beispiele für die Auswirkungen solcher Schäden auf zwei subzelluläre Strukturen, Mitochondrien und Clu-Glückseligkeitspartikel. Diese Methode ist jedoch auf jede subzelluläre Struktur anwendbar. Die Einschränkungen sind, dass Wasserstoffperoxid nur wässrigen Medien zugesetzt werden kann und nicht für die Bildgebung funktionieren würde, die Halocarbonöl verwendet. Die Vorteile sind, dass Wasserstoffperoxid leicht verfügbar und kostengünstig ist, schnell wirkt, seine Konzentrationen moduliert werden können, und oxidative Schäden ist eine gute Annäherung an Schäden durch Hypoxie sowie allgemeine Gewebeschäden durch Manipulation.
Einleitung
Mehrere verschiedene zelluläre Stressoren können während der experimentellen Kultur und Manipulation von Geweben ex vivo entstehen, einschließlich Hitzeschock, oxidativer Stress, osmotischer Stress, Ernährungsstress, und Toxizität Bedingungen. Live Imaging ist ein leistungsstarkes Werkzeug, das verwendet wird, um Echtzeit-Änderungen in Ex-vivo-Geweben nach experimenteller Behandlung und Manipulation zu visualisieren. Feine Gewebesektionen und Manipulationen nehmen Praxis in Anspruch, und die Zeit von der Zerlegung bis zur Bildgebung kann je nach Erfahrung variieren. Die Begründung für die Entwicklung dieser Methode basiert auf der Sorge, dass die Vorbereitung von Gewebe für die Live-Bildgebung zellulären Stress während der Zerlegung und bildgebenden Vorbereitung verursachen kann. Dies könnte besonders problematisch für Prozesse sein, die empfindlich auf Veränderungen des Zellstoffwechsels und verfügbare Sauerstoffwerte reagieren, wie z. B. die mitochondriale Funktion. Obwohl eine parallele Wildtypprobe eine wichtige Kontrolle ist, besteht immer noch die Möglichkeit, dass einige oder alle beobachteten Veränderungen in subzellulären Strukturen auf Schäden oder Zellstress durch Zerlegung zurückzuführen sein könnten und nicht die normale Physiologie oder die untersuchte Behandlung oder Mutation widerspiegeln.
Um dieses potenzielle Problem anzugehen, verwenden wir die Wasserstoffperoxidzugabe während der Live-Bildgebung, um zelluläre oxidative Schäden zu induzieren1. Der Zweck dieser Methode ist es, Schäden an Geweben zu induzieren, um die Auswirkungen auf subzelluläre Strukturen zu überwachen. Dieses Protokoll ist für zwei Zwecke nützlich: 1) die Bestimmung, ob Veränderungen in der subzellulären Lokalisierung der Struktur von Interesse auf die Belastung durch unerfahrene Sezieren verursacht und 2) sobald der Forscher mit den beschriebenen Seziertechniken vertraut ist, um die Auswirkungen der kontrollierten Spannung auf die Struktur des Interesses zu überwachen. Hier zeigen wir zwei Beispiele, wie erhöhte oxidative Schäden Veränderungen in zwei subzellulären Strukturen verursachen, Mitochondrien und Clu-Glückseligkeitspartikel. Um dies zu tun, verwenden wir die Drosophila Eierstock, die ein gemeinsames Modell für Live-Bildgebung Studien ist. Das erste Beispiel untersucht die mitochondriale Lokalisierung. Nach unserer Erfahrung ist die normale mitochondriale Lokalisation in weiblichen Keimzellen hochempfindlich gegenüber Störungen und kann als Vorbote zellulärer Stress wirken. Mitochondrien in Drosophila weiblichen Keimzellen sind normalerweise gleichmäßig über das Zytoplasmaverteilt 2. Die Wasserstoffperoxidaddition bewirkt, dass die Organellen schnell falsch lokalisiert und sich in ähnlicher Weise wie verschiedene Mutationen3,4,5. Das zweite Beispiel sind Glückspartikel, die von Clueless (Clu) gebildet werden. Clu ist ein Ribonukleoprotein, das im gesamten Zytoplasma diffus ist; es bildet aber auch Mitochondrien-assoziierte Teilchen unter optimalen zellulären Bedingungen5. Da das Vorhandensein von Clu-Partikeln von gesunden zellulären Bedingungen abhängt, haben wir sie als "Glückseligkeit" Partikel3,5,6bezeichnet. Die Zugabe von Wasserstoffperoxid bewirkt, dass sich diese Partikel schnell dispergieren und im Zytoplasma homogen werden5. Im Laufe unserer Studien haben wir Veränderungen in der Lokalisation dieser beiden subzellulären Strukturen beobachtet, aber erst nach der Durchführung von Live-Bildgebungsstudien konnten wir die Wirkung von zellulärem Stress und oxidativen Schäden auf die Lokalisation und Dynamik von Mitochondrien und Glückspartikeln vollständig erkennen.
Der Nutzen dieses Protokolls als Ergänzung zu bereits etablierten oder alternativen Methoden hängt von mehreren Faktoren ab. Erstens muss das Bildgebungsprotokoll für die Arzneimittelzugabe zugänglich sein. Wenn die Probe unter einem Deckschein und in Halocarbonöl montiert wird, wäre diese Methode nicht möglich7. H2O2 Zusatz verursacht einen schnellen Anstieg der oxidativen Schäden, daher kann diese Zeitskala nicht angemessen sein. Oxidative Schäden können als Proxy für Hypoxie angesehen werden; Es kann jedoch zu hart oder zu verallgemeinert sein, um als geeignete Kontrolle für Schäden für bestimmte subzelluläre Komponenten zu funktionieren. Schließlich kann für bildgebende Experimente, die Stunden dauern, wie sie nach einem Entwicklungsprozess dauern, dieH2O2-Zugabe zu stark sein (z. B.8). Das Testen einer Konzentrationskurve kann diese Einschränkung überwinden.
Protokoll
1. Herstellung von Sezier- und Bildmedien
HINWEIS: Das Für dieses Live-Bildgebungsexperiment am besten geeignete Medium enthält Schneiders Drosophila-Medien, die 15 % inaktiviertes fetales Rinderserum, 0,6x Pen-Strep und 200 g/ml Rinderinsulin enthalten, im Folgenden als Complete Schneiders Medien bezeichnet.
- Führen Sie die Medienzubereitung unter sterilen Bedingungen durch, um sicherzustellen, dass sie nicht kontaminiert wird. Die Medien wurden entwickelt, um Drosophila ovarioles für längere Zeit zu unterstützen9.
- Fügen Sie 15 % inaktiviertes fetales Rinderserum, 0,6x Pen-Strep und 200 g/ml Rinderinsulin zu den Medien des Schneider hinzu.
- Den Inhalt gut vermischen und über Nacht bei 4 °C lagern.
HINWEIS: Insulin löst sich nicht vollständig in den Medien von Complete Schneider auf, und Sie werden feststellen, dass sich ein Niederschlag im Boden des Rohres niederlässt. - Machen Sie Aliquots der Medien, sicher sein, den Niederschlag zu verlassen, da es die Bildgebung stören wird.
HINWEIS: Diese Lösung kann innerhalb eines Monats verwendet werden, wenn sie in Aliquots bei 4 °C gelagert wird.
2. Sammlung von Drosophila zur Zerlegung
HINWEIS: Detaillierte Drosophila-Sammlungs- und Sezierverfahren können auch in Weil et al.10 und Parker et al.11gefunden werden.
- Für eine optimale weibliche Keimzellbildgebung bereiten Sie zunächst eine Durchstechflasche mit Standard-Maismehl-Fliegenfutter und einen Tupfer mit nasser Hefepaste vor, der die Konsistenz von Erdnussbutter ist. Dadurch wird sichergestellt, dass die weiblichen Fliegen gut gefüttert sind und alle Follikelentwicklungsstadien für die Bildgebung produzieren.
- Für optimal gesunde Fliegen, sammeln 0-1 Tage alte Weibchen und transferieren mit Männchen in eine Fliegenfutter-Fläschchen mit nasser Hefepaste.
HINWEIS: Stellen Sie sicher, dass die schlafenden Fliegen die Hefepaste nicht kontaktieren, da sie daran kleben können. - Füttern Sie die Fliegen 3-7 Tage, ändern Sie die Durchstechflasche und die Hefepaste täglich.
HINWEIS: Stellen Sie sicher, dass die Hefepaste das Fliegenfutter kontaktiert, damit es nicht austrocknet.
3. Drosophila Ovarialsektion
HINWEIS: Es ist wichtig, die Medienlösungen frisch vorzubereiten, da Wasserstoffperoxid anfällig für Oxidation ist und TMRE im Laufe der Zeit abgebaut wird.
- Bereiten Sie in den Medien von Complete Schneider in den Medien von Complete Schneider ein frisches Aliquot von 2 MH2O2-Lösung, ein frisches Aliquot von 46 nM Tetramethylrhodin, Ethylester (TMRE) und ein frisches Aliquot einer 46 nM TMRE-Lösung vor, die 2 M H2O2 enthält.
- Für Eierstock-Sektion, verwenden Sie zwei Paare von feinen Zangen und ein Paar von elektrolytisch geschärften Wolframnadeln12. Um die Eierstöcke zu sezieren, füllen Sie 2-3 Brunnen einer Glasboden-Sezschale (Uhrenglas) mit Complete Schneider's, die auf Raumtemperatur erwärmt wurde.
- Anästhesisieren Sie die Durchstechflasche von gemästeten Fliegen mit Kohlendioxid und trennen Sie die gewünschte Anzahl weiblicher Fliegen, die seziert werden sollen. Platzieren Sie eine einzelne Fliege mit Zangen in den Medien.
- Greifen Sie unter einem Sezierendes Mikroskop die Fliege vorsichtig mit einem Paar feiner Zange am Thorax. Mit dem anderen Zangenpaar greifen Sie das Hinterteil und ziehen Sie sanft, um die Eierstöcke zu entfernen.
HINWEIS: Wenn die Eierstöcke mit dieser Methode nicht reibungslos herauskommen, kann auch der gesamte Bauch von der Fliege entfernt werden, und die Eierstöcke können vorsichtig aus beiden Enden des Bauches mit Zange gedrückt werden. - Entfernen Sie alle fremden Nagelhaut oder Gewebe, dann übertragen Sie die Eierstöcke auf einen neuen Brunnen mit frischen Medien. Die Eierstöcke sollten sich immer noch von der umgebenden Muskelscheide bewegen.
4. Vorbereitung von Ovariolen für die Bildgebung
- Mit geschärften Wolframnadeln, sanft necken die Ovarioles auseinander, wobei darauf geachtet wird, die umgebende Muskelhülle zu entfernen (Abbildung 1).
- Tauchsanft alle Muskelhüllen und Nervenfasern, die an den isolierten Ovariolen befestigt sind (Abbildung 2).
HINWEIS: Wenn der Muskelmantel nicht entfernt wird, wird das Ovariole zucken und sich bewegen, was Probleme mit der Bildaufnahme verursacht (Video 1). - Wenn die subzellulären Strukturen von Interesse endogen beschriftet sind, fahren Sie mit Schritt 4.4 fort. Wenn die Konstruktionen von Interesse mit einem Fluoreszenzfarbstoff gekennzeichnet werden, fahren Sie mit Abschnitt 5 fort.
- Nachdem die Ovariolen sauber seziert wurden, mit einer Mikropipette, übertragen Sie sie in einem 100-L-Tropfen von Complete Schneiders Bildmedien in die Glasdepression einer Glasbodenschale. Die einzelnen Ovariolen sinken auf den Boden des Tröpfchens.
- Fahren Sie mit Abschnitt 6 für die Bildgebung fort.
HINWEIS: Für die Abbildung von Mitochondrien und Clu-Glückseligkeitspartikeln sollten nicht mehr als fünf bis zehn Minuten vom Beginn der Zerlegung bis zur Bildgebung vergehen.
5. Färbung mitochondrien mit TMRE
HINWEIS: Weitere detaillierte Verfahren zur Live-Färbung von Mitochondrien mit fluoreszierenden Farbstoffen finden Sie in Parker et al. 2017.
- Nach Schritt 4.3 die isolierten Ovariolen in einem 100-L-Tropfen von 46 nM TMRE-Medien in die Glasdepression einer Glasbodenschale übertragen. Die einzelnen Ovariolen sinken auf den Boden des Tröpfchens.
- 20 Minuten bei Raumtemperatur inkubieren. Legen Sie den Deckel auf die Glasbodenschale und legen Sie die Schale für die Dauer des Experiments in eine überdachte Box, um sie vor Licht zu schützen.
HINWEIS: Nach der Inkubation können Proben direkt ohne Wassen abgebildet werden. - Wiederholen Sie die Schritte 5.1-5.2, um mindestens zwei Gerichte mit TMRE-beschrifteten Ovariolen zuzubereiten, eines als Versuchsgruppe und eines als Kontrolle dienend.
6. Live-Bildaufnahme
- Sobald die Ovariolen montiert sind, legen Sie eine der Glasbodenschalen auf das Mikroskop und konfigurieren Sie die bildgebenden Parameter nach Bedarf. Die optimalen Anregungs-/Emissionswellenlängen für den hier verwendeten TMRE liegen bei 549 nm/574 nm.
- Nach dem Auffinden des gewünschten Sichtfeldes können Sie Standbilder oder Kurzvideos von einem oder mehreren Ovariolen nach Belieben als Aufzeichnung der Vorbehandlungsbedingungen erfassen.
7. Zugabe von Wasserstoffperoxid während der Bildgebung
- Halten Sie die Live-Bildgebung an, entfernen Sie den Deckel von der Glasbodenschale, und fügen Sie der Schale vorsichtig 100 L von 2 ,MH 2O2-Lösung mit einer Mikropipette hinzu, wenn sie endogen beschriftete Strukturen abbilden. Wenn Sie Mitochondrien bildgeben, fügen Sie der Schale mit einer Mikropipette vorsichtig 100 l 46 nM TMRE mit 2 M H2O2-Lösung mit einer Mikropipette hinzu (Video 2).
- Vermeiden Sie es, die Oberfläche des vorhandenen Medientröpfchens zu brechen oder die Lösung zu schnell hinzuzufügen, um die auf der Unterseite der Schale ruhenden Eizellen nicht zu verdrängen (Video 2).
- Ersetzen Sie den Tellerdeckel (Schalenabdeckung), verschieben und richten Sie ggf. das gewünschte Sichtfeld neu aus, und setzen Sie die Bildgebung fort (Video 3, Video 4, Abbildung 3, Abbildung 4).
- Achten Sie darauf, die Bildgebung so schnell wie möglich nach H2O2-Zugabe wieder aufzunehmen, da die experimentelle Behandlung zeitempfindlich ist (Video 5).
- Erfassen Sie nach Belieben Standbilder oder kurze Videos von einem oder mehreren Ovariolen. Dies wird als Aufzeichnung der Nachbehandlungsbedingungen dienen.
- Legen Sie für die Steuerung die zweite Glasbodenschale auf das Mikroskop und wiederholen Sie Abschnitt 6.
- Wiederholen Sie Schritt 7.1, diesmal fügen Sie der Schale 100 L reines TMRE-Medium hinzu. Wenn die Bildgebung endogen beschriftete Strukturen darstellt, fügen Sie 100 l der reinen Medienlösung von Complete Schneider hinzu.
- Wiederholen Sie die Schritte 7.2 und 7.3, um Daten für die Kontrollgruppe zu erfassen.
HINWEIS: Für die Abbildung von Mitochondrien und Clu-Glückseligkeitspartikeln sollten nicht mehr als drei fünf Minuten von der Zugabe von Wasserstoffperoxid bis zur Bildgebung vergehen.
Ergebnisse
Die beschriebenen Protokolle können verwendet werden, um die Auswirkungen von Wasserstoffperoxid während der Live-Bildgebung von Drosophila-Ovarien zu untersuchen. Wie in Abbildung 3, Abbildung 4, Video 3 und Video 4 gezeigt, bietet dieses Verfahren eine effektive Möglichkeit, Gewebeveränderungen und Dynamiken nach experimenteller Behandlung in Echtzeit zu visualisieren. Wichtig ist, dass dieses Protokoll spezifisch für die Zugabe von H2O2 zu Ovariolen während der Bildgebung ist; es kann jedoch für die exogene Zugabe anderer Arzneimittel oder Reagenzien von Interesse angepasst werden. Darüber hinaus können Follikel vor der Bildgebung mit allen fluoreszierenden Farbstoffen (z. B. Tetramethylrhodinamin (TMRE), LysoTracker) gekennzeichnet werden (Video 3). Die wichtigsten Schritte zur Erzielung klarer Bildgebungsergebnisse sind 1) die richtige Zerlegung und Isolierung einzelner Ovariolen mit allen kontraktilen Elementen entfernt (Abbildung 1 und Abbildung 2) und 2) die Geschwindigkeit, mit der die Bildgebung nach Wasserstoffperoxidzugabe neu gestartet wird. Video 4 ist eine Illustration eines richtig sezierten Follikels, der während der gesamten Bilddauer im Vergleich zu Video 1stabil bleibt, was einen schlecht sezierten Follikel veranschaulicht, der das Sichtfeld während der Bildgebung verlässt. Video 5 ist eine Illustration, in der die H2O2-Effekte auf TMRE-markierte Mitochondrien bereits vor Beginn der Bildgebung aufgrund zu viel verstrichener Zeit vorangekommen sind. Im Vergleich zu Video 3, in dem die Bildgebung unmittelbar nach der Wasserstoffperoxidzugabe (Zeit 0) neu gestartet wurde und intakte, dispergierte Mitochondrien noch sichtbar sind, haben die Mitochondrien in Video 5 bereits begonnen, sich sichtbar zu verklumpen und ihr Membranpotenzial beim Neustart der Bildgebung zu verlieren. Dieses Problem wird hauptsächlich auf eine Störung der Probenpositionen während derH2O2-Zugabe zurückgeführt und kann durch Befolgung der Technik zur Intakthaltung der Bildmedien und der Probenposition(Video 2) gemildert werden. Bemerkenswert ist, dass bei Kontrollexperimenten, die ohne H2O2 durchgeführt wurden, die Mitochondrien in Follikel ordnungsgemäß dispergiert bleiben und der TMRE-Farbstoff in den Mitochondrien sequestriert bleibt.
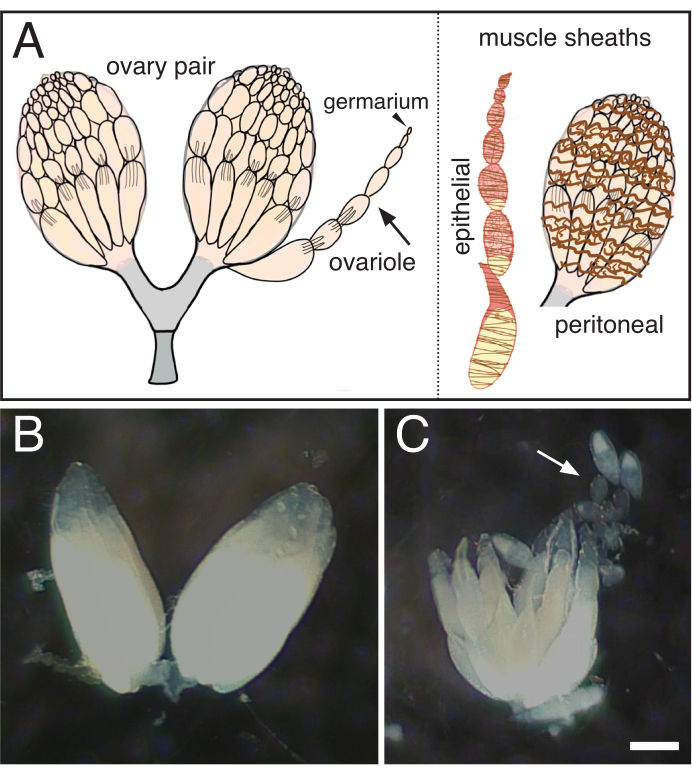
Abbildung 1: Isolierung einzelner Ovariolen von Drosophila-Ovarien. (A) Cartoon, die ein Paar Eierstöcke, ein einzelnes Ovariole (Pfeil) mit dem Germarium an der Spitze (Pfeilspitze) und die beiden Muskelscheiden, die die Ovariole (braun, epithelisch) und den Eierstock (braun, peritoneal) umgeben. (B) Disezierter Drosophila Eierstock. (C) Nachträgliche Trennung des gehänselten Eierstocks in einzelne Eizellen (Pfeil). Skalenbalken = 100 um. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
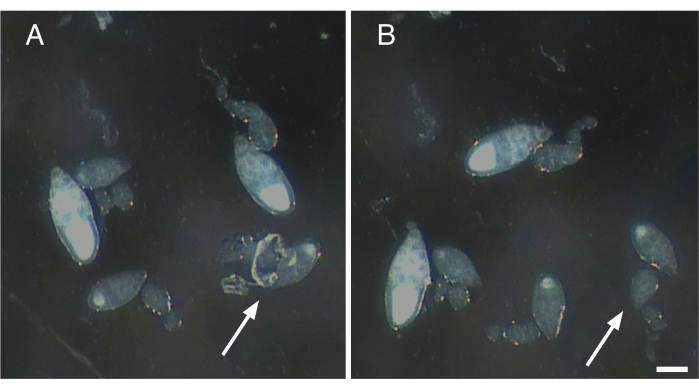
Abbildung 2: Entfernung von Nervenfasern und kontraktilen Elementen aus einzelnen Ovariolen. (A) Einzelne Ovariole mit Resten von Nervengewebe und der Muskelhülle noch befestigt (Pfeil). (B) Sanfte Entfernung des gesamten verbleibenden Gewebes, das in A (Pfeil) an Ovariole befestigt ist. Maßstabsleiste = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
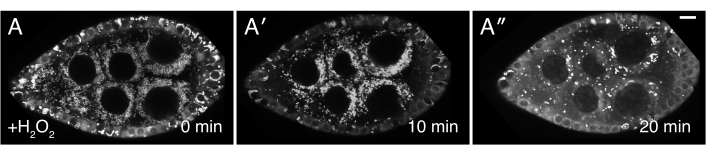
Abbildung 3: H2O2 verursacht mitochondriale Fehllokalisierung. (A-A") Live-Bild-Standbilder eines gut gefütterten Clu CA06604 (Clu::GFP fliegt) Follikel. Die Zugabe von H2O2 führt dazu, dass Mitochondrien über die Dauer der Bildgebung verklumpen. DIE TMRE-Kennzeichnung von Mitochondrien weist darauf hin, dass Mitochondrien zunächst zum Zeitpunkt 0 (A) dispergiert werden und dass Mitochondrien nach H2O2-Zugabe (A)zu verklumpen beginnen. Weiß = TMRE (A-A"). Skalenbalken: 10 'm in (A) für A-A"5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
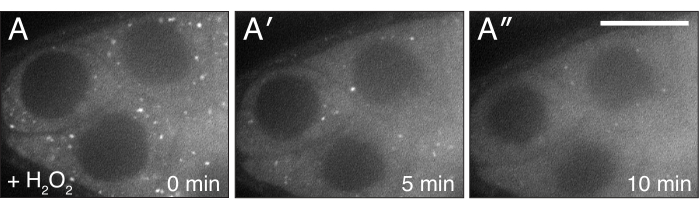
Abbildung 4:H2O2 zerstreut Clu. (A-A") Live-Bild-Standbilder eines gut gefütterten CluCA06604 Follikels. Die Zugabe von H2O2 bewirkt, dass sich Partikel im Zytoplasma über die Dauer der Bildgebung dispergieren und homogen werden. Weiß = Clu::GFP (A-A"). Maßstabsleiste: 40 'm in (A) für A-A"5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Follikel aus einem cluCA06604 Weibchen. Wie in Abbildung 2beschrieben, führt das Versäumnis, Nervenfaserkontraktile Elemente aus einzelnen Ovariolen zu entfernen, zu einem deutlichen Driften und Der Bewegung der Ovarioles während der Bildgebung und der anschließenden Unfähigkeit, bildgebende Daten zu analysieren. Weiß = Clu::GFP. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Richtige Zugabe von H2O2 zur Probeschale. Wasserstoffperoxid sollte der Probenschale mit einer mikropipette in angemessener Größe zugesetzt werden. Abgabe H2O2 ohne Bruch der Medienoberfläche. Es wird darauf geachtet, dass die Oberfläche der Bildmedien nicht gebrochen wird, um die Probendrift während der Wasserstoffperoxidzugabe zu minimieren. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 3: H2O2-Zugabe bei der Abbildung von TMRE-markierten Follikel. Follikel aus einem cluCA06604 Weibchen mit TMRE gebeizt. H2O2 verursacht eine mitochondriale Fehllokalisierung in Drosophila Follikel. Weiß = TMRE Farbstoff. Bildnis einen Frame pro 15 s für 20 min, und das Video ist 10 Bilder pro Sekunde5. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 4: H2O2-Zugabe während der Bildgebung von Clu::GFP Follikel. Follikel aus einem cluCA06604 Weibchen. H2O2 dispergiert Clu-Partikel, wie in Abbildung 4beschrieben. Weiß = Clu::GFP. Bildnis einen Frame pro 15 s für 15 min, und das Video ist 10 Bilder pro Sekunde. 5Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 5: Verzögerte Bildgebung nach H2O2-Zugabe. Follikel aus einem cluCA06604 Weibchen. Die Zugabe von Wasserstoffperoxid zu Follikel ist eine zeitkritische Behandlung. Der Neustart der Bildgebung verzögerte sich in diesem Video aufgrund der Probenverschiebung während der H2O2-Zugabe. Die Mitochondrien haben bereits begonnen, sichtbar zu verklumpen und verlieren ihr Membranpotenzial beim Neustart der Bildgebung zum Zeitpunkt 0 (im Vergleich zu Zeit 0 in Video 3). Wenn die Bildgebung nach der Behandlung nicht schnell wieder aufgenommen wird, führt dies zu ungenauen und unbrauchbaren Ergebnissen, da die frühen experimentellen Effekte vor der Bildgebung fehlen werden. Weiß = TMRE. Bildnis einen Frame pro 15 s für 20 min, und das Video ist 10 Bilder pro Sekunde. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Dieses Protokoll könnte eine nützliche Ergänzung als Kontrolle für Artefakte aufgrund der Eierstocksektion und Gewebeinkubation für jedes Live-Bildgebungsexperiment sein. Die kritischen Schritte ähneln denen anderer Live-Imaging-Protokolle. Zu lernen, wie man ganze Drosophila Eierstöcke seziert, braucht Praxis; Diese Fertigkeit kann jedoch in der Regel relativ schnell mit den entsprechenden Sezierwerkzeugen erlernt werden. Schwieriger zu meistern ist das Entfernen des Muskels, der die Eierstöcke und jedes Ovariole13umhüllt. Dies muss getan werden, um sicherzustellen, dass Muskelkontraktionen nicht mit der Bildaufnahme stören. Wenn die Verwendung von geschärften Wolframnadeln, um dies zu tun, nicht erfolgreich ist, kann das Germarium an der Spitze des Ovariole mit Zangen und die Ovariole aus der Muskelscheide gezogen werden. Diese Technik ist jedoch problematisch, wenn die frühesten Entwicklungsstadien untersucht werden sollen, da sie beschädigt werden können. Ein weiterer wichtiger Schritt ist es, die Ovariolen, die auf der Unterseite der Schale ruhen, beim Hinzufügen von H2O2nicht zu vertreiben. Ein weiterer wichtiger Aspekt wird von allen Live-Bildgebung geteilt: Der Forscher sollte sicherstellen, dass die Struktur von Interesse fluoreszierend gut markiert wird, bevor die Behandlung. Die hier verwendeten Gerichte (Tabelle der Materialien) werden häufig für Live-Bildgebung verwendet; Jedoch sollte jede Schale oder Rutsche mit einem Glasdeckel auf der Unterseite oder sogar einem großen Glasabdeckungsslip funktionieren, solange der Tropfen der Medien abgedeckt werden kann, um eine Verdunstung der Medien zu verhindern. Während wir ein bestimmtes Mikroskop verwenden, sollte jedes invertierte Mikroskop mit dem Ziel einer ausreichenden Vergrößerung, um die betreffende subzelluläre Struktur zu sehen, und eine angeschlossene Kamera mit ausreichender Auflösung und Bildaufnahmerate funktionieren.
Während unser Labor in erster Linie an mitochondrialer Funktion interessiert ist, könnte diese Methode hilfreich sein, die Dynamik und Lokalisierung jeder subzellulären Struktur oder Organelle, wie z. B. des Kerns, des Zytoskeletts oder des endoplasmatischen Retikulums, zu untersuchen. Diese Methode hat jedoch Einschränkungen. Um Wasserstoffperoxid hinzuzufügen, muss sich das Gewebe in einem wässrigen Medium begeben. Eine alternative Methode für die Live-Bildgebung ist die Verwendung von Halocarbonöl, das bei der Beschreibung vieler wichtiger Prozesse in Drosophila-Ovariolen, einschließlich des ersten Beispiels der dynamischen Bewegung von GFP in einem Modellorganismus,7,14,eine wichtige Rolle spielt. Darüber hinaus verursacht die Zugabe von Wasserstoffperoxid in die Medien eine weit verbreitete oxidative Schädigung, die eine zu allgemeine Beleidigung des Gewebes sein kann, um für den zellulären Prozess von Interesse informativ zu sein, insbesondere für längere Experimente, die die Entwicklung untersuchen. Obwohl es möglicherweise nicht möglich ist, Experimente durchzuführen, die aufgrund dieser schnellen, umfangreichen und wahrscheinlich irreversiblen oxidativen Schäden die Zelle über einen längeren Zeitraum visualisieren müssen, haben wir gesehen, dass die von uns beschriebene akute Wasserstoffperoxidbehandlung auf die meisten Stadien der Oogenese anwendbar ist, da wir in der Lage sind, die gleichen Effekte in den meisten Stadien innerhalb des Bildgebungszeitraums zu sehen. Angesichts der geringen Kosten und der Leichtigkeit des Protokolls kann es eine nützliche Kontrolle für Schäden sein und kann auch als Behandlung vor fixierender und Antikörperkennzeichnung verwendet werden.
In unseren Händen imitiert die H2O2-Behandlung die Veränderungen der mitochondrialen Fehllokalisierung und der Clu-Glückseligkeitspartikeldispersion, die wir in verschiedenen Drosophila-Mutanten sehen. Es imitiert auch Ergebnisse, die wir für neue Forscher im Labor lernen Seziertechniken sehen. Daher zeigte diese Methode deutlich, dass Probenvorbereitung und allgemeiner zellulärer Stress zu unerwarteten und zuvor unerklärlichen Veränderungen der mitochondrialen Fehllokalisierung und des Vorhandenseins von Glückspartikeln führen können. Um diese Technik voranzubringen, könnten Wasserstoffperoxidkonzentrationen mit einer höheren oder niedrigeren Konzentration moduliert werden. Wenn ein zellulärer Effekt mit einer niedrigeren Konzentration gesehen wird, ist es möglich, dass der Stress-Phänotyp reversibel ist, indem er das Medium durch Complete Schneiders ersetzt. Verschiedene Zellstressoren wie Carbonylcyanid m-Chlorphenylhydrazone (CCCP), Arsenit oder einfacher Hitzeschock könnten sich als nützlich für allgemeine zelluläre Belastungen für andere subzelluläre Strukturen erweisen. Da die Live-Bildgebung von Ex-vivo-Geweben eine manuelle Manipulation und Inkubation in verschiedenen Medien erfordert, sollte diese Kontrolle eine nützliche Ergänzung sein, um sicherzustellen, dass alle Beobachtungen so nah wie möglich an der normalen Physiologie liegen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Dr. Jeremy Smyth für die bildgebende Unterstützung und Ann C. Shenk für Illustrationen, Produktion und Videographie. Diese Arbeit wurde von den National Institutes of Health (1R01GM127938 bis R.T.C.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Active dry yeast | Red Star® | ||
| CO2 gas | 99.9% purity | ||
| CO2 pad | |||
| Dissecting microscope, Nikon SMZ645 model | Nikon | ||
| Dissecting needles - PrecisionGlide needles | BD | 305165 | B-D 21G1 size |
| Dissecting needles - PrecisionGlide syringes | BD | 309657 | Luer-Lok tip, 3 mL size |
| Dissecting needles - tungsten wire | Electron Microscopy Sciences | 73800 | |
| Dumont #5 forceps (2 pairs) | Fine Science Tools | 11251-10 | |
| NI-150 High Intensity Illuminator | Nikon Instruments Inc. | ||
| Gibco Fetal Bovine Serum, Heat Inactivated | Fisher Scientific | 10082-147 | |
| Gibco Schneider's Drosophila Media | Sigma-Aldrich | 21720-024 | |
| Hydrogen peroxide solution, 30% (w/w) in H2O | Sigma-Aldrich | H1009 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| Spinning disk microscope | Nikon | Equivalent scopes may also be used | |
| Lonza BioWhittaker Antibiotics: Penicillin-Streptomycin mixtures | Fisher Scientific | 17-602E | |
| MatTek Corporation Glass Bottom Dishes, 35 mm | Fisher Scientific | NC9344527 | |
| Micropipettes and tips of appropiate size | Eppendorf | ||
| Microcentrifuge tubes, 1.7 mL | VWR | 87003-294 | |
| Tetramethylrhodamine, Ethyl Ester, Perchlorate (TMRE) | AnaSpec | AS-88061 | |
| w[1118] | Bloomington Drosophila Stock Center | 5905 | Wild-type flies |
| y w; clu[CA06604] | Available upon request. | Clu::GFP trap flies |
Referenzen
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: the Fenton reaction. Toxicology Letters. 82-83, 969-974 (1995).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Cox, R. T., Spradling, A. C. Clueless, a conserved Drosophila gene required for mitochondrial subcellular localization, interacts genetically with parkin. Disease Models & Mechanisms. 2 (9-10), 490-499 (2009).
- Sen, A., Kalvakuri, S., Bodmer, R., Cox, R. T. Clueless, a protein required for mitochondrial function, interacts with the PINK1-Parkin complex in Drosophila. Disease Models & Mechanisms. 8 (6), 577-589 (2015).
- Sheard, K. M., Thibault-Sennett, S. A., Sen, A., Shewmaker, F., Cox, R. T. Clueless forms dynamic, insulin-responsive bliss particles sensitive to stress. Developmental Biology. 459 (2), 149-160 (2020).
- Sen, A., Cox, R. T. Clueless is a conserved ribonucleoprotein that binds the ribosome at the mitochondrial outer membrane. Biology Open. 5 (2), 195-203 (2016).
- Parton, R. M., Valles, A. M., Dobbie, I. M., Davis, I. Isolation of Drosophila egg chambers for imaging. Cold Spring Harbor Protocols. 2010 (4), 5402(2010).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
- Prasad, M., Montell, D. J. Cellular and molecular mechanisms of border cell migration analyzed using time-lapse live-cell imaging. Developmental Cell. 12 (6), 997-1005 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments. (60), e3679(2012).
- Parker, D. J., Moran, A., Mitra, K. Studying Mitochondrial Structure and Function in Drosophila Ovaries. Journal of Visualized Experiments. (119), e54989(2017).
- Brady, J. A simple technique for making fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314 (2), 329-340 (2008).
- Wang, S., Hazelrigg, T. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature. 369 (6479), 400-403 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten