Method Article
라이브 이미징을 사용하여 Drosophila 계란 챔버에 산화 손상의 효과 시각화
요약
이 프로토콜의 목적은 Drosophila 난소에서 세포 극체 구조의 국소화 및 역학에 산화 손상의 효력을 시각화하기 위하여 살아있는 화상 진찰을 사용하는 것입니다.
초록
Drosophila 멜라노가스터 난소의 라이브 이미징은 리보뉴클레오단백질 입자 운동, mRNA 국소화, 세포간 운동 및 세포 골격 역학을 포함하여 개발 중 다양한 기본 세포 과정을 이해하는 데 중요한 역할을 해 왔습니다. 개발 된 라이브 이미징을위한 몇 가지 방법이 있습니다. 각 방법은 미디어 또는 할로카본 오일에 배치 된 개별 혈관을 해부 포함한다는 사실로 인해 저산소증 및 / 또는 물리적 조작으로 인한 세포 손상은 시간이 지남에 따라 필연적으로 발생할 수 있습니다. 저산소증의 한 다운스트림 효과는 세포내 산화 손상을 증가시키는 것입니다. 이 프로토콜의 목적은 살아있는 이미징을 사용하여 제어된 세포 손상의 유도 후 Drosophila 난소에서 세포 전세포 구조의 국소화 및 역학에 대한 산화 손상의 효과를 시각화하는 것입니다. 여기서, 우리는 과산화수소를 사용하여 세포 산화 손상을 유도하고 두 개의 세포 외 구조, 미토콘드리아 및 Clu 행복 입자에 대한 이러한 손상의 영향을 예를 제공합니다. 그러나 이 방법은 모든 세포 전 체형 구조에 적용됩니다. 제한 사항은 과산화수소는 수성 매체에만 첨가할 수 있으며 할로탄소 오일을 사용하는 이미징에는 작동하지 않는다는 것입니다. 장점은 과산화수소가 쉽게 사용할 수 있고 저렴하고, 신속하게 작용하며, 농도가 변조될 수 있으며, 산화 손상은 저산소증에 의한 손상의 좋은 근사치뿐만 아니라 조작으로 인한 일반적인 조직 손상이다.
서문
여러 가지 세포 스트레스는 열 쇼크, 산화 스트레스, 삼투 스트레스, 영양 스트레스 및 독성 조건을 포함하여 조직 전 생체 의 실험 배양 및 조작 중에 발생할 수 있습니다. 라이브 이미징은 실험적 치료 및 조작 후 전 생체 조직의 실시간 변화를 시각화하는 데 사용되는 강력한 도구입니다. 미세 조직 해부 및 조작은 연습을 하고, 해부에서 화상 진찰에 이르는 시간의 양은 경험에 따라 달라질 수 있습니다. 이 방법을 개발하기위한 근거는 라이브 이미징을위한 조직을 준비하는 것이 해부 및 이미징 준비 중에 세포 스트레스를 일으킬 수 있다는 우려에 근거합니다. 이 세포 대사와 사용 가능한 산소 수준에 있는 변화에 민감한 프로세스에 대 한 특히 문제가 될 수 있습니다., 미토 콘 드리 아 기능 등. 병렬 야생형 시료가 중요한 대조군이지만, 세포체 구조의 일부 또는 전부 관찰된 변화는 해부로부터의 손상 또는 세포 스트레스로 인해 발생할 수 있으며 정상적인 생리학이나 치료 또는 돌연변이를 반영하지 않을 가능성이 여전히 있다.
이러한 잠재적인 문제를 해결하기 위해, 우리는 세포 산화 손상을 유도하기 위해 라이브 이미징 중에 과산화수소 추가를사용합니다. 이 방법의 목적은 세포 극체 구조에 미치는 영향을 모니터링하기 위해 조직에 손상을 유도하는 것이다. 이 프로토콜은 두 가지 목적을 위해 유용하다: 1) 관심구조의 세포세포 화의 변화가 미숙한 해부에 의한 응력 때문인지 여부를 결정하고 2) 일단 연구원이 관심 구조에 대한 제어응력의 효과를 모니터링하는 해부 기술에 확신을 가지면. 여기에서 우리는 증가된 산화 손상이 두 개의 세포 외 구조물, 미토콘드리아 및 Clu 행복 입자에 있는 변경을 일으키는 원인이 되는 방법의 2개의 예를 보여줍니다. 이를 위해, 우리는 살아있는 화상 진찰 연구 결과를 위한 일반적인 모형인 Drosophila 난소를 이용합니다. 첫 번째 예는 미토콘드리아 국소화를 검사합니다. 우리의 경험에서, 여성 세균 세포에 있는 일반적인 미토콘드리아 국소화는 동요에 높게 과민하고 세포 긴장의 선구자역할을 할 수 있습니다. 드로소필라 암컷 세균 세포의 미토콘드리아는 일반적으로 세포질2전체에 고르게 분산된다. 과산화수소 첨가는 세포기관이 다양한돌연변이3,4,5와유사한 방식으로 빠르게 오지역화되고 클러스터되는 원인이 된다. 두 번째 예는 Clueless(Clu)에 의해 형성된 행복 입자입니다. 클루는 세포질 전체에 확산되는 리보뉴클레오단백질이다. 그러나, 또한 최적의 세포 조건 하에서 미토콘드리아 관련 입자를형성한다 5. Clu 입자의 존재는 건강한 세포 조건에 의존하기 때문에, 우리는 그들을 "행복"입자3,5,6이라고합니다. 과산화수소의 첨가로 인해 이러한 입자가 빠르게 분산되어 세포질5에서균질화된다. 우리의 연구 과정에서, 우리는 이 세포 외 구조물의 현지화에 있는 변경을 관찰했습니다, 그러나 살아있는 화상 진찰 연구를 수행한 후에만 우리는 완전히 세포 긴장 및 미토콘드리아와 행복 입자의 지역화에 산화 손상의 효력을 이해할 수 있었습니다.
이미 설립된 또는 대체 방법에 추가된 이 프로토콜의 유용성은 여러 가지 요인에 따라 달라집니다. 첫째, 이미징 프로토콜은 약물 첨가에 순종해야 한다. 시료가 커버슬립 아래와 할로카본 오일에 장착된 경우 이 방법은7을불가능합니다. H2O2 첨가는 산화 손상의 급속한 상승을 야기하므로, 따라서, 이 기간은 적절하지 않을 수 있습니다. 산화 손상은 저산소증의 대리자로 간주될 수 있습니다. 그러나, 특정 세포 전 성분에 대한 손상에 대한 적절한 제어로 작동하기에는 너무 가혹하거나 너무 일반화 될 수 있습니다. 마지막으로, 발달 과정을 따르는 것과 같은 마지막 시간, H2 O2첨가가 너무 강할 수 있는 이미징 실험의 경우(예를 들어 8). 농도 곡선을 테스트하면 이러한 제한을 극복할 수 있습니다.
프로토콜
1. 해부 및 이미징 미디어 준비
참고: 이 라이브 이미징 실험에 가장 적합한 미디어에는 슈나이더의 Drosophila 미디어가 포함되어 있으며, 15% 열 불활성화 태아 소 혈청, 0.6x 펜-스트렙 및 200 μg/mL 소 인슐린이 포함되어 있으며, 그 후 완전한 슈나이더의 미디어라고 합니다.
- 멸균 조건에서 미디어 준비를 수행하여 오염되지 않도록 하십시오. 미디어는9시간의연장된 기간 동안 드로소필라 오바오리를 지원하기 위해 개발되었다.
- 슈나이더의 미디어에 15% 열 불활성화 태아 소 혈청, 0.6x 펜-스트렙, 200 μg/mL 소 인슐린을 추가합니다.
- 내용내용을 잘 섞고 하룻밤 사이에 4°C에 보관하십시오.
참고 : 인슐린은 완전한 슈나이더의 미디어에 완전히 용해되지 않으며, 당신은 침전물 튜브의 바닥에 정착을 알 수 있습니다. - 이미징을 방해할 수 있으므로 침전을 남기십시오.
참고: 이 용액은 4°C에서 알리쿼트에 저장하면 1개월 이내에 사용될 수 있다.
2. 해부를 위한 드로소필라 컬렉션
참고: 상세한 Drosophila 수집 및 해부 절차는 또한 Weil 외10 및 Parker 외11에서찾아볼 수 있습니다.
- 최적의 여성 세균 세포 이미징을 위해 먼저 표준 옥수수 밀 플라이 푸드와 땅콩 버터의 일관성인 젖은 효모 페이스트를 포함하는 유리병을 준비하십시오. 이것은 여성 파리가 잘 공급되고 화상 진찰을 위한 모든 여포 발달 단계를 생성할 것이라는 점을 보장합니다.
- 최적으로 건강한 파리의 경우 0-1일 된 암컷을 모으고 수컷과 함께 젖은 효모 페이스트를 함유한 플라이 푸드 바이알로 옮직합니다.
참고: 잠자는 파리가 효모 페이스트에 닿지 않도록 하십시오. - 파리를 3-7일 먹이고, 매일 유리병과 효모 페이스트를 바꿔보냅니다.
참고: 효모 페이스트가 플라이 푸드와 접촉하여 건조하지 않도록 하십시오.
3. 드로소필라 난소 해부
참고: 과산화수소는 산화에 취약하고 TMRE가 시간이 지남에 따라 저하되기 때문에 미디어 솔루션을 신선하게 준비하는 것이 중요합니다.
- 해부 직전, 완전한 슈나이더의 미디어에서 2 μM H2O2 용액의 신선한 알리쿼트, 46 nM 테트라메틸lrhodamine, 에틸 에스테르 (TMRE)의 신선한 알리쿼트, 2 μM H2O2O 2를 포함하는 46 nM TMRE 솔루션의 신선한 알리쿼트.
- 난소 해부의 경우, 미세 집게 2 쌍과 전해질 날카로운 텅스텐 바늘12쌍을 사용합니다. 난소를 해부하려면 실온으로 따뜻해졌던 완전한 슈나이더(Complete Schneider)와 함께 유리 바닥 해부 접시(시계 유리)의 2-3웰을 채웁니다.
- 이산화탄소로 살찐 파리의 유리병을 마취하고 원하는 수의 암컷 파리를 해부합니다. 집게를 사용하여 미디어에 단일 플라이를 배치합니다.
- 해부 현미경으로, 한 쌍의 미세 한 개의 집게를 사용하여 흉부로 부드럽게 비행을 잡습니다. 다른 한 쌍의 집게와 함께 후방을 잡고 부드럽게 당겨 난소를 제거합니다.
참고: 난소가 이 방법을 사용하여 원활하게 나오지 않으면 전체 복부도 즉석에서 제거될 수 있으며 난소는 집게를 사용하여 복부의 양쪽 끝에서 부드럽게 압착될 수 있습니다. - 어떤 외부 자피 또는 조직을 제거, 다음 신선한 미디어를 포함하는 새로운 우물에 난소를 전송. 난소는 여전히 주변 근육 칼집에서 이동해야 한다.
4. 이미징을 위한 악보를 준비
- 날카로운 텅스텐 바늘을 사용하여, 부드럽게 주변 근육 칼집을 제거하는 주의 복용, 떨어져 오바리오를 애타게(그림 1).
- 고립 된 바오리올에 부착 된 근육 칼집과 신경 섬유를 부드럽게 애타게합니다(그림 2).
참고: 근육 칼집이 제거되지 않으면, 오바리오일은 경련과 이동하여 이미지 수집에 문제가 발생합니다(비디오1). - 관심있는 세포 극체 구조가 내인성으로 표시되면 4.4 단계로 진행하십시오. 관심 있는 구조물이 형광염으로 표시될 경우 5절로 진행하십시오.
- 오바리오일이 마이크로 파이프를 사용하여 깨끗하게 해부되면, 완전한 슈나이더의 이미징 미디어를 100 μL 드롭으로 유리 바닥 접시의 유리 우울증으로 옮기다. 개별 오병은 물방울의 바닥에 가라 앉을 것입니다.
- 이미징을 위해 섹션 6으로 진행합니다.
참고: 미토콘드리아와 클루 블리스 입자를 이미징하는 경우 해부 시작부터 이미징까지 5-10분 이상 경과해야 합니다.
5. TMRE를 가진 염색 미토콘드리아
참고: 형광염료를 가진 미토콘드리아의 살아있는 염색에 대한 추가 상세한 절차는 Parker 외 2017에서 찾아볼 수 있습니다.
- 4.3단계 후, 46nM TMRE 의 100 μL 낙하로 잔류 식 소바를 유리 바닥 접시의 유리 우울증으로 옮킨다. 개별 오병은 물방울의 바닥에 가라 앉을 것입니다.
- 실온에서 20분 동안 배양하세요. 뚜껑을 유리 바닥 접시에 놓고 실험 기간 동안 지붕이 덮인 상자에 접시를 놓아 빛으로부터 보호하십시오.
참고: 인큐베이션 후 샘플을 세정 없이 직접 이미지화할 수 있습니다. - 5.1-5.2 단계를 반복하여 TMRE 라벨이 부착된 바오리올의 적어도 두 가지 요리를 준비하는 단계, 하나는 실험 그룹으로, 하나는 대조군역할을 한다.
6. 라이브 이미지 수집
- 바오리올이 장착되면 유리 바닥 접시 중 하나를 현미경에 놓고 필요에 따라 이미징 매개 변수를 구성하십시오. 여기에 사용되는 TMRE에 대한 최적의 여기 / 방출 파장은 549 nm / 574 nm입니다.
- 원하는 시야를 찾은 후, 치료 전 조건의 기록으로서 원하는 대로 하나 이상의 바오리올의 스틸 이미지 또는 간략한 비디오를 습득하십시오.
7. 이미징 중 과산화수소 첨가
- 라이브 이미징을 일시 중지하고, 유리 바닥 접시에서 뚜껑을 제거하고, 내인성 으로 표지된 구조를 이미징하는 경우 마이크로 파이프를 사용하여 접시에 2 μM H2O2 용액의 100 μL을 조심스럽게 추가합니다. 미토콘드리아를 이미징하는 경우, 마이크로피펫(비디오2)을사용하여 접시에 2μM H2O2 용액을 사용하여 46nM TMRE의 100 μL을 조심스럽게 첨가한다.
- 기존 미디어 액적의 표면을 깨거나 너무 빨리 솔루션을 추가하여 접시 바닥에 놓는 오바리오를 대체하지 않도록하십시오(비디오 2).
- 접시 뚜껑 (접시 덮개를 교체), 재배치 및 필요한 경우 보기의 원하는 필드를 재배치하고, 화상 촬영을 재개(비디오 3, 비디오 4, 그림 3, 도 4).
- 실험치료가 시간에 민감하기 때문에H2 O2추가후 가능한 한 빨리 이미징을 재개하도록 주의하십시오(비디오5).
- 원하는 대로 하나 이상의 바오리올의 스틸 이미지 또는 간략한 비디오를 수집합니다. 이것은 사후 처리 조건의 기록으로 봉사할 것입니다.
- 제어를 위해, 현미경에 두 번째 유리 바닥 접시를 놓고 섹션 6을 반복합니다.
- 7.1을 반복하면 이번에는 TMRE 전용 매체 100 μL을 접시에 추가합니다. 내인성으로 표지된 구조를 이미징하는 경우 완전한 슈나이더의 미디어 전용 솔루션에 100 μL을 추가합니다.
- 제어 그룹에 대한 데이터를 수집하기 위해 7.2 및 7.3 단계를 반복합니다.
참고: 미토콘드리아 와 클루 행복 입자를 이미징하는 경우 과산화수소를 첨가하여 이미징에 3-5분 이상 경과해야 합니다.
결과
설명된 프로토콜은 Drosophila 난소의 살아있는 화상 진찰 도중 과산화수소의 효력을 연구하기 위하여 이용될 수 있습니다. 도 3, 도 4, 비디오 3 및 비디오 4에 도시된 바와 같이, 본 절차는 실험 적 치료 후 조직 변화와 역학을 실시간으로 시각화하는 효과적인 수단을 제공한다. 중요한 것은, 이 프로토콜은 이미징 하는 동안 ovarioles에 H2O2의 추가에 대 한 구체적이다; 그러나, 다른 약물의 외인성 첨가또는 관심의 시약을 위해 적응될 수 있다. 또한, 모낭은 화상 진찰(Video3)에앞서 관심 있는 형광염료(예를 들어, 테트라메틸lrhodamine(TMRE), 리소트래커)로 표시될 수 있다. 명확한 이미징 결과를 얻기 위한 가장 중요한 단계는 1) 모든 수축 원소가 제거된 단일 혈관의 적절한 해부 및격리(도 1 및 도 2)및 2) 과산화수소 첨가 후 이미징이 다시 시작되는 속도이다. 비디오 4는 이미징 중에 시야를 빠져나가는 잘 해부된 여포를 보여주는 비디오 1과비교하여 이미징 기간 내내 안정적으로 유지되는 제대로 해부된 여포의 예입니다. 비디오 5는 TMRE 라벨미토콘드리아에 대한 H2O2 효과가 너무 많은 경과 된 시간의 결과로 이미징의 시작 전에 이미 진행된 그림입니다. 과산화수소 첨가(시간 0) 및 손상되지 않은 분산 된 미토콘드리아 가 여전히 볼 수있는 비디오 3에 비해 비디오 5의 미토콘드리아는 이미 눈에 띄게 덩어리가 되어 이미징의 재시작 시 막 잠재력을 잃기 시작했습니다. 이 문제는 주로H2 O2첨가 시 샘플 위치의 중단에 기인하며 이미징 미디어 및 샘플 위치를 그대로 유지하는 기술을 따르는 기술을 따르는 것으로 완화될 수 있다(Video2). 참고로, H2O2없이 수행 된 대조 실험에서 여포의 미토콘드리아는 제대로 분산되어 있으며 TMRE 염료는 미토콘드리아에서 격리 된 채로 남아 있습니다.
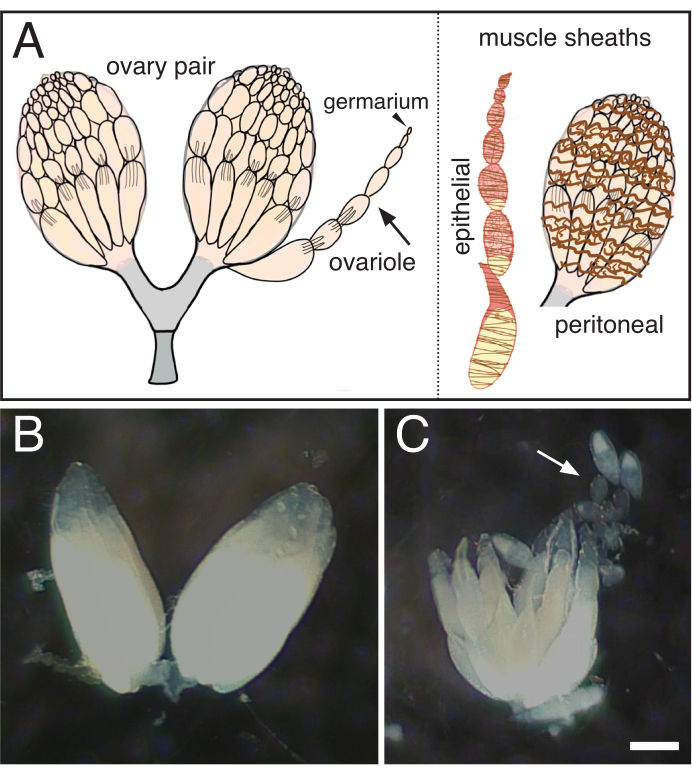
그림 1: 드로소필라 난소로부터 단일 혈관을 분리합니다. (A)각근기(화살표)에 게르마리움이 있는 단일 오바리오레(arrow)와 난소(갈색, 상피) 및 난소(갈색, 간장)를 둘러싼 두 개의 근육 칼집을 나타내는 만화. (B) 드로소필라 난소해부. (C)조롱된 난소의 후속 분리는 개별 난소(arrow)로 한다. 배율 막대 = 100음. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
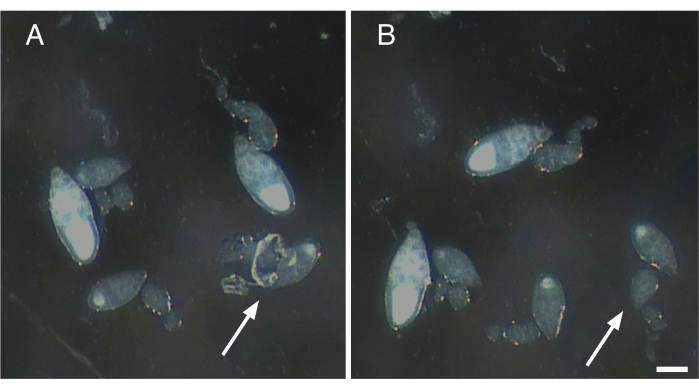
그림 2: 단일 ovarioles에서 신경 섬유 및 수축 원소의 제거. (A)신경 조직의 잔재와 근육 칼집이 여전히 부착 된 단일 ovariole (화살표). (B)A(화살표)에서 ovariole에 부착된 모든 남은 조직을 부드럽게 제거합니다. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
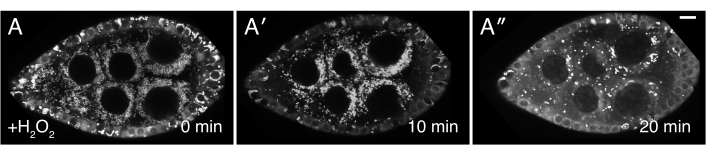
그림 3: H2O2는 미토콘드리아 오지역화를 일으킵니다. (A-A") 잘 공급되는 cluCA06604 (Clu::GFP flies) 여포의 라이브 이미지 스틸. H2 O2를첨가하면 미토콘드리아가 이미징 기간 동안 덩어리가 됩니다. 미토콘드리아의 TMRE 라벨링은 미토콘드리아가 처음에0(A)시에분산되어 있음을 나타내며, 미토콘드리아는 H2O2 첨가 후 덩어리가 되기시작(A′)이후, TMRE 라벨링은 미토콘드리아가 막 잠재력을 잃고 따라서 염료를 증정하는능력(A)을증식하는 능력으로 인해 얼룩이 된다. 흰색 = TMRE(A-A"). 스케일 바: A-A"5용10 μm(A) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
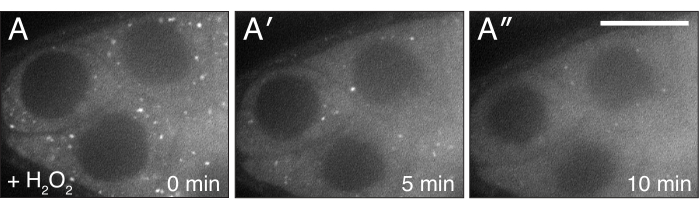
그림 4: H2O2클루스를 분산시합니다. (A-A") 잘 먹이 cluCA06604 여포의 라이브 이미지 스틸. H2 O2를첨가하면 입자가 이미징 기간 동안 세포질에서 분산되고 균일하게 변합니다. 화이트 = 클루::GFP(A-A"). 스케일 바: A-A"5용40 μm(A) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: cluCA06604 여성의 여포. 도 2에설명된 바와 같이, 단일 ovarioles에서 신경 섬유 수축 요소를 제거하지 못하면 이미징 중 바오리올의 현저한 표류 및 이동을 유발하고 이미징 데이터를 분석할 수 없게 된다. 화이트 = 클루::GFP. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2: 샘플 접시에 H 2O2를 적절히 추가합니다. 과산화수소는 적절한 크기의 마이크로 피펫을 사용하여 샘플 접시에 첨가해야합니다. 미디어 표면을 깨지 않고 H2O2를 분배합니다. 과산화수소 첨가 시 시 시료 드리프트를 최소화하기 위해 이미징 매체의 표면을 깨는 것을 방지하기 위해 주의를 기울입니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 3: TMRE 표지 된 여포의 이미징 중에 H2O2 추가. TMRE로 얼룩진 CLUCA06604 여성의 여포. H2O2는 드로소필라 여포에서 미토콘드리아 오지역화를 일으킨다. 흰색 = TMRE 염료. 15초당 1프레임당 20분 동안 이미지화되고 비디오는 초당 10프레임5입니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 4: Clu:GFP 여포의 이미징 도중 H2O2 추가. cluCA06604 여성의 여포. H2O2는 도 4에설명된 대로 클루 입자를 분산시킵니다. 화이트 = 클루::GFP. 15분당 1프레임의 이미지를 15분 동안 이미지화하고 비디오는 초당 10프레임입니다. 5이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 5: H2O2 추가 후 지연 된 이미징. cluCA06604 여성의 여포. 여포에 과산화수소의 첨가는 시간에 민감한 치료이다. 이미징의 재시작은 H2O2 추가 중 시료 변위의 결과로 이 비디오에서 지연되었습니다. 미토콘드리아는 이미 눈에 띄게 덩어리가 되기 시작했고 0시에 이미징을 다시 시작할 때 막 잠재력을 잃기 시작했습니다(비디오 3의 시간 0과 비교). 치료 후 신속하게 이미징을 재개하지 못하면 초기 실험 효과가 이미징 전에 누락되기 때문에 부정확하고 사용할 수없는 결과가 발생할 수 있습니다. 흰색 = TMRE. 15초당 1프레임당 20분 동안 이미지화되었으며 비디오는 초당 10프레임입니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 임의의 살아있는 화상 진찰 실험에 대한 난소 해부 및 조직 배양으로 인한 유물에 대한 제어로서 유용한 추가가 될 수 있습니다. 중요한 단계는 그밖 살아있는 화상 진찰 프로토콜을 위해 찾아낸 것과 유사합니다. Drosophila 난소 전체를 해부하는 방법을 배우는 것은 연습이 걸립니다. 그러나 이 기술은 일반적으로 적절한 해부 도구를 사용하여 상당히 빠르게 학습할 수 있습니다. 마스터하기 더 어려운 난소와 각 ovariole13을포위 근육을 제거하는 것입니다. 이것은 근육 수축이 이미지 수집을 방해하지 않도록하기 위해 수행해야합니다. 날카로운 텅스텐 바늘을 사용하여 성공을 입증하지 않는 경우, ovariole의 끝에 있는 게르마륨은 집게와 근육 칼집에서 뽑아온 ovariole로 파악할 수 있습니다. 그러나, 이 기술은 손상될 수 있기 때문에 초기 발달 단계가 검토될 경우에 문제가 됩니다. 또 다른 중요한 단계는 H 2 O2를추가 할 때 접시 바닥에 놓여있는 오오리올을 빼내지 않는것입니다. 추가 중요한 양상은 모든 살아있는 화상 진찰에 의해 공유됩니다: 연구원은 관심의 구조가 처리의 앞에 형광으로 잘 표지된다는 것을 확인해야 합니다. 여기에 사용되는 요리(재료의 표)일반적으로 라이브 이미징에 사용됩니다; 그러나 하단에 유리 커버슬립이 있는 접시 나 슬라이드 또는 큰 유리 커버 슬립은 미디어 의 드롭을 덮을 수있는 한 작동하여 미디어 증발을 방지해야합니다. 우리는 특정 현미경을 사용하는 동안, 문제의 세포 전체 구조를 볼 수있는 충분한 배율의 목표를 가진 반전 현미경과 충분한 해상도와 이미지 캡처 속도를 가진 부착 된 카메라가 작동해야합니다.
우리의 실험실은 주로 미토콘드리아 기능에 관심이 있지만,이 방법은 핵, 세포 골격 또는 내피 망상과 같은 모든 세포 전세포 구조 또는 세포기관의 역학 및 국소화를 검사하는 데 도움이 될 수 있습니다. 그러나 이 메서드에는 제한이 있습니다. 과산화수소를 추가하려면 조직은 수성 매체에 있어야 합니다. 라이브 이미징을 위한 대안방법은 모델 유기체7,14에서GFP의 역동적인 움직임의 첫 번째 예를 포함하여 드로소필라 혈관증에서 많은 중요한 프로세스를 설명하는 데 중요한 역할을 해온 할로카본 오일을 사용하는 것이다. 또한, 과산화수소를 미디어에 추가하면 광범위한 산화 손상을 야기하여 조직에 대한 모욕이 너무 일반적일 수 있으며, 특히 개발을 검토하는 더 긴 실험을 위해 관심있는 세포 과정에 대해 유익할 수 있습니다. 이 급속한, 광범위하고, 돌이킬 수 없는 산화 손상 때문에 오랜 기간 동안 세포를 시각화해야 하는 실험을 수행하는 것이 가능하지 않을 수 있지만, 우리는 우리가 설명한 급성 과산화수소 처리가 화상 진찰 기간 내에 대부분의 단계에서 동일한 효과를 볼 수 있기 때문에 oogenesis의 대부분의 단계에 적용 가능하다는 것을 보았습니다. 프로토콜의 저렴한 비용과 용이성을 감안할 때, 손상에 대한 유용한 제어가 될 수 있으며 고정 및 항체 라벨링 전에 치료로도 사용될 수 있다.
우리의 손에, H2O2 치료는 우리가 다양한 Drosophila 돌연변이에서 볼 미토콘드리아 오현지화및 Clu 행복 입자 분산의 변화를 모방. 그것은 또한 우리가 실험실 학습 해부 기술에 있는 새로운 연구원을 위해 보는 결과를 모방합니다. 따라서, 이 방법은 시료 준비 와 일반적인 세포 스트레스가 미토콘드리아 오중화 및 행복 입자의 존재에 예기치 않은 이전에 설명할 수 없는 변화로 이어질 수 있음을 분명히 밝혔다. 이 기술을 앞으로 이동, 과산화수소 농도 는 더 높거나 낮은 농도를 사용하여 변조 될 수있다. 세포 효과가 낮은 농도를 사용하여 보이는 경우, 미디어를 완전한 슈나이더로 대체하여 응력 표현형이 뒤집을 수 있습니다. 카보닐 시안화물 m-클로로페닐 히드라존(CCCP), 아르세니트 또는 간단한 열 쇼크와 같은 다른 세포 스트레스는 다른 세포 외 구조물에 대한 일반적인 세포 스트레스에 유용할 수 있습니다. 전 생체 조직의 라이브 이미징은 다른 매체에서 수동 조작 및 배양을 필요로하기 때문에,이 제어는 어떤 관측이 가능한 한 정상적인 생리학에 가깝지 않도록 하는 유용한 추가가 되어야합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 일러스트, 제작 및 비디오 그래피에 대한 이미징 지원에 대한 박사 제레미 Smyth와 앤 C. 셴크에게 감사드립니다. 이 작품은 건강의 국가 학회에 의해 지원되었다 (1R01GM127938 R.T.C.).
자료
| Name | Company | Catalog Number | Comments |
| Active dry yeast | Red Star® | ||
| CO2 gas | 99.9% purity | ||
| CO2 pad | |||
| Dissecting microscope, Nikon SMZ645 model | Nikon | ||
| Dissecting needles - PrecisionGlide needles | BD | 305165 | B-D 21G1 size |
| Dissecting needles - PrecisionGlide syringes | BD | 309657 | Luer-Lok tip, 3 mL size |
| Dissecting needles - tungsten wire | Electron Microscopy Sciences | 73800 | |
| Dumont #5 forceps (2 pairs) | Fine Science Tools | 11251-10 | |
| NI-150 High Intensity Illuminator | Nikon Instruments Inc. | ||
| Gibco Fetal Bovine Serum, Heat Inactivated | Fisher Scientific | 10082-147 | |
| Gibco Schneider's Drosophila Media | Sigma-Aldrich | 21720-024 | |
| Hydrogen peroxide solution, 30% (w/w) in H2O | Sigma-Aldrich | H1009 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| Spinning disk microscope | Nikon | Equivalent scopes may also be used | |
| Lonza BioWhittaker Antibiotics: Penicillin-Streptomycin mixtures | Fisher Scientific | 17-602E | |
| MatTek Corporation Glass Bottom Dishes, 35 mm | Fisher Scientific | NC9344527 | |
| Micropipettes and tips of appropiate size | Eppendorf | ||
| Microcentrifuge tubes, 1.7 mL | VWR | 87003-294 | |
| Tetramethylrhodamine, Ethyl Ester, Perchlorate (TMRE) | AnaSpec | AS-88061 | |
| w[1118] | Bloomington Drosophila Stock Center | 5905 | Wild-type flies |
| y w; clu[CA06604] | Available upon request. | Clu::GFP trap flies |
참고문헌
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: the Fenton reaction. Toxicology Letters. 82-83, 969-974 (1995).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Cox, R. T., Spradling, A. C. Clueless, a conserved Drosophila gene required for mitochondrial subcellular localization, interacts genetically with parkin. Disease Models & Mechanisms. 2 (9-10), 490-499 (2009).
- Sen, A., Kalvakuri, S., Bodmer, R., Cox, R. T. Clueless, a protein required for mitochondrial function, interacts with the PINK1-Parkin complex in Drosophila. Disease Models & Mechanisms. 8 (6), 577-589 (2015).
- Sheard, K. M., Thibault-Sennett, S. A., Sen, A., Shewmaker, F., Cox, R. T. Clueless forms dynamic, insulin-responsive bliss particles sensitive to stress. Developmental Biology. 459 (2), 149-160 (2020).
- Sen, A., Cox, R. T. Clueless is a conserved ribonucleoprotein that binds the ribosome at the mitochondrial outer membrane. Biology Open. 5 (2), 195-203 (2016).
- Parton, R. M., Valles, A. M., Dobbie, I. M., Davis, I. Isolation of Drosophila egg chambers for imaging. Cold Spring Harbor Protocols. 2010 (4), 5402(2010).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
- Prasad, M., Montell, D. J. Cellular and molecular mechanisms of border cell migration analyzed using time-lapse live-cell imaging. Developmental Cell. 12 (6), 997-1005 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments. (60), e3679(2012).
- Parker, D. J., Moran, A., Mitra, K. Studying Mitochondrial Structure and Function in Drosophila Ovaries. Journal of Visualized Experiments. (119), e54989(2017).
- Brady, J. A simple technique for making fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314 (2), 329-340 (2008).
- Wang, S., Hazelrigg, T. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature. 369 (6479), 400-403 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유