Method Article
Visualizando os efeitos do dano oxidativo nas câmaras de ovos de Drosophila usando imagens ao vivo
Neste Artigo
Resumo
O objetivo deste protocolo é utilizar imagens vivas para visualizar os efeitos dos danos oxidativos na localização e dinâmica das estruturas subcelulares nos ovários de Drosophila.
Resumo
A imagem ao vivo dos ovários de drosophila melanogaster tem sido fundamental na compreensão de uma variedade de processos celulares básicos durante o desenvolvimento, incluindo movimento de partículas de ribonucleoproteína, localização de mRNA, movimento organela e dinâmica citoesquelélenta. Existem vários métodos para imagens ao vivo que foram desenvolvidos. Devido ao fato de que cada método envolve dissecar ovários individuais colocados em mídia ou óleo de halocarbono, danos celulares devido à hipóxia e/ou manipulação física ocorrerão inevitavelmente ao longo do tempo. Um efeito a jusante da hipóxia é aumentar os danos oxidativos nas células. O objetivo deste protocolo é utilizar imagens vivas para visualizar os efeitos dos danos oxidativos na localização e dinâmica das estruturas subcelulares nos ovários de Drosophila após a indução de danos celulares controlados. Aqui, usamos peróxido de hidrogênio para induzir danos oxidativos celulares e dar exemplos dos efeitos de tais danos em duas estruturas subcelulares, mitocôndrias e partículas de felicidade clu. No entanto, este método é aplicável a qualquer estrutura subcelular. As limitações são que o peróxido de hidrogênio só pode ser adicionado à mídia aquosa e não funcionaria para imagens que usam óleo de halocarbono. As vantagens são que o peróxido de hidrogênio está prontamente disponível e barato, age rapidamente, suas concentrações podem ser moduladas, e danos oxidativos são uma boa aproximação de danos causados por hipóxia, bem como danos gerais do tecido devido à manipulação.
Introdução
Vários estressores celulares diferentes podem surgir durante a cultura experimental e manipulação de tecidos ex vivo, incluindo choque térmico, estresse oxidativo, estresse osmótico, estresse nutricional e condições de toxicidade. A imagem ao vivo é uma ferramenta poderosa usada para visualizar mudanças em tempo real nos tecidos ex vivo após tratamento experimental e manipulação. Dissecções finas de tecido e manipulação tomam prática, e a quantidade de tempo de dissecção para imagem pode variar dependendo da experiência. A lógica para o desenvolvimento desse método baseia-se na preocupação de que a preparação do tecido para imagens vivas possa causar estresse celular durante a dissecção e preparação de imagens. Isso pode ser particularmente problemático para processos sensíveis a mudanças no metabolismo celular e níveis de oxigênio disponíveis, como a função mitocondrial. Embora ter uma amostra de tipo selvagem paralelo seja um controle importante, ainda há a possibilidade de que algumas ou todas as alterações observadas nas estruturas subcelulares possam ser devido a danos ou estresse celular por dissecção e não refletem a fisiologia normal ou o tratamento ou mutação que está sendo estudado.
Para resolver esse problema potencial, usamos a adição de peróxido de hidrogênio durante a imagem ao vivo, a fim de induzir danos oxidativos celulares1. O objetivo deste método é induzir danos aos tecidos, a fim de monitorar o efeito sobre estruturas subcelulares. Este protocolo é útil para dois propósitos: 1) determinar se as mudanças na localização subcelular da estrutura de interesse se devem ao estresse causado pela dissecção inexperiente e 2) uma vez que o pesquisador está confiante com as técnicas de dissecção descritas para monitorar o efeito do estresse controlado na estrutura de interesse. Aqui mostramos dois exemplos de como o aumento do dano oxidativo causa mudanças em duas estruturas subcelulares, mitocôndrias e partículas de felicidade clu. Para isso, usamos o ovário Drosophila, que é um modelo comum para estudos de imagem ao vivo. O primeiro exemplo examina a localização mitocondrial. Em nossa experiência, a localização mitocondrial normal em células germinativas femininas é altamente sensível a perturbações e pode atuar como um prenúncio do estresse celular. Mitocôndrias em células germinativas femininas de Drosophila são normalmente dispersas uniformemente ao longo do citoplasma2. A adição de peróxido de hidrogênio faz com que as organelas se deslocalizem rapidamente e se aglomeram de forma semelhante às várias mutações3,4,5. O segundo exemplo são partículas de felicidade formadas por Clueless (Clu). Clu é uma ribonucleoproteína difusa em todo o citoplasma; no entanto, também forma partículas associadas a mitocôndrias em condições celulares ideais5. Como a presença de partículas clu depende de condições celulares saudáveis, nós as chamamos de partículas de "felicidade"3,5,6. A adição de peróxido de hidrogênio faz com que essas partículas se dispersem rapidamente e se tornem homogêneas no citoplasma5. No decorrer de nossos estudos, observamos mudanças na localização de ambas as estruturas subcelulares, mas somente após a realização de estudos de imagem ao vivo poderíamos apreciar plenamente o efeito do estresse celular e danos oxidativos na localização e dinâmica das mitocôndrias e partículas de felicidade.
A utilidade deste protocolo como acréscimo a métodos já estabelecidos ou alternativos depende de vários fatores. Primeiro, o protocolo de imagem deve ser receptivo à adição de drogas. Se a amostra for montada sob uma mancha de cobertura e em óleo de halocarboneto, este método não seria possível7. A adição de H2O2 causa um rápido aumento dos danos oxidativos, portanto, essa escala de tempo pode não ser apropriada. Danos oxidativos podem ser considerados como um proxy para a hipóxia; no entanto, pode ser muito severo ou muito generalizado para funcionar como um controle apropriado para danos para certos componentes subcelulares. Finalmente, para experimentos de imagem que duram horas como aqueles que seguem um processo de desenvolvimento, a adição de H2O2 pode ser muito forte (por exemplo8). Testar uma curva de concentração pode superar essa limitação.
Protocolo
1. Preparação de dissecção e mídia de imagem
NOTA: A mídia mais adequada para este experimento de imagem ao vivo contém a mídia Drosophila de Schneider contendo 15% de soro bovino fetal inativado de calor, 0,6x Pen-Strep e 200 μg/mL de insulina bovina, a partir de agora referida como mídia completa de Schneider.
- Realize a preparação da mídia em condições estéreis para garantir que ela não seja contaminada. A mídia foi desenvolvida para apoiar os ovários Drosophila por longos períodos de tempo9.
- Adicione 15% de soro bovino fetal inativado de calor, 0,6x Pen-Strep e 200 μg/mL de insulina bovina à mídia do Schneider.
- Misture bem o conteúdo e armazene a 4 °C durante a noite.
NOTA: A insulina não se dissolve completamente na mídia completa de Schneider, e você notará um precipitado se estabelecer na parte inferior do tubo. - Faça alíquotas da mídia, tendo a certeza de deixar o precipitado, pois vai interferir com a imagem.
NOTA: Esta solução pode ser usada dentro de um mês se armazenada em alíquotas a 4 °C.
2. Coleção de Drosophila para dissecção
NOTA: Procedimentos detalhados de coleta e dissecção de Drosophila também podem ser encontrados em Weil et al.10 e Parker et al.11.
- Para uma imagem de célula germinamental feminina ideal, primeiro prepare um frasco contendo alimentos padrão de mosca de fubá e um pouco de pasta de levedura molhada que é a consistência da manteiga de amendoim. Isso garante que as moscas fêmeas sejam bem alimentadas e produzirão todos os estágios de desenvolvimento de folículos para a imagem.
- Para moscas de 0 a 1 dias de idade e transfira com machos em um frasco de comida de mosca contendo pasta de levedura molhada.
NOTA: Certifique-se de que as moscas adormecidas não entrem em contato com a pasta de levedura, pois elas podem grudar nela. - Alimente as moscas de 3 a 7 dias, trocando o frasco e a pasta de levedura diariamente.
NOTA: Certifique-se de que a pasta de levedura entre em contato com a comida de mosca para que não seque.
3. Dissecção do ovário de Drosophila
NOTA: É importante preparar as soluções de mídia frescas porque o peróxido de hidrogênio é suscetível à oxidação e o TMRE se degrada ao longo do tempo.
- Logo antes da dissecção, na mídia completa de Schneider, prepare uma alíquota fresca de 2 μM H2O2, uma alíquota fresca de 46 nM tetramethylrhodamina, ester etílico (TMRE), e uma alíquota fresca de uma solução TMRE de 46 nM contendo 2 μM H2O2.
- Para dissecção do ovário, use dois pares de fórceps finos e um par de agulhas de tungstênio eletrólitos12. Para dissecar os ovários, encha 2-3 poços de um prato de dissecação de fundo de vidro (vidro de relógio) com Completo Schneider que foi aquecido à temperatura ambiente.
- Anestesiar o frasco de moscas engordadas com dióxido de carbono e segregar o número desejado de moscas fêmeas a serem dissecadas. Coloque uma única mosca na mídia usando fórceps.
- Sob um microscópio dissecando, segure suavemente a mosca pelo tórax usando um par de fórceps finos. Com o outro par de fórceps, segure o posterior e puxe suavemente para remover os ovários.
NOTA: se os ovários não saírem suavemente usando este método, todo o abdômen também pode ser removido da mosca, e os ovários podem ser suavemente espremidos para fora de cada extremidade do abdômen usando fórceps. - Remova qualquer cutícula ou tecido íntegro e transfira os ovários para um novo poço que contenha mídia fresca. Os ovários ainda devem estar se movendo da baia muscular circundante.
4. Preparando ovários para imagem
- Usando agulhas de tungstênio afiadas, provoque delicadamente os ovários à parte, tomando cuidado para remover a baáta muscular circundante(Figura 1).
- Provoque suavemente qualquer baia muscular e fibras nervosas presas aos ovários isolados(Figura 2).
NOTA: Se a baia muscular não for removida, a ovalo se contrairá e se moverá, causando problemas com a aquisição de imagem(Vídeo 1). - Se as estruturas subcelulares de interesse forem etiquetadas endógenamente, proceda à Etapa 4.4. Se as estruturas de interesse forem rotuladas com um corante fluorescente, siga para a Seção 5.
- Uma vez que os ovários tenham sido dissecados limpamente, usando uma micropipette, transfira-os em uma gota de 100 μL da mídia de imagem completa schneider para a depressão de vidro de um prato de fundo de vidro. Os ovários individuais afundarão no fundo da gotícula.
- Vá para a Seção 6 para imagem.
NOTA: Para imagens mitocôndrias e partículas de felicidade Clu, não mais do que cinco-dez minutos devem passar do início da dissecação para a imagem.
5. Mitocôndrias de coloração com TMRE
NOTA: Podem ser encontrados procedimentos detalhados adicionais sobre a coloração ao vivo de mitocôndrias com corantes fluorescentes em Parker et al. 2017.
- Após o passo 4.3, transfira as ovários isolados em uma queda de 100 μL de mídia TMRE de 46 nM para a depressão de vidro de um prato de fundo de vidro. Os ovários individuais afundarão no fundo da gotícula.
- Incubar em temperatura ambiente por 20 minutos. Coloque a tampa sobre o prato de fundo de vidro e coloque o prato em uma caixa coberta durante a duração do experimento para proteger da luz.
NOTA: Após a incubação, as amostras podem ser imagens diretamente sem lavagens. - Repita os passos 5.1-5.2 para preparar pelo menos dois pratos de ovários rotulados por TMRE, um para servir como um grupo experimental e outro para servir como controle.
6. Aquisição de imagem ao vivo
- Uma vez que os ovários são montados, coloque um dos pratos inferiores de vidro no microscópio e configure os parâmetros de imagem conforme necessário. Os comprimentos de onda de excitação/emissão ideais para o TMRE utilizado aqui são 549 nm/574 nm.
- Depois de localizar o campo de visão desejado, adquira imagens estádas ou breves vídeos de um ou mais ovários como desejado como registro de condições de pré-tratamento.
7. Adição de peróxido de hidrogênio durante a imagem
- Pausar a imagem ao vivo, remover a tampa do prato de fundo de vidro e adicionar cuidadosamente 100 μL de 2 μM H2O2 solução para o prato usando uma micropipette se imagem etiquetadas em estruturas endógenas. Se a imagem mitocôndrias, adicione cuidadosamente 100 μL de 46 nM TMRE com 2 μM H2O2 solução para o prato usando uma micropipette (Vídeo 2).
- Evite quebrar a superfície da gota de mídia existente ou adicionar a solução muito rapidamente para não deslocar os ovários que estão na parte inferior do prato(Vídeo 2).
- Substitua a tampa do prato (tampa do prato), remaneje e refoque o campo de visão desejado, se necessário, e retome a imagem(Vídeo 3, Vídeo 4, Figura 3, Figura 4).
- Tome cuidado para retomar a imagem o mais rápido possível após a adição de H2O2, pois o tratamento experimental é sensível ao tempo(Vídeo 5).
- Adquira imagens estádas ou breves vídeos de um ou mais ovários conforme desejado. Isso servirá como um registro das condições pós-tratamento.
- Para o controle, coloque a segunda placa de fundo de vidro sobre o microscópio e repita a Seção 6.
- Repita o passo 7.1, desta vez adicionando 100 μL de mídia somente TMRE ao prato. Se as estruturas etiquetadas endógenamente, adicione 100 μL da solução somente de mídia do Complete Schneider.
- Repita as etapas 7.2 e 7.3 para adquirir dados para o grupo de controle.
NOTA: Para imagens mitocôndrias e partículas de felicidade Clu, não mais do que três cinco minutos devem passar da adição de peróxido de hidrogênio à imagem.
Resultados
Os protocolos descritos podem ser usados para estudar os efeitos do peróxido de hidrogênio durante a imagem ao vivo dos ovários de Drosophila. Como mostrado na Figura 3, Figura 4, Vídeo 3 e Vídeo 4, este procedimento fornece um meio eficaz para visualizar mudanças teciduais e dinâmicas após o tratamento experimental em tempo real. É importante ressaltar que este protocolo é específico para a adição de H2O2 aos ovários durante a imagem; no entanto, pode ser adaptado para a adição exógena de outras drogas ou reagentes de interesse. Além disso, os folículos podem ser rotulados com quaisquer corantes fluorescentes de interesse (por exemplo, tetrametilrhodamina (TMRE), LysoTracker) antes da imagem(Vídeo 3). As etapas mais críticas para obter resultados de imagem claras são 1) a dissecção adequada e isolamento de ovários únicos com todos os elementos contractíveis removidos(Figura 1 e Figura 2) e 2) a velocidade com que a imagem é reiniciada após a adição de peróxido de hidrogênio. O vídeo 4 é uma ilustração de um folículo devidamente dissecado que permanece estável durante toda a duração da imagem em comparação com o Vídeo 1, que ilustra um folículo mal dissecado saindo do campo de visão durante a imagem. O vídeo 5 é uma ilustração na qual os efeitos H2O2 nas mitocôndrias rotuladas pelo TMRE já progrediram antes do início da imagem como resultado de muito tempo decorrido. Em comparação com o Vídeo 3 em que a imagem foi reiniciada imediatamente após a adição de peróxido de hidrogênio (tempo 0) e mitocôndrias dispersas ainda são visíveis, as mitocôndrias no Vídeo 5 já começaram a se aglomerar visivelmente e perder seu potencial de membrana após o reinício da imagem. Este problema é atribuído principalmente à interrupção das posições amostrais durante a adição de H2O2 e pode ser aliviada seguindo a técnica para manter intacta a mídia de imagem e a posição da amostra(Vídeo 2). Note-se que em experimentos de controle realizados sem H2O2 adicionados à mídia, as mitocôndrias em folículos permanecem devidamente dispersas, e o corante TMRE permanece sequestrado nas mitocôndrias.
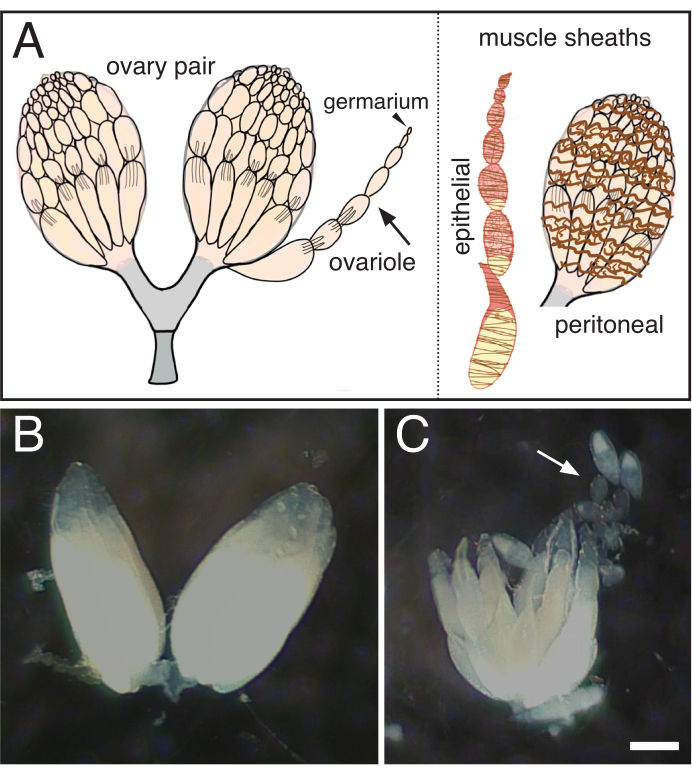
Figura 1: Isolamento de ovários únicos dos ovários de Drosophila. (A) Desenho animado indicando um par de ovários, um único ovário (flecha) com o germário na ponta (ponta de flecha) e as duas baás musculares que circundam o ovário (marrom, epitelial) e o ovário (marrom, peritoneal). (B) Dissecado ovário drosophila. (C) Separação subsequente do ovário provocado em ovários individuais (seta). Barra de escala = 100 hum. Clique aqui para ver uma versão maior desta figura.
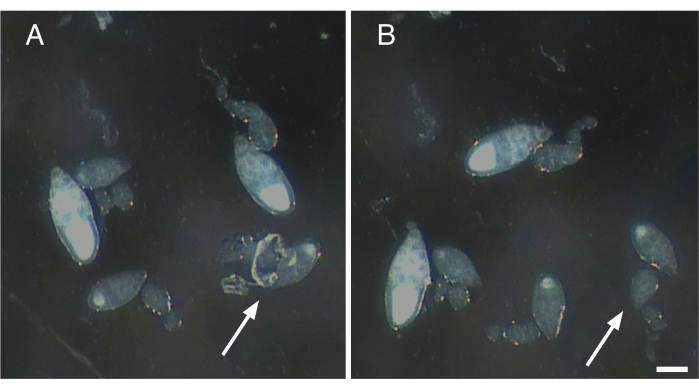
Figura 2: Remoção de fibras nervosas e elementos contratuais de ovários únicos. (A) Ovário único com restos de tecido nervoso e babato muscular ainda preso (seta). (B) Remoção suave de todo o tecido restante preso à ovariole em A (seta). Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
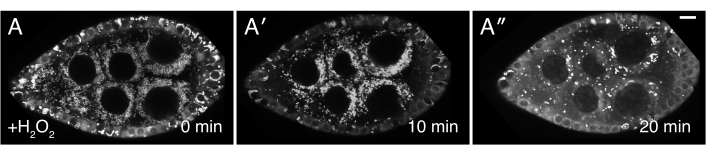
Figura 3: H2O2 causa mislocalização mitocondrial. (A-A") Imagens vivas de um bem alimentado clu CA06604 (Clu::GFP voa) folículo. A adição de H2O2 faz com que as mitocôndrias se aglomeram ao longo da duração da imagem. A rotulagem TMRE de mitocôndrias indica que as mitocôndrias são inicialmente dispersas no momento 0 (A), e que as mitocôndrias começam a se agrupar após a adição de H2O2 (A′) Em um momento posterior, a rotulagem TMRE torna-se irregular devido às mitocôndrias perderem seu potencial de membrana e, portanto, sua capacidade de sequestrar o corante (A"). Branco = TMRE (A-A"). Barras de escala: 10 μm em (A) para A-A"5. Clique aqui para ver uma versão maior desta figura.
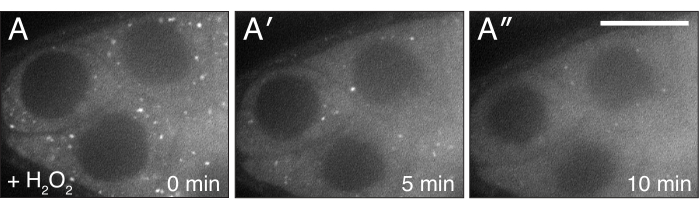
Figura 4: H2O2 dispersa Clu. (A-A") Imagens ao vivo de um bem alimentado cluCA06604 folículo. A adição de H2O2 faz com que as partículas se dispersem e se tornem homogêneas no citoplasma ao longo da duração da imagem. Branco = Clu::GFP (A-A"). Barra de escala: 40 μm em (A) para A-A"5. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Folículo de uma fêmeaclu CA06604. Como descrito na Figura 2,a falha na remoção de elementos contratuais de fibra nervosa de ovários únicos causará deriva acentuada e movimento das ovários durante a imagem e subsequente incapacidade de analisar dados de imagem. Branco = Clu::GFP. Clique aqui para baixar este vídeo.
Vídeo 2: Adição adequada de H2O2 para provar prato. Peróxido de hidrogênio deve ser adicionado ao prato de amostra usando uma micropipette de tamanho apropriado. Dispensando H2O2 sem quebrar a superfície da mídia. Cuidados são tomados para evitar quebrar a superfície da mídia de imagem para minimizar a deriva da amostra durante a adição de peróxido de hidrogênio. Clique aqui para baixar este vídeo.
Vídeo 3: Adição H2O2 durante a imagem de folículos rotulados pela TMRE. Folículo de uma cluCA06604 fêmea manchada com TMRE. H2O2 causa mislocalização mitocondrial em folículos de Drosophila. Branco = Corante TMRE. Imagem de um quadro por 15 s por 20 minutos, e o vídeo é de 10 quadros por segundo5. Clique aqui para baixar este vídeo.
Vídeo 4: Adição H2O2 durante a imagem de folículos Clu::GFP. Folículo de uma fêmeaclu CA06604. H2O2 dispersa partículas clu como descrito na Figura 4. Branco = Clu::GFP. Imagem de um quadro por 15 s por 15 minutos, e o vídeo é de 10 quadros por segundo. 5Clique aqui para baixar este vídeo.
Vídeo 5: Imagem atrasada após aadição de H2O2. Folículo de uma fêmeaclu CA06604. A adição de peróxido de hidrogênio aos folículos é um tratamento sensível ao tempo. O reinício das imagens foi adiado neste vídeo como resultado do deslocamento da amostra durante a adição de H2O2. As mitocôndrias já começaram a se aglomerar visivelmente e perder seu potencial de membrana após o reinício da imagem no momento 0 (em comparação com o tempo 0 no Vídeo 3). A não retomada das imagens rapidamente após o tratamento resultará em resultados imprecisos e inutilizáveis, pois os efeitos experimentais iniciais serão perdidos antes da imagem. Branco = TMRE. Imagem de um quadro por 15 s por 20 minutos, e o vídeo é de 10 quadros por segundo. Clique aqui para baixar este vídeo.
Discussão
Este protocolo pode ser uma adição útil como um controle para artefatos devido à dissecção do ovário e incubação de tecidos para qualquer experimento de imagem ao vivo. Os passos críticos são semelhantes aos encontrados para outros protocolos de imagem ao vivo. Aprender a dissecar ovários drosophila inteiros requer prática; no entanto, essa habilidade geralmente pode ser aprendida rapidamente com as ferramentas de dissecção apropriadas. Mais difícil de dominar é remover o músculo envolvendo os ovários e cada ovário13. Isso deve ser feito para garantir que as contrações musculares não interfiram na aquisição de imagem. Se usar agulhas de tungstênio afiadas para fazer isso não se mostrar bem sucedido, o germário na ponta do ovário pode ser apreendido com fórceps e o ovário retirado da bainha muscular. No entanto, essa técnica é problemática para que os primeiros estágios de desenvolvimento sejam examinados porque podem ficar danificados. Outro passo fundamental é não desalojar as ovários que repousam na parte inferior do prato ao adicionar H2O2. Um aspecto importante adicional é compartilhado por todas as imagens ao vivo: o pesquisador deve garantir que a estrutura de interesse seja fluorescentemente bem rotulada antes do tratamento. Os pratos utilizados aqui (Tabela de Materiais) são comumente utilizados para imagens vivas; no entanto, qualquer prato ou slide com uma mancha de vidro na parte inferior ou mesmo uma grande mancha de vidro deve funcionar desde que a gota de mídia possa ser coberta para evitar a evaporação da mídia. Enquanto usamos um microscópio particular, qualquer microscópio invertido com um objetivo de ampliação suficiente para ver a estrutura subcelular em questão e uma câmera anexada que tenha resolução suficiente e taxa de captura de imagem deve funcionar.
Embora nosso laboratório esteja interessado principalmente na função mitocondrial, este método pode ser útil examinando a dinâmica e localização de qualquer estrutura subcelular ou organela, como o núcleo, citoesqueleto ou tiquellum endoplasmático. No entanto, esse método tem limitações. Para adicionar peróxido de hidrogênio, o tecido deve estar em uma mídia aquosa. Um método alternativo para imagens vivas é o uso de óleo de halocarbono, que tem sido fundamental para descrever muitos processos importantes em ovários de Drosophila, incluindo o primeiro exemplo de movimento dinâmico de GFP em um organismo modelo7,14. Além disso, adicionar peróxido de hidrogênio à mídia causa danos oxidativos generalizados que podem ser muito gerais um insulto ao tecido para ser informativo para o processo celular de interesse, particularmente para experimentos mais longos examinando o desenvolvimento. Embora possa não ser viável realizar experimentos que requerem visualização da célula por longos períodos de tempo devido a este dano oxidativo rápido, extenso e provavelmente irreversível, vimos que o tratamento agudo de peróxido de hidrogênio que descrevemos é aplicável à maioria dos estágios da oogênese, pois somos capazes de ver os mesmos efeitos na maioria dos estágios dentro do período de tempo de imagem. Dado o baixo custo e facilidade do protocolo, pode ser um controle útil para danos e pode ser usado como tratamento antes da fixação e rotulagem de anticorpos também.
Em nossas mãos, o tratamento H2O2 imita as mudanças na mislocalização mitocondrial e a dispersão de partículas de felicidade clu que vemos em vários mutantes de Drosophila. Também imita resultados que vemos para novos pesquisadores nas técnicas de dissecção de aprendizagem em laboratório. Portanto, este método revelou claramente que a preparação da amostra e o estresse celular geral podem levar a mudanças inesperadas e previamente inexplicáveis na mislocalização mitocondrial e na presença de partículas de felicidade. Movendo esta técnica para a frente, as concentrações de peróxido de hidrogênio poderiam ser moduladas usando uma concentração maior ou menor. Se um efeito celular for visto usando uma concentração mais baixa, é possível que o fenótipo de estresse possa ser reversível substituindo a mídia por Completa Schneider. Diferentes estressores celulares, como a hidrato de cianeto de carbonil m-clorofenil (CCCP), arsenita ou choque térmico simples podem ser úteis para o estresse celular geral para outras estruturas subcelulares. Uma vez que a imagem ao vivo dos tecidos ex vivo requer manipulação manual e incubação em diferentes mídias, este controle deve ser uma adição útil para garantir que quaisquer observações estejam o mais próxima possível da fisiologia normal.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer ao Dr. Jeremy Smyth pelo apoio de imagem e Ann C. Shenk por ilustrações, produção e videografia. Este trabalho contou com o apoio dos Institutos Nacionais de Saúde (1R01GM127938 a R.T.C.).
Materiais
| Name | Company | Catalog Number | Comments |
| Active dry yeast | Red Star® | ||
| CO2 gas | 99.9% purity | ||
| CO2 pad | |||
| Dissecting microscope, Nikon SMZ645 model | Nikon | ||
| Dissecting needles - PrecisionGlide needles | BD | 305165 | B-D 21G1 size |
| Dissecting needles - PrecisionGlide syringes | BD | 309657 | Luer-Lok tip, 3 mL size |
| Dissecting needles - tungsten wire | Electron Microscopy Sciences | 73800 | |
| Dumont #5 forceps (2 pairs) | Fine Science Tools | 11251-10 | |
| NI-150 High Intensity Illuminator | Nikon Instruments Inc. | ||
| Gibco Fetal Bovine Serum, Heat Inactivated | Fisher Scientific | 10082-147 | |
| Gibco Schneider's Drosophila Media | Sigma-Aldrich | 21720-024 | |
| Hydrogen peroxide solution, 30% (w/w) in H2O | Sigma-Aldrich | H1009 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| Spinning disk microscope | Nikon | Equivalent scopes may also be used | |
| Lonza BioWhittaker Antibiotics: Penicillin-Streptomycin mixtures | Fisher Scientific | 17-602E | |
| MatTek Corporation Glass Bottom Dishes, 35 mm | Fisher Scientific | NC9344527 | |
| Micropipettes and tips of appropiate size | Eppendorf | ||
| Microcentrifuge tubes, 1.7 mL | VWR | 87003-294 | |
| Tetramethylrhodamine, Ethyl Ester, Perchlorate (TMRE) | AnaSpec | AS-88061 | |
| w[1118] | Bloomington Drosophila Stock Center | 5905 | Wild-type flies |
| y w; clu[CA06604] | Available upon request. | Clu::GFP trap flies |
Referências
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: the Fenton reaction. Toxicology Letters. 82-83, 969-974 (1995).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Cox, R. T., Spradling, A. C. Clueless, a conserved Drosophila gene required for mitochondrial subcellular localization, interacts genetically with parkin. Disease Models & Mechanisms. 2 (9-10), 490-499 (2009).
- Sen, A., Kalvakuri, S., Bodmer, R., Cox, R. T. Clueless, a protein required for mitochondrial function, interacts with the PINK1-Parkin complex in Drosophila. Disease Models & Mechanisms. 8 (6), 577-589 (2015).
- Sheard, K. M., Thibault-Sennett, S. A., Sen, A., Shewmaker, F., Cox, R. T. Clueless forms dynamic, insulin-responsive bliss particles sensitive to stress. Developmental Biology. 459 (2), 149-160 (2020).
- Sen, A., Cox, R. T. Clueless is a conserved ribonucleoprotein that binds the ribosome at the mitochondrial outer membrane. Biology Open. 5 (2), 195-203 (2016).
- Parton, R. M., Valles, A. M., Dobbie, I. M., Davis, I. Isolation of Drosophila egg chambers for imaging. Cold Spring Harbor Protocols. 2010 (4), 5402(2010).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
- Prasad, M., Montell, D. J. Cellular and molecular mechanisms of border cell migration analyzed using time-lapse live-cell imaging. Developmental Cell. 12 (6), 997-1005 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments. (60), e3679(2012).
- Parker, D. J., Moran, A., Mitra, K. Studying Mitochondrial Structure and Function in Drosophila Ovaries. Journal of Visualized Experiments. (119), e54989(2017).
- Brady, J. A simple technique for making fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314 (2), 329-340 (2008).
- Wang, S., Hazelrigg, T. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature. 369 (6479), 400-403 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados