Method Article
肺炎 連鎖 球菌のウイルス重感染によるコロニー形成者から病原体への移行に関するマウスモデルが加齢増悪疾患を再現
* これらの著者は同等に貢献しました
要約
この論文では、ウイルス感染中の無症候性コロニーから病気の原因となる病原体への肺炎球菌の移行に関する新しいマウスモデルについて説明します。このモデルは、疾患進行のさまざまな段階およびさまざまな宿主にわたる多微生物および宿主-病原体の相互作用を研究するために容易に適応できます。
要約
肺炎連鎖球菌(肺炎球菌)は、ほとんどの人の鼻咽頭の無症候性コロニー形成者ですが、インフルエンザAウイルス(IAV)感染時に肺および全身性病原体に進行する可能性があります。高齢は、二次性肺炎球菌性肺炎に対する宿主の感受性を高め、疾患転帰の悪化と関連している。これらのプロセスを推進する宿主要因は、無症候性のコロニー形成から重度の臨床疾患への移行を再現する動物モデルが不足していることもあり、明確に定義されていません。
本稿では、ウイルス感染による無症候性保菌から疾患への肺炎球菌の移行を再現する新しいマウスモデルについて説明します。このモデルでは、マウスに最初にバイオフィルム成長肺炎球菌を鼻腔内接種して無症候性の保菌を確立し、続いて鼻咽頭と肺の両方にIAV感染させます。これは、肺への細菌の拡散、肺の炎症、および致死に進行する可能性のある病気の明らかな兆候をもたらします。病気の程度は細菌株と宿主因子に依存します。
重要なことに、このモデルは、若いマウスと比較して、老齢マウスはより重篤な臨床疾患を示し、より頻繁に病気に屈するため、老化の感受性を再現します。この 肺炎球菌/IAV共感染モデルは、保菌と疾患を別々のステップに分け、病原体と宿主の両方の遺伝的変異を分析する機会を提供することにより、疾患進行のさまざまな段階における重要な病態と宿主との相互作用の詳細な検査を可能にします。このモデルは、感受性宿主における二次性肺炎球菌性肺炎に対する潜在的な治療標的を特定するための重要なツールとしても役立ちます。
概要
肺炎連鎖球菌(肺炎球菌)は、ほとんどの健康な人の鼻咽頭に漸近的に存在するグラム陽性菌です1,2。完全に定義されていない要因によって促進される肺炎球菌は、鼻咽頭の良性コロニー形成者から他の臓器に広がる病原体に移行し、中耳炎、肺炎、菌血症などの深刻な感染症を引き起こす可能性があります3。肺炎球菌性疾患の提示は、部分的には、莢膜多糖の組成に基づく血清型を含む株特異的な違いに依存する。これまでに特徴付けられた100以上の血清型があり、いくつかはより侵襲的な感染症に関連しています4,5。他のいくつかの要因が肺炎球菌疾患のリスクを高めます。そのような要因の1つはウイルス感染であり、肺炎球菌性肺炎のリスクはIAV 6,7によって100倍に増加します。歴史的に、肺炎球菌はインフルエンザ後の二次性細菌性肺炎の最も一般的な原因の1つであり、より悪い結果と関連しています8。もう一つの主要な危険因子は高齢です。実際、S.肺炎は、65歳以上の高齢者における市中細菌性肺炎の主な原因です9,10。高齢者は肺炎とインフルエンザによる死亡の大部分(>75%)を占めており、加齢とIAV感染という2つの危険因子が相乗的に疾患感受性を悪化させることを示しています11,12,13,14。しかし、ウイルス感染が無症候性コロニー形成者から侵襲性病原体への肺炎球菌の移行を促すメカニズムと、これが宿主因子によってどのように形成されるかは、十分に定義されていない。これは主に、無症候性肺炎球菌コロニー形成から重篤な臨床疾患への移行を要約する小動物モデルがないためです。
重感染研究は、インフルエンザ感染の7日後に肺に直接肺炎球菌を接種したマウスで古典的にモデル化されています15,16。これは二次性細菌性肺炎に対する感受性を再現し、抗ウイルス免疫応答が抗菌防御をどのように損なうかを研究するのに理想的です17。しかし、ヒトにおける縦断的研究は、細菌が無症候性のバイオフィルムを形成することができる鼻咽頭における肺炎球菌の保菌が18、侵襲性疾患と一様に関連していることを示した19,20。中耳、肺、および血液の感染症からの細菌分離株は、鼻咽頭に見られるものと遺伝的に同一です20。したがって、IAV感染後の無症候性保菌から侵襲性疾患への移行を研究するために、マウスにバイオフィルム成長肺炎球菌を鼻腔内投与した後、鼻咽頭にIAV感染を行うモデルが確立されました21,22。上気道のウイルス感染は宿主環境の変化をもたらし、バイオフィルムからの肺炎球菌の拡散と下気道への拡散をもたらしました21。これらの分散した細菌は、感染に重要な病原性因子の発現をアップレギュレートし、それらをコロニーから病原体に変換しました21。これらの観察結果は、ウイルス、宿主、細菌の間の複雑な相互作用を強調し、ウイルス感染によって引き起こされる宿主への変化が肺炎球菌の行動に直接影響を及ぼし、それが細菌感染の経過を変えることを示しています。しかし、このモデルは、おそらくウイルスが鼻腔に限定されており、宿主免疫と肺損傷に対するウイルス感染の全身的影響が再現されていないため、ヒトで観察される病気の重篤な兆候を再現することはできません。
私たちは最近、宿主と病原体の間の複雑な相互作用を組み込んだモデルを確立しましたが、ヒトで観察される病気の重症度をより厳密に模倣しています23。このモデルでは、マウスは最初にバイオフィルム成長肺炎球菌を鼻腔内感染させて無症候性の保菌を確立し、続いて鼻咽頭と肺の両方にIAV感染します。その結果、肺への細菌の拡散、肺の炎症、および病気が発生し、若いマウスの一部で致死性に進行しました23。この以前の研究は、ウイルス感染と細菌感染の両方が宿主防御を変化させることを示しました:ウイルス感染は細菌の播種を促進し、以前の細菌コロニー形成は肺IAVレベルを制御する宿主の能力を損ないました23。免疫応答を調べると、IAV感染は好中球の抗菌活性を低下させ、細菌のコロニー形成は抗ウイルス防御に重要なI型インターフェロン応答を鈍らせることが明らかになりました23。重要なことに、このモデルは老化の感受性を再現しました。若いマウスと比較して、老齢マウスは病気の兆候を早く示し、より深刻な臨床的病気を示し、より頻繁に感染に屈しました23。この原稿で提示された研究は、侵襲性肺炎球菌株がIAV感染時により効率的に播種し、肺炎症のより明白な兆候を示し、非侵襲的株と比較して疾患の発生率が加速するため、疾患の程度も細菌株に依存することを示しています。したがって、この 肺炎球菌/IAV共感染モデルは、病原体と宿主因子の両方の詳細な検査を可能にし、疾患進行のさまざまな段階での多微生物感染に対する免疫応答の研究に適しています。
プロトコル
すべての動物実験は、実験動物の世話と使用に関するガイドの推奨事項に準拠して実施されました。.すべての手順は、バッファロー大学施設動物管理および使用委員会によって承認されました。
1.化学的に定義された培地(CDM)の準備
- 次のように在庫を準備します。
- 攪拌しながら表1に記載の化合物を100mLの超純水に溶解する。200 μLのアリコートで-20°Cで保存してください。
- 撹拌しながら表1に列挙したミックスII化合物を 0.1 M NaOHの20 mLに溶解する。100 μLのアリコートで-20°Cで保存してください。
- 表1に記載のミックスIII化合物を攪拌しながら超純水1mLに溶解する。10 μLのアリコートで4°Cで保存します。
- 攪拌しながら表1に記載のミックスIV化合物を超純水1mLに溶解する。10 μLのアリコートで-20°Cで保存します。
- 表2に記載の化合物を攪拌しながら最初に15mLの超純水に溶解する。0.1 M NaOHを数滴垂らしてpHを7.0に調整し、超純水を使用して最終容量を20 mLに調整します。1 mL アリコートで -20 °C で保存します。
- 表3に記載の化合物を攪拌しながら50°Cのホットプレート上の超純水90mLに溶解する。0.1 M NaOHでpHを7.0に調整した後、超純水を使用して最終容量を100 mLに調整します。5 mL アリコートで -20 °C で保存します。
- 攪拌しながら表4の化合物を超純水70mLに溶解して毎回新鮮にスターターストックを作る。
- 新鮮なスターターストックに、次のミックスストックを順に追加します:ミックスIストック200 μL(表1)、ミックスIIストック80 μL(表1)、ミックスIIIストック10 μL(表1)、ミックスIVストック10 μL(表2)、ビタミンストック1 mL(表3)、およびアミノ酸ストック5 mL(表4)。
- ストックを追加したら、ビーカーに30mLの超純水を加えて最終容量を100mLに調整します。
- CDMに表4の化合物を補充する。完全に混合したら、フィルター滅菌し、4°Cで最大2週間保存します。
2. 肺炎球菌 バイオフィルムの成長
- 445 mLのRPMI 1640を50 mLの熱不活化ウシ胎児血清(FBS)および5 mLのペニシリン/ストレプトマイシンとそれぞれ10,000 U / mLおよび10,000 μg/ mLで混合することにより、RP-10培地を調製します。
- NCI-H292(H292)粘膜表皮癌細胞株を増殖させる。購入した1つのバイアルから細胞をT-25組織培養処理フラスコ内の5 mLのRP-10培地に加えます。37°C / 5%CO2 で3〜5日間インキュベートして、100%コンフルエントに到達します。
- コンフルエンシーを評価するために、10倍の倍率を使用して光学顕微鏡で細胞を確認します。
注:すべてのセルが他のセルと接触していて、間にギャップがない場合、目的の100%コンフルエンシーに達します。 - 細胞を5 mLの室温PBSで2回洗浄します。次のステップでEDTAをキレート化しないように、バッファーがカルシウムを含まないことを確認してください。
- 1 mLのトリプシン-EDTAをフラスコに加え、細胞が剥離するまで37°C/5%CO2 で5〜10分間インキュベートします。4 mLのRP-10培地で中和します。上下にピペッティングして穏やかに混合し、50 mLのコニカルチューブに移します。
- ウェルあたり500 μLの細胞懸濁液を組織培養処理した24ウェルプレートに加えます。コンフルエントなT-25フラスコから、2 ×10 6-4×106 細胞/ mLを期待してください。
- 翌日、ステップ2.3のように、光学顕微鏡で細胞をチェックして、細胞がコンフルエントであることを確認します。そうでない場合は、より長くインキュベートします。
- H292細胞が24ウェルプレートで100%コンフルエントになったら、1 mLの室温PBSで細胞を3倍穏やかに洗浄し、抗生物質や破片を含む培地が残らないようにします。
- 細胞を洗浄した後、250 μL/ウェルの4%パラホルムアルデヒドを加えて細胞を固定します。氷上で1時間、または4°Cで一晩インキュベートします。
- 細胞固定の前夜に、目的の 肺炎球菌 株を血液寒天プレートにストリークし、37°C/5%CO2で一晩インキュベートします。
注:ここに提示されたデータは、共同交換によって得られた次のS.肺炎株に関するものです:血清型19F中耳炎分離株EF3030 24、古典血清型2エイブリー株D3925、および血清型4菌血症分離物TIGR4 26。ひずみは、材料表で参照されているパブリックコレクションからも入手できます。 - 20 mLのCDMに100 μLのオキシラーゼ(30 U/mL)を加えて、CDMとオキシラーゼ(0.15 U/mL)を調製します。
注:オキシラーゼは酸素を除去し、液体培養で 肺炎球菌 を効率的に増殖させるために使用されます27。 - 寒天をこすらないように注意しながら、1 mLのCDM +オキシラーゼを添加し、1 mLのピペットチップの側面を使用して細菌コロニーを静かに持ち上げて、プレートから細菌をプレートから洗い流すことによって、プレートから新しいCDM +オキシラーゼに細菌を接種します。または、接種ループを使用して細菌を持ち上げ、1 mLのCDM +オキシラーゼを含むチューブに接種します。
- 細菌をCDM +オキシラーゼで開始OD600 の開始OD 0.05に希釈します。
- 37°C / 5%CO2 で立っている緩いキャップの50mLコニカルチューブで、OD600 が0.2に達するまでバクテリアを増殖させます(これには2〜5時間かかります)。OD600 を毎時チェックして、ODが0.2を超えていないことを確認します。
- ODが0.2に達したら、細菌培養チューブをボルテックスします。固定H292細胞上に0.5 mLの細菌を播種し、ウェルあたりさらに0.5 mLのCDM +オキシラーゼ培地を追加します。1 mLのCDM +オキシラーゼを細菌のないコントロールウェルに追加します。プレートを34°C/5%CO2で48時間インキュベートします。
注:34°Cでの成長は、鼻咽頭21の低温をより厳密に模倣するために使用されます。 - 最初の播種後12時間ごとに、0.5 mLの培地を静かに取り除き、0.5 mLの新鮮なCDM +オキシラーゼを補充します。形成中のバイオフィルムを乱さないように注意してください。プレートの底にバイオフィルムがないか確認し、バイオフィルムの成長により時間が経つにつれて曇りが増すのを探します。汚染を制御するには、バクテリアのないウェルをチェックして、コントロールウェルが透明であることを確認してください。
- 接種後48時間で、上清を取り除き、1 mLのPBSで2回非常に穏やかに洗浄します。1 mLの新鮮なCDMに再懸濁し、ピペットで激しく上下させてバイオフィルムを持ち上げます。細菌株ごとに、すべてのウェルから細菌を50 mLのコニカルチューブにプールします。しっかりと蓋をしたチューブを数回上下にそっと傾けてよく混ぜます。
- 50 mLコニカルチューブに、CDM中の40%グリセロールを等容量で添加して、最終濃度20%グリセロールの細菌懸濁液を達成します。1 mLを微量遠心チューブに分注し、ドライアイスで瞬間凍結し、-80°Cで保存します。
- 使用前に、1つのアリコートを氷上で解凍し、チューブを1,700 × g で5分間回転させ、上清を除去し、ペレットを1 mLのPBSに再懸濁し、血液寒天プレート28に段階希釈液をプレーティングすることにより、細菌を列挙します。
- 寒天プレートを37°C/5%CO2 で一晩増殖させ、関連する希釈液でコロニーをカウントして、コロニー形成単位(CFU)/mLの細菌濃度を取得します。
注:最初の24時間以内に細菌の生存率が低下するため、凍結の少なくとも1日後以降にストック内の細菌を列挙することをお勧めします。保存された凍結アリコートは、最大2ヶ月間のマウスのその後の感染に使用することができる。
3. バイオフィルム成長マウスへの肺炎球菌の鼻腔内接種
- マウスを購入し、希望の年齢で使用してください。
注:3〜4ヶ月齢のマウスは若い宿主をモデル化するよりも好まれ、21〜24ヶ月齢のマウスは65歳>29歳の高齢者をモデル化するために使用することができる。ここに示されているデータは、C57BL / 6雄マウスに関するものです。 - バイオフィルムで増殖させた細菌アリコートを氷上で解凍し、1,700 × g で5分間回転させます。ペレットを乱さずに上清を注意深く除去して廃棄し、ペレットを1 mLのPBSに再懸濁して細菌を洗浄し、1,700 × g で5分間再び回転させます。上清を取り除き、所望の濃度に達するのに必要な量でペレットを再懸濁します(鼻腔内接種のために5 ×10 6 CFU / 10μLを目指します)。調製した接種材料をステップ2.19と同様に血液寒天プレートにプレーティングして投与した菌量を確認する。
- 5 μLの希釈接種材料を各ナリスにピペッティングすることにより、マウスに5 ×10 6 CFUを接種します。容量が吸入されるまで(通常、ボリュームを鼻腔にピペッティングしてから数秒以内に)、マウスをしっかりと保持し、頭を安定させます。接種材料の肺誤嚥を防ぐために、麻酔がない状態でこのステップを実行します。
4.インフルエンザAウイルス(IAV)によるウイルス感染
- S. pneumoniaeの鼻腔内接種後48時間で、目的のIAV株を氷上で解凍します。
注:ここに示されているデータは、共同交換30を介して得られたインフルエンザAウイルスA/PR/8/34 H1N1のマウス適応株に関するものです。 - ウイルスが解凍したら、PBSでウイルスを希望の濃度に希釈します。気管内感染の場合は20プラーク形成単位(PFU)/ 50 μL、鼻腔内感染の場合は200 PFU / 10 μLを目指します。模擬感染グループおよび細菌のみのグループの場合は、PBSを使用してマウスに接種します。
- 麻酔前にマウスの目に眼科用潤滑剤を置きます。5%イソフルランを用いてマウスを麻酔し、つま先をしっかりつまんで麻酔を確認する。
- 動物に麻酔をかけたら、イソフルランチャンバーから取り出し、麻酔をかけたマウスに50 μL(20 PFU)のIAVを鈍いピンセットを使用して気管内に感染させ、舌を口から引き出し、気管に液体の量をピペッティングします。
- マウスを別のケージに入れ、完全に回復するまで監視します(胸骨横臥を維持することができます[胸に直立させることができます])。
- 回復後、直ちにステップ3.3の接種方法を用いて10μL(200PFU)のIAVをマウスに鼻腔内接種する。
- 同じ感染グループで単一または二重の細菌およびウイルス感染を受けたハウスマウスを飼い、他のグループから分離します。
5.マウスの病気の症状のモニタリング
- マウスを少なくとも10日間毎日監視し、次のように病気の兆候を盲目的にスコアリングします。
- 減量のためのスコアは以下の通り:0 = 5%以下。1 = 5%-10%;2 = 10%-15%;3 = 20%以上。減量スコアが3のときにCO2 吸入を使用してマウスを安楽死させる。
- アクティビティのスコアは次のとおりです:0 =通常/アクティブ。1 =移動しているがわずかに減少している。2 = 減少;3 =ひどく減少/無気力(触れた場合にのみ動く)、4 =昏睡/動かない。活動スコアが3のときにマウスを安楽死させる。
- 姿勢のスコアは次のとおりです:0 =予感なし(通常)。1 =わずかに猫背の姿勢。2 =激しい予感。姿勢スコアが2のときにマウスを安楽死させます。
- 目について次のようにスコアを付けます:0 =正常。1 =突き出ています。1 =沈没。1 = クローズ。1 = 放電。組み合わせにすることができます。最終的な目のスコアの合計を追加します。
- 呼吸のスコアは次のとおりです:0 =通常の呼吸。1 =不規則または変更(より高い/より低いレート)。2 =労力(誇張された努力またはあえぎ)。呼吸スコアが2のときにマウスを安楽死させます。
- 上記の基準に基づいて、健康(0)から極度(15)の合計臨床スコアの個々のスコアを加算します。合計スコアが2を超えるマウスは病気であると考えてください。合計スコアが9を超えるマウスまたは各基準の示されたスコアを示しているマウスを人道的に安楽死させ、生存曲線にマークします。
6.細菌計数のための感染組織の処理
- IAV感染後48時間で、マウスを安楽死させる。
- マウスを仰臥位に置きます。70%エタノールを使用して、マウスの胸部と腹部にスプレーして毛皮をきれいにします。鉗子を使用して、マウスの中央で毛皮と皮膚をつまみ、解剖ハサミで4.5で毛皮を切り、肝臓から胸までの領域を露出させます。
- 採血
- 解剖ハサミを使用して、肝臓を露出させるために腹腔に静かに切り込みます。鉗子を使用して、横隔膜近くの肝臓の上部にある肝門脈を露出させます。解剖ハサミを使用して肝門脈を切断します。血液が腹腔に溜まり始めたら、マイクロピペットを使用して10 μLの血液を採取し、90 μLの抗凝固剤溶液(PBS中の50 mM EDTA溶液)にマイクロ遠心チューブに入れて、細菌負担をプレーティングします。
- P-1000マイクロピペットを使用して残りの血液を採取し、採血管に入れ、7,600 × g で2分間遠心分離して血清を採取します。血清を-80°Cの微量遠心チューブに保存し、その後、目的のサイトカインまたは代謝物を分析できるようにします。
- 肺コレクション
- 解剖ハサミを使用して、露出した胸郭の側面を切り取り、肋骨をマウスの頭に向かってゆっくりと引き上げて心臓を露出させます。PBSを事前に充填した10 mLシリンジに取り付けられた25 G針を右心室に挿入し、ゆっくりと灌流を開始します。灌流の成功の指標として肺の漂白を探します。肺組織を壊さないようにゆっくりと洗い流してください。
- 鉗子で心臓を持ち上げ、肺と心臓を分離するために切り込みを入れます。分離したら、鉗子で肺のすべての葉を拾い上げ、滅菌PBSを含む皿ですすぎ、残留血液を取り除きます。ペトリ皿で、肺を細かく刻み、よく混ぜます。細菌CFUまたはウイルスPFUを測定するために肺ミックスの半分を取り除き、ホモジナイズのために0.5 mLのPBSを事前に充填した丸底15 mLチューブに入れます。
注:さまざまな評価のために、同じ肺の異なる葉を服用しないことが重要です。代わりに、すべてのローブを細かく刻み、よく混ぜ合わせ、さまざまな評価のために均等に解析する必要があります。 - フローサイトメトリーのために肺の残りの半分を取り出し(以下のセクション7)、各ウェルに0.5 mLのRP-10をプレフィルした非組織培養処理24ウェルプレートに入れます。処理するまで室温で放置してください。
- 鼻咽頭コレクション
- 首では、解剖ハサミを使って毛皮を切り取り、次に筋肉を切り取って気管を露出させます。
注:気管は筋肉の下にある管状の構造です。 - マウスの顎から1 cmの距離で気管の下に小さな鉗子を置き、マウスの顎を安定させます。解剖ハサミを使用して、気管の前部に0.1cmのスリットをそっと作り、気管を完全に切断しないようにします。
- 0.5 mLのPBSを充填した1 mLシリンジを準備し、0.58 gの針に0.58 mmのチューブを取り付けます。鼻咽頭に向かって上向きにチューブを気管に挿入して、鼻洗浄液を収集します。鼻腔に入る抵抗が感じられたら、微小遠心チューブを鼻に置き、気管を通してPBSをゆっくりと洗い流して鼻洗浄液を収集します。
- マウスを腹臥位に置きます。マウスの頭にエタノールをスプレーします。解剖ハサミを使用して毛皮と神秘的なパッドを切断し、マウスの頭骨を露出させます。
- 解剖ハサミを使用して、下顎骨の側面と目の間を1 cm切ります。鉗子を使用して、顔の骨をゆっくりと体から引き離し、鼻腔を露出させます。
- 鉗子を使用して鼻組織を静かに取り除き、均質化のために0.5 mLのPBSを事前に充填した丸底チューブに入れます。
- 首では、解剖ハサミを使って毛皮を切り取り、次に筋肉を切り取って気管を露出させます。
- 採取した組織を均質化するには、まずホモジナイザープローブを70%エタノールに入れ、ホモジナイザーを60%の電力で30秒間オンにして洗浄します。滅菌水で10秒間この手順を繰り返します。各組織を1分間均質化します。ホモジナイザープローブを各サンプル間の滅菌水で洗浄し、各臓器とサンプルグループの間に70%エタノールの新しいチューブで洗浄します。
- 細菌数の列挙
- すべての臓器を採取して均質化したら、血液寒天プレートでプレート段階希釈します。総CFUを計算するには、10 μLを使用してプレートし、各サンプルの最終容量をmL単位で書き留めます。鼻咽頭サンプルを3 μg/mLのゲンタマイシンを添加した血液寒天プレートにプレートし、その組織にコロニーを形成する他の微生物の増殖を抑制しながら、 肺炎球菌 の増殖を選択します。37°C/5%CO2で一晩インキュベートします。
- 肺と鼻咽頭の細菌CFUを列挙するには、まず血液寒天プレート上のコロニーを数えます。次に、式(1)および式(2)を使用して、mLあたりの量および総数を計算します。
1mL当たりの量=コロニー数×希釈倍率100×(1)
総数=mLあたりの量×サンプルあたりの総量 (2)
注:式(1)では、100 μLがメッキされているため、100 mLの100倍希釈で乗算します。式(2)におけるサンプル当たりの総体積はステップ6.7.1からのものであり、これは臓器当たり100の検出限界をもたらす。 - 細菌CFUを列挙するには 菌血症の場合、まず血液寒天プレート上のコロニーを数えます。次に、式(3)を使用して、血液1mLあたりの量を求めます。
血液1mL当たりのコロニー数=コロニー数×希釈倍率×100×10(3)
注:式(3)では、100は10μLがメッキされているときに使用され、これは1mLの100倍希釈であり、10は抗凝固剤での血液の1:10希釈を示します。これにより、検出限界は1,000/mLとなります。
7. フローサイトメトリーのための肺サンプルの処理
- 必要なメディアを次のように準備します。
- 手順 2.1 の説明に従って RP-10 を準備します。
- RP-10を2 mg/mLのコラゲナーゼおよび30 μL/mLのDNase Iと混合して消化バッファーを調製します。
- 8.29 gのNH4Cl、1 gのNaHCO3、および0.038 gのEDTAを1 LのH2Oに溶解して溶解バッファーを調製します。
- 450 mLのHBSSを50 mLの熱不活性化FBSおよび5 gのアジ化ナトリウムと混合することにより、10x FACSバッファーを調製します。
- 50 mLの10x FACSバッファーを450 mLのHBSSで希釈することにより、1x FACSバッファーを調製します。
- ステップ6.4.3から肺サンプルを採取し、24ウェルプレートに入れます。各ウェルに500 μLの消化バッファーを加えます。37°C/5%CO2で45分間最大1時間インキュベートします。
- 各サンプルの50 mLコニカルチューブに5 mLのRP-10をプレフィルします。インキュベーションが終了したら、50 mLのコニカルチューブの上部に100 μmのフィルターを置き、1 mLのRP-10で濡らします。
- P-1000マイクロピペットを使用して、消化された肺を動かし、フィルターの上に置きます。3 mLシリンジのプランジャーを使用して臓器をマッシュします。毎回1mLのRP-10で2回すすぎます。
- サンプルを4°C、327 × g で5分間スピンします。上清を吸引し、ペレットを1 mLの溶解バッファーに再懸濁します。赤血球の溶解を可能にするために3分間放置します。5 mLのRP-10で中和します。
- サンプルを4°C、327 × g で5分間スピンします。上清を吸引し、ペレットを1 mLのRP-10に再懸濁し、サンプルをカウントするために10 μLを取ります。
- サンプルを4°C、327 × gで5分間スピンします。上清を吸引し、ペレットをRP-10に2 ×10 6-4 × 106細胞/mLで再懸濁します。各サンプル60 μLを96ウェルプレートに加え、ステップ7.9、表5、および表6にリストされている目的の細胞タイプ23を染色します。
- プレートを4°C、327 × g で5分間回転させます。
- その間、抗体マスターミックス、蛍光マイナス1(FMO)、および目的の抗体を使用したシングルステインコントロールを準備します。多形核白血球(PMN)、マクロファージ、単球、樹状細胞、およびT細胞を染色するには、表 5 および 表6に記載されている抗体および最終希釈液を使用します。抗体ミックスの総容量は100 μL/ウェルを使用してください。表に記載されている希釈率に従って、マスターミックスの適切な量と必要な個々の抗体を決定します。
- スピンが完了したら(ステップ7.8)、上清をデカントし、100 μLの抗体ミックス、FMO、または単一染色コントロールにペレットを再懸濁し、暗所で30分間氷上でインキュベートします。
- 150 μLのFACSバッファーをウェルに加え、プレートを4°Cおよび327 × g で5分間回転させて、細胞を2倍洗浄します。
- スピンが完了したら、上清をデカントし、ペレットを100 μLの固定バッファーに再懸濁し、氷上で20分間インキュベートします。
- 150 μLのFACSバッファーをウェルに加え、プレートを4°Cおよび327 × g で5分間回転させて、細胞を2倍に洗浄します。
- 標識したFACSチューブを200 μLのFACSバッファーで調製します。ペレットを150 μLのFACSバッファーに再懸濁します。100 μmフィルターを使用して、各サンプルを対応するFACSチューブに個別にろ過します。氷上または4°Cに保ち、分析の準備ができるまで光から保護してください。
- フローサイトメーターを使用して細胞を分析します。
8. IAVを列挙するためのプラークアッセイ
- 必要なメディアを次のように準備します。
- 2.5 gのウシ血清アルブミン(BSA)を40 mLのDMEMに溶解し、溶解するまで37°Cで10〜20分間攪拌しながら感染培地を調製します。460 mLのDMEMにフィルター滅菌します。
- 1.2 mgの微結晶セルロースを50 mLのH 2 Oに溶解して2.4%微結晶セルロースを調製し、液体設定でオートクレーブし、室温で保存します。
- 37°Cで10〜20分間攪拌しながら、2.5 gのBSAを40 mLのDMEMに溶解することにより、5%のBSA DMEMを調製します。残りの10 mLのDMEMを加えて、最終容量50 mLにします。フィルター滅菌し、4°Cで保存します。
- 1 mLの5%BSA DMEMと9 mLの2x MEMを混合して、2x MEM/0.5% BSAを調製します。
- 1:1の比率の2.4%微結晶セルロースと2x MEM/0.5%BSAを1 mg/mL TPCK(キモトリプシン阻害剤)トリプシンと混合することにより、低粘度オーバーレイ培地を調製します。
- 450 mLのイーグルの最小必須培地(EMEM)と50 mLの熱不活性化FBSを混合して、EMEM/10%FBSを調製します。
- マディン・ダービー・イヌ腎臓(MDCK)細胞株を増殖させる。購入したバイアル1本の細胞を、T-25組織培養処理フラスコ内の5 mLのEMEM/10%FBSに加えます。細胞が100%コンフルエントに達するまで、37°C / 5%CO2 で3〜5日間インキュベートします。手順 2.3 のようにコンフルエンシーを確認します。
- 培養液を取り出して廃棄し、室温PBS5 mLで2回すすぎます。1 mLのトリプシン-EDTAをフラスコに加え、細胞が剥離するまで37°C / 5%CO2 で10〜15分間インキュベートします。持ち上げたら、4mLのEMEM/10%FBSで中和し、2 × 105 細胞/mLの細胞懸濁液を得ます。
- プラークアッセイを開始する1日前に、1ウェルあたり1 mLの再懸濁細胞(2×105 細胞/ウェル)を加えて、MDCK細胞を12ウェル組織培養処理プレートに播種します。
注:使用前に細胞が100%コンフルエントに達していることを確認し、コンフルエントに達するために必要な場合はより長くインキュベートします。 - 標準として使用するには、ステップ8.1.1にリストされている感染培地でIAVストック(既知の力価)の10倍の段階希釈(106-10 1)を行います。各希釈液を1.2 mLずつ作り、3回に分けて試験します。
- 臓器ホモジネートを氷上で解凍します。卓上遠心分離機で2,000 × g でスピンダウンし、透明な上清を収集します。
- ステップ8.5を繰り返しますが、ステップ8.6のサンプルの上清を使用します。
- 細胞から培地を吸引し、1 mLのPBSで2回洗浄して、すべてのFBSを除去します。
- 各標準希釈液または連続希釈サンプルを300 μLずつ、各ウェルの側面に沿って、最高希釈から最低希釈まで穏やかに加え、これを3回に分けて行います。
- プレートを37°C / 5%CO2のインキュベーターに入れ、10分ごとにプレートを合計50分間振とうします。インキュベーターに平らに置き、積み重ねないでください。
- 50分後、細胞を1mLのPBSで2回洗浄する。
- 2 mLの低粘度オーバーレイ培地を、最低希釈ウェルと無ウイルスウェルを除く各ウェルに追加します。それらに、感染培地とトリプシンを追加します。
- プレートを37°C / 5%CO2 のインキュベーターに2〜4日間戻し、肉眼で視覚化できるプラークを作成します。
- 2 mLのPBSを側面から各ウェルにすばやく加えてプレートを洗浄し、穏やかに振って、落ち着いた低粘度オーバーレイ媒体を懸濁させます。
- 培地を静かにピペッティングして、ウェル内の液体ボリューム全体を廃棄します。
- 各ウェルに2 mLのPBSを入れてもう一度洗浄を繰り返し、穏やかなピペッティングで液体容量全体を廃棄します。
- プラークを固定するには、500 μLの4%パラホルムアルデヒドを各ウェルに加え、振とうして30分間放置します。
- 1 mLのPBSで側面をゆっくりと洗い流します。次に、液体をそっと捨てます。
- 細胞単層を覆うために、500 μLの1%クリスタルバイオレット(水で希釈)を各ウェルに加えます。5分間インキュベートします。
- 水道水1mLで洗ってください。穏やかなピペッティングによってウェル内のすべての液体を捨てるようにしてください。プレートをおむつパッドに逆さまにして置き、一晩乾かします。
- プラークを視覚的に数え、利用可能なイメージャーに画像を保存します。
結果
バイオフィルム成長したS.肺炎(図1A)を使用して、麻酔をかけていないマウスに鼻腔内に送達された小さな10μLの接種源を使用してマウス(図1B)に感染させた。この少量の接種材料は、全身の広がりを回避しながら、鼻咽頭に限定された一貫した肺炎球菌キャリッジ(図2A、+ spグループ)をもたらします(図2B、C、+ spグループ)。鼻腔内接種から2日後、マウスにマウス適応型H1N1インフルエンザAウイルスA/PR/8/34(IAV)22,30を感染させ、鼻腔内および気管内に送達し、鼻咽頭および肺に特定の量を一貫して送達した23。
ここでは、このモデルを用いて、肺炎が進行して菌血症に至る侵襲株であるTIGR4およびD39、および中耳炎株であるEF3030を含む、鼻腔内チャレンジマウスの異なる株の肺炎菌の疾患経過を比較しました21,24,25,26,31。S. pneumoniae/IAV同時感染マウスにおける疾患発現は、細菌株に依存していました(図2)。いずれの菌株間でも鼻咽頭の細菌数に有意差はなかったが(図2A)、肺炎球菌TIGR4およびD39は、IAV感染後48時間までに肺に播種したがEF3030は播種しなかった(図2B)。肺炎球菌TIGR4に鼻腔内に感染したマウスの40%が肺への細菌の播種を示し、そのうちの半分が細菌性になり(図2C)、以前の所見と一致しました23。
S. pneumoniae D39に鼻腔内感染マウスは、同時感染マウスの100%で肺への拡がりが観察されたので、より効率的な播種を示した(図2B)。肺炎球菌TIGR4と同様に、それらの半数が菌血症を経験しました(図2C)。全生存期間の追跡において、細菌株に関係なく、同時感染マウスの生存率は、試験したすべての株について、単独で肺炎球菌のみに挑戦したマウスよりも有意に低かった(図2D)。IAVのみに挑戦した対照マウスと比較して、鼻腔内にS.ニューモニエTIGR4およびD39に感染したマウスは、EF3030ではなく、疾患の加速率を示した。IAV感染後2日目までに、マウスの30%(D39)および20%(TIGR4)が死亡したのに対し、IAVのみの対照群はチャレンジ後5日目まで死亡し始めませんでした(図2D)。肺炎球菌EF3030とIAVに同時感染したマウスは、IAVのみの対照により類似した遅延症状を示しました(図2D)。これらの知見は、共感染モデルが若年健康なマウスにおいて細菌株依存性の疾患をもたらすことを示しており、疾患進行の各段階で必要な細菌因子を探索するのに理想的である。
このモデルは、異なる株のS.肺炎を鼻腔内接種したマウスにおけるIAV感染後の肺における様々な免疫細胞の存在(図3の細胞型およびゲーティング戦略)を評価するために使用された。 IAV感染後に肺に分散した細菌株D39およびTIGR4は、好中球(PMN)や単球などの循環からの炎症性免疫細胞の流入においてベースライン(非感染)以上の有意な増加を誘発したが、EF3030はそうではなかった(図4A-C)。IAV感染単独では、NK細胞およびガンマデルタT細胞などのウイルス感染に対する宿主防御に重要な免疫細胞の流入においてベースラインを上回る有意な増加を誘発した(図4A−C)。これらの抗ウイルス応答は、ウイルスチャレンジの前に肺炎球菌に鼻腔内感染させたマウスにおいて有意に鈍化した(図4A−C)。これは、S. pneumoniae保菌がI型インターフェロンの産生を鈍らせ、肺におけるIAV負荷を制御する宿主の能力を損なったことを発見したサイトカイン応答を評価する以前の研究と一致している23。これらの知見は、共感染モデルを用いて、単微生物感染と多微生物感染における免疫応答がどのように変化するかを研究できることを示している。
このモデルは、 肺炎球菌 TIGR4に鼻腔内に感染したマウスのIAV感染後の疾患経過に対する老化の影響を評価するためにも使用されました。単一感染マウスでは、ウイルス力価は若年コホートと高齢コホートの間で変化しませんでした(図5A)23。以前の研究23と同様に、高齢マウスは、より高い臨床スコアによって実証されるように、若いマウスと比較して、より早く、有意に重篤な疾患の兆候を示しました(図5B)。疾患の症状と一致して、 肺炎球菌 を接種した老齢マウスは、IAV感染後24時間以内により早く死亡し始め、全員が病気に屈したのに対し、若い対照群は有意に高い(33%)割合で感染を生き延びました(図5C)。これらの知見は、共感染モデルが脆弱な宿主のより重篤な疾患の検出に使用できることを実証しており、共感染に対する耐性または感受性を付与する宿主因子の探索に理想的である。
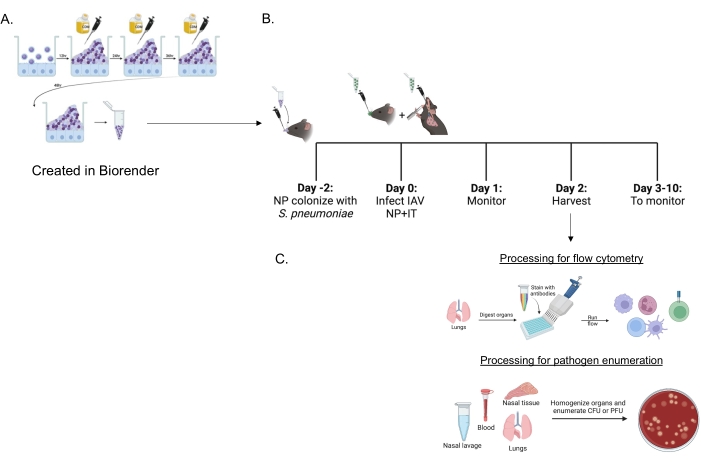
図1:免疫細胞の流入と病原体の負荷を評価するための共感染と臓器処理のタイムライン。 (A)肺炎連鎖球菌はバイオフィルムで増殖する。(B)マウスに、示されたバイオフィルム成長したS.ニューモニエ株の5×106 CFUを鼻腔内に接種して、鼻咽頭保菌を確立するか、または未処理のまま放置する。48時間後、マウスはPBSで模擬処理されるか、鼻腔内に200PFUのインフルエンザAウイルスPR8を、気管内に20PFUを投与されます。マウスは、臨床疾患スコアおよび生存について経時的にモニターされる。(C)IAV感染後48時間で、さまざまな臓器の細菌CFUまたはウイルスPFUまたは肺の免疫細胞の流入が評価されます。略語:CFU =コロニー形成単位;PFU =プラーク形成単位;IAV = インフルエンザAウイルスPR8;IT =気管内;NP =鼻咽頭。この図の拡大版を表示するには、ここをクリックしてください。
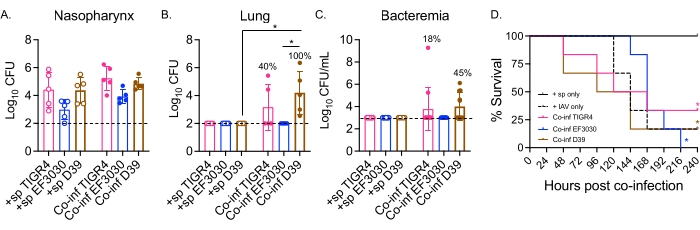
図2:肺炎球菌を接種したマウスの鼻腔内/気管内IAVの二重感染は、細菌株に依存する細菌の拡散と病気につながります。 若い(10〜12週齢)雄C57BL/6(B6)マウスを図1のように感染させた。(A)鼻咽頭、(B)肺、および(C)血液の細菌数はすべて、IAV感染後48時間で決定されました。(B,C)百分率は、広がりを示したマウスの割合を示す。(D)IAV感染後10日間生存率をモニターした。グループごとに(A、B)n=5、(C)n=11、および(D)n=6匹のマウスからのプールデータが示されている。各円は1匹のマウスに対応し、破線は検出限界を示します。(A−C)*は、クラスカル・ウォリス検定によって決定された示された群間の有意差(p<0.05)を示す。(D)*は、ログランク(Mantel-Cox)検定によって決定された細菌株当たりの+spマウスとCo−infマウスとの間の有意差(p<0.05)を示す。略語:+ sp =示された株のみを使用して細菌に鼻腔内に感染したマウス。Co-inf =IAVに感染した細菌感染マウス;IAV =インフルエンザAウイルスを投与されたマウス;CFU = コロニー形成単位。この図の拡大版を表示するには、ここをクリックしてください。
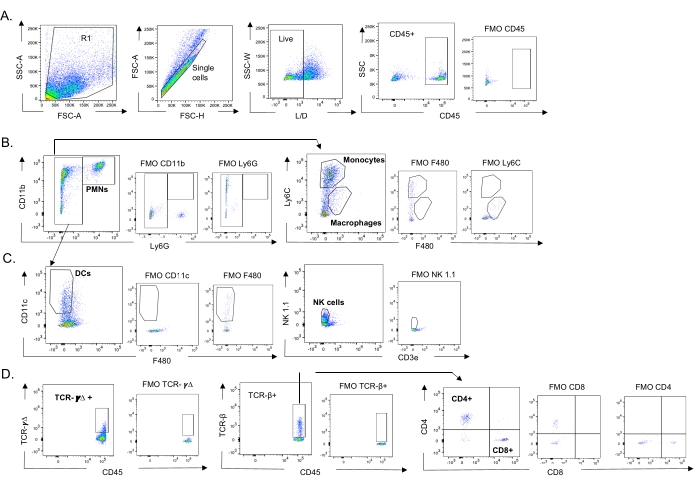
図3:免疫細胞ゲーティング戦略。肺を採取し、免疫細胞流入をフローサイトメトリーで測定した。異なる細胞型の代表的なゲーティング戦略を示す。(A)CD45+、生単一細胞をゲーティングし、(B)PMN(Ly6G+、CD11b+)、マクロファージ(Ly6G-、Ly6C-、F480+)、および単球(Ly6G-、Ly6C+)、(C)DC(Ly6G-、CD11c+)およびNK細胞(NK1.1+、CD3-)、(D)TCR−γΔおよびCD8(CD8+、TCRβ+)およびCD4(CD4+、TCRβ+)の割合をゲーティングした。)T細胞を測定した。略語: SSC-A = 側方散乱ピーク面積;FSC-A = 前方散乱ピーク面積;FSC-H = 前方散乱ピークの高さ;SSC-W = 側方散乱ピーク幅;L / D =生きている/死んでいる;FMO =蛍光マイナス1;NK =ナチュラルキラー;PMN =多形核白血球;DC =樹状細胞;TCR = T細胞受容体。この図の拡大版を表示するには、ここをクリックしてください。
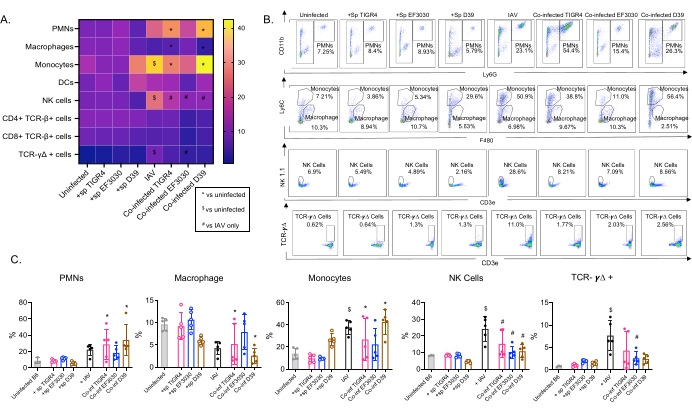
図4:肺免疫応答は細菌株に依存する。若い(10〜12週齢)C57BL / 6雄マウスは、感染していないか、示された肺炎球菌株(+sp)を単独で接種するか、IAV(IAV)に単独で挑戦するか、または肺炎球菌とIAV(Co-inf)に同時感染しました。IAV感染の48時間後(図1の実験デザインを参照)、肺を採取し、免疫細胞の流入を図3のゲーティング戦略に従ってフローサイトメトリーによって決定しました。(A)CD45ゲート内の示された各細胞タイプの平均パーセンテージは、ヒートマップ上のすべての治療グループについて表示されます。(B)各マウス群について、処理間で有意差を示した細胞型の代表的なドットプロットを示す。(C)示された免疫細胞タイプのパーセンテージが示されている。各円は1つのマウスに対応します。(A,C)群当たりn=5匹のマウスからのプールされたデータが示されている。*は、Co-infと非感染者との間の有意差(p < 0.05)を示します。$は、IAVと非感染の間の有意性を示します。#は、Co−infとIAV単独の有意差を示す。各細胞タイプのチャレンジグループ間の有意差は、ANOVAとそれに続くテューキーの検定によって決定されました。略語:NK =ナチュラルキラー;PMN =多形核白血球;DC =樹状細胞;TCR = T細胞受容体;IAV = インフルエンザAウイルス。この図の拡大版を表示するには、ここをクリックしてください。
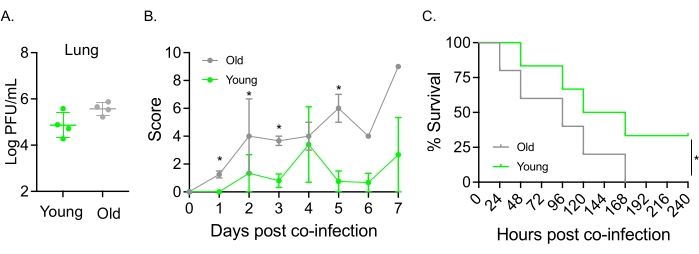
図5:加齢とIAV/肺炎連鎖球菌の同時感染に対する宿主感受性の増加。若齢(10〜12週)および高齢(21〜22ヶ月)のC57BL/6雄マウスは、肺炎球菌TIGR4 i.n.およびIAV i.n.およびi.t.(図1と同様)に同時感染するか、IAVのみに単独で挑戦した。(a)ウイルス力価は48時間後に測定した。アスタリスクは、スチューデントのt検定によって決定された統計的有意性(p < 0.05)を示します。データは、群当たりn=4匹のマウスからプールする。(B)臨床スコアおよび(C)生存期間を経時的にモニターした。(B)1群あたりn=6匹のマウスからプールしたSEMの平均±を示す。アスタリスクは、Mann-Whitney検定によって決定された示された時点での若齢マウスと老齢マウスの間の統計的有意性(p < 0.05)を示す。(c)データは、1群あたりn=6匹のマウスからプールする。アスタリスクは、ログランク(Mantel-Cox)検定によって決定された、若齢マウスと老齢マウスの間の統計的有意性(p < 0.05)を示す。略語:IAV =インフルエンザAウイルス;I.n. =鼻腔内;I.T. =気管内;SEM = 平均の標準誤差図5Aは、Jomaらの許可を得て転載した23。この図の拡大版を表示するには、ここをクリックしてください。
| CDM用ミックスIストック | |
| アデニン | 0.1グラム |
| D-アラニン | 0.25 グラム |
| CaCl2 無水物 | 0.025 グラム |
| 硫酸マンガン | 0.03 グラム |
| シアノコバラミン | 100 μL の 10 mg/mL ストック |
| パラアミノ安息香酸 | 400 μL の 5 mg/mL ストック |
| ピリドキサミン2塩酸 | 100 μL の 10 mg/mL ストック |
| CDM用ミックスIIストック | |
| グアニン | 0.05 グラム |
| ウラシル | 0.05 グラム |
| CDM用ミックスIIIストック | |
| 硝酸第二鉄9H2O | 50ミリグラム/ミリリットル |
| 硫酸第二鉄7H2O | 10ミリグラム/ミリリットル |
| CDM用ミックスIVストック | |
| β-ニコチンアミドアデニンジヌクレオチド | 25ミリグラム/ミリリットル |
表1:CDM用のI、II、III、IVストックの混合。 略語:CDM =化学的に定義された媒体。
| CDM用ビタミンミックスストック | |
| ピリドキサール塩酸塩 | 0.8グラム |
| チアミンCl2 | 0.4グラム |
| リボフラビン | 0.4グラム |
| Ca-パントテン酸塩 | 0.4グラム |
| ビオチン | 0.04 グラム |
| 葉酸 | 0.4グラム |
| ナイアシンアミド | 0.4グラム |
表2:CDM用のビタミンミックスストック。 略語:CDM =化学的に定義された媒体。
| CDM用アミノ酸ストック | |
| L-アラニン | 0.480 グラム |
| L-アルギニン | 0.250 グラム |
| L-アスパラギン | 0.700 グラム |
| L-アスパラギン酸 | 0.600 グラム |
| L-システイン | 1.000グラム |
| L-シスチン | 0.100 グラム |
| L-グルタミン酸 | 0.200 グラム |
| L-グルタミン | 0.780 グラム |
| L-グリシン | 0.350 グラム |
| L-ヒスチジン | 0.300グラム |
| L-イソロイシン | 0.430 グラム |
| L-ロイシン | 0.950 グラム |
| L-リジン | 0.880 グラム |
| L-メチオニン | 0.250 グラム |
| L-フェニルアラニン | 0.550 グラム |
| L-プロリン | 1.350 グラム |
| L-セリン | 0.680 グラム |
| L-トレオニン | 0.450 グラム |
| L-トリプトファン | 0.100 グラム |
| L-バリン | 0.650 グラム |
表3:CDMのアミノ酸ストック。 略語:CDM =化学的に定義された媒体。
| CDM用スターターストック | |
| 葡萄糖 | 1.0グラム |
| 硫酸マグネシウム-7-水和物 | 0.070 グラム |
| リン酸カリウム二塩基性 | 0.02 グラム |
| リン酸カリウム一塩基性 | 0.1グラム |
| 酢酸ナトリウム無水物 | 0.45 グラム |
| 炭酸水素ナトリウム | 0.25 グラム |
| リン酸ナトリウム二塩基性 | 0.735 グラム |
| リン酸ナトリウム一塩基性 | 0.32 グラム |
| CDMの最終サプリメント | |
| 塩化コリン | 0.1グラム |
| L-システイン塩酸塩 | 0.075 グラム |
| 炭酸水素ナトリウム | 0.25 グラム |
表4:CDMのスターターストックと最終サプリメント。 略語:CDM =化学的に定義された媒体。
| 抗体/蛍光色素 | クローン | 希釈係数 |
| UV励起のためのL / D | 該当なし | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b APC | M1/70 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| マウス FC ブロック | 2.4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | アル-21 | 0.25 |
| CD103 BV 421 | M290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
表5:抗体パネル1。
| 抗体/蛍光色素 | クローン | 希釈係数 |
| UV励起のためのL / D | 該当なし | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (パシフィックブルー) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| マウス FC ブロック | 2.4G2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
表6:抗体パネル2。
ディスカッション
既存の肺炎球菌/IAV重感染実験研究のほとんどは、IAVに感染する前のマウスの肺への細菌送達に依存しています。これらのモデルは、宿主を二次的な細菌感染に感受性にする肺環境の変化および全身免疫応答を特定するのに役立ちました15、16、17、32、33、34、35、36、37。しかし、これらのモデルは、無症候性のコロニー形成者から深刻な肺および全身感染症を引き起こす可能性のある病原体へのS.肺炎への移行を模倣することができませんでした。さらに、これらのモデルは、感染に対する感受性に寄与する上気道における宿主因子および宿主-病原体相互作用の研究には適していません。IAV感染後の鼻咽頭から肺への肺炎球菌の移動に関する以前のモデルは、鼻咽頭の細菌感染とそれに続くウイルス感染に依存していました。しかし、ヒト患者21において観察される疾患の重篤な徴候を再現することはできなかった。ここで説明する修正マウス感染モデルは、無症候性の保菌から重篤な臨床疾患を引き起こす病原体への肺炎球菌の移行を要約しています。
このモデルの重要なステップは、鼻咽頭に肺炎球菌感染を確立することです。肺炎連鎖球菌はバイオフィルムを形成し、異なる効率で鼻咽頭にコロニーを形成します21,38。一貫した感染を確立するために、これまでに試験されたバイオフィルム増殖細菌株の少なくとも5×106 CFUが必要である23。ウイルス感染の前に、新しい細菌株の鼻咽頭の安定した感染についてテストすることをお勧めします。ウイルスの重感染については、以前の研究では、鼻咽頭からの細菌の分散にIAVによる鼻腔内感染が必要であることがわかっています21,22,23。これらの先行研究では、鼻腔内送達に500 PFUのIAVが使用されましたが、この研究では、鼻咽頭の細菌数を増やすには200 PFUで十分でした。IAV感染は上気道に限定されず、肺に広がる可能性があり39,40、これは肺環境を細菌感染に対してより寛容にするための鍵です15,16,41。肺へのIAVの送達は、麻酔をかけたマウスの鼻腔内送達または気管内設置のいずれかによって達成することができる。BALB / cByJマウスを使用した以前の研究では、鼻腔内送達がウイルス性肺炎を引き起こすことがわかりました21;ただし、鼻腔内接種後の肺への接種材料のアクセスは、C57BL / 6マウスではより制限されています。.C57BL/6マウスでは、ウイルス23の一貫した送達のために気管内設置が必要である。このモデルでは、以前の細菌コロニー形成は、ウイルス感染後の疾患症状の提示を加速する23。ウイルス感染自体が動態の潜在的な変動を伴う疾患症状を引き起こす可能性があるため、最初にテストされた新しいウイルス株の用量の範囲をテストし、同時感染宿主の加速された動態を明らかにする用量を選択することをお勧めします。
肺は、このモデルにおける疾患評価のための別の重要な読み出しを提供します。病原体負荷および免疫細胞流入の評価には、同じマウスからの肺を使用することができる。ただし、感染と炎症の重症度は葉によって異なる可能性があるため、さまざまな評価のために同じ肺の異なる葉を服用しないことをお勧めします。むしろ、すべてのローブを細かく刻み、よく混ぜ合わせてから、さまざまな評価のために均等に解析することができます。同様に、鼻咽頭は、細菌CFUまたはウイルスPFUおよび免疫応答の列挙に使用することができる。しかし、洗浄および組織から得られた細胞の数は、同じグループ内のマウスからのサンプルをプールせずにフローサイトメトリーを実行するには少なすぎます。あるいは、鼻咽頭の炎症を組織学的に評価することができます23。
このモデルの重要な特徴は、患者に見られる臨床疾患を再現することです。ヒトでは、IAV感染後の二次性肺炎球菌性肺炎は、咳、呼吸困難、発熱、筋肉痛などの明らかな病気の兆候を引き起こすことが多く、入院、呼吸不全、さらには死に至る可能性があります8,15,42,43。このモデルは、マウスが示す呼吸困難(呼吸スコアに反映)と全体的な倦怠感(姿勢と運動スコアに反映)、および一部の健康な若い対照の死亡に関して、ヒトで観察された臨床疾患の重篤な兆候を再現します。同時感染マウスにおける悪化した疾患症状は、肺への細菌播種および肺炎球菌保有マウスにおけるウイルスクリアランス障害の両方の結果である可能性が高い23。このモデルの限界は、臨床疾患の発生率と鼻咽頭からの細菌播種がマウス間で異なり、細菌株、宿主年齢、および遺伝子型21、22、23の影響を受けることです。これを反映して、侵襲性株の場合、局所感染(検出可能な菌血症なし)から死への進行は24時間以内に発生する可能性があります。したがって、全身の広がりを真に評価するためには、菌血症をより短い間隔(6〜12時間ごと)で追跡する必要があります。同様に、疾患スコアは、特に重感染後の最初の72時間で急速に変化する可能性があります。したがって、疾患の症状を綿密に追跡するために、IAV感染後1〜3日目にマウスを1日3回モニターすることをお勧めします。
要約すると、このモデルは、鼻咽頭の無症候性コロニーナイザーからIAV感染時に肺および全身性疾患を引き起こす可能性のある病原体への S.肺炎 の動きを再現します。このモデルでは、IAVは鼻咽頭の細菌の挙動を改変し、肺への細菌の広がりを増加させ、抗菌免疫を変化 させることによって、肺炎球菌 の移行を引き起こします23。同様に、細菌キャリッジは抗ウイルス免疫応答を鈍らせ、肺23からのIAVクリアランスを損なう。これにより、このモデルは、単一微生物感染と多菌感染における免疫応答の変化を解析するのに理想的です。さらに、重感染後の疾患の経過は、部分的には、鼻咽頭に存在する肺炎球菌の株に依存しています。したがって、このモデルは、無症候性コロニー形成と 肺炎球菌 の病原性移行に必要な細菌因子を解剖するのに適しています。最後に、このモデルは加齢の重感染に対する感受性を再現しており、ここではテストされていませんが、宿主の背景が疾患の経過に与える影響を評価するために簡単に使用できます。結論として、保菌と疾患を別々のステップに分離することで、病原体と宿主の両方の遺伝的変異を分析する機会が得られ、疾患進行のさまざまな段階における重要な病態と宿主との相互作用を詳細に調べることができます。今後、このモデルは、脆弱な宿主の治療オプションを調整するために使用できます。
開示事項
著者は開示する利益相反を持っていません。
謝辞
この原稿を批判的に読んで編集してくれたNick Lenhardに感謝します。また、細菌株のアンドリュー・カミリとアンソニー・カンパニャーリ、ウイルス株のブルース・デビッドソンにも感謝します。この研究は、国立衛生研究所助成金(R21AG071268-01)からJ.L.に、国立衛生研究所助成金(R21AI145370-01A1)、(R01AG068568-01A1)、(R21AG071268-01)からE.N.B.G.に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
参考文献
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved