Method Article
Un modello murino per la transizione di Streptococcus pneumoniae da colonizzatore a patogeno in seguito a co-infezione virale ricapitola la malattia esacerbata dall'età
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive un nuovo modello murino per la transizione dello pneumococco da colonizzatore asintomatico a patogeno che causa malattie durante l'infezione virale. Questo modello può essere facilmente adattato per studiare le interazioni polimicrobiche e ospite-patogeno durante le diverse fasi della progressione della malattia e tra vari ospiti.
Abstract
Streptococcus pneumoniae (pneumococco ) è un colonizzatore asintomatico del rinofaringe nella maggior parte degli individui, ma può progredire in un patogeno polmonare e sistemico dopo l'infezione da virus dell'influenza A (IAV). L'età avanzata aumenta la suscettibilità dell'ospite alla polmonite da pneumococco secondaria ed è associata a un peggioramento degli esiti della malattia. I fattori dell'ospite che guidano questi processi non sono ben definiti, in parte a causa della mancanza di modelli animali che riproducano la transizione dalla colonizzazione asintomatica alla grave malattia clinica.
Questo articolo descrive un nuovo modello murino che ricrea la transizione degli pneumococchi dal trasporto asintomatico alla malattia dopo infezione virale. In questo modello, i topi vengono prima inoculati per via intranasale con pneumococchi cresciuti con biofilm per stabilire un trasporto asintomatico, seguito da infezione IAV sia del rinofaringe che dei polmoni. Ciò si traduce in disseminazione batterica ai polmoni, infiammazione polmonare e segni evidenti di malattia che possono progredire fino alla letalità. Il grado di malattia dipende dal ceppo batterico e dai fattori dell'ospite.
È importante sottolineare che questo modello riproduce la suscettibilità all'invecchiamento, perché rispetto ai topi giovani, i topi anziani mostrano malattie cliniche più gravi e soccombono alla malattia più frequentemente. Separando il trasporto e la malattia in fasi distinte e fornendo l'opportunità di analizzare le varianti genetiche sia del patogeno che dell'ospite, questo modello di co-infezione S. pneumoniae/IAV consente l'esame dettagliato delle interazioni di un importante patobionte con l'ospite nelle diverse fasi della progressione della malattia. Questo modello può anche servire come strumento importante per identificare potenziali bersagli terapeutici contro la polmonite pneumococcica secondaria in ospiti sensibili.
Introduzione
Streptococcus pneumoniae (pneumococco) sono batteri Gram-positivi che risiedono asintomaticamente nel rinofaringe della maggior parte degli individui sani 1,2. Promossi da fattori non completamente definiti, gli pneumococchi possono passare da colonizzatori benigni del rinofaringe a patogeni che si diffondono ad altri organi con conseguenti infezioni gravi, tra cui otite media, polmonite e batteriemia3. La presentazione della malattia pneumococcica dipende, in parte, dalle differenze specifiche del ceppo, incluso il sierotipo, che si basa sulla composizione dei polisaccaridi capsulari. Ci sono stati oltre 100 sierotipi caratterizzati finora, e alcuni sono associati a infezioni più invasive 4,5. Diversi altri fattori aumentano il rischio di malattia da pneumococco. Uno di questi fattori è l'infezione virale, in cui il rischio di polmonite da pneumococco è aumentato di 100 volte da IAV 6,7. Storicamente, S. pneumoniae è una delle cause più comuni di polmonite batterica secondaria dopo l'influenza ed è associata a esiti peggiori8. Un altro importante fattore di rischio è l'età avanzata. Infatti, S. pneumoniae è la principale causa di polmonite batterica acquisita in comunità in individui anziani sopra i 65 anni 9,10. Gli individui anziani rappresentano la maggioranza (>75%) dei decessi dovuti a polmonite e influenza, indicando che i due fattori di rischio - invecchiamento e infezione da IAV - peggiorano sinergicamente la suscettibilità alla malattia11,12,13,14. Tuttavia, i meccanismi attraverso i quali l'infezione virale induce la transizione degli pneumococchi da colonizzatore asintomatico a patogeno invasivo e come questo è modellato dai fattori dell'ospite rimangono scarsamente definiti. Ciò è in gran parte dovuto all'assenza di un piccolo modello animale che ricapitola la transizione dalla colonizzazione pneumococcica asintomatica alla malattia clinica critica.
Studi di co-infezione sono stati classicamente modellati in topi inoculati con pneumococchi direttamente nei polmoni 7 giorni dopo l'infezione influenzale15,16. Questo riproduce la suscettibilità alla polmonite batterica secondaria ed è ideale per studiare come le risposte immunitarie antivirali compromettono le difese antibatteriche17. Tuttavia, studi longitudinali sull'uomo hanno dimostrato che il trasporto pneumococcico nel rinofaringe, dove i batteri possono formare biofilm asintomatici18, è uniformemente associato a malattie invasive 19,20. Gli isolati batterici da infezioni dell'orecchio medio, del polmone e del sangue sono geneticamente identici a quelli trovati nel rinofaringe20. Pertanto, per studiare la transizione dal trasporto asintomatico alla malattia invasiva a seguito di infezione da IAV, è stato stabilito un modello in cui ai topi sono stati somministrati per via intranasale pneumococchi cresciuti con biofilm seguiti da infezione IAV del rinofaringe21,22. L'infezione virale delle vie aeree superiori ha portato a cambiamenti nell'ambiente ospite che hanno portato alla dispersione di pneumococchi dai biofilm e alla loro diffusione alle vie aeree inferiori21. Questi batteri dispersi avevano sovraregolato l'espressione di fattori di virulenza importanti per l'infezione, convertendoli da colonizzatori a patogeni21. Queste osservazioni evidenziano la complessa interazione tra virus, ospite e batteri e dimostrano che i cambiamenti nell'ospite innescati dall'infezione virale hanno un impatto diretto sul comportamento pneumococcico, che, a sua volta, altera il decorso dell'infezione batterica. Tuttavia, questo modello non riesce a ricapitolare i gravi segni di malattia osservati negli esseri umani, probabilmente perché il virus è limitato alla cavità nasale e gli effetti sistemici dell'infezione virale sull'immunità dell'ospite e sul danno polmonare non sono ricapitolati.
Abbiamo recentemente stabilito un modello che incorpora la complessa interazione tra l'ospite e i patogeni, ma imita anche più da vicino la gravità della malattia osservata negli esseri umani23. In questo modello, i topi vengono prima infettati per via intranasale con pneumococchi cresciuti in biofilm per stabilire un trasporto asintomatico, seguito da infezione IAV sia del rinofaringe che dei polmoni. Ciò ha provocato la disseminazione batterica ai polmoni, l'infiammazione polmonare e la malattia che è progredita fino alla letalità in una frazione di topi giovani23. Questo studio precedente ha dimostrato che sia l'infezione virale che quella batterica alteravano la difesa dell'ospite: l'infezione virale promuoveva la disseminazione batterica e la precedente colonizzazione batterica comprometteva la capacità dell'ospite di controllare i livelli di IAV polmonare23. L'esame della risposta immunitaria ha rivelato che l'infezione da IAV ha diminuito l'attività antibatterica dei neutrofili, mentre la colonizzazione batterica ha attenuato la risposta all'interferone di tipo I critica per la difesa antivirale23. È importante sottolineare che questo modello ha riprodotto la suscettibilità all'invecchiamento. Rispetto ai topi giovani, i topi anziani mostravano segni di malattia prima, mostravano malattie cliniche più gravi e soccombevano all'infezione più frequentemente23. Il lavoro presentato in questo manoscritto mostra che il grado di malattia dipende anche dal ceppo batterico, perché i ceppi pneumococcici invasivi mostrano una diffusione più efficiente dopo l'infezione da IAV, mostrano segni più evidenti di infiammazione polmonare e provocano tassi accelerati di malattia rispetto ai ceppi non invasivi. Pertanto, questo modello di co-infezione S. pneumoniae/IAV consente l'esame dettagliato sia dei fattori patogeni che di quelli dell'ospite ed è adatto per lo studio delle risposte immunitarie alle infezioni polimicrobiche nelle diverse fasi della progressione della malattia.
Protocollo
Tutti gli studi sugli animali sono stati condotti in conformità con le raccomandazioni contenute nella Guida per la cura e l'uso degli animali da laboratorio. Tutte le procedure sono state approvate dall'Università di Buffalo Institutional Animal Care and Use Committee.
1. Preparazione di mezzi chimicamente definiti (CDM)
- Preparare le scorte come segue:
- Sciogliere i composti della miscela I elencati nella Tabella 1 in 100 ml di acqua ultrapura mentre si agita. Conservare in aliquote da 200 μL a -20 °C.
- Sciogliere i composti della miscela II elencati nella tabella 1 in 20 mL di 0,1 M NaOH agitando. Conservare in aliquote da 100 μL a -20 °C.
- Sciogliere i composti della miscela III elencati nella Tabella 1 in 1 mL di acqua ultrapura agitando. Conservare in aliquote da 10 μL a 4 °C.
- Sciogliere il composto della miscela IV elencato nella Tabella 1 in 1 mL di acqua ultrapura mentre si agita. Conservare in aliquote da 10 μL a -20 °C.
- Sciogliere i composti elencati nella Tabella 2 inizialmente in 15 ml di acqua ultrapura agitando. Regolare il pH a 7,0 con alcune gocce di 0,1 M NaOH e regolare il volume finale a 20 ml utilizzando acqua ultrapura. Conservare in 1 mL di aliquote a -20 °C.
- Sciogliere i composti elencati nella Tabella 3 in 90 ml di acqua ultrapura su una piastra calda a 50 °C agitando. Regolare il pH a 7,0 con 0,1 M NaOH, quindi regolare il volume finale a 100 ml utilizzando acqua ultrapura. Conservare in 5 ml di aliquote a −20 °C.
- Preparare il brodo iniziale fresco ogni volta sciogliendo i composti nella Tabella 4 in 70 ml di acqua ultrapura mentre si mescola.
- Al brodo iniziale fresco, aggiungere le seguenti scorte di miscela nell'ordine: 200 μL di stock di miscela I (tabella 1), 80 μL di stock di miscela II (tabella 1), 10 μL di stock di miscela III (tabella 1), 10 μL di madre di miscela IV (tabella 2), 1 ml di stock di vitamine (tabella 3) e 5 ml di madre di amminoacidi (tabella 4).
- Una volta aggiunte le scorte, regolare il volume finale a 100 ml aggiungendo 30 ml di acqua ultrapura al becher.
- Integrare il CDM con composti della Tabella 4. Una volta miscelato accuratamente, filtrare e conservare a 4 °C per un massimo di 2 settimane.
2. Coltivare il biofilm di S. pneumoniae
- Preparare il terreno RP-10 mescolando 445 ml di RPMI 1640 con 50 ml di siero fetale bovino (FBS) inattivato dal calore e 5 ml di penicillina/streptomicina rispettivamente a 10.000 U/ml e 10.000 μg/ml.
- Coltivare la linea cellulare di carcinoma mucoepidermoide NCI-H292 (H292). Aggiungere le cellule di un flaconcino acquistato a 5 ml di terreno RP-10 in un matraccio trattato con coltura tissutale T-25. Incubare a 37 °C/5% CO2 per 3-5 giorni fino a raggiungere il 100% di confluenza.
- Controllare le cellule al microscopio ottico utilizzando un ingrandimento 10x per valutare la confluenza.
NOTA: Quando tutte le celle sono in contatto con altre cellule e non ci sono spazi vuoti in mezzo, viene raggiunta la confluenza desiderata del 100%. - Lavare le celle 2x in 5 ml di PBS a temperatura ambiente. Assicurarsi che il tampone sia privo di calcio per evitare chelare l'EDTA nella fase successiva.
- Aggiungere 1 mL di tripsina-EDTA al matraccio e incubare a 37 °C/5% CO2 per 5-10 minuti fino al distacco delle cellule. Neutralizzare con 4 mL di terreno RP-10. Mescolare delicatamente pipettando su e giù e trasferire in un tubo conico da 50 ml.
- Aggiungere 500 μL di sospensione cellulare per pozzetto a una piastra a 24 pozzetti trattata con coltura tissutale. Da un pallone T-25 confluente, aspettarsi 2 × 10 6-4 × 106 cellule / ml.
- Il giorno seguente, controllare le cellule al microscopio ottico per assicurarsi che siano confluenti, come nel passaggio 2.3. Se non lo sono, allora incubare più a lungo.
- Una volta che le cellule H292 sono confluenti al 100% nella piastra a 24 pozzetti, lavare delicatamente le cellule 3 volte con 1 ml di PBS a temperatura ambiente per assicurarsi che non rimanga alcun mezzo contenente antibiotici o detriti.
- Dopo aver lavato le cellule, aggiungere 250 μL/pozzetto di paraformaldeide al 4% per fissare le cellule. Incubare per 1 ora su ghiaccio o per una notte a 4 °C.
- La notte prima della fissazione cellulare, striare il ceppo di interesse di S. pneumoniae su piastre di agar sangue e incubare per una notte a 37 °C/5% CO2.
NOTA: I dati qui presentati sono con i seguenti ceppi di S. pneumoniae ottenuti tramite scambio collaborativo: sierotipo 19F otite media isolato EF3030 24, sierotipo classico 2 Avery ceppo D3925 e sierotipo 4 batteriemia isolatoTIGR4 26. I ceppi sono disponibili anche da collezioni pubbliche a cui si fa riferimento nella tabella dei materiali. - Preparare CDM più ossidasi (0,15 U/mL) aggiungendo 100 μL di ossirasi (30 U/mL) a 20 mL di CDM.
NOTA: L'ossirasi viene utilizzata per eliminare l'ossigeno per consentire la crescita efficiente di S. pneumoniae in coltura liquida27. - Inoculare i batteri dalla piastra in CDM fresco + ossirasi lavando i batteri dalla piastra aggiungendo 1 mL di CDM + ossirasi e sollevando delicatamente le colonie batteriche usando il lato di una punta di pipetta da 1 ml, facendo attenzione a non raschiare l'agar. In alternativa, utilizzare un circuito di inoculazione per sollevare i batteri e inocularli in una provetta contenente 1 mL di CDM + ossirasi.
- Diluire i batteri in CDM + ossirasi a un OD600 iniziale di 0,05.
- Coltivare i batteri in un tubo conico da 50 mL con tappo libero in piedi a 37 ° C / 5% CO 2 fino a raggiungere un OD600 di 0,2 (questo richiederà ovunque tra2-5 h). Controllare l'OD600 ogni ora per assicurarsi che l'OD non superi 0,2.
- Una volta che l'OD ha raggiunto 0,2, vortice il tubo di coltura batterica. Seminare 0,5 ml di batteri sulle cellule H292 fisse e aggiungere altri 0,5 ml di CDM + mezzo di ossirasi per pozzetto. Aggiungere 1 mL di CDM + ossirasi ai pozzetti di controllo senza batteri. Incubare la piastra per 48 ore a 34 °C/5% CO2.
NOTA: La crescita a 34 °C viene utilizzata per imitare più da vicino la temperatura più bassa nel rinofaringe21. - Ogni 12 ore successive alla semina iniziale, rimuovere delicatamente 0,5 ml di terreno e reintegrare con 0,5 ml di CDM fresco + ossirasi. Fare attenzione a non interrompere il biofilm in formazione. Controlla la parte inferiore della piastra per il biofilm e cerca l'aumento della nuvolosità con il passare del tempo a causa della crescita del biofilm. Per controllare la contaminazione, controllare i pozzetti senza batteri per assicurarsi che i pozzetti di controllo rimangano liberi.
- A 48 ore dopo l'inoculazione, rimuovere il surnatante e lavare 2 volte molto delicatamente con 1 mL di PBS. Risospendere in 1 mL di CDM fresco e pipettare su e giù vigorosamente per sollevare il biofilm. Per ogni ceppo batterico, raggruppare i batteri da tutti i pozzetti in un tubo conico da 50 ml. Mescolare bene inclinando delicatamente il tubo strettamente tappato su e giù più volte.
- Al tubo conico da 50 ml, aggiungere il 40% di glicerolo in CDM a volumi uguali per ottenere una sospensione batterica con una concentrazione finale del 20% di glicerolo. Aliquote 1 mL in provette da microcentrifuga, congelamento flash su ghiaccio secco e risparmio a -80 °C.
- Prima dell'uso, enumerare i batteri scongelando un'aliquota sul ghiaccio, ruotando il tubo a 1.700 × g per 5 minuti, rimuovendo il surnatante, risospendendo il pellet in 1 mL di PBS e placcando le diluizioni seriali su piastre di agar sanguigno28.
- Far crescere le piastre di agar per una notte a 37 °C/5% di CO2 e contare le colonie alle diluizioni pertinenti per ottenere la concentrazione batterica nelle unità formanti colonie (CFU)/ml.
NOTA: Si raccomanda di enumerare i batteri presenti nelle scorte almeno un giorno dopo il congelamento o più tardi, poiché vi è un calo della vitalità batterica entro le prime 24 ore. Le aliquote congelate conservate possono essere utilizzate per la successiva infezione dei topi per un massimo di 2 mesi.
3. Inoculazione intranasale di topi con S. pneumoniae cresciuti in biofilm
- Acquista topi e usa all'età desiderata.
NOTA: I topi di età compresa tra 3 e 4 mesi sono preferiti ai giovani ospiti modello e i topi di età compresa tra 21 e 24 mesi possono essere utilizzati per modellare individui anziani >65 anni di età29. I dati presentati qui sono con topi maschi C57BL / 6. - Scongelare le aliquote batteriche cresciute con biofilm sul ghiaccio e centrifugare a 1.700 × g per 5 minuti. Rimuovere con cura e scartare il surnatante senza interrompere il pellet, lavare i batteri risospendendo il pellet in 1 ml di PBS e ruotare di nuovo a 1.700 × g per 5 minuti. Rimuovere il surnatante e risospendere il pellet nel volume necessario per raggiungere la concentrazione desiderata (obiettivo 5 × 106 CFU/10 μL per l'inoculazione intranasale). Confermare la quantità di batteri somministrati placcando l'inoculo preparato su piastre di agar sangue come al punto 2.19.
- Inoculare i topi per via intranasale con 5 × 106 CFU pipettando 5 μL dell'inoculo diluito in ciascun naride. Assicurati di tenere saldamente i topi, stabilizzando la testa, fino a quando il volume non viene inalato (in genere entro pochi secondi dal pipettaggio del volume nelle narici). Eseguire questo passaggio in assenza di anestesia per prevenire l'aspirazione polmonare dell'inoculo.
4. Infezione virale da virus dell'influenza A (IAV)
- A 48 ore dopo l'inoculazione intranasale con S. pneumoniae, scongelare il ceppo IAV di interesse sul ghiaccio.
NOTA: I dati qui presentati si riferiscono a un ceppo di virus dell'influenza A A/PR/8/34 H1N1 adattato al topo che è stato ottenuto tramite scambio collaborativo30. - Una volta che il virus si è scongelato, diluire il virus in PBS alla concentrazione desiderata; obiettivo per 20 unità formanti placca (PFU)/50 μL per l'infezione intratracheale e 200 PFU/10 μL per l'infezione intranasale. Per i gruppi finti infetti e solo batteri, utilizzare PBS per inoculare i topi.
- Posizionare il lubrificante oftalmico sugli occhi dei topi prima dell'anestesia. Anestetizzare i topi usando isoflurano al 5% e confermare l'anestesia con un pizzico fermo.
- Una volta che l'animale è anestetizzato, rimuoverlo dalla camera di isoflurano e infettare immediatamente i topi anestetizzati con 50 μL (20 PFU) di IAV per via intratracheale usando pinzette smussate per estrarre la lingua dalla bocca e pipettare il volume di liquido lungo la trachea.
- Metti i topi in una gabbia separata e monitora fino al completo recupero (sono in grado di mantenere la reclinazione sternale [in grado di giacere in posizione verticale sul petto]).
- Dopo il recupero, inoculare immediatamente per via intranasale i topi con 10 μL (200 PFU) di IAV utilizzando il metodo di inoculazione nella fase 3.3.
- Topi domestici che hanno subito un'infezione batterica e virale singola o doppia con lo stesso gruppo di infezione e li separano dagli altri gruppi.
5. Monitoraggio dei topi per i sintomi della malattia
- Monitorare i topi ogni giorno per almeno 10 giorni e segnare ciecamente i segni di malattia come segue:
- Punteggio come segue per la perdita di peso: 0 = 5% o meno; 1 = 5%-10%; 2 = 10%-15%; 3 = 20% o più. Eutanasia i topi usando l'inalazione di CO2 quando il punteggio di perdita di peso è a 3.
- Punteggio come segue per l'attività: 0 = normale/attivo; 1 = in movimento ma leggermente diminuito; 2 = diminuito; 3 = gravemente diminuito/letargico (si muove solo se toccato), 4 = coma/immobile. Eutanasia dei topi quando il punteggio di attività è a 3.
- Punteggio come segue per la postura: 0 = nessuna intuizione (normale); 1 = postura leggermente curva; 2 = grave intuizione. Eutanasia dei topi quando il punteggio della postura è a 2.
- Punteggio come segue per gli occhi: 0 = normale; 1 = sporgente; 1 = affondato; 1 = chiuso; 1 = scarico. Può essere una combinazione. Aggiungi i totali per il punteggio finale degli occhi.
- Punteggio come segue per la respirazione: 0 = Respirazione normale; 1 = irregolare o alterato (tasso più alto/più basso); 2 = faticato (sforzo esagerato o ansimante). Eutanasia dei topi quando il punteggio di respirazione è a 2.
- Sulla base dei criteri di cui sopra, aggiungere i punteggi individuali per un punteggio clinico totale di sano (0) a estremamente malato (15). Considera che qualsiasi topo che mostra un punteggio totale superiore a 2 è malato. Eutanasia umana tutti i topi che mostrano un punteggio totale superiore a 9 o i punteggi indicati per ciascun criterio e contrassegnarli sulla curva di sopravvivenza.
6. Trattamento di tessuti infetti per l'enumerazione batterica
- A 48 ore dopo l'infezione da IAV, eutanasia i topi.
- Posizionare il mouse in posizione supina. Usando il 70% di etanolo, spruzzare il petto e l'addome del topo per pulire la pelliccia. Usando una pinza, pizzicare la pelliccia e la pelle nel mezzo del topo e tagliare la pelliccia con 4,5 forbici da dissezione per esporre l'area dal fegato fino al petto.
- Raccolta del sangue
- Usando le forbici da dissezione, tagliare delicatamente nella cavità peritoneale per esporre il fegato. Usando una pinza, esporre la vena porta epatica nella parte superiore del fegato vicino al diaframma. Tagliare la vena porta epatica usando le forbici da dissezione. Una volta che il sangue inizia a raggrupparsi nella cavità peritoneale, raccogliere 10 μL di sangue usando una micropipetta e metterli in 90 μL di soluzione anticoagulante (soluzione EDTA 50 mM in PBS) in una provetta da microcentrifuga per placcare la carica batterica.
- Utilizzare una micropipetta P-1000 per raccogliere il resto del sangue, metterlo in una provetta per la raccolta del sangue e centrifugare a 7.600 × g per 2 minuti per raccogliere il siero. Conservare i sieri in provette da microcentrifuga a -80 °C per la successiva analisi di qualsiasi citochina o metabolita desiderato.
- Collezione Lung
- Usando le forbici da dissezione, fai un taglio sui lati della gabbia toracica esposta e tira delicatamente le costole verso la testa del topo per esporre il cuore. Inserire un ago da 25 G collegato a una siringa da 10 ml preriempita con PBS nel ventricolo destro e iniziare lentamente a perfondere. Cerca lo sbiancamento dei polmoni come indicatore di perfusione riuscita. Sciacquare lentamente per evitare di rompere il tessuto polmonare.
- Sollevare il cuore con la pinza e fare un taglio per separare i polmoni e il cuore. Una volta separati, raccogliere tutti i lobi del polmone con la pinza e risciacquare in un piatto con PBS sterile per rimuovere eventuali residui di sangue. In una capsula di Petri, tritare i polmoni in piccoli pezzi e mescolare bene. Rimuovere metà della miscela polmonare per la determinazione del CFU batterico o PFU virale e posizionarla in un tubo rotondo da 15 ml preriempito con 0,5 ml di PBS per l'omogeneizzazione.
NOTA: È importante non prendere diversi lobi dello stesso polmone per le varie valutazioni. Invece, tutti i lobi dovrebbero essere tritati, mescolati bene insieme e analizzati allo stesso modo per le diverse valutazioni. - Rimuovere l'altra metà del polmone per la citometria a flusso (sezione 7 sotto) e posizionarla in una piastra a 24 pozzetti non trattata con coltura tissutale con ciascun pozzetto preriempito con 0,5 ml di RP-10. Lasciare a temperatura ambiente fino alla lavorazione.
- Collezione Nasofaringe
- Al collo, usa le forbici da dissezione per tagliare via la pelliccia, quindi taglia via il muscolo ed esponi la trachea.
NOTA: La trachea è una struttura tubolare situata sotto il muscolo. - Posizionare una piccola pinza sotto la trachea a una distanza di 1 cm dalla mascella del topo per stabilizzarla. Utilizzando le forbici da dissezione, fare delicatamente una fessura di 0,1 cm sulla porzione anteriore della trachea, evitando di tagliare completamente la trachea.
- Preparare una siringa da 1 mL riempita con 0,5 mL di PBS con tubo da 0,58 mm collegato a un ago da 25 G. Raccogliere il lavaggio nasale inserendo il tubo nella trachea andando verso l'alto verso il rinofaringe. Una volta che si avverte la resistenza che entra nella cavità nasale, posizionare un tubo di microcentrifuga sul naso e lavare lentamente il PBS attraverso la trachea per raccogliere la lavanda nasale.
- Posizionare il mouse in posizione prona. Spruzzare la testa del topo con etanolo. Usa le forbici da dissezione per tagliare la pelliccia e il cuscinetto mistaciale per esporre l'osso della testa del topo.
- Usando le forbici da dissezione, fai un taglio di 1 cm lungo i lati della mandibola e tra gli occhi. Usando una pinza, allontanare lentamente le ossa facciali dal corpo per esporre la cavità nasale.
- Utilizzare una pinza per rimuovere delicatamente il tessuto nasale e posizionarlo in un tubo inferiore rotondo preriempito con 0,5 ml di PBS per l'omogeneizzazione.
- Al collo, usa le forbici da dissezione per tagliare via la pelliccia, quindi taglia via il muscolo ed esponi la trachea.
- Per omogeneizzare il tessuto raccolto, pulire prima la sonda omogeneizzatore mettendola in etanolo al 70% e accendendo l'omogeneizzatore al 60% di potenza per 30 s. Ripetere il passaggio in acqua sterile per 10 secondi. Omogeneizzare ogni tessuto per 1 minuto. Pulire la sonda omogeneizzatore in acqua sterile tra ciascun campione e in una provetta fresca di etanolo al 70% tra ciascun organo e gruppo di campioni.
- Enumerazione dei numeri batterici
- Una volta che tutti gli organi sono stati prelevati e omogeneizzati, diluizioni seriali su piastre di agar sangue. Per calcolare la CFU totale, utilizzare 10 μL per placcare e annotare il volume finale in ml per ciascun campione. Placcare i campioni di rinofaringe su piastre di agar sanguigno integrate con 3 μg / mL di gentamicina per selezionare la crescita di S. pneumoniae mentre inibisce la crescita di altri microrganismi che colonizzano quel tessuto. Incubare per una notte a 37 °C/5% CO2.
- Per enumerare i CFU batterici per il polmone e il rinofaringe, prima contare le colonie sulle piastre di agar sangue. Quindi, utilizzare l'equazione (1) e l'equazione (2) per calcolare la quantità per ml e il numero totale.
Quantità per mL = numero di colonie × fattore di diluizione × 100 (1)
Numero totale = quantità per ml × volume totale per campione (2)
NOTA: Nell'equazione (1), 100 viene utilizzato per moltiplicare poiché 10 μL è placcato, che è una diluizione di 100 volte di 1 ml. Il volume totale per campione nell'equazione (2) è del punto 6.7.1, che si traduce nel limite di rilevazione di 100 per organo. - Per enumerare il CFU batterico Per la batteriemia, prima contare le colonie sulle piastre di agar sangue. Quindi, utilizzare l'equazione (3) per determinare la quantità per ml di sangue.
Quantità per ml di sangue = numero di colonie × fattore di diluizione × 100 × 10 (3)
NOTA: Nell'equazione (3), 100 è usato quando 10 μL è placcato, che è una diluizione 100 volte di 1 mL, e 10 indica una diluizione 1:10 del sangue nell'anticoagulante. Ciò si traduce nel limite di rilevamento di 1.000 / ml.
7. Elaborazione dei campioni polmonari per citometria a flusso
- Preparare il supporto richiesto come segue:
- Preparare RP-10 come descritto al punto 2.1.
- Preparare il tampone di digestione mescolando RP-10 con 2 mg/mL di collagenasi e 30 μL/mL di DNasi I.
- Preparare il tampone di lisi sciogliendo 8,29 g di NH4Cl, 1 g di NaHCO3 e 0,038 g di EDTA in 1 L di H2O.
- Preparare 10x tampone FACS mescolando 450 mL di HBSS con 50 mL di FBS inattivato dal calore e 5 g di azoturo di sodio.
- Preparare 1x tampone FACS diluendo 50 mL di tampone FACS 10x in 450 mL di HBSS.
- Prelevare i campioni polmonari del punto 6.4.3 e metterli in una piastra da 24 pozzetti. Aggiungere 500 μL di tampone di digestione a ciascun pozzetto. Incubare per 45 minuti fino a 1 h a 37 °C/5% CO2.
- Preriempire tubi conici da 50 mL per ogni campione con 5 mL di RP-10. Al termine dell'incubazione, posizionare un filtro da 100 μm nella parte superiore del tubo conico da 50 mL e bagnarlo con 1 mL di RP-10.
- Utilizzando una micropipetta P-1000, spostare i polmoni digeriti e posizionarli sul filtro. Utilizzare lo stantuffo di una siringa da 3 mL per schiacciare l'organo. Risciacquare 2 volte con 1 mL di RP-10.
- Centrifugare i campioni a 4 °C e 327 × g per 5 minuti. Aspirare il surnatante e risospendere il pellet in 1 mL di tampone di lisi. Lasciare agire per 3 minuti per consentire la lisi dei globuli rossi. Neutralizzare con 5 mL di RP-10.
- Centrifugare i campioni a 4 °C e 327 × g per 5 minuti. Aspirare il surnatante, risospendere il pellet in 1 mL di RP-10 e prelevare 10 μL per il conteggio dei campioni.
- Centrifugare i campioni a 4 °C e 327 × g per 5 minuti. Aspirare il surnatante e risospendere il pellet in RP-10 a 2 × 10 6-4 × 106 cellule/ml. Aggiungere 60 μL di ciascun campione in una piastra da 96 pozzetti per colorare i tipi di cellule desiderati23 elencati al punto 7.9, Tabella 5 e Tabella 6.
- Girare la piastra a 4 °C e 327 × g per 5 minuti.
- Nel frattempo, preparare le miscele master di anticorpi, fluorescenti meno uno (FMO) e controlli monomacchia con gli anticorpi desiderati. Per colorare i leucociti polimorfonucleati (PMN), i macrofagi, i monociti, le cellule dendritiche e le cellule T, utilizzare gli anticorpi e le diluizioni finali elencati nella Tabella 5 e nella Tabella 6. Utilizzare un volume totale di 100 μL/pozzetto della miscela anticorpale. Seguire le diluizioni elencate nelle tabelle per determinare il volume appropriato della miscela master e dei singoli anticorpi necessari.
- Al termine dello spin (fase 7.8), decantare il surnatante, risospendere i pellet in 100 μL delle miscele di anticorpi, FMO o controlli monomacchia e incubare su ghiaccio per 30 minuti al buio.
- Lavare le celle 2 volte aggiungendo 150 μL di tampone FACS ai pozzetti e ruotando la piastra a 4 °C e 327 × g per 5 minuti.
- Al termine della centrifuga, decantare il surnatante, risospendere i pellet in 100 μL di tampone di fissazione e incubare su ghiaccio per 20 minuti.
- Lavare le celle 2 volte aggiungendo 150 μL di tampone FACS ai pozzetti e ruotando la piastra a 4 °C e 327 × g per 5 minuti.
- Preparare tubi FACS marcati con 200 μL di tampone FACS. Risospendere i pellet in 150 μL di tampone FACS. Filtrare individualmente ogni campione nella provetta FACS corrispondente utilizzando un filtro da 100 μm. Conservare sul ghiaccio o a 4 °C e al riparo dalla luce fino al momento dell'analisi.
- Analizzare le cellule utilizzando un citometro a flusso.
8. Saggio della placca per l'enumerazione dell'IAV
- Preparare il supporto richiesto come segue:
- Preparare il terreno di infezione sciogliendo 2,5 g di sieroalbumina bovina (BSA) in 40 mL di DMEM agitando a 37 °C per 10-20 minuti fino alla dissoluzione. Filtrare-sterilizzare in 460 mL di DMEM.
- Preparare il 2,4% di cellulosa microcristallina sciogliendo 1,2 mg di cellulosa microcristallina in 50 ml di H2O. Autoclave sull'impostazione del liquido e conservare a temperatura ambiente.
- Preparare il 5% di BSA DMEM sciogliendo 2,5 g di BSA in 40 mL di DMEM agitando a 37°C per 10-20 minuti. Aggiungere i restanti 10 ml di DMEM per un volume finale di 50 ml. Filtrare-sterilizzare e conservare a 4 °C.
- Preparare 2x MEM/0,5% BSA mescolando 1 mL di 5% BSA DMEM con 9 mL di 2x MEM.
- Preparare un mezzo di sovrapposizione a bassa viscosità mescolando un rapporto 1:1 di cellulosa microcristallina al 2,4% e 2x MEM/0,5% BSA con 1 mg/mL di TPCK (inibitore della chimotripsina) tripsina.
- Preparare EMEM/10% FBS mescolando 450 mL di Eagle's Minimum Essential Medium (EMEM) con 50 mL di FBS termoattivato.
- Coltivare la linea cellulare del rene canino Madin-Darby (MDCK). Aggiungere le cellule di un flaconcino acquistato a 5 ml di EMEM/10% FBS in un matraccio trattato con coltura tissutale T-25. Incubare per 3-5 giorni a 37 °C/5% CO2 fino a quando le cellule raggiungono il 100% di confluenza. Verificare la confluenza come al punto 2.3.
- Rimuovere ed eliminare il terreno di coltura e risciacquare 2 volte con 5 ml di PBS a temperatura ambiente. Aggiungere 1 mL di tripsina-EDTA al matraccio e incubare a 37 °C/ 5% CO2 per 10-15 minuti fino al distacco delle cellule. Una volta sollevato, neutralizzare con 4mL di EMEM/10% FBS per ottenere una sospensione cellulare a 2 × 105 cellule/mL.
- Seminare le cellule MDCK in una piastra trattata con coltura tissutale a 12 pozzetti aggiungendo 1 ml di cellule risospese per pozzetto (a 2 × 105 cellule / pozzetto) 1 giorno prima di iniziare il test della placca.
NOTA: Assicurarsi che le cellule raggiungano il 100% di confluenza prima dell'uso e incubano più a lungo se necessario per raggiungere la confluenza. - Per l'uso come standard, effettuare diluizioni seriali 10 volte (106-10 1) di stock IAV (di un titolo noto) nel mezzo di infezione elencato al punto 8.1.1. Produrre 1,2 ml di ogni diluizione per testare in triplice copia.
- Scongelare l'organo omogenea sul ghiaccio. Girare su una centrifuga da tavolo a 2.000 × g e raccogliere il surnatante chiaro.
- Ripetere il passaggio 8.5 ma con il surnatante dei campioni nel punto 8.6.
- Aspirare il mezzo dalle cellule e lavare 2 volte con 1 mL di PBS per rimuovere tutto l'FBS.
- Aggiungere 300 μL di ogni diluizione standard o campione diluito in serie delicatamente lungo il lato di ciascun pozzetto, iniziando dalla diluizione più alta fino alla più bassa, e farlo in triplice copia.
- Posizionare le piastre nell'incubatore a 37 °C/5% CO2, agitando la piastra ogni 10 minuti per un totale di 50 minuti. Assicurati di posizionarli piatti nell'incubatrice e non impilarli.
- Dopo i 50 minuti, lavare le celle 2x con 1 mL di PBS.
- Aggiungere 2 mL del mezzo di rivestimento a bassa viscosità in ciascun pozzetto ad eccezione dei pozzetti a più bassa diluizione e senza virus; A quelli, aggiungi mezzo di infezione e tripsina.
- Riposizionare la piastra nell'incubatore a 37 °C/5% CO 2 per2-4 giorni per ottenere placche visualizzabili ad occhio nudo.
- Lavare le piastre aggiungendo 2 ml di PBS in ciascun pozzetto velocemente dal lato e agitare delicatamente per sospendere il mezzo di sovrapposizione a bassa viscosità depositato.
- Scartare l'intero volume di liquido nel pozzetto rimuovendo delicatamente il fluido.
- Ripetere il lavaggio ancora una volta con 2 ml di PBS in ciascun pozzetto, quindi eliminare l'intero volume di liquido mediante pipettaggio delicato.
- Per fissare le placche, aggiungere 500 μL di paraformaldeide al 4% in ciascun pozzetto, agitare e lasciare riposare per 30 minuti.
- Lavare lentamente lungo il lato con 1 mL di PBS; Quindi, scartare delicatamente il liquido.
- Aggiungere 500 μL di viola cristallino all'1% (diluito in acqua) in ciascun pozzetto per coprire il monostrato cellulare. Incubare per 5 min.
- Lavare con 1 mL di acqua di rubinetto. Assicurarsi di gettare tutto il liquido nel pozzetto mediante pipettaggio delicato. Metti il piatto capovolto su un pannolino per asciugarlo durante la notte.
- Conta visivamente le targhe e salva le immagini su qualsiasi imager disponibile.
Risultati
S. pneumoniae coltivato con biofilm (Figura 1A) è stato utilizzato per infettare i topi (Figura 1B) utilizzando un piccolo inoculo da 10 μL somministrato per via intranasale a topi non anestetizzati. Questo inoculo di piccolo volume si traduce in un trasporto pneumococcico coerente limitato al rinofaringe (Figura 2A, gruppi +sp) evitando la diffusione sistemica (Figura 2B, C, gruppi +sp). Due giorni dopo l'inoculazione intranasale, i topi sono stati infettati da un virus dell'influenza A H1N1 adattato alle urine A/PR/8/34 (IAV)22,30 somministrato sia per via intranasale che intratracheale per ottenere una consegna coerente di quantità specifiche al rinofaringe e ai polmoni 23.
Qui, il modello è stato utilizzato per confrontare il decorso della malattia a seguito di infezione virale in topi sfidati per via intranasale con diversi ceppi di S. pneumoniae, tra cui TIGR4 e D39, che sono ceppi invasivi che provocano polmonite che progredisce in batteriemia, e EF3030, che è un ceppo di otite media 21,24,25,26,31. La presentazione della malattia nei topi co-infetti da S. pneumoniae/IAV dipendeva dal ceppo batterico (Figura 2). Mentre non vi era alcuna differenza significativa nel numero batterico del rinofaringe (Figura 2A) tra nessuno dei ceppi, S. pneumoniae TIGR4 e D39, ma non EF3030, si sono diffusi ai polmoni entro 48 ore dopo l'infezione IAV (Figura 2B). Il quaranta percento dei topi infettati per via intranasale con S. pneumoniae TIGR4 ha mostrato disseminazione batterica ai polmoni, e di questi, la metà di loro è diventata batterica (Figura 2C), coerentemente con i risultati precedenti23.
I topi infettati per via intranasale con S. pneumoniae D39 hanno mostrato una disseminazione più efficiente, perché la diffusione ai polmoni è stata osservata nel 100% dei topi co-infetti (Figura 2B). Simile a S. pneumoniae TIGR4, la metà di quelli ha sperimentato batteriemia (Figura 2C). Nel tracciare la sopravvivenza globale, indipendentemente dal ceppo batterico, il tasso di sopravvivenza dei topi co-infetti era significativamente inferiore rispetto ai topi singolarmente sfidati con S. pneumoniae da solo per tutti i ceppi testati (Figura 2D). Rispetto ai topi di controllo sfidati con IAV da solo, i topi infettati per via intranasale con S. pneumoniae TIGR4 e D39, ma non EF3030, hanno mostrato tassi accelerati di malattia. Al giorno 2 dopo l'infezione da IAV, il 30% (D39) e il 20% (TIGR4) dei topi avevano ceduto, mentre i gruppi di controllo solo IAV non hanno iniziato a soccombere fino al giorno 5 dopo la sfida (Figura 2D). I topi co-infettati con S. pneumoniae EF3030 e IAV avevano sintomi ritardati, più simili ai controlli solo IAV (Figura 2D). Questi risultati dimostrano che il modello di co-infezione provoca la malattia in giovani topi sani che è dipendente dal ceppo batterico, il che lo rende ideale per esplorare i fattori batterici richiesti in ogni fase della progressione della malattia.
Questo modello è stato utilizzato per valutare la presenza di varie cellule immunitarie nei polmoni (tipi di cellule e strategia di gating in Figura 3) a seguito di infezione da IAV in topi inoculati per via intranasale con diversi ceppi di S. pneumoniae. I ceppi batterici D39 e TIGR4, che si sono dispersi nei polmoni dopo l'infezione da IAV, hanno provocato un aumento significativo al di sopra del basale (non infetti) nell'afflusso di cellule immunitarie infiammatorie dalla circolazione, come neutrofili (PMN) e monociti, mentre EF3030 non lo ha fatto (Figura 4A-C). L'infezione da IAV da sola ha provocato un aumento significativo al di sopra del basale nell'afflusso di cellule immunitarie importanti per la difesa dell'ospite contro l'infezione virale, come le cellule NK e le cellule T gamma-delta (Figura 4A-C). Queste risposte antivirali sono state significativamente attenuate nei topi infettati per via intranasale da S. pneumoniae prima della sfida virale (Figura 4A-C). Ciò è coerente con studi precedenti che valutavano le risposte delle citochine che hanno scoperto che il trasporto di S. pneumoniae attenuava la produzione di interferoni di tipo I e comprometteva la capacità dell'ospite di controllare i carichi IAV nei polmoni23. Questi risultati dimostrano che il modello di co-infezione può essere utilizzato per studiare come le risposte immunitarie cambiano nelle infezioni mono rispetto a quelle polimicrobiche.
Questo modello è stato utilizzato anche per valutare l'effetto dell'invecchiamento sul decorso della malattia a seguito di infezione da IAV in topi infettati per via intranasale con S. pneumoniae TIGR4. Nei topi infettati singolarmente, i titoli virali non variavano tra le coorti giovani e anziane (Figura 5A)23. Come negli studi precedenti23, i topi anziani hanno mostrato segni di malattia più precoci e significativamente più gravi rispetto alle loro controparti giovani, come dimostrato dai punteggi clinici più elevati (Figura 5B). Coerentemente con i sintomi della malattia, i topi anziani inoculati con S. pneumoniae hanno iniziato a morire più velocemente entro 24 ore dall'infezione IAV e tutti hanno ceduto alla malattia, mentre i giovani controlli sono sopravvissuti all'infezione con un tasso significativamente più alto (33%) (Figura 5C). Questi risultati dimostrano che il modello di co-infezione può essere utilizzato per rilevare la malattia più grave negli ospiti vulnerabili, rendendolo ideale per esplorare i fattori dell'ospite che conferiscono resistenza o suscettibilità alla co-infezione.
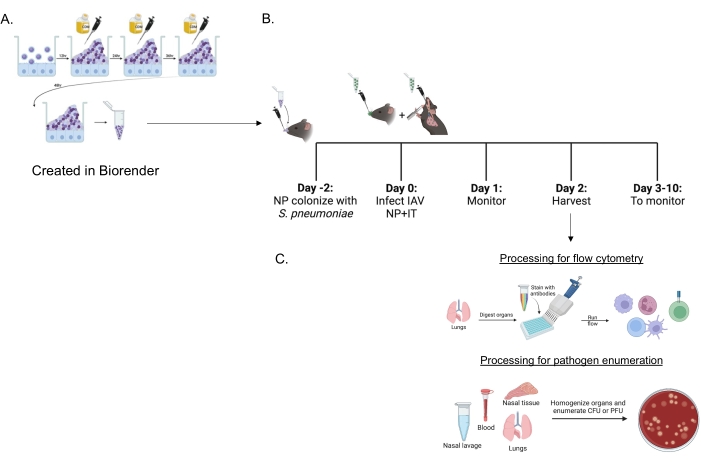
Figura 1: Cronologia della co-infezione e del trattamento degli organi per la valutazione dell'afflusso di cellule immunitarie e del carico patogeno . (A) Streptococcus pneumoniae sono coltivati in biofilm. (B) I topi vengono inoculati per via intranasale con 5 × 106 CFU del ceppo indicato di S. pneumoniae coltivato con biofilm per stabilire il trasporto nasofaringeo o non trattati. Quarantotto ore dopo, i topi vengono fintamente trattati con PBS o ricevono 200 PFU del virus dell'influenza A PR8 per via intranasale e 20 PFU per via intratracheale. I topi vengono monitorati nel tempo per i punteggi clinici della malattia e la sopravvivenza. (C) A 48 ore dopo l'infezione da IAV, vengono valutati i CFU batterici o i PFU virali nei diversi organi o l'afflusso di cellule immunitarie nei polmoni. Abbreviazioni: CFU = unità formanti colonie; PFU = unità formanti placca; IAV = virus dell'influenza A PR8; IT = intratrachealmente; NP = nasofaringea. Fare clic qui per visualizzare una versione ingrandita di questa figura.
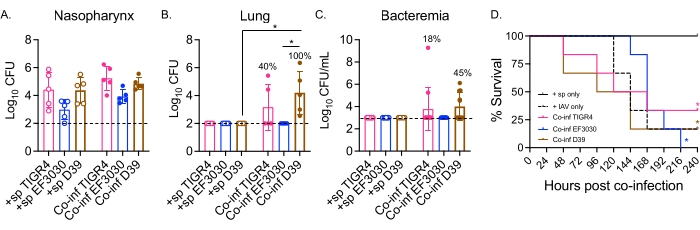
Figura 2: La doppia infezione da IAV intranasale/intratracheale di topi inoculati da S. pneumoniae porta alla diffusione batterica e alla malattia che dipende dal ceppo batterico. I topi maschi C57BL/6 (B6) giovani (10-12 settimane) sono stati infettati come nella Figura 1. I numeri batterici nel rinofaringe (A), nei polmoni (B) e nel sangue (C) sono stati tutti determinati a 48 ore dopo l'infezione IAV. (B,C) Le percentuali indicano la frazione di topi che hanno mostrato diffusione. (D) La sopravvivenza è stata monitorata per 10 giorni dopo l'infezione da IAV. Vengono mostrati i dati aggregati di (A,B) n = 5, (C) n = 11 e (D) n = 6 topi per gruppo. Ogni cerchio corrisponde a un mouse e le linee tratteggiate indicano il limite di rilevamento. (A-C) *, indica una differenza significativa (p < 0,05) tra i gruppi indicati come determinato dal test di Kruskal-Wallis. (D) *, indica una differenza significativa (p < 0,05) tra topi +sp e Co-inf per ceppo batterico come determinato dal test log-rank (Mantel-Cox). Abbreviazioni: +sp = topi infettati per via intranasale con batteri utilizzando solo il ceppo indicato; Co-inf = topi infetti da batteri che sono stati infettati da IAV; IAV = topi che hanno ricevuto il virus dell'influenza A; CFU = unità formanti colonie. Fare clic qui per visualizzare una versione ingrandita di questa figura.
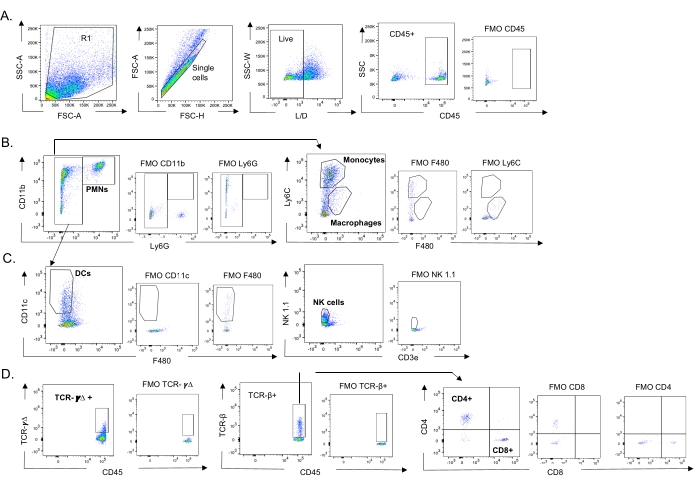
Figura 3: Strategia di gating delle cellule immunitarie. I polmoni sono stati raccolti e l'afflusso di cellule immunitarie è stato determinato mediante citometria a flusso. Viene mostrata la strategia di gating rappresentativa dei diversi tipi di cellula. (A) CD45+, singole cellule vive sono state controllate e le percentuali di (B) PMN (Ly6G+, CD11b+), macrofagi (Ly6G-, Ly6C-, F480+) e monociti (Ly6G-, Ly6C+), (C) DC (Ly6G-, CD11c+) e cellule NK (NK1.1+, CD3-), (D) TCR- γΔ e CD8 (CD8+, TCRβ+) e CD4 (CD4+, TCRβ+ ) Sono state determinate le cellule T. Abbreviazioni: SSC-A = area laterale scatter-peak; FSC-A = area di picco di dispersione in avanti; FSC-H = altezza del picco di dispersione in avanti; SSC-W = larghezza del picco di dispersione laterale; L/D = vivi/morti; FMO = fluorescente meno uno; NK = natural killer; PMN = leucocita polimorfonucleato; DC = cellula dendritica; TCR = Recettore delle cellule T. Fare clic qui per visualizzare una versione ingrandita di questa figura.
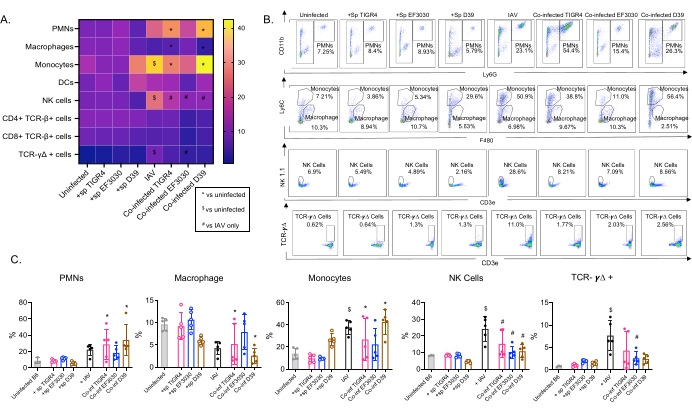
Figura 4: Le risposte immunitarie polmonari sono dipendenti dal ceppo batterico. I topi maschi C57BL / 6 giovani (10-12 settimane) non erano infetti, inoculati singolarmente con il ceppo indicato di Streptococcus pneumoniae (+sp), singolarmente sfidati con IAV (IAV) o co-infettati con S. pneumoniae e IAV (Co-inf). Quarantotto ore dopo l'infezione da IAV (vedi il disegno sperimentale in Figura 1), i polmoni sono stati raccolti e l'afflusso di cellule immunitarie è stato determinato mediante citometria a flusso seguendo la strategia di gating in Figura 3. (A) Le percentuali medie di ciascun tipo di cellula indicato all'interno del gate CD45 sono visualizzate per tutti i gruppi di trattamento sulla mappa di calore. (B) Per ciascun gruppo di topi sono mostrati grafici a punti rappresentativi di tipi di cellule che hanno mostrato differenze significative tra i trattamenti. (C) Sono indicate le percentuali dei tipi di cellule immunitarie indicate. Ogni cerchio corrisponde a un mouse. (A,C) Vengono mostrati i dati aggregati di n = 5 topi per gruppo. *, indica una differenza significativa (p < 0,05) tra Co-inf e non infetti; $, indica un significativo tra IAV e non infetti; #, indica una differenza significativa tra Co-inf e IAV da solo. Le differenze significative tra i gruppi di sfida per ciascun tipo di cellula sono state determinate da ANOVA seguito dal test di Tukey. Abbreviazioni: NK = natural killer; PMN = leucocita polimorfonucleato; DC = cellula dendritica; TCR = recettore delle cellule T; IAV = virus dell'influenza A. Fare clic qui per visualizzare una versione ingrandita di questa figura.
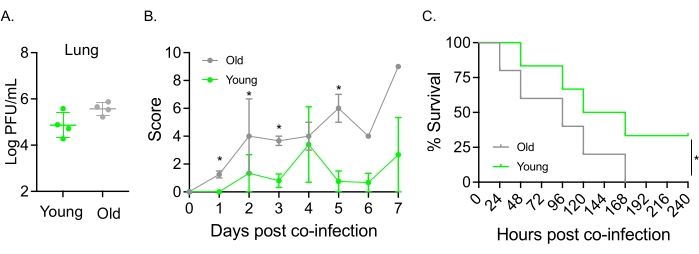
Figura 5: Invecchiamento e aumento della suscettibilità dell'ospite alla co-infezione IAV/Streptococcus pneumoniae . Topi maschi giovani (10-12 settimane) e invecchiati (21-22 mesi) C57BL/6 sono stati co-infettati con S. pneumoniae TIGR4 i.n. e IAV i.n. e i.t. (come nella Figura 1) o singolarmente sfidati con IAV da solo. (A) I titoli virali sono stati determinati 48 ore dopo. Gli asterischi indicano la significatività statistica (p < 0,05) determinata dal test t dello studente. I dati sono raggruppati da n = 4 topi per gruppo. (B) Il punteggio clinico e (C) la sopravvivenza sono stati monitorati nel tempo. (B) Viene mostrata la media ± SEM aggregati da n = 6 topi per gruppo. Gli asterischi indicano la significatività statistica (p < 0,05) tra i topi giovani e quelli anziani al punto temporale indicato, come determinato dal test di Mann-Whitney. (C) I dati sono raggruppati da n = 6 topi per gruppo. Gli asterischi indicano la significatività statistica (p < 0,05) tra topi giovani e vecchi come determinato dal test log-rank (Mantel-Cox). Abbreviazioni: IAV = virus dell'influenza A; i.n. = per via intranasale; i.t. = intratrachealmente; SEM = errore standard della media. La Figura 5A è ristampata con il permesso di Joma et al.23. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Mix I stock per CDM | |
| Adenina | 0,1 g |
| D-Alanina | 0,25 g |
| CaCl2 Anidra | 0,025 g |
| Solfato di manganese | 0,03 g |
| Cianocobalamina | 100 μL di 10 mg/mL di brodo |
| Acido para-aminobenzoico | 400 μL di 5 mg/mL di brodo |
| Piridossamina 2HCl | 100 μL di 10 mg/mL di brodo |
| Stock Mix II per CDM | |
| Guanina | 0,05 g |
| Uracile | 0,05 g |
| Stock Mix III per CDM | |
| Nitrato ferrico 9H2O | 50 mg/ml |
| Solfato ferrico 7H2O | 10 mg/ml |
| Mix IV stock per CDM | |
| Beta-nicotinammide adenina dinucleotide | 25 mg/ml |
Tabella 1: Mix I, II, III e IV stock di CDM. Abbreviazione: CDM = mezzi chimicamente definiti.
| Mix di vitamine per CDM | |
| Piridossale cloridrato | 0,8 g |
| Tiamina Cl2 | 0,4 g |
| Riboflavina | 0,4 g |
| Ca-pantotenato | 0,4 g |
| Biotina | 0,04 g |
| Acido folico | 0,4 g |
| Niacinamide | 0,4 g |
Tabella 2: Mix di vitamine per CDM. Abbreviazione: CDM = mezzi chimicamente definiti.
| Stock di aminoacidi per CDM | |
| L-Alanina | 0,480 g |
| L-arginina | 0,250 g |
| L-Asparagina | 0,700 g |
| Acido L-aspartico | 0,600 g |
| L-cisteina | 1.000 g |
| L-cistina | 0,100 g |
| Acido L-glutammico | 0,200 g |
| L-Glutammina | 0,780 g |
| L-glicina | 0,350 g |
| L-istidina | 0,300 g |
| L-Isoleucina | 0,430 g |
| L-Leucina | 0,950 g |
| L-lisina | 0,880 g |
| L-Metionina | 0,250 g |
| L-Fenilalanina | 0,550 g |
| L-Prolina | 1,350 g |
| L-Serina | 0,680 g |
| L-Treonina | 0,450 g |
| L-triptofano | 0,100 g |
| L-Valina | 0,650 g |
Tabella 3: Stock di aminoacidi per CDM. Abbreviazione: CDM = mezzi chimicamente definiti.
| Starter Stock per CDM | |
| Destrosio | 1,0 g |
| Solfato di magnesio-7-idrato | 0,070 g |
| Potassio fosfato bibasico | 0,02 g |
| Fosfato di potassio monobasico | 0,1 g |
| Acetato di sodio anidro | 0,45 g |
| Bicarbonato di sodio | 0,25 g |
| Sodio fosfato bibasico | 0,735 g |
| Sodio fosfato monobasico | 0,32 g |
| Supplementi finali per CDM | |
| Cloruro di colina | 0,1 g |
| L-cisteina HCl | 0,075 g |
| Bicarbonato di sodio | 0,25 g |
Tabella 4: Starter stock e supplementi finali per CDM. Abbreviazione: CDM = mezzi chimicamente definiti.
| Anticorpo/Fluoroforo | Clone | Fattore di diluizione |
| L/D per l'eccitazione UV | N/D | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b APC | M1/70 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| Mouse Fc Block | 2,4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | AL-21 · | 0.25 |
| CD103 BV 421 | M290 · | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
Tabella 5: Pannello anticorpali 1.
| Anticorpo/Fluoroforo | Clone | Fattore di diluizione |
| L/D per l'eccitazione UV | N/D | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (Blu Pacifico) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| Mouse Fc Block | 2,4G2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 · | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
Tabella 6: Pannello anticorpali 2.
Discussione
La maggior parte degli studi sperimentali esistenti sulla co-infezione S. pneumoniae/IAV si basano sulla consegna batterica nei polmoni di topi pre-infettati da IAV. Questi modelli hanno contribuito a identificare i cambiamenti nell'ambiente polmonare e nella risposta immunitaria sistemica che rendono l'ospite suscettibile all'infezione batterica secondaria 15,16,17,32,33,34,35,36,37. Tuttavia, questi modelli non sono riusciti a imitare la transizione di S. pneumoniae da un colonizzatore asintomatico a un agente patogeno in grado di causare gravi infezioni polmonari e sistemiche. Inoltre, questi modelli non sono adatti per studiare i fattori dell'ospite e le interazioni ospite-patogeno nel tratto respiratorio superiore che contribuiscono alla suscettibilità alle infezioni. Un modello precedente per il movimento degli pneumococchi dal rinofaringe al polmone dopo l'infezione da IAV si basava sull'infezione batterica del rinofaringe seguita da infezione virale. Tuttavia, non è riuscito a riprodurre i gravi segni di malattia osservati nei pazienti umani21. Il modello di infezione murina modificato qui descritto ricapitola la transizione di S. pneumoniae da trasporto asintomatico a un patogeno che causa gravi malattie cliniche.
Un passo fondamentale di questo modello è stabilire l'infezione da S. pneumoniae nel rinofaringe. Streptococcus pneumoniae forma biofilm e colonizza il rinofaringe a diverse efficienze 21,38. Per stabilire un'infezione consistente, sono necessari almeno 5 × 106 CFU dei ceppi batterici cresciuti in biofilm finora testati23. Si raccomanda che qualsiasi nuovo ceppo batterico sia testato per l'infezione stabile del rinofaringe prima dell'infezione virale. Per la co-infezione virale, studi precedenti hanno scoperto che l'infezione intranasale con IAV è necessaria per la dispersione dei batteri dal rinofaringe21,22,23. In questi studi precedenti, sono stati utilizzati 500 PFU di IAV per la consegna intranasale, mentre in questo studio, 200 PFU erano sufficienti per aumentare il numero di batteri nel rinofaringe. L'infezione da IAV non è limitata alle vie aeree superiori e può diffondersi ai polmoni39,40, che è la chiave per rendere l'ambiente polmonare più permissivo per l'infezione batterica15,16,41. La consegna di IAV ai polmoni può essere ottenuta mediante somministrazione intranasale o installazione intratracheale di topi anestetizzati. Precedenti lavori con topi BALB / cByJ hanno scoperto che la consegna intranasale provoca polmonite virale21; tuttavia, l'accesso dell'inoculo ai polmoni dopo l'inoculazione intranasale è più limitato nei topi C57BL/6. Nei topi C57BL/6, l'installazione intratracheale è necessaria per una consegna coerente del virus23. In questo modello, la precedente colonizzazione batterica accelera la presentazione dei sintomi della malattia dopo l'infezione virale23. Poiché l'infezione virale può essa stessa causare sintomi di malattia con potenziale variazione della cinetica, si raccomanda di testare prima una gamma di dosi per ogni nuovo ceppo virale testato e scegliere una dose che riveli una cinetica accelerata negli ospiti co-infetti.
I polmoni forniscono un'altra lettura critica per la valutazione della malattia in questo modello. Per la valutazione del carico patogeno e dell'afflusso di cellule immunitarie, è possibile utilizzare un polmone dello stesso topo. Tuttavia, poiché la gravità dell'infezione e dell'infiammazione può differire tra i lobi, si raccomanda di non prendere diversi lobi dello stesso polmone per le varie valutazioni. Piuttosto, tutti i lobi possono essere tritati in piccoli pezzi, mescolati bene insieme e quindi analizzati ugualmente per le diverse valutazioni. Allo stesso modo, il rinofaringe può essere utilizzato per l'enumerazione di CFU batterico o PFU virale e risposta immunitaria. Tuttavia, il numero di cellule ottenute dai lavaggi e dai tessuti è troppo basso per eseguire la citometria a flusso senza raggruppare i campioni dai topi all'interno dello stesso gruppo. In alternativa, l'infiammazione nel rinofaringe può essere valutata istologicamente23.
Una caratteristica critica di questo modello è che ricapitola la malattia clinica osservata nei pazienti. Nell'uomo, la polmonite da pneumococco secondaria a seguito di infezione da IAV spesso provoca evidenti segni di malattia, tra cui tosse, dispnea, febbre e dolori muscolari che possono portare a ricoveri ospedalieri, insufficienza respiratoria e persino morte 8,15,42,43. Questo modello riassume i gravi segni di malattia clinica osservati negli esseri umani in termini di difficoltà respiratoria (riflessa nel punteggio di respirazione) e malessere generale (riflesso nei punteggi di postura e movimento) mostrati dai topi, nonché la morte in alcuni dei controlli giovani sani. I sintomi esacerbati della malattia nei topi co-infetti sono probabilmente il risultato sia della diffusione batterica ai polmoni che della compromissione della clearance virale nei topi con trasporto pneumococcico23. Una limitazione del modello è che l'incidenza della malattia clinica e della disseminazione batterica dal rinofaringe varia tra i topi ed è influenzata dal ceppo batterico, dall'età dell'ospite e dal genotipo21,22,23. Riflettendo questo, per i ceppi invasivi, la progressione dall'infezione localizzata (senza batteriemia rilevabile) alla morte può avvenire entro 24 ore. Pertanto, per una vera valutazione della diffusione sistemica, la batteriemia deve essere seguita a intervalli più brevi (ogni 6-12 ore). Allo stesso modo, il punteggio della malattia può cambiare rapidamente, in particolare nelle prime 72 ore successive alla co-infezione. Pertanto, per monitorare da vicino i sintomi della malattia, è consigliabile monitorare i topi tre volte al giorno per i giorni 1-3 dopo l'infezione da IAV.
In sintesi, questo modello replica il movimento di S. pneumoniae da un colonizzatore asintomatico del rinofaringe a un patogeno in grado di causare malattie polmonari e sistemiche in seguito all'infezione da IAV. In questo modello, IAV innesca la transizione di S. pneumoniae modificando il comportamento batterico nel rinofaringe, aumentando la diffusione batterica al polmone e alterando l'immunità antibatterica23. Allo stesso modo, il trasporto batterico attenua le risposte immunitarie antivirali e altera la clearance IAV dai polmoni23. Ciò rende questo modello ideale per analizzare i cambiamenti nelle risposte immunitarie nelle infezioni singole rispetto a quelle polimicrobiche. Inoltre, il decorso della malattia dopo la co-infezione dipende, in parte, dal ceppo di pneumococchi presente nel rinofaringe. Pertanto, il modello è adatto a sezionare i fattori batterici necessari per la colonizzazione asintomatica rispetto alla transizione patogena di S. pneumoniae. Infine, questo modello riproduce la suscettibilità dell'invecchiamento alle co-infezioni e, sebbene questo non sia stato testato qui, può essere facilmente utilizzato per valutare l'impatto del background dell'ospite sul decorso della malattia. In conclusione, separare il trasporto e la malattia in fasi distinte offre l'opportunità di analizzare le varianti genetiche sia dei patogeni che dell'ospite, consentendo l'esame dettagliato delle interazioni di un importante patobionte con l'ospite nelle diverse fasi della progressione della malattia. Andando avanti, questo modello può essere utilizzato per personalizzare le opzioni di trattamento per gli ospiti vulnerabili.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Vorremmo ringraziare Nick Lenhard per la lettura critica e l'editing di questo manoscritto. Vorremmo anche ringraziare Andrew Camilli e Anthony Campagnari per i ceppi batterici e Bruce Davidson per i ceppi virali. Questo lavoro è stato sostenuto dal National Institute of Health Grant (R21AG071268-01) a J.L. e dal National Institute of Health Grants (R21AI145370-01A1), (R01AG068568-01A1), (R21AG071268-01) a E.N.B.G.
Materiali
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
Riferimenti
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon