このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
圧力過負荷誘発心肥大をモデル化するためのOリング大動脈バンディングと従来の横大動脈狭窄の比較
要約
本プロトコールは、圧力過負荷心肥大を誘発するマウスにおける大動脈バンディングの新しい技術を記載する。バンディングには、内径が固定されたゴムリングが使用されます。この新しい手法は、将来の実験のために分散が少なく、再現性の高いデータを約束します。
要約
マウスの大動脈バンディングは、心圧過負荷誘発性心肥大および心不全の誘発に最も一般的に使用される実験モデルの1つです。以前に使用された技術は、狭窄を引き起こすために鈍い27Gの針の上に結ばれた大動脈弓の周りのねじ付き縫合糸に基づいています。この方法は、外科医が手動で糸を締めることに依存し、したがって、直径サイズの大きな変動をもたらす。Mellebyらによって記述された新しく洗練された方法は、手術後の変動が少なく、再現性が高いことを約束します。新しい技術であるOリング大動脈バンディング(ORAB)は、糸付きの縫合糸の代わりに滑り止めのゴムリングを使用しているため、圧力過負荷の変動が減少し、心肥大の再現可能な表現型が得られます。手術中、Oリングは腕頭動脈と左頸動脈の間に配置されます。成功した狭窄は心エコー検査によって確認されます。1日後、リングを正しく配置すると、Oリング誘発狭窄に対する横行大動脈の流速が増加します。2週間後、駆出率の低下と壁の厚さの増加によって心機能障害が証明されます。重要なことに、直径サイズのばらつきが少ないことに加えて、ORABは横行大動脈狭窄(TAC)と比較して術中および術後の死亡率が低いことに関連しています。したがって、ORABは、一般的に使用されているTAC手術よりも優れた方法であり、より再現性の高い結果をもたらし、必要な動物の数を減らすことができます。
概要
生理的心肥大は発達、運動、妊娠中に観察できますが、病的心肥大は動脈性高血圧、心臓弁膜症、遺伝子変異などの血行動態ストレス状態に反応します。最初に、心臓は、心筋細胞サイズの増加と心室壁の肥厚を特徴とするリモデリングを受け、心機能を維持します1,2。一方、病的心臓リモデリングは、不整脈、突然死、および高い死亡率のリスクの増加と関連しています。最後に、時間の経過とともに、心室拡張、収縮機能の大幅な低下、そして最終的には心不全(HF)への進行をもたらし、これは高い罹患率、死亡率、および社会的コストに関連しています3。したがって、新しい治療戦略を開発するためには、分子背景を理解することが急務である4。
大動脈バンディングは、マウス5において圧力過負荷誘発性左心室(LV)肥大および心不全を模倣するモデルである。この方法を用いることにより、生体内の圧力過負荷誘発心臓リモデリングの病態メカニズムを調べることができる。マウスにおける最初の大動脈バンディング手順は、Rockmanらによって報告された6。圧力過負荷は、大動脈の周り(腕頭動脈と左総頸動脈の間)の糸縫合ベースの結紮によって誘発されます。直径0.4 mmの狭窄を作成するには、27 Gの針と大動脈の周りに縫合糸を配置します。結紮後、針を取り外し6,7。
針の直径は固定されていますが、糸の締め付けは外科医に大きく依存しているため、誘発された心肥大の表現型に影響を与えます。さらに、糸/縫合ベースの方法では、手術後の狭窄直径の程度が変動し、死亡率の分散が大きい8,9。さらに、この方法のトレーニングは、特に糸を締める際の適切なレベルと一貫性を見つけることに関して、困難です。最後に、訓練の開始時に、大動脈の破壊または他の組織損傷による術中および術後の高い死亡率、ならびに生存動物における狭窄の程度における高い変動が起こる。
最近、大動脈バンディングの最適化された手順がMellebyらによって記述されました10。内径0.71mm、0.66mm、0.61mmに固定された滑り止めゴム製Oリングを用いて、狭窄のばらつきが少なく、圧力過負荷の再現性が高いORAB(Oリング大動脈バンディング)法を発表した。要するに、Oリングは切り開かれ、上行アーチの周りに置かれ、そして糸によって再び閉じられる。これらのOリングを使用している他の科学者は、誘発された心肥大の変動性が少ないと報告しました9。彼らはまた、術中および術後の死亡率、ならびに誘発された肥大表現型の再現性の向上と変動の減少を観察しました9,11。本稿では、この独自の戦略の手順を段階的なプロトコルで説明します。このレポートで共有されている専門知識は、他の科学者がこの分野での技術を向上させるのに役立ちます。
6週間後に心不全を引き起こす心肥大を誘発するために、12週齢のC57BL / 6N雄マウスが手術に推奨されます。マウス亜系統C57BL / 6NとC57BL / 6Jの間の大動脈バンディングの2週間後の比較は、C57BL / 6Nマウスで重度の心機能障害と関連する死亡率の増加を示しました。したがって、これらは心不全のモデルにより適しています12。12週齢のオスとメスのマウスは、大動脈の露出と特別な器具によるOリングの配置に最適なサイズを持っています。
プロトコル
動物実験は、地域委員会(シュレースヴィヒ・ホルシュタイン州エネルギー大臣、ラントヴィルトシャフト、環世界、シュレースヴィヒ・ホルシュタイン州自然・デジタル協会、許可番号:V242-21249/2020 [38-4/20])の原則に基づいて実施されました。本研究に用いたマウスは、市販の供給源から入手した( 資料表参照)。動物を12時間の光、12時間の夜間サイクルで標準的な条件下で飼育した。水と食べ物は 自由に提供されました。
1.動物の世話
- 寝具、巣作り材料、隠れ場所、飲料水や食物への適切なアクセスを備えた特殊なケージにマウスを収容します。
- 動物を継続的に専門の獣医管理と治療下に置いてください。
注意: 外部サプライヤーから注文されたマウスの場合、手順を開始する前に7日間の順応を確認してください。
2. Oリングの準備
注:2週間後に心肥大を誘発するには、直径0.4mmの固定Oリングが推奨されます。誘発される心臓表現型の程度および重症度は、Oリング直径の大きさに依存する。
- まず、顕微鏡下でOリング( 材料表を参照)をハサミまたはメスで1回切断し、大動脈の周りに配置できるようにします(図1A、B)。
- 8-0で接続された針でカットに近い各リング側を突き刺します非吸収性の縫合糸と糸を引っ張ります。片側を2〜3 cm、反対側に2 cmカットして残し、最後のステップで大動脈の周りにOリングを固定します(図1C、D)。
- 手術の前に、結紮補助具(種の器具、 材料の表を参照)を取り、片方のリング側の糸の端(長く保たれている)をくびれの穴に通します(図1E、F)。Oリングが取り付けられたライゲーションエイドを、次のステップ(ステップ6)に配置するために脇に置きます。
- 糸でリングを消毒するには、リングをアルコール溶液に30分間入れます。その後、セルロースの上に置いて乾かします。使用するまで、乾燥したリングを密閉された浴槽またはケースに保管してください。手術中、結紮補助具を通して糸を引っ張った後、使用するまでリングをきれいな面に置きます。
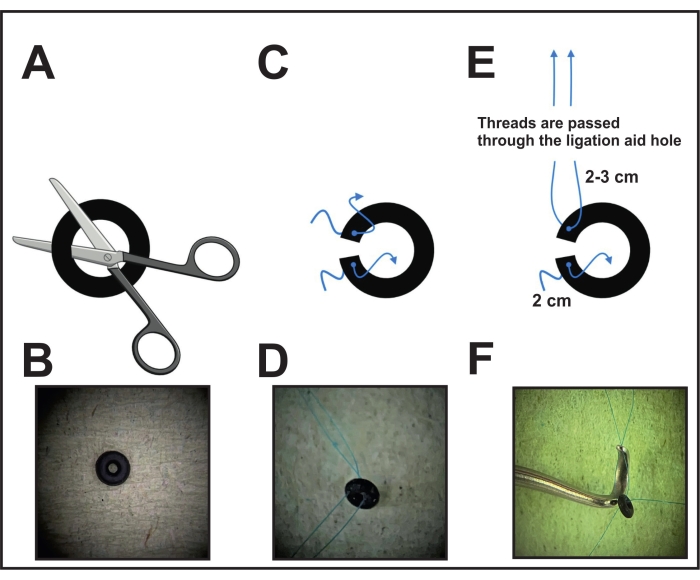
図1:結紮のためのOリング調製を行う 。 (A)直径が固定されたOリングを片面をハサミまたはメスで切断します。(B)Oリングの画像。(C)各Oリング側に8-0が突き刺さっていますプロレンスレッド。(D)2本の糸で穴を開けたOリング。(E)Oリングの片方のリング側のねじ山をライゲーションエイドの穴に通します。(F)配置前の最終位置:片側の糸はライゲーションエイドの穴を通して配置され、反対側の糸は緩んだままになります。 この図の拡大版を表示するには、ここをクリックしてください。
3.マウスの前投薬と手術野の準備
- 手術中に十分な鎮痛を受けるには、手術に進む20分前に鎮痛剤ブプレノルフィン(0.1 mg / kg、 材料表を参照)を腹腔内に注射します。
注:本研究では、鎮痛剤は、実験動物科学協会(GV-SOLAS)の推奨に従って使用されました。 - 前投薬後、マウスを誘導チャンバーで麻酔し、2%〜4%イソフルランを0.5〜1.0 L / minの100%O2と混合します。
- 鎮静マウスの左胸部の毛皮を剃ります。剃毛後、マウスをイソフルラン充填チャンバーに戻し、十分な鎮静を待ってから動物に挿管します。
注:鎮静の適切な時点は、ゆっくりとした呼吸を示しますが、スナップ呼吸を回避します。イソフルランガスの設定に応じて、適切なレベルの鎮静を達成するのに2〜3分かかります。 - 動物の体温(37°C)を維持するために、手術前に加熱パッドをオンにします。加熱パッドを直腸プローブ( 材料表を参照)に接続して、マウスの体温を自動的に維持します。
4.マウスの挿管
- 必要な機器を準備します(図2A)。手術前に喉頭鏡をアルコールに約1〜3分間入れてから、一晩乾燥させて消毒します。
- 加熱パッドの周りに輪ゴムを伸ばして、前歯をプレートに固定します。鎮静マウスを仰臥位の加熱パッドに置きます。
- 動物の前歯の上に輪ゴムを置き、プレートの首を伸ばします。
- 気管内挿管のための気管の開口部の視認性を高めるために、光源を喉に焦点を合わせます(図2B)。
- 挿管補助具(手作りの喉頭鏡、 資料表を参照)を片手でそっと口を開けます(図2A[3])。
- もう一方の手と小さな鉗子で、舌をそっと動かして気管の開口部をきれいにします。
- この手を使用して、気管内チューブを気管に導入します。一方、挿管補助剤をまだ保持します。挿管には、22 Gのカニューレを使用します( 材料表を参照)(図2A[1])。
- 気管内チューブの位置を3方向活栓 を介して マウスの人工呼吸器( 材料の表を参照)に接続し、正しい気管内チューブの位置(気管内)を確認します。
- 製造元の指示に従って、適切な換気を監視します(一回換気量200μL、呼吸数100〜150呼吸/分)(図2C)。
- 足指挟み反射チェックで十分な麻酔深度を確認(反射反応なし)。
- 麻酔設定を0.5-1.0 L / min 100%O 2と混合した2%イソフルランに変えます。
- 手術中の乾燥を避けるために、眼科用軟膏を目に塗ります。
- 綿棒を使用して、市販の消毒液で手術部位を3回消毒します( 材料の表を参照)。
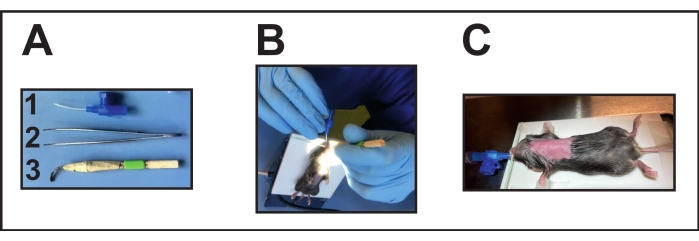
図2:マウスの挿管。 (A)挿管器具: (1)22 G i.v.カニューレは気管内チューブとして使用されます(マンダリンなし)。(2)鉗子;(3)手作りの喉頭鏡(変形/平らにしたカニューレを木の棒とテープで接着)。(B)配置された加熱パッドに挿管を行う。(C)人工呼吸器に接続された挿管マウス。 この図の拡大版を表示するには、ここをクリックしてください。
5.手術とリングポジショニングの準備
注意: 感染を避けるために、滅菌材料と器具を使用してください。
- はさみを使用して、剣状突起と左腋窩の間の線の中央に長さ0.5〜1 cmの皮膚切開を行います。鉗子を使用して筋肉層を下にある肋骨から分離し、2つの開創器(長さ5 mm、 材料の表を参照)を切開部に配置して胸郭を露出させます。
- 左開胸術を開始するには、マイクロスプリングハサミを使用して、第2肋骨と第3肋骨の間の肋間筋を小さく切開(~1〜2 mm)します。胸腔を開き、45°の角度の鉗子で切開を広げます。
- 胸部開創器(長さ1.0〜2.5 mm)を3つ切開部に配置し、胸腔を開き、視覚化を改善します。
- 大動脈弓を露出させるには、胸腺と脂肪組織を持ち上げて、細い先端の45°の角度の鉗子で胸腺と脂肪組織をアーチからそっと分離してみてください。
6.横行大動脈とOリングの結紮
- 片手で45°の角度の鉗子で大動脈弓を露出させます。位置は、他方の手で、片側の糸 を介して 結紮助剤と接続されたOリングである(ステップ2)。
- 大動脈弓の下の結紮補助具を使用して、腕頭動脈と左総頸動脈の間の横大動脈の尾側から頭蓋側に糸を通します(図3A)。
- 結紮補助具と大動脈弓の間の両方の糸を鉗子で慎重に取ります。結紮補助具を引っ込めて取り外し、両側のねじ山を引っ張って、Oリングをアーチの周りにそっと配置します(図3B)。
- 位置決めが成功したら、Oリングを糸と外科用結び目で固定します。両側の結び目が開かないように、追加の結び目を作成します(図3C)。
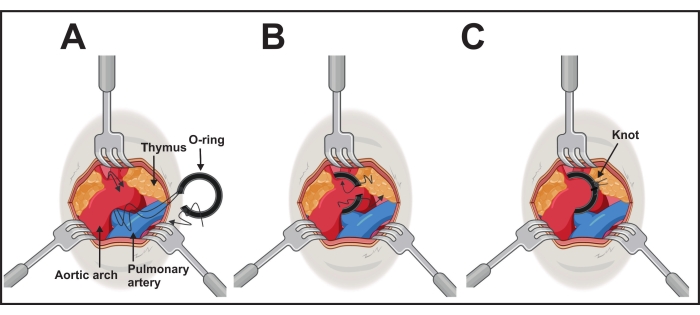
図3:Oリング移植を行う 。 (A)大動脈弓は、1.0〜2.5mmの3つの開創器によって露出している。片方のリング側の両方の長い糸が大動脈の下を通過します。(B)Oリングは、リングをそっと押して糸を引っ張ることによって配置されます。(C)Oリングは正しい位置にあり、1本の頭蓋糸が両側に尾糸で結ばれています。 この図の拡大版を表示するには、ここをクリックしてください。
7.縫合と術後の回復
- 3つの胸部開創器(長さ2.5 mm)を切開部から取り外します。
- 必要に応じて、温かい0.9%等張塩溶液で胸郭を満たすことにより、胸部から残留空気を除去します。
- 縫合のために胸郭切開部を露出させるには、再び2つの開創器(長さ5 mm)を取り、皮膚を側面に保持します。
- 2つまたは3つの6-0非吸収性縫合糸( 材料の表を参照)で胸部を閉じ、人工呼吸器の流出を2秒間つまんで肺を再膨張させます。
- 2つの開創器を取り外し、3〜5本の4-0-吸収性縫合糸で皮膚を閉じます。
- イソフルランとモニターをオフにします。動物が自己呼吸を始め、ひげが動いていて、つま先のつまみ反射が引き起こされると、マウスを抜管します。ケアユニットのヒートランプの下の左側にマウスを置き、完全に目覚めるまで観察します。
- 十分な意識を取り戻すまで、動物を放置しないでください。
注:手術を受けた動物は、より良い回復のために独自のケアユニット(ケージ)を取得する必要があります。 - 必要に応じて、飲料水中のトラマドール(1 mg / mL)を7日間、ブプレノルフィン(0.1 mg / kg、1日3回)を腹腔内注射で必要に応じて3日間疼痛管理します。.
注:術後鎮痛については、地元の動物倫理委員会の推奨事項に従ってください。 - 毎日水筒の重さを量って薬をチェックし、動物の行動を観察します。
8.リングのくびれと正しい位置の確認
- 手術の1日後、狭窄の最大流速を測定し、超音波を使用して狭窄を確認します。
- 測定には、超音波システムと周波数30 MHzのトランスデューサープローブを備えた心エコー検査を使用します(材料の表を参照)。
- 上記のように、1.5%〜2%イソフルランのマスクを使用して麻酔を維持し、0.5〜1.0 L / minの100%O2を使用します。
- 麻酔をかけた動物を仰臥位の加熱パッドに置きます。加熱パッドを直腸プローブに接続して体温を37°C±1°Cに維持し、4つのマウス足センサーを使用してECGで心拍数を監視します( 資料表を参照)。
- より良い視覚化のために、脱毛クリームを使用してください。
- ORABが正常に実行されると、超音波(~2,400 mm / s)で測定された狭窄上の流速が増加します(図4C)。この測定では、トランスデューサーヘッドを右胸郭側に傍胸部に配置し、2次元(2D)イメージング(「Bモード」)によって大動脈弓を局在化させます。
- カラードップラーを使用して大動脈の血流を視覚化し、狭窄上の血流速度をパルス波ドップラーで測定します。
注:偽手術マウス(狭窄のない対照手術)は、~600-900 mm / sの血流速度を示します。さらに、ORABが成功すると、マウスの右頸動脈(~150 mm/s)(RC、図 4A)と左頸動脈(~300 mm/s)LC、図4B)の速度流量比も増加します。
- カラードップラーを使用して大動脈の血流を視覚化し、狭窄上の血流速度をパルス波ドップラーで測定します。
- 左右の動脈内動脈を2次元(2D)イメージング(Bモード)で可視化します。探触子ヘッドを首の左右に45°の角度で水平に配置し、パルス波ドップラーを使用して血流速度を決定します。
注:偽手術マウスでは、両方の動脈の速度の流れは似ています。
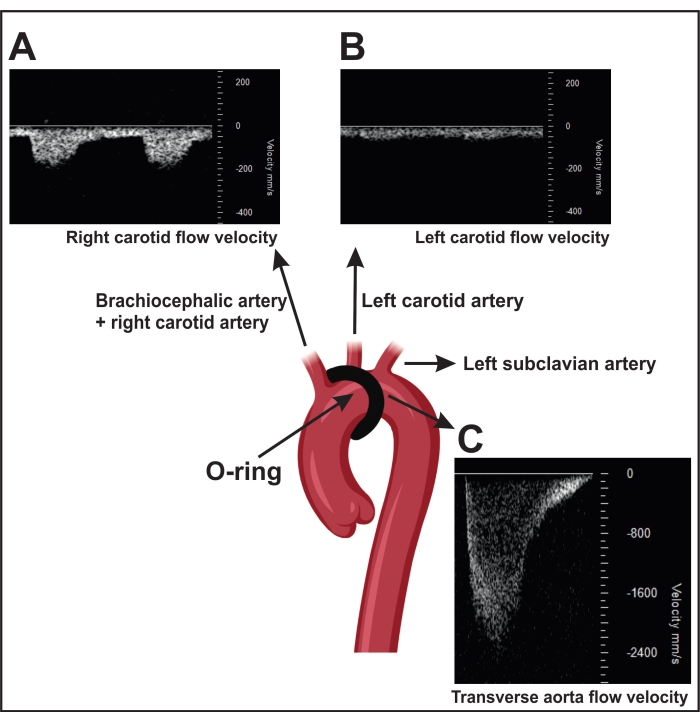
図4:頸動脈における脈波ドップラー速度測定による横行大動脈結紮の確認 。 (a)右頸動脈の代表的なパルス波ドップラー速度信号。(B)狭窄により、右頸動脈は左頸動脈よりも流速が速くなります。(C)狭窄によって誘発される狭窄は、下行大動脈の流速が2,400mm/sを超える結果となる。偽マウスは600-900 mm / sの流速を示します。 この図の拡大版を表示するには、ここをクリックしてください。
結果
一般に、大動脈バンディングはヒトの大動脈弁狭窄症を模倣し、マウスに心肥大を誘発する。成功した手順は、心肥大と心機能の低下に反映される心臓組織のリモデリングによって特徴付けられます5,6。
手術後1日目に直接、横行大動脈のOリング狭窄の影響は、心エコー検査13によってin vivoで判定する?...
ディスカッション
糸/縫合ベースの大動脈バンディングは、マウスの圧力過負荷心肥大を誘発するために長年使用されてきました。生体内での心臓リモデリングや疾患進行の病態メカニズムを調べるための確立された方法です 。 制限は、狭窄の程度の比較的高い分散であり、その結果、リモデリングです。Mellebyらによって最初に記述された最近導入されたORAB技術は10 、ゴム製のOリン?...
開示事項
著者は開示するものは何もありません。
謝辞
この作業は、ドイツ連邦共和国(BMBF)からL.L.、N.F.、O.J.M.(IVOLADMT-HF;FKZ 01KC2006A)。
資料
| Name | Company | Catalog Number | Comments |
| 1 x long Fixators, 6 cm | 18200-01 | ||
| 2 x Blunt Retractors, 5 mm wide | 18200-11 | ||
| 2 x Short Fixators, 3 cm | 18200-02 | ||
| 2 x fine tip 45° angled forceps | FST (fine sience tools) | 11160-10 | |
| 3 x Blunt Retractors, 2.5 mm wide | 18200-10 | ||
| 3 x Retractor Wires | 18200-05 | ||
| 4-0 absorbable suture (Vicryl) | ETHICON | SABBKLT0 | Used to suture skin |
| 6-0 suture (Prolene), needle size:13 mm | ETHICON | JDP879 | Used to suture chest muscle |
| 8-0 suture (Prolene), needle size: 6.5 mm | ETHICON | RHBECH | Used to fast the Ring |
| Anesthetizing Box, Small | Havard apparatus | 50-0108 | |
| C57BL/6N mice | Charles River | ||
| Fluosorber Activated Charcoal Filter Canister | Havard apparatus | 34-0415 | Used to induce and maintain anesthesia |
| Handmade laryngsopcope | Intubationshelp | ||
| Harvard Apparatus Anesthetic Vaporizer | Havard apparatus | Used to induce and maintain anesthesia | |
| Heating pad + rectal probe (LSI Letica Scientific Instruments:Temperature control unit HB 101/2 ) | Panlab/ Havard apparatus | Used to control and maintain body temperature | |
| i.v. cannula blue 22-gauge (Vasofix Braunüle 0.9 x 25 mm) | B/Braunsharing Expertise | 4268091B | intubation |
| isofluran | Baxter | Anesthesia | |
| Kodan (betadine solution) | Schülke | 20003960-A | Desinfection |
| ligation aid | FST (fine sience tools) | 18062-12 | Used to perform liagtion with O-ring |
| Microscope Lighting: Schott VisiLED Set MC1500/S80-55 (+ controller) | SCHOTT | Ligth | |
| Microscope camera (Leica IC80 HD) | Leica | Used for visualiation operating field | |
| MiniVac Complete Anesthesia Systems for small rodents | Havard apparatus | 75-0233 | Used to induce and maintain anesthesia |
| Mouse Ventilator MiniVent Type 845 | Havard Apparatus | 73-0044 | Used to ventilation during surgery |
| Needle holder | FST (fine sience tools) | TE-10804 | |
| O-ring, non-slip rubber (0.0018 mm x 0.020 mm) | Apple Rubber Products | Liagtion of the aortic arch | |
| Scissors | FST (fine sience tools) | 14040-09 | Used to cut the skin and threads |
| Small Animal Retraction System (Kit for Animals up to 200 g) | FST (fine sience tools) | 18200-20 | |
| Small Base Plate, 20 x 30 cm | 18200-03 | ||
| Table intgerated with heating pad + rectal probe + ECG and transducer tripod | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Temgesic (Buprenorphin) | Indivior UK Limited | 997.00.00 | Pain pre-medication |
| three-way stop cock (blue) | |||
| Tramal (Tamadol) | Grünental | Pain post-medication | |
| transducer probe MS400 (Visual Sonics) | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Ultrasound system with cardioligy package | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST (fine sience tools) | 15000-08 | Used to cut intercostal chest muscle |
| vet ointment | Bepanten | Used to prevent eyes from drying out |
参考文献
- Frey, N., Olson, E. N. Cardiac hypertrophy: The good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Bui, A. L., Horwich, T. B., Fonarow, G. C. Epidemiology and risk profile of heart failure. Nature Reviews Cardiology. 8 (1), 30-41 (2011).
- Bolli, R. New initiatives to improve the rigor and reproducibility of articles published in Circulation Research. Circulation Research. 121 (5), 472-479 (2017).
- Dunlay, S. M., Weston, S. A., Jacobsen, S. J., Roger, V. L. Risk factors for heart failure: A population-based case-control study. The American Journal of Medicine. 122 (11), 1023-1028 (2009).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Circulation Research. 115 (13), 1838-1849 (2019).
- Rockman, H. A., et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8277-8281 (1991).
- Hu, P., et al. Minimally invasive aortic banding in mice: effects of altered cardiomyocyte insulin signaling during pressure overload. American Journal of Physiology-Heart and Circulatory Physiology. 285 (3), 1261-1269 (2003).
- Mohammed, S. F., et al. Variable phenotype in murine transverse aortic constriction. Cardiovascular Pathology. 21 (3), 188-198 (2012).
- Nakao, Y., et al. O-ring-induced transverse aortic constriction (OTAC) is a new simple method to develop cardiac hypertrophy and heart failure in mice. Scientific Reports. 12, 85 (2022).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Garcia-Menendez, L., Karamanlidis, G., Kolwicz, S., Tian, R. Substrain specific response to cardiac pressure overload in C57BL/6 mice. American Journal of Physiology-Heart and Circulatory Physiology. 305 (3), 397-402 (2013).
- deAlmeida, A. C., van Oort, R. J., Wehrens, X. H. Transverse aortic constriction in mice. Journal of Visualized Experiments. (38), e1729 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved