Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Уплотнительное кольцо аортального бандажа в сравнении с традиционным поперечным сужением аорты для моделирования гипертрофии сердца, вызванной перегрузкой давления
В этой статье
Резюме
Настоящий протокол описывает новую технику полосирования аорты у мышей, чтобы вызвать перегрузку давлением сердечной гипертрофии. Для обвязки используется резиновое кольцо с фиксированным внутренним диаметром. Этот новый метод обещает меньшую дисперсию и более воспроизводимые данные для будущих экспериментов.
Аннотация
Полосатость аорты у мышей является одной из наиболее часто используемых экспериментальных моделей гипертрофии сердца, вызванной перегрузкой сердечного давления, и индукции сердечной недостаточности. Ранее используемая техника основана на резьбовом шве вокруг дуги аорты, перевязанной поверх притупленной иглы 27 G для создания стеноза. Этот метод зависит от того, вручную ли хирург затягивает нить и, таким образом, приводит к высокой дисперсии в размере диаметра. Недавно усовершенствованный метод, описанный Melleby et al., обещает меньшую дисперсию и большую воспроизводимость после операции. Новая методика, уплотнительное кольцо-аортальное бандажирование (ORAB), использует нескользящее резиновое кольцо вместо шва с резьбой, что приводит к уменьшению вариации перегрузки давлением и воспроизводимым фенотипам гипертрофии сердца. Во время операции уплотнительное кольцо помещается между брахиоцефальной и левой сонной артериями. Успешное сужение подтверждается эхокардиографией. Через 1 день правильное размещение кольца приводит к увеличению скорости потока в поперечной аорте по сравнению со стенозом, вызванным уплотнительным кольцом. Через 2 недели нарушение сердечной функции подтверждается уменьшением фракции выброса и увеличением толщины стенки. Важно отметить, что помимо меньшей дисперсии в размере диаметра, ORAB связан с более низкими показателями внутри- и послеоперационной смертности по сравнению с поперечным сужением аорты (TAC). Таким образом, ORAB представляет собой превосходный метод по сравнению с широко используемой хирургией TAC, что приводит к более воспроизводимым результатам и возможному сокращению количества необходимых животных.
Введение
В то время как физиологическая гипертрофия сердца может наблюдаться во время развития, физических упражнений и беременности, патологическая гипертрофия сердца реагирует на гемодинамические стрессовые состояния, такие как артериальная гипертензия, порок клапанов сердца или генные мутации. Первоначально сердце подвергается ремоделированию, характеризующемуся увеличением размера кардиомиоцитов и утолщением стенок желудочков для поддержания сердечной функции 1,2. С другой стороны, патологическое ремоделирование сердца связано с повышенным риском развития аритмии, внезапной смерти и высокой смертности. Наконец, со временем это приводит к расширению желудочков, сильному снижению сократительной функции и возможному прогрессированию сердечной недостаточности (HF), что связано с высокой заболеваемостью, смертностью и социальными издержками3. Поэтому существует острая необходимость в понимании молекулярного фона для разработки новых терапевтических стратегий4.
Полосатость аорты представляет собой модель, которая имитирует гипертрофию левого желудочка (ЛЖ), вызванную перегрузкой давления, и сердечную недостаточность у мышей5. С помощью этого метода можно исследовать патомеханизмы вызванного перегрузкой давления ремоделирования сердца in vivo. О первой процедуре полосирования аорты у мышей сообщили Rockman et al.6. Перегрузка давлением индуцируется перевязкой на основе шва нити вокруг аорты (между брахиоцефальной и левой общей сонной артерией). Для создания стеноза диаметром 0,4 мм вокруг иглы 27 Г и аорты накладывается шов. После перевязки иглу удаляют 6,7.
Несмотря на то, что диаметр иглы фиксирован, герметичность нити сильно зависит от хирурга и, следовательно, влияет на индуцированный фенотип гипертрофии сердца. Кроме того, в методе на основе резьбы/шва существует переменная степень диаметра стеноза после операции, связанная с высокой дисперсией смертности 8,9. Кроме того, обучение этому методу является сложной задачей, особенно в отношении поиска нужного уровня и последовательности в затягивании нити. Наконец, в начале обучения возникает высокая внутри- и послеоперационная смертность из-за нарушения работы аорты или другого повреждения тканей, а также высокая вариативность степени стеноза у выживших животных.
Недавно оптимизированная процедура полосирования аорты была описана Melleby et al.10. Они представили метод ORAB (уплотнительное кольцо аортальной полосы) с меньшей дисперсией в стенозе и высоковоспроизводимыми уровнями перегрузки давлением с использованием нескользящего резинового уплотнительного кольца с фиксированным внутренним диаметром 0,71 мм, 0,66 мм и 0,61 мм. Короче говоря, уплотнительное кольцо разрезается, помещается вокруг восходящей арки и снова закрывается нитями. Другие ученые, использующие эти уплотнительные кольца, сообщили о меньшей вариабельности индуцированной гипертрофии сердца9. Они также наблюдали интра- и послеоперационную смертность, а также лучшую воспроизводимость и меньшую дисперсию в индуцированном гипертрофическом фенотипе 9,11. В настоящей статье описана процедура реализации этой уникальной стратегии в пошаговом протоколе. Опыт, которым поделился в этом отчете, поможет другим ученым улучшить свои методы в этой области.
Чтобы вызвать гипертрофию сердца, приводящую к сердечной недостаточности через 6 недель, 12-недельные мыши C57BL / 6N мужского пола рекомендуются для операции. Сравнение через 2 недели после полосирования аорты между подстренами мышей C57BL/6N и C57BL/6J показало тяжелую сердечную дисфункцию и связанную с ней повышенную смертность у мышей C57BL/6N. Поэтому они лучше подходят для моделей сердечной недостаточности12. Двенадцатинедельные самцы и самки мышей имеют оптимальный размер для обнажения аорты и размещения уплотнительного кольца специальными инструментами.
протокол
Эксперименты на животных проводились в соответствии с принципами регионального комитета (Ministerium für Energiewende, Landwirtschaft, Umwelt, Natur und Digitalisierung des Landes Schleswig-Holstein, номер разрешения: V242-21249/2020 [38-4/20]). Мыши, использованные для настоящего исследования, были получены из коммерческого источника (см. Таблицу материалов). Животные содержались в стандартных условиях с 12-часовым светом, 12-часовым ночным циклом; вода и еда предлагались ad libitum.
1. Уход за животными
- Размещайте мышей в специализированных клетках с подстилкой, гнездовым материалом, укрытием и надлежащим доступом к питьевой воде и пище.
- Держите животных под постоянным специализированным ветеринарным контролем и лечением.
ПРИМЕЧАНИЕ: Для мышей, заказанных внешними поставщиками, пожалуйста, обеспечьте 7 дней акклиматизации перед началом процедуры.
2. Подготовка уплотнительного кольца
ПРИМЕЧАНИЕ: Уплотнительное кольцо с фиксированным диаметром 0,4 мм рекомендуется индуцировать гипертрофию сердца через 2 недели. Степень и тяжесть индуцированного сердечного фенотипа зависят от размера диаметра уплотнительного кольца.
- Во-первых, выполните один разрез уплотнительного кольца (см. Таблицу материалов) под микроскопом с помощью ножниц или скальпеля, чтобы обеспечить размещение вокруг аорты (рисунок 1A, B).
- Проткните каждую сторону кольца близко к разрезу иглой, соединенной с 8-0 нерассасывающийся шов и натянуть нить. Отрежьте и оставьте 2-3 см с одной стороны и 2 см с другой стороны, чтобы закрепить уплотнительное кольцо вокруг аорты на заключительном этапе (рисунок 1C, D).
- Перед операцией возьмите средство для перевязки (видовой инструмент, см. Таблицу материалов) и потяните конец нити (которая держится дольше) одной кольцевой стороны через отверстие сужения (рисунок 1E, F). Отложите средство для перевязки с прикрепленным уплотнительным кольцом в сторону для размещения на следующем этапе (шаг 6).
- Для дезинфекции кольца нитками поместите кольцо в спиртовой раствор на полчаса. После этого выложите его на целлюлозу для высыхания. Держите высушенное кольцо в закрытой ванне или футляре до использования. Во время операции, после протягивания нити через средство перевязки, поместите кольцо на чистую поверхность до использования.
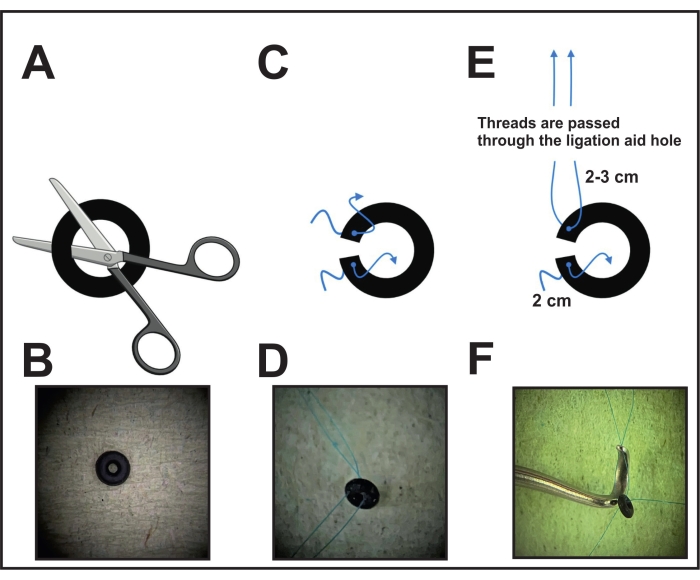
Рисунок 1: Выполнение подготовки уплотнительного кольца к перевязке. (А) Уплотнительное кольцо фиксированного диаметра разрезается ножницами или скальпелем с одной стороны. (B) Изображение уплотнительного кольца. (C) Каждая сторона уплотнительного кольца прокалывается со счетом 8-0 проленовая нить. (D) Уплотнительное кольцо, пробитое двумя нитями. (E) Нити одной кольцевой стороны уплотнительного кольца протягиваются через отверстие лигативного средства. (F) Конечное положение перед размещением: нити одной стороны помещаются через отверстие лигативного средства, в то время как нити другой стороны остаются свободными. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Премедикация мышей и подготовка операционного поля
- Чтобы получить достаточную анальгезию во время операции, вводите анальгетик бупренорфин (0,1 мг/кг, см. Таблицу материалов) внутрибрюшинно за 20 мин до начала операции.
ПРИМЕЧАНИЕ: Для настоящего исследования обезболивающее использовалось в соответствии с рекомендациями Gesellschaft für Versuchstierkunde/Общества лабораторных наук о животных (GV-SOLAS). - После премедикации обезболивают мышь в индукционной камере 2%-4% изофлураном, смешанным с 0,5-1,0 л/мин 100%O2.
- Сбрить мех на левой стороне грудной клетки успокоенной мыши. После бритья поместите мышь обратно в камеру, заполненную изофлураном, и дождитесь достаточной седации, прежде чем интубировать животное.
ПРИМЕЧАНИЕ: Правильная точка седации показывает медленное дыхание, но позволяет избежать мгновенного дыхания. В зависимости от газовой установки изофлурана для достижения нужного уровня седации требуется 2-3 мин. - Включите грелку перед операцией, чтобы поддерживать температуру тела животного (37 °C). Подключите грелку к ректальному зонду (см. Таблицу материалов) для автоматического поддержания температуры тела мыши.
4. Интубация мышей
- Подготовьте необходимые приборы (рисунок 2А). Продезинфицируйте ларингоскоп перед операцией, поместив его в спирт примерно на 1-3 минуты, а затем оставив его для высыхания на ночь.
- Растяните резинку вокруг грелки, чтобы закрепить мышь передними зубьями на пластине. Поместите седативную мышь на грелку в лежачем положении.
- Поместите резинку на передние зубы животного, чтобы вытянуть шею на пластине.
- Сфокусируйте источник света на горле для хорошей видимости отверстия трахеи для эндотрахеальной интубации (рисунок 2B).
- Осторожно откройте рот одной рукой, позиционируя вспомогательное средство для интубации (ларингоскоп ручной работы, см. Таблицу материалов) (рисунок 2A[3]).
- Другой рукой и небольшими щипцами осторожно двигайте языком, чтобы очистить отверстие трахеи.
- Используйте эту руку также для введения эндотрахеальной трубки в трахею. С другой стороны, до сих пор держат интубационную помощь. Для интубации используйте канюлю весом 22 Г (см. Таблицу материалов) (рисунок 2A[1]).
- Подключите положение эндотрахеальной трубки через трехсторонний стоп-кран к вентилятору (см. Таблицу материалов) для мышей, чтобы подтвердить правильное положение эндотрахеальной трубки (эндотрахеальной).
- Контролируйте правильную вентиляцию в соответствии с инструкциями производителя (приливный объем 200 мкл и частота дыхания между 100-150 вдохами/мин) (рисунок 2C).
- Подтвердите достаточную глубину анестезии с помощью рефлекторной проверки пальца ноги (нет рефлекторного ответа).
- Превратите анестезиологическую установку в 2% изофлуран, смешанный с 0,5-1,0 л/мин 100% O2.
- Нанесите офтальмологическую мазь на глаза, чтобы избежать сухости во время операции.
- Используя ватный тампон, продезинфицируйте область операции 3 раза коммерчески доступным дезинфицирующим раствором (см. Таблицу материалов).
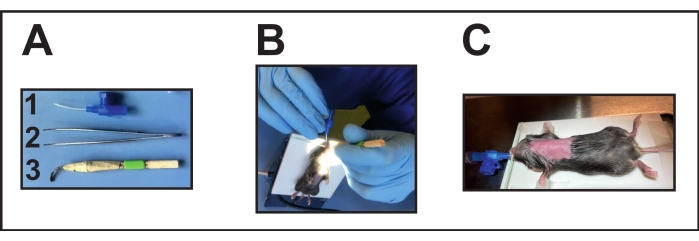
Рисунок 2: Интубация мыши. (А) Инструменты интубации: (1) В качестве эндотрахеальной трубки (без мандарина) используется канюля 22 Г и.В.; 2) щипцы; (3) Ларингоскоп ручной работы (деформированная/сплющенная канюля, склеенная деревянными палочками и лентой). (B) Выполнение интубации на расположенной грелке. (C) Интубированная мышь, подключенная к вентилятору. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Хирургия и подготовка к позиционированию кольца
ПРИМЕЧАНИЕ: Используйте стерильные материалы и инструменты, чтобы избежать инфекций.
- С помощью ножниц сделайте разрез кожи длиной 0,5-1 см в середине линии между клифовым отростком и левой подмышечной впадиной. Используйте щипцы, чтобы отделить мышечный слой от нижележащих ребер и поместить два втягивающих устройства (длиной 5 мм, см. Таблицу материалов) в разрез, чтобы обнажить грудную клетку.
- Чтобы начать левую торакотомию, выполните небольшой разрез (~1-2 мм) в межреберных мышцах между вторым и третьим ребром с помощью микропружинальных ножниц. Откройте грудную полость и распределите разрез щипцами под углом 45°.
- Поместите три ретрактора грудной клетки (длиной 1,0-2,5 мм) в разрез для открытия грудной полости для улучшения визуализации.
- Чтобы обнажить дугу аорты, попробуйте поднять вверх и аккуратно отделить тимус и жировую ткань от дуги тонким кончиком 45° угловыми щипцами.
6. Перевязка поперечной аорты уплотнительным кольцом
- Обнажите дугу аорты щипцами под углом 45° в одной руке. Поместите, с другой стороны, уплотнительное кольцо, соединенное с помощью лигирования через нити одной стороны (шаг 2).
- Пропустите нити с помощью средства перевязки под дугу аорты с каудальной стороны на черепную сторону поперечной аорты между брахиоцефальной и левой общей сонной артериями (рисунок 3А).
- Осторожно возьмите обе нити между средством перевязки и дугой аорты щипцами. Втяните и извлеките средство перевязки и аккуратно расположите уплотнительное кольцо вокруг арки, потянув резьбу с каждой стороны (рисунок 3B).
- После успешного позиционирования закрепите уплотнительное кольцо нитями и хирургическим узлом. Сделайте дополнительный, чтобы избежать вскрытия узла с каждой стороны (рисунок 3C).
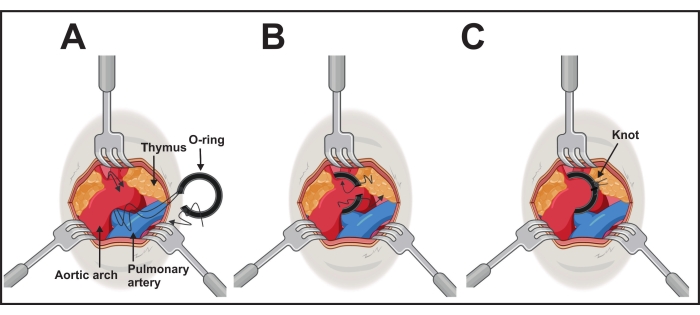
Рисунок 3: Выполнение имплантации уплотнительного кольца. (А) Дуга аорты обнажается тремя втягивающими устройствами размером 1,0-2,5 мм. Обе длинные нити одной кольцевой стороны проходят под аорту. (B) Уплотнительное кольцо будет помещено путем осторожного нажатия кольца и вытягивания резьбы. (C) Уплотнительное кольцо находится в правильном положении, и одна черепная нить завязана каудальной нитью с каждой стороны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Шов и послеоперационное восстановление
- Извлеките из разреза три ретрактора грудной клетки (длиной 2,5 мм).
- При необходимости исключите остаточный воздух из грудной клетки, заполнив ее теплым 0,9% изотоническим раствором соли.
- Чтобы обнажить разрез грудной клетки для шва, снова возьмите два втягивателя (длиной 5 мм), чтобы зажать кожу сбоку.
- Закройте грудную клетку двумя или тремя 6-0 нерассасывающимися швами (см. Таблицу материалов) и отщипните отток вентилятора на 2 с, чтобы повторно сдуть легкие.
- Удалите два втягивающих средства и закройте кожу тремя-пятью 4-0-рассасывающимися швами.
- Выключите изофлуран и монитор. Когда животное начинает самодыхать, усы двигаются, и на пальце ноги могут срабатывать рефлексы защемления, экстубировать мышь. Положите мышь с левой стороны под тепловую лампу в ее блоке ухода и наблюдайте за ней, пока она полностью не проснется.
- Не оставляйте животное без присмотра до тех пор, пока оно не придет в достаточное сознание.
ПРИМЕЧАНИЕ: Животное, перенесшее операцию, должно получить собственное отделение по уходу (клетку) для лучшего выздоровления. - Проводят лечение боли трамадолом (1 мг/мл) в питьевой воде в течение 7 дней и бупренорфином (0,1 мг/кг, 3 раза в сутки) путем внутрибрюшинной инъекции в течение 3 дней после операции, если это необходимо.
ПРИМЕЧАНИЕ: Следуйте рекомендациям местного комитета по этике животных для послеоперационного обезболивания. - Проверяйте лекарства, ежедневно взвешивая бутылки с водой и наблюдайте за поведением животного.
8. Подтверждение успешного сужения и правильного положения кольца
- Через день после операции проверьте стеноз с помощью ультразвука, измерив максимальную скорость потока над стенозом.
- Для измерений используют эхокардиографию с ультразвуковой системой и датчиком зонда с частотой 30 МГц (см. Таблицу материалов).
- Как описано выше, поддерживают анестезию с помощью маски при 1,5%-2% изофлурана с 0,5-1,0 л/мин 100%O2.
- Поместите обезболенное животное на грелку в лежачем положении. Подключите грелку с ректальным зондом для поддержания температуры тела на уровне 37 °C ± 1 °C и контролируйте частоту сердечных сокращений с помощью ЭКГ с помощью четырех датчиков лап мыши (см. Таблицу материалов).
- Для лучшей визуализации используйте крем для депиляции.
- Успешно выполненный ORAB приводит к увеличению скорости потока над стенозом, измеренной ультразвуком (~ 2 400 мм / с) (рисунок 4C). Для этого измерения расположите головку преобразователя парастернально на правой стороне грудной клетки, чтобы локализовать дугу аорты с помощью двумерной (2D) визуализации («B-режим»).
- Используйте цветной допплер для визуализации кровотока в аорте и измерения с помощью импульсной волны допплеровской скорости кровотока над стенозом.
ПРИМЕЧАНИЕ: Мыши с фиктивной операцией (контрольная операция без сужения) показывают скорость кровотока ~ 600-900 мм / с. Кроме того, успешный ORAB также приводит к увеличению скоростного расхода между правой сонной артерией (~ 150 мм / с) (RC, рисунок 4A) и левой сонной (~ 300 мм / с) LC, рисунок 4B) в мыши.
- Используйте цветной допплер для визуализации кровотока в аорте и измерения с помощью импульсной волны допплеровской скорости кровотока над стенозом.
- Визуализируйте правую и левую артерию carotis interna с помощью двумерной (2D) визуализации (B-режим). Расположите головку преобразователя горизонтально на левой и правой сторонах шеи под углом 45° и используйте импульсную волну допплера для определения скорости кровотока.
ПРИМЕЧАНИЕ: У мышей с фиктивной операцией скорость потока в обеих артериях одинакова.
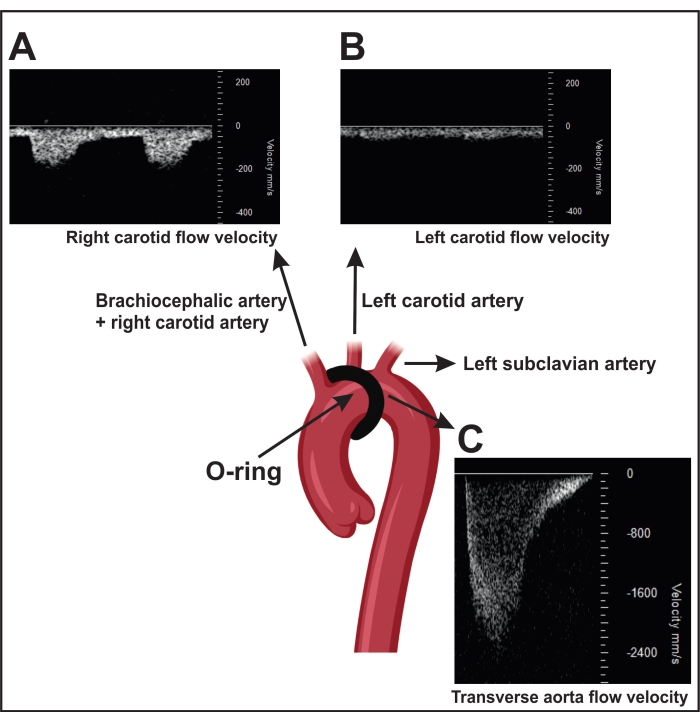
Рисунок 4: Подтверждение перевязки поперечной аорты с помощью импульсно-волнового доплеровского измерения скорости в сонных артериях. (А) Репрезентативная импульсная волна доплеровской скорости сигналов правой сонной артерии. (B) Стеноз приводит к более высокой скорости потока в правой сонной артерии, чем в левой. (C) Стеноз, вызванный сужением, приводит к скорости потока в нисходящей аорте более 2 400 мм/с. Фиктивные мыши показывают скорость потока 600-900 мм/с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Как правило, полосатость аорты имитирует стеноз аорты человека и вызывает гипертрофию сердца у мышей. Успешная процедура характеризуется ремоделированием сердечной ткани, что выражается в гипертрофии сердца и снижении функции сердца 5,6.
...
Обсуждение
Полосатость аорты на основе нитей / швов использовалась в течение многих лет, чтобы вызвать гипертрофию сердца при перегрузке давлением у мышей. Это устоявшийся метод исследования патомеханизмов ремоделирования сердца и прогрессирования заболевания in vivo. Ограничениями являются...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Bundesministerium für Bildung und Forschung (BMBF) для L.L., N.F. и O.J.M. (IVOLADMT-HF; ФКЗ 01КЦ2006А).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 x long Fixators, 6 cm | 18200-01 | ||
| 2 x Blunt Retractors, 5 mm wide | 18200-11 | ||
| 2 x Short Fixators, 3 cm | 18200-02 | ||
| 2 x fine tip 45° angled forceps | FST (fine sience tools) | 11160-10 | |
| 3 x Blunt Retractors, 2.5 mm wide | 18200-10 | ||
| 3 x Retractor Wires | 18200-05 | ||
| 4-0 absorbable suture (Vicryl) | ETHICON | SABBKLT0 | Used to suture skin |
| 6-0 suture (Prolene), needle size:13 mm | ETHICON | JDP879 | Used to suture chest muscle |
| 8-0 suture (Prolene), needle size: 6.5 mm | ETHICON | RHBECH | Used to fast the Ring |
| Anesthetizing Box, Small | Havard apparatus | 50-0108 | |
| C57BL/6N mice | Charles River | ||
| Fluosorber Activated Charcoal Filter Canister | Havard apparatus | 34-0415 | Used to induce and maintain anesthesia |
| Handmade laryngsopcope | Intubationshelp | ||
| Harvard Apparatus Anesthetic Vaporizer | Havard apparatus | Used to induce and maintain anesthesia | |
| Heating pad + rectal probe (LSI Letica Scientific Instruments:Temperature control unit HB 101/2 ) | Panlab/ Havard apparatus | Used to control and maintain body temperature | |
| i.v. cannula blue 22-gauge (Vasofix Braunüle 0.9 x 25 mm) | B/Braunsharing Expertise | 4268091B | intubation |
| isofluran | Baxter | Anesthesia | |
| Kodan (betadine solution) | Schülke | 20003960-A | Desinfection |
| ligation aid | FST (fine sience tools) | 18062-12 | Used to perform liagtion with O-ring |
| Microscope Lighting: Schott VisiLED Set MC1500/S80-55 (+ controller) | SCHOTT | Ligth | |
| Microscope camera (Leica IC80 HD) | Leica | Used for visualiation operating field | |
| MiniVac Complete Anesthesia Systems for small rodents | Havard apparatus | 75-0233 | Used to induce and maintain anesthesia |
| Mouse Ventilator MiniVent Type 845 | Havard Apparatus | 73-0044 | Used to ventilation during surgery |
| Needle holder | FST (fine sience tools) | TE-10804 | |
| O-ring, non-slip rubber (0.0018 mm x 0.020 mm) | Apple Rubber Products | Liagtion of the aortic arch | |
| Scissors | FST (fine sience tools) | 14040-09 | Used to cut the skin and threads |
| Small Animal Retraction System (Kit for Animals up to 200 g) | FST (fine sience tools) | 18200-20 | |
| Small Base Plate, 20 x 30 cm | 18200-03 | ||
| Table intgerated with heating pad + rectal probe + ECG and transducer tripod | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Temgesic (Buprenorphin) | Indivior UK Limited | 997.00.00 | Pain pre-medication |
| three-way stop cock (blue) | |||
| Tramal (Tamadol) | Grünental | Pain post-medication | |
| transducer probe MS400 (Visual Sonics) | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Ultrasound system with cardioligy package | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST (fine sience tools) | 15000-08 | Used to cut intercostal chest muscle |
| vet ointment | Bepanten | Used to prevent eyes from drying out |
Ссылки
- Frey, N., Olson, E. N. Cardiac hypertrophy: The good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Bui, A. L., Horwich, T. B., Fonarow, G. C. Epidemiology and risk profile of heart failure. Nature Reviews Cardiology. 8 (1), 30-41 (2011).
- Bolli, R. New initiatives to improve the rigor and reproducibility of articles published in Circulation Research. Circulation Research. 121 (5), 472-479 (2017).
- Dunlay, S. M., Weston, S. A., Jacobsen, S. J., Roger, V. L. Risk factors for heart failure: A population-based case-control study. The American Journal of Medicine. 122 (11), 1023-1028 (2009).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Circulation Research. 115 (13), 1838-1849 (2019).
- Rockman, H. A., et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8277-8281 (1991).
- Hu, P., et al. Minimally invasive aortic banding in mice: effects of altered cardiomyocyte insulin signaling during pressure overload. American Journal of Physiology-Heart and Circulatory Physiology. 285 (3), 1261-1269 (2003).
- Mohammed, S. F., et al. Variable phenotype in murine transverse aortic constriction. Cardiovascular Pathology. 21 (3), 188-198 (2012).
- Nakao, Y., et al. O-ring-induced transverse aortic constriction (OTAC) is a new simple method to develop cardiac hypertrophy and heart failure in mice. Scientific Reports. 12, 85 (2022).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Garcia-Menendez, L., Karamanlidis, G., Kolwicz, S., Tian, R. Substrain specific response to cardiac pressure overload in C57BL/6 mice. American Journal of Physiology-Heart and Circulatory Physiology. 305 (3), 397-402 (2013).
- deAlmeida, A. C., van Oort, R. J., Wehrens, X. H. Transverse aortic constriction in mice. Journal of Visualized Experiments. (38), e1729 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены