Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Anneaux toriques par rapport à la constriction aortique transversale traditionnelle pour la modélisation de l’hypertrophie cardiaque induite par surcharge de pression
Dans cet article
Résumé
Le présent protocole décrit une nouvelle technique de cerclage aortique chez la souris pour induire une hypertrophie cardiaque par surcharge de pression. Pour le bandage, un anneau en caoutchouc avec un diamètre intérieur fixe est utilisé. Cette nouvelle technique promet moins de variance et des données plus reproductibles pour les expériences futures.
Résumé
Le cerclage aortique chez la souris est l’un des modèles expérimentaux les plus couramment utilisés pour l’hypertrophie cardiaque induite par une surcharge de pression cardiaque et l’induction de l’insuffisance cardiaque. La technique précédemment utilisée est basée sur une suture filetée autour de l’arc aortique attachée sur une aiguille émoussée de 27 G pour créer une sténose. Cette méthode dépend du fait que le chirurgien serre manuellement le fil et, par conséquent, entraîne une grande variance de la taille du diamètre. Une méthode nouvellement affinée décrite par Melleby et al. promet moins de variance et plus de reproductibilité après la chirurgie. La nouvelle technique, le joint torique-bande aortique (ORAB), utilise un anneau en caoutchouc antidérapant au lieu d’une suture avec filetage, ce qui réduit la variation de la surcharge de pression et les phénotypes reproductibles de l’hypertrophie cardiaque. Pendant la chirurgie, le joint torique est placé entre les artères brachiocéphales et carotides gauches. Une constriction réussie est confirmée par l’échocardiographie. Après 1 jour, le placement correct de l’anneau entraîne une augmentation de la vitesse d’écoulement dans l’aorte transversale au-dessus de la sténose induite par le joint torique. Après 2 semaines, une altération de la fonction cardiaque est prouvée par une diminution de la fraction d’éjection et une augmentation de l’épaisseur de la paroi. Il est important de noter qu’en plus d’une variance moindre dans la taille du diamètre, l’ORAB est associé à des taux de mortalité per- et postopératoire plus faibles que la constriction aortique transversale (TAC). Ainsi, ORAB représente une méthode supérieure à la chirurgie TAC couramment utilisée, ce qui entraîne des résultats plus reproductibles et une réduction possible du nombre d’animaux nécessaires.
Introduction
Alors que l’hypertrophie cardiaque physiologique peut être observée pendant le développement, l’exercice et la grossesse, l’hypertrophie cardiaque pathologique répond à des conditions de stress hémodynamique telles que l’hypertension artérielle, les cardiopathies valvulaires ou les mutations génétiques. Dans un premier temps, le cœur subit un remodelage caractérisé par une augmentation de la taille des cardiomyocytes et un épaississement des parois ventriculaires pour maintenir la fonction cardiaque 1,2. D’autre part, le remodelage cardiaque pathologique est associé à un risque accru d’arythmie, de mort subite et de mortalité élevée. Enfin, avec le temps, il en résulte une dilatation ventriculaire, une forte diminution de la fonction contractile et une progression éventuelle vers l’insuffisance cardiaque (IC), qui est associée à une morbidité, une mortalité et des coûts sociétaux élevés3. Il est donc urgent de comprendre le fond moléculaire afin de développer de nouvelles stratégies thérapeutiques4.
L’anneau aortique est un modèle qui imite l’hypertrophie ventriculaire gauche (VG) induite par une surcharge de pression et l’insuffisance cardiaque chez la souris5. Avec cette méthode, il est possible d’examiner les mécanismes pathologiques du remodelage cardiaque induit par surcharge de pression in vivo. La première procédure de cerclage aortique chez la souris a été rapportée par Rockman et al.6. La surcharge de pression est induite par une ligature basée sur la suture du fil autour de l’aorte (entre l’artère carotide brachiocéphalique et l’artère carotide commune gauche). Pour créer une sténose de 0,4 mm de diamètre, une suture est placée autour d’une aiguille de 27 G et de l’aorte. Après la ligature, l’aiguille est retirée 6,7.
Même si le diamètre de l’aiguille est fixe, l’étanchéité du fil dépend fortement du chirurgien et, par conséquent, affecte le phénotype induit de l’hypertrophie cardiaque. De plus, dans la méthode à base de filetage/suture, il existe un degré variable de diamètre de sténose après la chirurgie, associé à une forte variance de la mortalité 8,9. De plus, la formation de cette méthode est difficile, en particulier pour trouver le bon niveau et la cohérence dans le serrage du fil. Enfin, au début de la formation, une mortalité per- et postopératoire élevée due à une perturbation de l’aorte ou à d’autres lésions tissulaires se produit, ainsi qu’à une forte variation de l’étendue de la sténose chez les animaux survivants.
Récemment, une procédure optimisée de cerclage aortique a été décrite par Melleby et al.10. Ils ont présenté la méthode ORAB (bande aortique du joint torique) avec moins de variance dans la sténose et des niveaux hautement reproductibles de surcharge de pression en utilisant un joint torique en caoutchouc antidérapant avec un diamètre intérieur fixe de 0,71 mm, 0,66 mm et 0,61 mm. En bref, le joint torique est ouvert, placé autour de l’arc ascendant et refermé par des fils. D’autres scientifiques utilisant ces joints toriques ont signalé moins de variabilité dans l’hypertrophie cardiaque induite9. Ils ont également observé une mortalité intra et postopératoire, ainsi qu’une meilleure reproductibilité et une moindre variance du phénotype hypertrophique induit 9,11. Le présent article décrit la procédure de cette stratégie unique dans un protocole étape par étape. L’expertise partagée dans ce rapport aidera d’autres scientifiques à améliorer leurs techniques dans ce domaine.
Pour induire une hypertrophie cardiaque entraînant une insuffisance cardiaque après 6 semaines, des souris mâles C57BL / 6N âgées de 12 semaines sont recommandées pour la chirurgie. Une comparaison 2 semaines après le bandage aortique entre les sous-souches de souris C57BL/6N et C57BL/6J a montré un dysfonctionnement cardiaque sévère et une mortalité accrue associée chez les souris C57BL/6N. Par conséquent, ceux-ci sont mieux adaptés aux modèles d’insuffisance cardiaque12. Les souris mâles et femelles âgées de douze semaines ont une taille optimale pour l’exposition de l’aorte et le placement du joint torique avec des instruments spéciaux.
Protocole
Les expérimentations animales ont été réalisées selon les principes du comité régional (Ministerium für Energiewende, Landwirtschaft, Umwelt, Natur und Digitalisierung des Landes Schleswig-Holstein, numéro d’autorisation: V242-21249/2020 [38-4/20]). Les souris utilisées pour la présente étude ont été obtenues d’une source commerciale (voir le tableau des matériaux). Les animaux ont été gardés dans des conditions standard avec un cycle de 12 h de lumière et 12 h de nuit; De l’eau et de la nourriture ont été offertes ad libitum.
1. Soins aux animaux
- Hébergez les souris dans des cages spécialisées avec de la litière, du matériel de nidification, une cachette et un accès adéquat à l’eau potable et à la nourriture.
- Garder les animaux sous contrôle et traitement vétérinaires spécialisés continus.
REMARQUE: Pour les souris commandées par des fournisseurs externes, veuillez vous assurer 7 jours d’acclimatation avant de commencer la procédure.
2. Préparation du joint torique
REMARQUE: Un joint torique d’un diamètre fixe de 0,4 mm est recommandé pour induire une hypertrophie cardiaque après 2 semaines. L’étendue et la gravité du phénotype cardiaque induit dépendent de la taille du diamètre du joint torique.
- Tout d’abord, effectuez une coupe du joint torique (voir le tableau des matériaux) au microscope à l’aide de ciseaux ou d’un scalpel pour permettre le placement autour de l’aorte (Figure 1A, B).
- Percez chaque côté de l’anneau près de la coupe avec une aiguille reliée à un 8-0 suture non résorbable et tirer le fil. Couper et laisser 2-3 cm d’un côté et 2 cm de l’autre côté pour fixer le joint torique autour de l’aorte à l’étape finale (Figure 1C, D).
- Avant la chirurgie, prenez l’aide à la ligature (instrument de l’espèce, voir le tableau des matériaux) et tirez l’extrémité du fil (qui est conservé plus longtemps) d’un côté de l’anneau à travers le trou de la constriction (Figure 1E, F). Mettez l’aide à la ligature avec le joint torique attaché de côté pour la placer à l’étape suivante (étape 6).
- Pour la désinfection de l’anneau avec les fils, placez l’anneau dans une solution d’alcool pendant une demi-heure. Ensuite, posez-le sur de la cellulose pour sécher. Conserver l’anneau séché dans une cuve ou un étui fermé jusqu’à utilisation. Pendant la chirurgie, après avoir tiré le fil à travers l’aide à la ligature, placez l’anneau sur une surface propre jusqu’à utilisation.
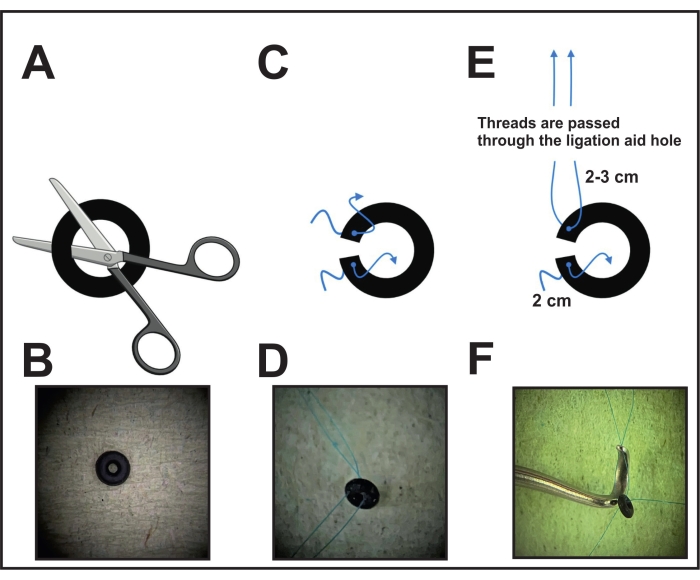
Figure 1 : Préparation du joint torique pour la ligature. (A) Un joint torique de diamètre fixe est coupé avec des ciseaux ou un scalpel sur un côté. (B) Image d’un joint torique. (C) Chaque côté du joint torique est percé d’un 8-0 fil prolène. D) Joint torique percé de deux fils. (E) Les filetages d’un côté annulaire du joint torique sont tirés à travers le trou de l’aide à la ligature. (F) Position finale avant la mise en place: les fils d’un côté sont placés à travers le trou de l’aide à la ligature, tandis que les fils de l’autre côté sont maintenus lâches. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Prémédication des souris et préparation du champ opératoire
- Pour recevoir une analgésie suffisante pendant la chirurgie, injectez l’analgésique buprénorphine (0,1 mg/kg, voir le tableau des matériaux) par voie intrapéritonéale 20 minutes avant de procéder à la chirurgie.
NOTE: Pour la présente étude, l’analgésique a été utilisé conformément aux recommandations de la Gesellschaft für Versuchstierkunde/Society of Laboratory Animal Science (GV-SOLAS). - Après prémédication, anesthésier la souris dans une chambre d’induction avec 2%-4% d’isoflurane mélangé avec 0,5-1,0 L / min de 100% O2.
- Rasez la fourrure du côté gauche du thorax de la souris sous sédation. Après le rasage, remettez la souris dans la chambre remplie d’isoflurane et attendez une sédation suffisante avant d’intuber l’animal.
REMARQUE: Le bon moment de la sédation montre une respiration lente, mais évite la respiration instantanée. Selon le réglage du gaz isoflurane, il faut 2-3 minutes pour atteindre le bon niveau de sédation. - Allumez le coussin chauffant avant la chirurgie pour maintenir la température corporelle de l’animal (37 °C). Connectez le coussin chauffant à une sonde rectale (voir le tableau des matériaux) pour maintenir automatiquement la température corporelle de la souris.
4. Intubation des souris
- Préparez les instruments requis (figure 2A). Désinfectez le laryngoscope avant la chirurgie en le plaçant dans de l’alcool pendant environ 1 à 3 minutes, puis en le conservant pour le sécher pendant la nuit.
- Étirez un élastique autour du coussin chauffant pour fixer la souris avec les dents de devant sur la plaque. Placez la souris sous sédation sur le coussin chauffant en décubitus dorsal.
- Placez l’élastique sur les dents de devant de l’animal pour étendre le cou sur la plaque.
- Focaliser une source lumineuse sur la gorge pour une bonne visibilité de l’ouverture de la trachée pour l’intubation endotrachéale (Figure 2B).
- Ouvrez doucement la bouche avec une main en positionnant un auxiliaire d’intubation (laryngoscope fait main, voir le tableau des matériaux) (figure 2A[3]).
- Avec l’autre main et de petites pinces, déplacez doucement la langue pour dégager l’ouverture de la trachée.
- Utilisez également cette main pour introduire le tube endotrachéal dans la trachée. D’autre part, tenez toujours l’aide à l’intubation. Pour l’intubation, utiliser une canule de 22 G (voir le tableau des matériaux) (figure 2A[1]).
- Reliez la position du tube endotrachéal à un ventilateur à l’aide d’un robinet d’arrêt à trois voies (voir le tableau des matériaux) pour que les souris confirment la position correcte du tube endotrachéal (endotrachéale).
- Surveiller la bonne ventilation selon les instructions du fabricant (volume courant de 200 μL et fréquence respiratoire entre 100 et 150 respirations/min) (figure 2C).
- Confirmer une profondeur anesthésique suffisante par une vérification du réflexe de pincement des orteils (pas de réponse réflexe).
- Tourner le réglage de l’anesthésie à 2% d’isoflurane mélangé avec 0,5-1,0 L / min 100% O2.
- Appliquez une pommade ophtalmique sur les yeux pour éviter la sécheresse pendant la chirurgie.
- À l’aide d’un coton-tige, désinfectez la zone de chirurgie 3 fois avec une solution désinfectante disponible dans le commerce (voir le tableau des matériaux).
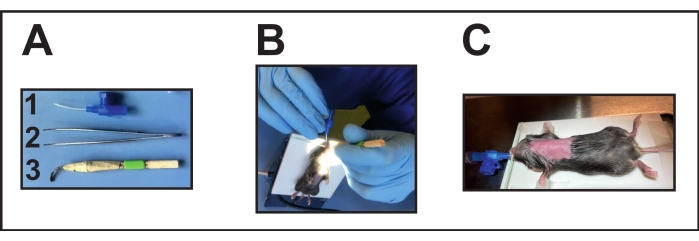
Figure 2 : Intubation de la souris. (A) Instruments d’intubation : (1) Une canule intraveineuse de 22 G est utilisée comme tube endotrachéal (sans mandarine); (2) Pinces ; (3) Laryngoscope fait main (canule déformée/aplatie collée avec des bâtons et du ruban adhésif en bois). (B) Effectuer l’intubation sur le coussin chauffant positionné. (C) Souris intubée connectée à un ventilateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Chirurgie et préparation au positionnement de l’anneau
REMARQUE : Utilisez du matériel et des instruments stériles pour éviter les infections.
- Utilisez des ciseaux pour faire une incision cutanée de 0,5 à 1 cm de long au milieu d’une ligne entre le processus xyphoïde et l’aisselle gauche. Utilisez des pinces pour séparer la couche musculaire des côtes sous-jacentes et placez deux rétracteurs (5 mm de longueur, voir le tableau des matériaux) dans l’incision pour exposer la cage thoracique.
- Pour commencer la thoracotomie gauche, effectuez une petite incision (~1-2 mm) dans les muscles intercostaux entre la deuxième et la troisième côte à l’aide de micro-ciseaux à ressort. Ouvrez la cavité thoracique et écartez l’incision avec une pince inclinée à 45°.
- Placez trois rétracteurs thoraciques (1,0-2,5 mm de longueur) dans l’incision pour ouvrir la cavité thoracique afin d’améliorer la visualisation.
- Pour exposer l’arc aortique, essayez de soulever et de séparer doucement le thymus et le tissu adipeux de l’arc avec une pince inclinée à 45°.
6. Ligature de l’aorte transversale avec le joint torique
- Exposez l’arc aortique avec une pince inclinée à 45° dans une main. Positionnez, de l’autre côté, le joint torique relié à l’aide à la ligature via les fils d’un côté (étape 2).
- Passez les fils à l’aide de l’aide à la ligature sous l’arc aortique du côté caudale au côté crânien de l’aorte transversale entre les artères carotides brachiocéphales et carotides communes gauches (Figure 3A).
- Prenez soigneusement les deux fils entre l’aide à la ligature et l’arc aortique avec la pince. Rétractez et retirez l’aide à la ligature et positionnez doucement le joint torique autour de la voûte en tirant les fils de chaque côté (Figure 3B).
- Après un positionnement réussi, fixez le joint torique avec les fils et un nœud chirurgical. Faites-en un supplémentaire pour éviter d’ouvrir le nœud de chaque côté (Figure 3C).
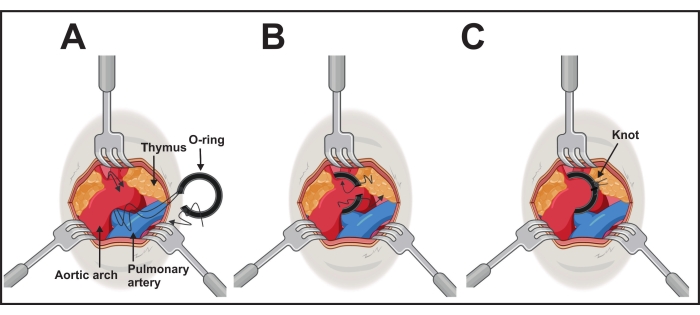
Figure 3 : Réalisation de l’implantation du joint torique. (A) L’arc aortique est exposé par trois rétracteurs de 1,0 à 2,5 mm. Les deux longs fils d’un côté annulaire sont passés sous l’aorte. (B) Le joint torique sera placé en poussant doucement l’anneau et en tirant les fils. (C) Le joint torique est dans la bonne position et un fil crânien est noué avec un fil caudal de chaque côté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Suture et récupération postopératoire
- Retirez les trois rétracteurs thoraciques (2,5 mm de longueur) de l’incision.
- Si nécessaire, éliminez l’air résiduel du thorax en le remplissant d’une solution saline isotonique chaude à 0,9%.
- Pour exposer l’incision thoracique pour la suture, prenez à nouveau deux rétracteurs (5 mm de longueur) pour maintenir la peau sur le côté.
- Fermez le thorax avec deux ou trois sutures non résorbables 6-0 (voir le tableau des matériaux) et pincez le débit sortant du ventilateur pendant 2 s pour regonfler les poumons.
- Retirez les deux rétracteurs et fermez la peau avec trois à cinq sutures résorbables 4-0.
- Éteignez l’isoflurane et surveillez. Lorsque l’animal commence à respirer lui-même, les moustaches bougent et les réflexes de pincement des orteils peuvent être déclenchés, extuber la souris. Posez la souris sur le côté gauche sous la lampe chauffante dans son unité d’entretien et observez-la jusqu’à ce qu’elle soit complètement réveillée.
- Ne laissez pas un animal sans surveillance jusqu’à ce qu’il ait repris suffisamment conscience.
REMARQUE : Un animal qui a subi une intervention chirurgicale devrait avoir sa propre unité de soins (cage) pour un meilleur rétablissement. - Effectuer la gestion de la douleur avec le tramadol (1 mg / mL) dans l’eau potable pendant 7 jours et la buprénorphine (0,1 mg / kg, 3x par jour) par injection intrapéritonéale pendant 3 jours après la chirurgie si nécessaire.
REMARQUE : Suivez les recommandations du comité local d’éthique animale pour l’analgésie postopératoire. - Vérifiez les médicaments en pesant les bouteilles d’eau tous les jours et observez le comportement de l’animal.
8. Confirmation de la constriction réussie et de la bonne position de l’anneau
- Un jour après la chirurgie, vérifier la sténose à l’aide d’une échographie en mesurant la vitesse d’écoulement maximale sur la sténose.
- Pour les mesures, utiliser l’échocardiographie avec un système à ultrasons et une sonde à transducteur d’une fréquence de 30 MHz (voir le tableau des matériaux).
- Comme décrit ci-dessus, maintenir l’anesthésie à l’aide d’un masque à 1,5%-2% d’isoflurane avec 0,5-1,0 L / min de 100% O2.
- Placez l’animal anesthésié sur le coussin chauffant en décubitus dorsal. Connectez le coussin chauffant à une sonde rectale pour maintenir la température corporelle à 37 °C ± 1 °C et surveillez la fréquence cardiaque à l’aide d’un ECG à l’aide de quatre capteurs de patte de souris (voir le tableau des matériaux).
- Pour une meilleure visualisation, utilisez une crème d’épilation.
- Un ORAB réalisé avec succès entraîne une augmentation de la vitesse d’écoulement sur la sténose mesurée par ultrasons (~ 2 400 mm / s) (Figure 4C). Pour cette mesure, positionnez la tête du transducteur parasternellement sur le côté droit du thorax pour localiser l’arc aortique par imagerie bidimensionnelle (2D) (« mode B »).
- Utilisez la couleur Doppler pour visualiser le flux sanguin dans l’aorte et mesurez avec l’onde pulsée la vitesse du flux sanguin Doppler sur la sténose.
REMARQUE: Les souris opérées par simulacre (chirurgie de contrôle sans constriction) montrent une vitesse de flux sanguin de ~600-900 mm / s. De plus, un ORAB réussi entraîne également une augmentation du rapport d’écoulement de vitesse entre la carotide droite (~150 mm/s) (RC, Figure 4A) et la carotide gauche (~300 mm/s) LC, Figure 4B) chez la souris.
- Utilisez la couleur Doppler pour visualiser le flux sanguin dans l’aorte et mesurez avec l’onde pulsée la vitesse du flux sanguin Doppler sur la sténose.
- Visualisez l’arteria carotis interne droite et gauche par imagerie bidimensionnelle (2D) (mode B). Placez la tête du transducteur horizontalement sur les côtés gauche et droit du cou à un angle de 45° et utilisez le Doppler à ondes pulsées pour déterminer la vitesse du flux sanguin.
REMARQUE: Chez les souris opérées de manière simulée, le flux de vitesse dans les deux artères est similaire.
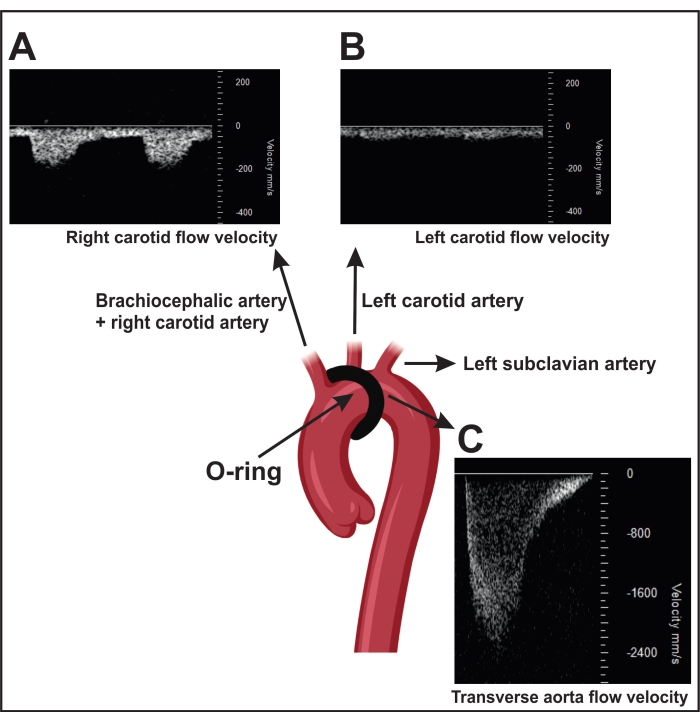
Figure 4 : Confirmation de la ligature transversale de l’aorte à l’aide de la mesure de la vitesse Doppler à ondes de pouls dans les artères carotides. (A) Signaux représentatifs de vitesse Doppler à ondes pulsées de l’artère carotide droite. (B) La sténose entraîne une vitesse d’écoulement plus élevée dans l’artère carotide droite que dans la gauche. (C) La sténose induite par la constriction entraîne une vitesse d’écoulement dans l’aorte descendante de plus de 2 400 mm/s. Les souris fictives montrent une vitesse d’écoulement de 600 à 900 mm/s. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Généralement, les bandes aortiques imitent la sténose aortique humaine et induisent une hypertrophie cardiaque chez la souris. Une procédure réussie est caractérisée par un remodelage du tissu cardiaque reflété par une hypertrophie cardiaque et une fonction cardiaque réduite 5,6.
Directement 1 jour après l’opération, l’effet de la constriction du joint torique de l’aorte transversale peut être déterminé in vivo...
Discussion
La bande aortique filetée/suture est utilisée depuis de nombreuses années pour induire une hypertrophie cardiaque par surcharge de pression chez la souris. Il s’agit d’une méthode établie pour étudier les mécanismes pathologiques du remodelage cardiaque et de la progression de la maladie in vivo. Les limites sont la variance relativement élevée du degré de sténose et, par conséquent, le remodelage. La technique ORAB récemment introduite décrite pour la première fois par Melleby et
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Bundesministerium für Bildung und Forschung (BMBF) à L.L., N.F., et O.J.M. (IVOLADMT-HF; FKZ 01KC2006A).
matériels
| Name | Company | Catalog Number | Comments |
| 1 x long Fixators, 6 cm | 18200-01 | ||
| 2 x Blunt Retractors, 5 mm wide | 18200-11 | ||
| 2 x Short Fixators, 3 cm | 18200-02 | ||
| 2 x fine tip 45° angled forceps | FST (fine sience tools) | 11160-10 | |
| 3 x Blunt Retractors, 2.5 mm wide | 18200-10 | ||
| 3 x Retractor Wires | 18200-05 | ||
| 4-0 absorbable suture (Vicryl) | ETHICON | SABBKLT0 | Used to suture skin |
| 6-0 suture (Prolene), needle size:13 mm | ETHICON | JDP879 | Used to suture chest muscle |
| 8-0 suture (Prolene), needle size: 6.5 mm | ETHICON | RHBECH | Used to fast the Ring |
| Anesthetizing Box, Small | Havard apparatus | 50-0108 | |
| C57BL/6N mice | Charles River | ||
| Fluosorber Activated Charcoal Filter Canister | Havard apparatus | 34-0415 | Used to induce and maintain anesthesia |
| Handmade laryngsopcope | Intubationshelp | ||
| Harvard Apparatus Anesthetic Vaporizer | Havard apparatus | Used to induce and maintain anesthesia | |
| Heating pad + rectal probe (LSI Letica Scientific Instruments:Temperature control unit HB 101/2 ) | Panlab/ Havard apparatus | Used to control and maintain body temperature | |
| i.v. cannula blue 22-gauge (Vasofix Braunüle 0.9 x 25 mm) | B/Braunsharing Expertise | 4268091B | intubation |
| isofluran | Baxter | Anesthesia | |
| Kodan (betadine solution) | Schülke | 20003960-A | Desinfection |
| ligation aid | FST (fine sience tools) | 18062-12 | Used to perform liagtion with O-ring |
| Microscope Lighting: Schott VisiLED Set MC1500/S80-55 (+ controller) | SCHOTT | Ligth | |
| Microscope camera (Leica IC80 HD) | Leica | Used for visualiation operating field | |
| MiniVac Complete Anesthesia Systems for small rodents | Havard apparatus | 75-0233 | Used to induce and maintain anesthesia |
| Mouse Ventilator MiniVent Type 845 | Havard Apparatus | 73-0044 | Used to ventilation during surgery |
| Needle holder | FST (fine sience tools) | TE-10804 | |
| O-ring, non-slip rubber (0.0018 mm x 0.020 mm) | Apple Rubber Products | Liagtion of the aortic arch | |
| Scissors | FST (fine sience tools) | 14040-09 | Used to cut the skin and threads |
| Small Animal Retraction System (Kit for Animals up to 200 g) | FST (fine sience tools) | 18200-20 | |
| Small Base Plate, 20 x 30 cm | 18200-03 | ||
| Table intgerated with heating pad + rectal probe + ECG and transducer tripod | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Temgesic (Buprenorphin) | Indivior UK Limited | 997.00.00 | Pain pre-medication |
| three-way stop cock (blue) | |||
| Tramal (Tamadol) | Grünental | Pain post-medication | |
| transducer probe MS400 (Visual Sonics) | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Ultrasound system with cardioligy package | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST (fine sience tools) | 15000-08 | Used to cut intercostal chest muscle |
| vet ointment | Bepanten | Used to prevent eyes from drying out |
Références
- Frey, N., Olson, E. N. Cardiac hypertrophy: The good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Bui, A. L., Horwich, T. B., Fonarow, G. C. Epidemiology and risk profile of heart failure. Nature Reviews Cardiology. 8 (1), 30-41 (2011).
- Bolli, R. New initiatives to improve the rigor and reproducibility of articles published in Circulation Research. Circulation Research. 121 (5), 472-479 (2017).
- Dunlay, S. M., Weston, S. A., Jacobsen, S. J., Roger, V. L. Risk factors for heart failure: A population-based case-control study. The American Journal of Medicine. 122 (11), 1023-1028 (2009).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Circulation Research. 115 (13), 1838-1849 (2019).
- Rockman, H. A., et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8277-8281 (1991).
- Hu, P., et al. Minimally invasive aortic banding in mice: effects of altered cardiomyocyte insulin signaling during pressure overload. American Journal of Physiology-Heart and Circulatory Physiology. 285 (3), 1261-1269 (2003).
- Mohammed, S. F., et al. Variable phenotype in murine transverse aortic constriction. Cardiovascular Pathology. 21 (3), 188-198 (2012).
- Nakao, Y., et al. O-ring-induced transverse aortic constriction (OTAC) is a new simple method to develop cardiac hypertrophy and heart failure in mice. Scientific Reports. 12, 85 (2022).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Garcia-Menendez, L., Karamanlidis, G., Kolwicz, S., Tian, R. Substrain specific response to cardiac pressure overload in C57BL/6 mice. American Journal of Physiology-Heart and Circulatory Physiology. 305 (3), 397-402 (2013).
- deAlmeida, A. C., van Oort, R. J., Wehrens, X. H. Transverse aortic constriction in mice. Journal of Visualized Experiments. (38), e1729 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon