Method Article
老化研究のためのiPS細胞由来脳オルガノイドの長期培養のための堅牢な組織作製
要約
本プロトコルは、ヒト誘導多能性幹細胞(iPSC)由来の脳オルガノイドの再現性のある生成、維持、および老化のための段階的な手順を提供します。この方法により、脳オルガノイドを長期間培養・成熟させることができ、脳の老化や加齢に伴う病態形成に関わる過程のモデル化が容易になります。
要約
現在利用可能な動物および細胞モデルは、老化した人間の脳で起こる変化の複雑さを完全には再現していません。ヒト人工多能性幹細胞(iPSC)に由来するヒト脳オルガノイドの生成を記述する手順の最近の開発は、ヒト脳の老化および関連する病原性プロセスをモデル化および理解する能力を根本的に変える可能性を秘めています。ここでは、ヒトiPS細胞由来の大脳オルガノイドを作製、維持、老化、および特性評価するための最適化されたプロトコルを紹介します。このプロトコルは、再現性のある方法で脳オルガノイドを生成するために実装することができ、オルガノイドの成熟と培養の老化を改善する最新の技術を組み込んだステップバイステップガイドとして機能します。オルガノイドの成熟、壊死、変動性、およびバッチ効果に関連する特定の問題に対処しています。これらの技術的進歩を総合すると、さまざまな若年および高齢のヒトドナー、および加齢に伴う脳障害に苦しむ個人に由来するオルガノイドの脳老化のモデリングが可能になり、ヒトの脳老化の生理学的および病原性メカニズムの特定が可能になります。
概要
人間の平均余命が伸び続けるにつれて、老化疾患モデルはますます重要になっています。大規模なゲノム研究により、分子プロセスの調節不全と生活の質に影響を与える遺伝的変化を伴う高齢者が明らかになりました1。老化プロセスは、認知機能の喪失、神経変性疾患のリスクの増加、および多くの慢性疾患を含む、生物の機能の一般的な喪失によって特徴付けられます2。
現在の細胞培養技術は、これらの機能不全が突然変異、毒素、または感染症を使用して適切に複製できないため、老化の多因子性を適切に表していません3。老化の過程を探求する動物モデルは、多くの場合、長い実験時間と高いコストに関連していますが、倫理的な考慮事項ももたらします。患者由来の人工多能性幹細胞(iPSC)を用いることで、iPS細胞は細胞の成熟組織への自然な発達を可能にするため、疾患進行の根底にある分子メカニズムを解明することができます3。iPS細胞は、採取された細胞の細胞リプログラミングがドナーの病気や老化の痕跡を消さないように見えるため、神経変性疾患を研究する多くの研究室の作業馬になっています4。これらのインプリントは、ヒトおよび動物モデルで実証されている細胞表現型を再現し、高密度脳組織の個々の細胞劣化を調べるのに適したiPS細胞になります5,6。IPSC由来のオルガノイドは、組織の三次元培養の卓越したモデルとなり、より複雑な細胞間相互作用と発生再現の改善を可能にしています。オルガノイドは主に発生データに使用されますが、疾患モデリング、特に炎症、神経変性、老化のモデルにますます適用されています7。以前のiPS細胞研究に基づいて、オルガノイドは、組織様ネットワーク接続の生理学的コンテキスト内で疾患表現型と細胞表現型を保持します8,9。ただし、特定の寸法の3次元組織を培養することは、特に長期間にわたって困難な場合があります。
この研究は、組織が長期間にわたって実質的に成熟することを可能にする脳オルガノイドの再現性のある生成のための詳細な方法を提示します。脳オルガノイドの作成は比較的標準化されたままであり、いくつかの著名なプロトコルからの方法を採用しています10,11。しかしながら、改良された分化および維持のためにいくつかの修正が提案されている。これらの代替方法には、神経分化を促進するための神経原性因子の使用12、細胞の寿命を促進する栄養交換を改善するための追加の足場13、および長期の培養と成長のための低ストレス攪拌14が含まれます。これらの改良は、神経変性および老化表現型を発現することができる成熟オルガノイドを開発するためにこの方法に組み込まれています。
プロトコル
患者研究は治験審査委員会によって承認された。すべての参加者は、データと生物試料の再利用を許可するために、書面によるインフォームドコンセントとリポジトリの同意に署名しました。iPS細胞株は、IRBおよび治験ガイドラインに従って作製した。 図1 は、このプロトコルのワークフローの概略図を示しています。
1. iPS細胞の再プログラミングとメンテナンス
- 被験者の血液8mL(高齢者または疾患患者、65歳以上)をクエン酸ナトリウムを含む細胞調製チューブ(CPT)またはEDTAまたはヘパリン化チューブに収集します。
- 室温(RT)で1,800 x g で30分間遠心分離し、末梢血のみを含み血清を含まないペレットを回収します15。
- 製造元のプロトコル( 材料表を参照)に従って特殊なリプログラミングベクターを使用して、iPS細胞16を取得します。
- フィーダーフリー、ラクトースデヒドロゲナーゼ上昇ウイルス(LDEV)フリーの還元成長因子基底膜マトリックスコーティングされた6ウェル培養プレートで、5%CO2を含む加湿雰囲気中、37°Cでエッセンシャル8(E8)培地(材料の表を参照)でiPS細胞を培養します。
- 過密や自発的な分化を避けるために、E8培地中のiPS細胞を3〜4日間維持します。
- 免疫蛍光マーカーを用いてiPS細胞株の多能性を検証し(ステップ2)、マイコプラズマを検査します(ステップ3)。
2. 多能性染色
- 溶液と抗体を保存するには、分析の3〜4日前に、コーティングされた(ステップ1.4)24ウェル培養プレート上に細胞を播種します。培地をピペットで吸引し、リン酸緩衝生理食塩水(1x PBS)中の4%ホルムアルデヒドで細胞をRTで15〜20分間固定します。
- 細胞を1x PBSで3回洗浄し、PBS中の1%ウシ血清アルブミン(BSA)中の0.1%Triton-X 100で少なくとも15分間、RTで1時間以内で透過処理します。
- 1x PBSで3回洗浄し、PBS中の5%BSAでRTで30分間ブロックします。
- 1x PBSで再度3回洗浄し、抗体Sox2およびOct3/4(1:100希釈; 材料の表を参照)、および核酸染色DAPIを1%BSA(1:4,000希釈)で4°Cで一晩加えます。光から保護するためにアルミホイルで包みます。
- 1x PBSで3回洗浄し、細胞をPBSのままにします。10〜20倍の倍率での蛍光顕微鏡による画像。多能性マーカーSox2およびOct3/4が細胞17、18の核に局在していることを確認します。
3. マイコプラズマ検査
注:詳細なアッセイの実行および分析手順については、検出キットのプロトコル( 材料表を参照)を参照してください。検出キットは、マイコプラズマ検査用の試薬、基質、およびアッセイバッファーを提供します。
- 細胞またはリフレッシュ培地を継代する前に、2〜3 mLの細胞培養培地を遠沈管に集め、細胞または破片を200 x g でRTで5分間ペレット化します。 上清を4°Cで≤5日間保存します。細胞を培地で少なくとも24時間インキュベートして、検出可能なシグナルを確保します。
- 100 μLの細胞上清を、新しいチューブまたは白壁の96ウェルプレートのウェルに追加します(不透明な底を推奨、 材料の表を参照)。試薬と基質をアッセイバッファーで再構成し、RTで15分間平衡化します。
- 100 μLの試薬をサンプルに加え、RTで5分間インキュベートします。 ルミノメーターで発光を測定します(測定#1)。
- 100 μLの基質をサンプルに加え、RTで10分間インキュベートします。 発光を測定します(測定#2)。
- マイコプラズマ汚染は、測定値#2と#1の比率によって決定します。結果の解釈については、キットのマニュアルを参照してください。
4.マイクロフィラメントの準備
- ポリ(乳酸-co-グリコール酸)(PLGA、 材料表を参照)マイクロフィラメントの調製は、メスの鈍い端で縫合糸をほつれさせることによって開始します。擦り切れた繊維を70%エタノールで軽く塗る。
- 顕微鏡下で定規を使用して、PLGAファイバーを500μmから1mmの長さのストランドの断片に切断し始めます。合計で約25mmの繊維をカットします。フィラメントを1 mLの抗生物質抗真菌溶液を入れた15 mLチューブに保管します。
- フード内で、繊維溶液を10 mLのDMEM/F-12で希釈します(表1)。溶液を混合するためによく渦を巻く。
注:無菌環境の細胞培養フローフードで作業してください。
- フード内で、繊維溶液を10 mLのDMEM/F-12で希釈します(表1)。溶液を混合するためによく渦を巻く。
- 20 μLのファイバー溶液を、96ウェルプレートの3つの胚様体(EB)形成ウェルに加えます。明視野顕微鏡下で、ウェルあたりの繊維を数えて平均します。ウェルあたり平均5〜10 PLGAマイクロフィラメントに希釈または濃縮します。この方法で各ウェルを準備します。
- これで、ウェルに細胞を播種する準備が整いました。プレートは、必要になるまで室温で、翌日は4°Cで保管してください。
5. 胚様体(EB)形成
メモ: すべてのメディアとソリューションは、RT にウォームアップする必要があります。
- iPS細胞が70%〜80%のコンフルエント性に達すると(図2A)、継代してEB形成に使用する準備が整います。10x-20倍の倍率で顕微鏡で細胞を確認します。コロニーが自発的分化の最小領域(<10%)を示すことを確認します。
- 培地をピペットで吸引し、DPBSで細胞を1回洗浄します。500 μLの細胞剥離溶液( 材料表を参照)または0.5 mMのエチレンジアミン四酢酸(EDTA)を加えてコロニーを解離し、37°Cで3〜5分間インキュベートします。
注:無菌環境の細胞培養フローフードで作業してください。 - 各ウェルに1 mLの新鮮なE8培地を加えて放出された細胞を収集し、すべての細胞が剥離するまで穏やかにピペットで留めます。
- 1.5 mLの細胞懸濁液を15 mLチューブに移し、さらに1 mLの新鮮なE8培地を加えて、総容量2.5 mLにします。
- 290 x g でRTで3分間遠心分離します。
- 上清をピペットで吸引し、細胞ペレットを50μM ROCK阻害剤を添加した1mLのエッセンシャル6(E6、 材料表参照)培地に再懸濁し、血球計算盤19を用いて細胞を計数した。
- 50 μMのROCK阻害剤を添加したE6培地で、希望する播種密度に応じて60,000〜90,000細胞/mLの細胞懸濁液を調製します(材料の表を参照)。
- 150μLの細胞懸濁液を96ウェルULAプレート(または調製した凹型プレート20)の各ウェルに加える。ウェルあたり9,000〜11,000個の細胞を播種します。
- プレートを遠心分離して、細胞を290 x g でRTで1分間強制凝集させます。 プレートを5%CO2を含む加湿雰囲気の37°Cのインキュベーターに入れます。
6.神経上皮誘導
- 24時間後、120 μLの培地をピペットで慎重に吸引します。ピペットチップをウェル内に下げすぎてEBを吸引しないように注意してください。
- ウェルあたり2 μMのXAV939とSMAD阻害剤を添加した150 μLのE6培地(RT時)(10 μMのSB431542および500 nMのLDN 193189)を追加します(材料の表を参照)。
- 2 μMのXAV939、10 μMのSB431542、および500 nMのLDN 193189を添加した、新しく調製したE6培地で培地を毎日交換してください。
注:6日目(DIV6)までに、EBの直径は550〜600μmになり、さらなる分化の準備が整うはずです。
7. オルガノイドの分化と成熟
メモ: すべてのメディアを RT にウォームアップする必要があります。
- 約DIV7で、すべてのEBが550〜600μmの直径に達し、滑らかで明確なエッジを表示するかどうかを確認します(図2B)。この段階で、それらは細胞外マトリックス(ECM)に埋め込まれる準備ができています。
注意: 無菌環境で作業してください。 - 空のP200ボックスにフィルムシート(長さ約4枚)を置き、熱可塑性シーリングフィルム( 材料表を参照)からディンプル埋め込みシートを準備します。15 mLのコニカルチューブまたは500 μLのマイクロ遠心チューブを使用して、フィルムシートを穴にそっと押し下げて、12個のディンプルを作ります。フィルムシートに70%エタノールをスプレーし、UVライトを少なくとも30分間オンにしてフローフード内で乾燥させます。
- 十分な量の基底膜マトリックス(マトリゲル、 材料表を参照)を氷上で解凍し、フローフード内に置きます。
注:EBあたり、約30μLの未希釈メンブレンマトリックスが必要です。メンブレンマトリックスは、ゲル化を防ぐために常に4°C未満に保ってください。プレチルドピペットチップは、ピペッティング中にマトリックスがチップ内で重合するのを減速させ、それによって材料の損失を低減するため、推奨されます。 - ワイドボアP200チップを使用して、各ディンプルに1つのEBを移し、通常のピペットチップでできるだけ多くの培地を除去します。EBを乾燥させないように注意してください。通常のP200チップを使用して、各オルガノイドに~30 μLの未希釈メンブレンマトリックスを加え、EBが液滴の中心にあることを確認します。
- すべてのEBがマトリックスに埋め込まれたら、EBを含むフィルムシートを滅菌ペトリ皿に入れます。
注:オプションで、滅菌水で満たされた小さなペトリ皿をフィルムシートの横にある大きなペトリ皿に入れて、蒸発を防ぐことができます。- ディッシュをインキュベーターに移し、5%CO2 を含む加湿雰囲気中で37°Cで約10分間インキュベートして、膜マトリックスを固化させます。
- 12個の包埋オルガノイドの各セットについて、ULA 6ウェルプレートの1ウェルにビタミンAを含まないB27を含む5 mLの分化培地(表1)を調製します。プレートをインキュベーター内で37°Cに予熱します。
- インキュベーション時間が終了したら、フィルムシートを取り、シートの裏側からディンプルを押し出して、埋め込まれたEBをULA 6ウェルプレートに移します。必要に応じて、ウェルから1 mLを取り出し、シート上にピペットで留めて、液滴がフィルムから剥がれるようにします。
注:重要な形態学的変化は、埋め込みの1日後に見られます。EBは、滑らかなエッジから芽を形成する膨らんだ突起になります(図2C)。 - 2日後(DIV9)、ハーフメディア交換を実行します。プロセス中に膜マトリックス液滴を吸引または損傷しないように注意してください。
- さらに2日後(DIV11)、培地を完全に交換し、3 μMのCHIR99021を培地に補充します(材料の表を参照)。
- DIV14で、培地をビタミンAを含むB27を含む分化培地に変更し(表1)、オルガノイドサイズを徐々に増やします。
- DIV16で、ウェルプレートをインキュベーター内の90rpmのオービタルシェーカーに置きます。メディアは 2 日ごとに交換してください。
- 40 DIVごとに、培地50 mLごとに500 μLのメンブレンマトリックスを希釈して、培地中の栄養素を追加します。
結果
PLGAファイバー、ディンプル埋め込み、攪拌を統合することで、iPS細胞由来の培養物を長期間維持できる強力な脳オルガノイドの生成につながります(図1)。
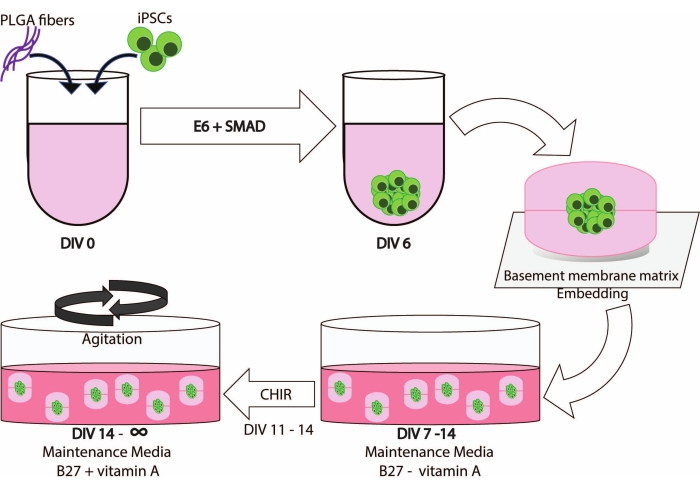
図 1: このメソッドのワークフローとタイムラインの概略図。 この図の拡大版を表示するには、ここをクリックしてください。
初期の神経誘導期間は、以前に発表された手順11に匹敵します。胚様体(EB)は、白または透明な縁を持つ円形の集合体(図2B)として始まります。DIV7でEBが神経誘導培地から神経維持培地に変化すると、円形組織から24時間以内に突起と出芽が現れます(図2C)。さらに、オルガノイドが成長し続けるにつれて、PLGAファイバーの表面積がオルガノイドの伸長を助けます(図2D)。成熟の間、オルガノイドの縁は健康な細胞と発達の良い兆候であるため、無傷のままである必要があります。それ以外の場合は、追加の栄養素を提供する必要があります13 (図2E)。オルガノイドの成長は、栄養素との灌流を改善するため、オルガノイド培養物の攪拌によってさらに促進されます。
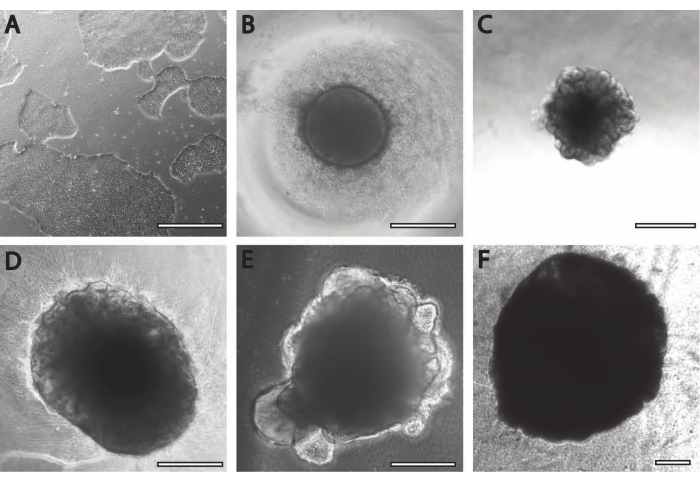
図2:脳オルガノイドの分化と成熟 。 (A)70%-80%コンフルエントでのiPS細胞培養の代表的な画像。(B)胚様体(EB)を作製し、DIV7まで神経上皮形成を誘導した。その後、EBは膜マトリックスに埋め込まれ、脳オルガノイドに向かってさらに分化しました。(C)明確な出芽形成を示すDIV10のオルガノイド。オルガノイドは、(D)ディンプルまたは(E)サンドイッチ包埋のいずれかを使用して膜マトリックス中でさらに成熟させることができる(ここではDIV30で示す)。(F)長期培養は、脳オルガノイドが有意なサイズ(DIV70)に成長していることを示しています。スケールバー= 500μm。 この図の拡大版を表示するには、ここをクリックしてください。
オルガノイドの寸法と外部形態は、オルガノイド内部の複雑な構造によって補完されます。分化の1段階目以降のDIV7で組織を固定した後、EBの細胞は、多能性神経幹細胞21のマーカーとして作用するHMGボックス転写因子であるSOX2、ならびに対をなすタンパク質ボックスPax-6を発現する、神経前駆細胞を示す(図3)。TuJ1(クラスIII β-チューブリン)22 によってマークされた未熟ニューロンは、すでに組織全体に散在しているのを見ることができます。
この段階で、これらのオルガノイドが通過する自己組織化の例が明らかになります。ロゼットと呼ばれる放射状構造の組織は神経管に類似しており、ロゼット中心21 にSOX2+細胞があり、ロゼット周辺に向かってPAX6があります。これらのロゼットは、ニューロンが移動するにつれてニューロンを生じさせる。これらの放射細胞は、最初は神経幹/前駆細胞マーカーであるネスチン23 とグリア線維性酸性タンパク質(GFAP)に対して二重陽性であり、 in vivo 脳の神経原性領域に見られる放射状グリアに似ています。これらの遊走ニューロンが成熟するにつれて、細胞骨格マーカーはこの変化を反映する22。初期段階の神経分化マーカーTuJ122 は、ロゼットの内側の円に見え、末梢のニューロン特異的成熟マーカーである微小管関連タンパク質2(MAP2)24に移行します。
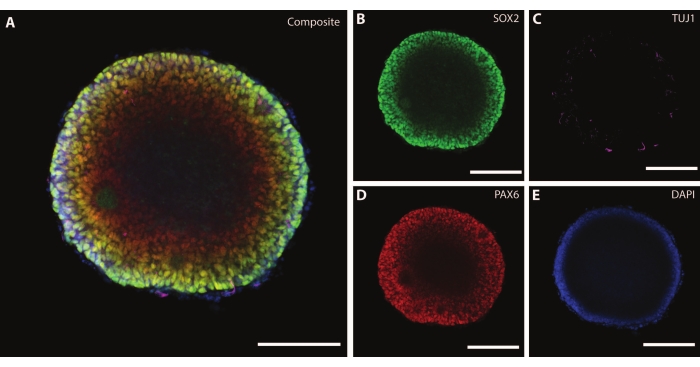
図3:DIV7の胚様体は、構造組織と未成熟な特徴を示しています。 DIV7でのEBのホールマウント免疫組織化学画像。(A)(B)SOX2+神経ロゼット、(C)EB全体に散在する未熟ニューロン(TUJ1)、(D)神経前駆細胞(PAX6)、および(E)DAPIによって視覚化された核を表示するEBの合成画像。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
オルガノイドが老化するにつれて、発達中のニューロンの組織とマーカーは生理学的状態を再現し始めます。DIV30では、発達中の脳と同等の神経原性領域を生じさせる多くのロゼットが観察され得る25。DIV60により、これらのSOX2+神経原性領域は存在せず、ニューロン分化マーカーである成熟MAP2およびNeuN26、および陽性ニューロンに置き換えられます(図4および図5)。
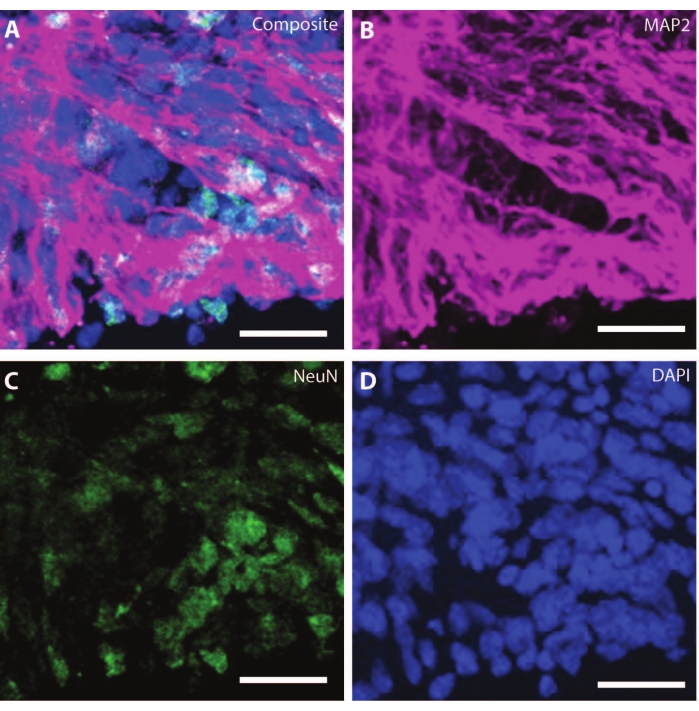
図4:DIV120のオルガノイドは、成熟したニューロンの特性を示しています。 DIV 120でのオルガノイド切片の免疫組織化学画像。(A)(B)MAP2(紫色)および(C)NeuN(緑色)の成熟ニューロンマーカーを示す切片の合成画像。(D)原子核はDAPIによって可視化された。スケールバー= 20μm。 この図の拡大版を表示するには、ここをクリックしてください。
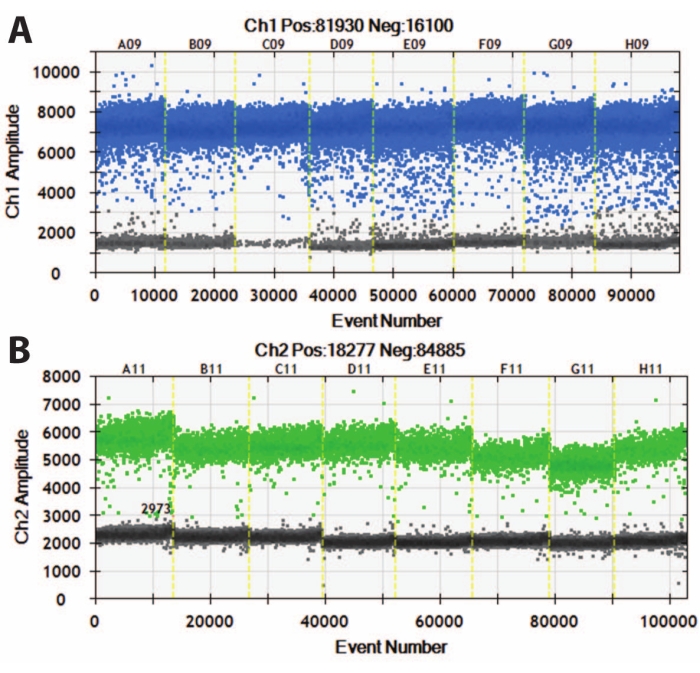
図5:DIV120オルガノイドのデジタルドロップレットPCR。 (A)MAP2(上、青)および(B)NeuN(下、緑)の絶対発現値を示すデジタルドロップレットPCRグラフ。黄色のスラッシュラインは異なるiPS細胞株(A、B、Cなど)を分離し、オルガノイドはバッチ処理されています。N = 5。 この図の拡大版を表示するには、ここをクリックしてください。
これらの細胞骨格マーカーは、他の有糸分裂後マーカー(ダブルコルチン27 やシナプシン28など)と組み合わせて使用 して、シナプス可塑性やその他の加齢に伴う衰退(図6)、およびアストロサイトやグリアなどの追加の脳組織(図7)を調べることができます。
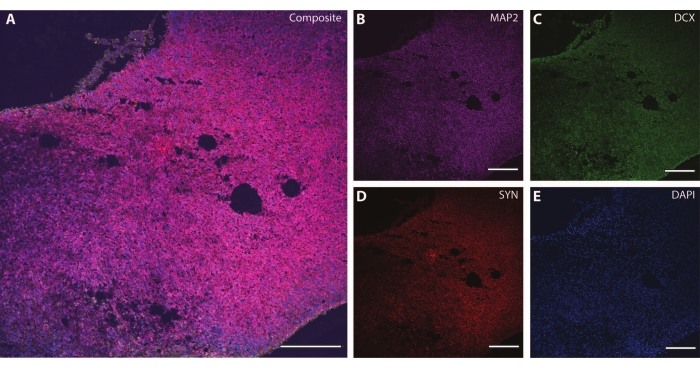
図6:シナプス終末解析の例。 DIV 120におけるオルガノイドの切片の免疫組織化学像。(A)(B)MAP2、(C)ダブルコルチン(DCX)、および(D)シナプシンI(SYN)について染色した切片の合成画像。(E)原子核はDAPIによって可視化された。スケールバー= 200μm。 この図の拡大版を表示するには、ここをクリックしてください。
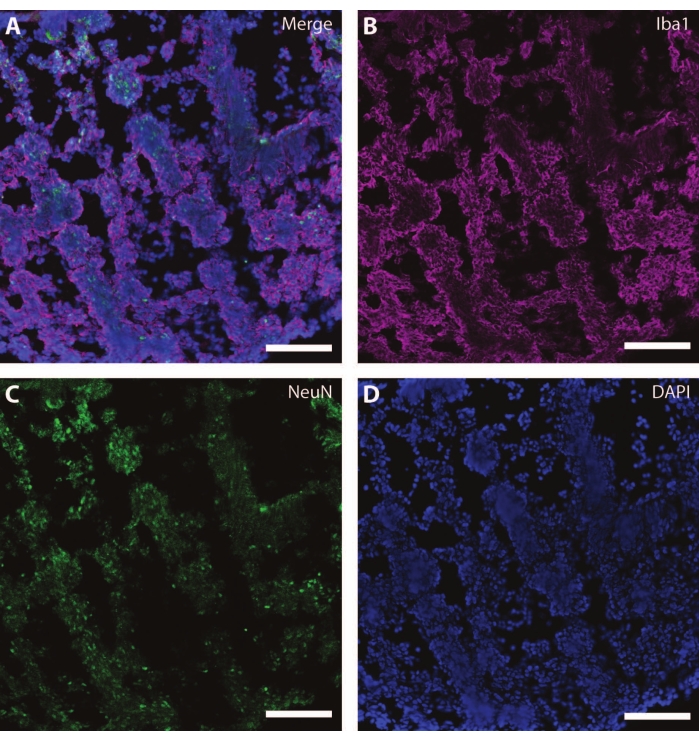
図7:グリアの発達の証拠。 DIV 120におけるオルガノイドの切片の免疫組織化学像。(A)(B)イオン化カルシウム結合アダプター分子1(Iba1)および(C)NeuNについて染色した切片の合成像。(D)原子核はDAPIによって可視化された。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
| 試薬 | 最終濃度 | 容量(合計50mL) |
| DMEM-F12 | 50% | 25ミリリットル |
| 神経基礎培地 | 50% | 25ミリリットル |
| N2サプリメント(100x) | 1倍速 | 0.25 ミリリットル |
| B27サプリメント-/+ビタミンA(50x) | 0.5倍 | 0.5ミリリットル |
| インスリン | 0.25% | 12.5 μL |
| グルタマックス(100倍) | 1倍速 | 0.5ミリリットル |
| MEM-NEAA (100x) | 0.5倍 | 0.25 ミリリットル |
| ヘペス (1 M) | 10ミリメートル | 0.5ミリリットル |
| 抗生物質/抗真菌薬(100x) | 1倍速 | 0.5ミリリットル |
| 2-β-メルカプトエタノール | 50 μM | 17.5 μL |
| *注:一部のDMEM-F12にはすでにGlutaMAXが含まれているため、追加する必要はありません。 | ||
表1:本研究で用いた分化培地の組成。
ディスカッション
EBの標準化された形成は、多能性幹細胞の脳オルガノイドへの再現性のある変換における重要なステップです。幹細胞の特異組織への力の凝集は、凹状のウェルの形状、播種密度、およびウェル処理によって異なります。現在の方法では、6日後に500〜600μmの直径範囲が引用されていますが、他の多くの直径が成功していることが証明されているため、これらの直径は適切なオルガノイド形成の他の直径を排除するものではありません。ただし、直径の変化は分化率と成功に影響を与えることが示されています29。再現性のために、50μm未満の直径変動を強くお勧めします20。さらに、SMAD阻害剤の使用は、わずか5日間の曝露後に神経上皮形成を効率的に生成および維持することが示されているため、EBの直径が大きくなることを可能にするために、神経誘導日数を6日から10日に延長することができる30。SMAD阻害剤がない場合、神経誘導は一貫性のない結果をもたらす可能性があり、より長い誘導期間を必要とします。この研究で引用されているSMAD阻害剤が最も効果的ですが、他のドルソモルフィンおよびTGF-β小分子を有効濃度で使用できます。
基底膜マトリックスは、成長のための優れた基質を提供し、異なる方法で投与することができる。マトリックスの初期の使用は、ウェルコーティング31としての基底膜を含んでいた。しかしながら、組織を包埋するためのマトリックスの使用は、これらの組織32における分化および成熟を改善することを示した。オルガノイドの場合、マトリックスの使用は、オルガノイドへのEB分化を改善し、成熟を促進し、培養期間を延長することが示されています33。多くのグループがマトリックスフリーの組織培養を達成するために努力してきたため、オルガノイドはマトリックスなしで形成できますが34,35、研究により、マトリックスに埋め込まれたオルガノイドは培養時間が長くなる可能性が高く、メンテナンスが少なくて済むことがわかっています36。ディンプル埋め込み法は、オルガノイド表面を均等にカバーし、同様の拡散、栄養素へのアクセス、および再現性のある分化を保証します。あるいは、ドーム包埋は、オルガノイド37を完全に封入するために採用され得る。
膜マトリックスディンプルへのEBの移動は重要なステップです。1 mL ピペットチップは EB を移送するのに十分な開口部を備えていますが、移送を容易にするために 200 μL チップが推奨されます。200 μLのチップを切断して十分な大きさの開口部を作り、ピペッティング時のせん断応力を軽減するために滑らかなエッジを確保する必要があります。また、ワイドボアの200μLチップは、移送を容易にするために存在します。高速ピペッティングはオルガノイドの周辺を破壊し、適切な成長を妨げる可能性があるため、ピペッティングはゆっくりと行う必要があります。栄養素を提供するのに十分な培地が確実に移動されるように特別な注意を払う必要があります。.培地が少なすぎると、オルガノイドが乾燥し、壊死を引き起こすリスクがあります。培養液が多すぎると、マトリックスが希釈されすぎてオルガノイドをしっかりとカプセル化できなくなる可能性があります。理想的には、マトリックスは、その重合を確実にし、EBのECMとして機能するために50%を超えて希釈してはなりません。埋め込みが失敗した場合は、EB を回復して再カプセル化できます。新鮮なマトリックスへの再カプセル化は、オルガノイドに追加のサポートを提供するために任意の時点で行うことができます。
足場用のマトリックス埋め込みと同様に、PLGAファイバーは3次元成長をさらにサポートします。もともとは細長いオルガノイドを生成し、表面積を増やすために組み込まれていましたが38、PLGAファイバーの組み込みは、オルガノイドの分化と成熟を改善するための追加のツールとして徐々に特定されています39。より多くのラボがマトリックスの使用を減らすか、完全に廃止しようとしているので、組み込まれた繊維によって支持されたオルガノイドの自己組織化特性は、三次元組織の作成と分化に十分な足場を提供します39。ここでは、両方の方法を組み合わせ、長期培養の可能性を高めた38、39。最初の凝集中の繊維の組み込みは、後の段階で導入されない可能性があるため、非常に重要です。遠心分離後、いくつかの繊維が凝集細胞内にあることを確認することで、繊維がEBに組み込まれていることを確認できます。成功しない場合は、ウェルの穏やかな吸引と再遠心分離により、混合が保証されます。
オルガノイド維持におけるもう一つの重要なステップは、より良い培地灌流のためのオービタルシェーカーの導入です。オルガノイドプロトコルの初期の反復では、回転するバイオリアクターを使用して攪拌を作成しました11。90rpmのオービタルシェーカーは、マトリックス液滴を破壊したり、オルガノイドの形態を損傷したりすることなく、十分な攪拌を提供します。いくつかのグループは、マトリックス足場の使用を控えるが、適切な環境34を提供するためにシェーカー攪拌を保持する。すべてのプロトコルと同様に、せん断応力の量を減らすために、シェーカーに応じて回転速度を調整する必要があります。ドーム埋め込みを選択した場合、傾斜シェーカーを使用してせん断応力の量を減らすことができます11,34。
まとめると、いくつかの選択された技術の統合により、iPS細胞由来のオルガノイド形成の堅牢な方法が提供されます。オルガノイドの作成と維持にはいくつかの方法がありますが、それらの多くは初期の分化軌道に焦点を当てています。この研究では、複数の異なる技術を組み合わせて、分化段階を過ぎ、老化表現型が発達し始める成熟期に長期間オルガノイドを培養しました。これらの技術を組み込むことで、培養物を維持するための外因性の生物学的要因を必要とせずに長期の成熟が可能になり、自己組織化と老化の自然な進行が維持されます。
開示事項
著者は開示するものは何もありません。
謝辞
この作業は、オランダ政府の教育文化科学省が資金提供するNWO重力プロジェクト(024.003.001)であるオランダオルガンオンチップイニシアチブによってサポートされました。D.C.B.は、博士課程の奨学金の形でConsejo Nacional de Ciencia y Tecnología(CONACyT)の財政的支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 2-β-Mercaptoethanol | Thermo Fisher Scientific | 31350010 | |
| 4′,6-Diamidino-2-phenylindoledihydrochloride (DAPI) | Invitrogen | D1306 | 1:4000 |
| 6-well Clear Flat Bottom CELLSTAR Cell Culture Multiwell Plate | Greiner Bio-One | 657185 | |
| 6-well Clear Flat Bottom Ultra-Low Attachment Well Plate | Corning | 3471 | |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Fisher Scientific | 136101 | |
| Accutase | Sigma-Aldrich | 46964 | cell detachment solution |
| Antibiotic-Antimycotic (100x) | Gibco | 15240062 | |
| B27 Suppement (with Vitamin A) (50x) | Gibco | 17504044 | |
| B27 Supplement (minus Vitamin A) (50x) | Gibco | 12587010 | |
| BD Vacutainer™ Glass Mononuclear Cell Preparation (CPT) Tubes | Thermo Fisher Scientific | 02-685-125 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Centrifuge | Eppendorf | 5810 R | With plate holders |
| CHIR99021 | Selleck Chemicals | S2924 | |
| CytoTune Sendai Reprogramming Vector | Thermo Fisher Scientific | A1378001 | |
| ddPCR primers | human | MAPT | Bio-Rad | dHsaCPE192234 | |
| ddPCR primers | human | RBFOX3 (NeuN) | Bio-Rad | dHsaCPE5052108 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320074 | |
| Doublecortin (DCX) | Santa Cruz Biotechnology | SC-8066 | 1:500 |
| Dulbecco’s phosphate buffered saline (DPBS) | Thermo Fisher Scientific | 14190144 | no calcium, no magnesium |
| Eppendorf cups, 1.5 mL | Eppendorf | 0030 125.215 | |
| Essential 6 | Gibco | A1516401 | |
| Essential 8 | Gibco | A1517001 | |
| Ethylenediaminetetraacetic acid (EDTA) | Invitrogen | 15575020 | |
| Falcon tubes, 15 mL, conical | Greiner Bio-One | 188271-N | |
| Formaldehyde | Sigma-Aldrich | 252549 | 37% Stock solution, diluted to 4% in PBS |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413202 | |
| GlutaMax (100x) | Gibco | 35050038 | |
| Hemacytometer cell counter | Hausser scientific | 1490 | |
| HEPES Buffer | Thermo Fisher Scientific | 15-630-080 | |
| Insulin | Sigma-Aldrich | I9278 | |
| LDN 193189 | StemCell Technologies | 72147 | |
| MAP2 | Abcam | ab32454 | 1:200 |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free | Corning | 356230 | basement membrane matrix |
| MEM-Non Essential Amino Acid Solution (MEM-NEAA; 100x) | Thermo Fisher Scientific | 11140050 | |
| Multilabel Counter Victor 3 Plate Reader | Perkin Elmer | 1420 | luminometer |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| N-2 Supplement (100x) | Thermo Fisher Scientific | 17502-048 | |
| NeuN | Millipore | MAB377 | 1:500 |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | |
| Oct-3/4 Antibody (C-10) Alexa Fluor 647 | Santa Cruz Biotechnology | sc-5279 AF647 | 1:100 |
| Parafilm | Bemis | PM-996 | thermoplastic film sheet |
| PAX6 | Thermo Fisher Scientific | 42-6600 | 1:200 |
| Penicillin/Streptomycin | Gibco | 15070063 | |
| Poly(lactic-co-glycolic acid) (PLGA) microfilaments | Ethicon | J463 | |
| QX200 Droplet digital PCR system | Bio-Rad | 1864001 | |
| ROCK inhibitor (Y27632) | Selleck Chemicals | S1049 | |
| SB431542 | R&D Systems | 1614/50 | |
| SOX2 Monoclonal Antibody (Btjce), Alexa Fluor 488, eBioscience | Invitrogen | 53-9811-80 | 1:100 |
| Synapsin I (SYN) | Calbiochem | 574777 | 1:200 |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| TUJ1 | Santa Cruz Biotechnology | sc-80005 | Beta-3-tubulin; 1:500 |
| XAV939 | Tocris Bioscience | 3748 |
参考文献
- Liu, G. H., et al. Aging Atlas: a multi-omics database for aging biology. Nucleic Acids Research. 49, 825-830 (2021).
- Ferrucci, L., et al. Measuring biological aging in humans: A quest. Cell. 19 (2), 13080 (2020).
- Mertens, J., Reid, D., Lau, S., Kim, Y., Gage, F. H. Aging in a dish: iPSC-derived and directly induced neurons for studying brain aging and age-related neurodegenerative diseases. Annu Rev Genet. 52, 271-293 (2018).
- Mertens, J., et al. Age-dependent instability of mature neuronal fate in induced neurons from Alzheimer's patients. Cell Stem Cell. 28 (9), 1533-1548 (2021).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1141-1154 (2018).
- Fang, E. F., et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease. Nature Neuroscience. 22 (3), 401-412 (2019).
- Hu, J. L., Todhunter, M. E., LaBarge, M. A., Gartner, Z. J. Opportunities for organoids as new models of aging. Journal of Cell Biology. 217 (1), 39-50 (2018).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Gonzalez, C., et al. Modeling amyloid beta and tau pathology in human cerebral organoids. Molecular Psychiatry. 23 (12), 2363-2374 (2018).
- Yoon, S. -. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Muratore, C. R., Srikanth, P., Callahan, D. G., Young-Pearse, T. L. Comparison and optimization of hiPSC forebrain cortical differentiation protocols. PLoS ONE. 9 (8), 105807 (2014).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2020).
- Goto-Silva, L., et al. Computational fluid dynamic analysis of physical forces playing a role in brain organoid cultures in two different multiplex platforms. BMC Developmental Biology. 19 (1), 1-10 (2019).
- Sommer, A. G., et al. Generation of human induced pluripotent stem cells from peripheral blood using the STEMCCA lentiviral vector. Journal of Visualized Experiments. (68), e4327 (2012).
- Beers, J., et al. A cost-effective and efficient reprogramming platform for large-scale production of integration-free human induced pluripotent stem cells in chemically defined culture. Scientific Reports. 5 (1), 1-9 (2015).
- Wakao, S., et al. Morphologic and gene expression criteria for identifying human induced pluripotent stem cells. PLoS ONE. 7 (12), e48677 (2012).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2022).
- Choy Buentello, D., Koch, L. S., Trujillo-De Santiago, G., Alvarez, M. M., Broersen, K. Use of standard U-bottom and V-bottom well plates to generate neuroepithelial embryoid bodies. PLOS ONE. 17 (5), 0262062 (2022).
- Ellis, P., et al. SOX2, a persistent marker for multipotential neural stem cells derived from embryonic stem cells, the embryo or the adult. Developmental Neuroscience. 26 (2-4), 148-165 (2004).
- Lee, S., et al. TuJ1 (class III β-tubulin) expression suggests dynamic redistribution of follicular dendritic cells in lymphoid tissue. European Journal of Cell Biology. 84 (2-3), 453-459 (2005).
- Suzuki, S., Namiki, J., Shibata, S., Mastuzaki, Y., Okano, H. The neural stem/progenitor cell marker nestin is expressed in proliferative endothelial cells, but not in mature vasculature. Journal of Histochemistry and Cytochemistry. 58 (8), 721-730 (2010).
- Soltani, M. H., et al. Microtubule-associated protein 2, a marker of neuronal differentiation, induces mitotic defects, inhibits growth of melanoma cells, and predicts metastatic potential of cutaneous melanoma. The American Journal of Pathology. 166 (6), 1841-1850 (2005).
- Wilson, P. G., Stice, S. S. Development and differentiation of neural rosettes derived from human embryonic stem cells. Stem Cell Reviews. 2 (1), 67-77 (2006).
- Gusel'nikova, V. V., Korzhevskiy, D. E. NeuN as a neuronal nuclear antigen and neuron differentiation marker. Acta Naturae. 7 (25), 42-47 (2015).
- Rao, M. S., Hattiangady, B., Shetty, A. K. The window and mechanisms of major age-related decline in the production of new neurons within the dentate gyrus of the hippocampus. Aging Cell. 5 (6), 545-558 (2006).
- Meng, L., et al. A synapsin I cleavage fragment contributes to synaptic dysfunction in Alzheimer's disease. Aging Cell. 21 (5), 13619 (2022).
- Moon, S. H., et al. Optimizing human embryonic stem cells differentiation efficiency by screening size-tunable homogenous embryoid bodies. Biomaterials. 35 (23), 5987-5997 (2014).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Lee, S. -. W., et al. Optimization of Matrigel-based culture for expansion of neural stem cells. Animal Cells and Systems. 19 (3), 175-180 (2015).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: The matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Hocevar, S. E., Liu, L., Duncan, R. K. Matrigel is required for efficient differentiation of isolated, stem cell-derived otic vesicles into inner ear organoids. Stem Cell Research. 53, 102295 (2021).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Communications Biology. 4 (1), 1-15 (2021).
- Kaiser, A., Kale, A., Novozhilova, E., Olivius, P. The effects of Matrigel® on the survival and differentiation of a human neural progenitor dissociated sphere culture. The Anatomical Record. 303 (3), 441-450 (2020).
- Kakni, P., et al. Intestinal organoid culture in polymer film-based microwell arrays. Advanced Biosystems. 4 (10), 2000126 (2020).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Tejchman, A., Znój, A., Chlebanowska, P., Frączek-Szczypta, A., Majka, M. Carbon fibers as a new type of scaffold for midbrain organoid development. International Journal of Molecular Sciences. 21 (17), 5959 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved