Method Article
Надежное тканевое производство для долгосрочного культивирования органоидов мозга, полученных из iPSC, для исследований старения
В этой статье
Резюме
Настоящий протокол представляет собой пошаговую процедуру воспроизводимой генерации, поддержания и старения церебральных органоидов, полученных из индуцированных человеком плюрипотентных стволовых клеток (ИПСК). Этот метод позволяет культивировать и созревать церебральные органоиды в течение длительных периодов времени, что облегчает моделирование процессов, связанных со старением мозга и возрастным патогенезом.
Аннотация
Доступные в настоящее время животные и клеточные модели не полностью отражают сложность изменений, происходящих в стареющем человеческом мозге. Недавняя разработка процедур, описывающих генерацию церебральных органоидов человека, полученных из индуцированных плюрипотентных стволовых клеток человека (ИПСК), может фундаментально трансформировать способность моделировать и понимать старение человеческого мозга и связанные с ним патогенные процессы. Здесь представлен оптимизированный протокол для генерации, поддержания, старения и характеристики церебральных органоидов головного мозга, полученных из ИПСК человека. Этот протокол может быть реализован для создания органоидов мозга воспроизводимым образом и служит пошаговым руководством, включающим новейшие методы, которые приводят к улучшению созревания и старения органоидов в культуре. Рассматриваются конкретные вопросы, связанные с созреванием органоидов, некрозом, изменчивостью и периодическими эффектами. Взятые вместе, эти технологические достижения позволят моделировать старение мозга в органоидах, полученных от различных молодых и пожилых доноров человека, а также людей, страдающих возрастными заболеваниями головного мозга, что позволит идентифицировать физиологические и патогенные механизмы старения мозга человека.
Введение
Модели болезней старения становятся все более актуальными, поскольку ожидаемая продолжительность жизни человека продолжает расти. Крупномасштабные геномные исследования выявили возрастные популяции с нарушением регуляции молекулярных процессов и генетическими изменениями, влияющими на качество жизни1. Процесс старения характеризуется общей потерей функциональности организма, включая потерю когнитивных функций, повышенный риск нейродегенеративных расстройств и множество хронических заболеваний2.
Современные методы культивирования клеток не отражают должным образом многофакторную природу старения, поскольку эти дисфункции не могут быть должным образом воспроизведены с помощью мутаций, токсинов или инфекций3. Модели животных, которые исследуют процесс старения, часто связаны с длительным временем экспериментов и высокими затратами, но также несут с собой этические соображения. Использование индуцированных плюрипотентных стволовых клеток (ИПСК) у пациентов может прояснить молекулярные механизмы, лежащие в основе прогрессирования заболевания, поскольку ИПСК обеспечивают естественное развитие клеток в зрелую ткань3. ИПСК стали рабочей лошадкой многих лабораторий, исследующих нейродегенеративные расстройства, поскольку клеточное перепрограммирование собранных клеток, по-видимому, не стирает отпечатки болезней или старения доноров4. Эти отпечатки повторяют клеточные фенотипы, которые были продемонстрированы на моделях человека и животных, что делает ИПСК пригодными для изучения индивидуального клеточного разрушения высокоплотной мозговой ткани 5,6. Органоиды, полученные из IPSC, стали выдающейся моделью для трехмерного культивирования ткани, обеспечивая более сложные межклеточные взаимодействия и улучшенную рекапитуляцию развития. Несмотря на то, что органоиды в основном используются для данных о развитии, они все чаще применяются для моделирования заболеваний, в частности, моделей воспаления, нейродегенерации и старения7. Основываясь на предыдущих исследованиях ИПСК, органоиды сохраняют фенотипы болезней и клеточные фенотипы в физиологическом контексте тканеподобных сетевых связей 8,9. Однако культивирование трехмерной ткани определенных размеров может быть сложной задачей, особенно в течение длительных периодов времени.
В этой работе представлен подробный метод воспроизводимой генерации церебральных органоидов, который позволяет ткани существенно созревать в размерах в течение более длительных периодов времени. Создание церебральных органоидов оставалось относительно стандартизированным, используя методы из нескольких известных протоколов10,11. Тем не менее, было предложено несколько модификаций для улучшения дифференциации и обслуживания. Эти альтернативные методы включают использование нейрогенных факторов для усиления нейронной дифференцировки12, дополнительные каркасы для улучшения обмена питательных веществ, способствующие клеточному долголетию 13, и низкое стрессовое возбуждение для длительного культивирования и роста14. Эти усовершенствования были включены в этот метод для разработки зрелых органоидов, способных выражать нейродегенеративные и стареющие фенотипы.
протокол
Исследования пациентов были одобрены Институциональным наблюдательным советом. Все участники подписали письменное информированное согласие и согласие репозитория на повторное использование их данных и биологических образцов. Линии iPSC были сформированы в соответствии с IRB и институциональными руководящими принципами. На рисунке 1 показан схематический обзор рабочего процесса этого протокола.
1. Перепрограммирование и обслуживание iPSC
- Соберите 8 мл крови субъекта (пожилого или больного пациента; в возрасте 65 лет и старше) в пробирки для подготовки клеток (CPT) с цитратом натрия или в ЭДТА или гепаринизированные пробирки.
- Центрифугу в дозе 1,800 x g в течение 30 мин при комнатной температуре (RT) для сбора гранул, содержащих только периферическую кровь и без сыворотки15.
- Для получения ИПСК16 используют специализированные векторы перепрограммирования по протоколу производителя (см. Таблицу материалов).
- Культивирование ИПСК в 6-луночных культуральных планшетах без фидера, без вируса повышения уровня лактозодегидрогеназы (LDEV) с пониженным фактором роста, покрытых матрицей базальной мембраны, покрытых 6-луночными культуральными пластинами в среде Essential 8 (E8) (см. Таблицу материалов) при 37 ° C в увлажненной атмосфере с 5% CO2.
- Поддерживайте ИПСК в среде E8 в течение 3-4 дней, чтобы избежать переполненности или спонтанной дифференциации.
- Валидируют плюрипотентность линий iPSC с помощью иммунофлюоресцентных маркеров (шаг 2) и теста на микоплазму (шаг 3).
2. Плюрипотентное окрашивание
- Чтобы сохранить растворы и антитела, засейте клетки на 24-луночные культуральные планшеты с покрытием (этап 1.4) за 3-4 дня до анализа. Аспирируйте среду пипеткой и зафиксируйте клетки 4% формальдегидом в фосфатно-буферном физиологическом растворе (1x PBS) в течение 15-20 минут при RT.
- Промойте клетки 3 раза 1x PBS и пермеабилизируйте 0,1% Triton-X 100 в 1% бычьем сывороточном альбумине (BSA) в PBS в течение не менее 15 мин, но не более 1 ч при RT.
- Промывайте 3 раза с 1x PBS и блокируйте с 5% BSA в PBS в течение 30 минут при RT.
- Промыть еще раз 3 раза с 1x PBS и добавить антитела Sox2 и Oct3/4 (разведение 1:100; см. Таблицу материалов) и нуклеиновое окрашивание DAPI в 1% BSA (разведение 1:4,000) на ночь при 4 ° C. Заверните в алюминиевую фольгу для защиты от света.
- Промойте 3x с 1x PBS и оставьте ячейки в PBS. Изображение с помощью флуоресцентного микроскопа с 10-20-кратным увеличением. Убедитесь, что маркеры плюрипотентности Sox2 и Oct3/4 локализованы в ядрах клеток17,18.
3. Тестирование микоплазмы
ПРИМЕЧАНИЕ: Обратитесь к протоколу комплекта для обнаружения (см. Таблицу материалов) для подробного выполнения анализа и этапов анализа. Набор для обнаружения содержит реагент, субстрат и тестовый буфер для тестирования микоплазмы.
- Перед прохождением клеток или освежающей среды соберите 2-3 мл среды для культивирования клеток в центрифужную пробирку и гранулируйте любые клетки или мусор в 200 x g в течение 5 мин при RT. Храните надосадочную жидкость при температуре 4 °C в течение ≤5 дней. Инкубируйте клетки со средой в течение не менее 24 часов, чтобы обеспечить обнаруживаемый сигнал.
- Добавьте 100 мкл надосадочной жидкости в свежую пробирку или лунку с белыми стенками 96-луночной пластины (рекомендуется непрозрачное дно, см. Таблицу материалов). Восстановите реагент и субстрат в тестовом буфере и уравновесьте в течение 15 мин при RT.
- Добавьте 100 мкл реагента в образец и инкубируйте в течение 5 мин при RT. Измерьте люминесценцию люминометром (измерение #1).
- Добавьте 100 мкл субстрата в образец и инкубируйте в течение 10 мин при RT. Измерьте люминесценцию (измерение #2).
- Определите загрязнение микоплазмой по соотношению измерений #2 к #1. Обратитесь к руководству по набору для интерпретации результатов.
4. Подготовка микрофиламентов
- Начните приготовление микрофиламентов поли (молочнокислой кислоты) (PLGA, см. Таблицу материалов) с перетирания шовной нити тупым концом скальпеля. Слегка стерилизовать перетертое волокно 70% этанолом.
- Под микроскопом и с помощью линейки начните разрезать волокно PLGA на фрагменты длиной от 500 мкм до 1 мм. Всего отрежьте около 25 мм волокна. Храните нити в пробирке объемом 15 мл с 1 мл антибиотико-антимикотического раствора.
- В вытяжке разбавьте раствор волокна 10 мл DMEM/F-12 (таблица 1). Хорошо перемешайте раствор.
ПРИМЕЧАНИЕ: Работайте в вытяжном шкафу для клеточных культур в стерильной среде.
- В вытяжке разбавьте раствор волокна 10 мл DMEM/F-12 (таблица 1). Хорошо перемешайте раствор.
- Добавьте 20 мкл волокнистого раствора к трем эмбриоидным телам (ЭБ), образуя лунки из 96-луночной пластины. Под светлопольной микроскопией подсчитайте и усредните волокна на лунку. Разбавьте или сконцентрируйте в среднем 5-10 микрофиламентов PLGA на лунку. Подготовьте каждую лунку таким образом.
- Теперь лунки готовы к засеиванию клетками. Храните тарелку при комнатной температуре до надобности или при температуре 4 °C в течение следующего дня.
5. Формирование эмбриоидного тела (БЭ)
ПРИМЕЧАНИЕ: Все носители и растворы должны быть подогреты до RT.
- Как только ИПСК достигают 70-80% слияния (рис. 2А), они готовы к прохождению и использованию для формирования ЭБ. Проверьте клетки с помощью микроскопа при 10-20-кратном увеличении. Убедитесь, что колонии демонстрируют минимальные (<10%) области спонтанной дифференцировки.
- Аспирируйте среду пипеткой и один раз промойте клетки DPBS. Диссоциируют колонии, добавляя 500 мкл раствора для отслоения клеток (см. Таблицу материалов) или 0,5 мМ этилендиаминтетрауксусной кислоты (ЭДТА) и инкубируют в течение 3-5 мин при 37 ° C.
ПРИМЕЧАНИЕ: Работайте в вытяжном шкафу для клеточных культур в стерильной среде. - Соберите высвобожденные клетки, добавив по 1 мл свежего носителя E8 в каждую лунку, и аккуратно пипеткой до тех пор, пока все клетки не отсоединятся.
- Перенесите 1,5 мл клеточной суспензии в пробирку объемом 15 мл и добавьте еще 1 мл свежей среды E8, чтобы достичь общего объема 2,5 мл.
- Центрифуга при 290 x g в течение 3 мин при RT.
- Аспирируйте надосадочную жидкость пипеткой, ресуспендируйте клеточную гранулу в 1 мл среды Essential 6 (E6, см. Таблицу материалов), дополненной ингибитором ROCK 50 мкМ, и подсчитайте клетки с помощью гемоцитометра19.
- Приготовьте клеточную суспензию в количестве 60 000-90 000 клеток/мл, в зависимости от желаемой плотности посева, в среде Е6 с добавлением 50 мкМ ингибитора ROCK (см. Таблицу материалов).
- Добавьте 150 мкл клеточной суспензии в каждую лунку 96-луночной пластины ULA (или подготовленной вогнутой пластины20). Высевают 9 000-11 000 клеток в лунку.
- Центрифугируйте планшет для принудительной агрегации клеток при 290 x g в течение 1 мин при RT. Поместите планшет в инкубатор при 37 °C в увлажненной атмосфере с 5% CO2.
6. Нейроэпителиальная индукция
- Через 24 ч тщательно аспирируйте пипеткой 120 мкл среды. Следите за тем, чтобы не аспирировать ЭБ, опустив наконечник пипетки слишком далеко в лунку.
- Добавьте 150 мкл среды E6 (при RT) с добавлением 2 мкМ XAV939 и ингибиторов SMAD: 10 мкМ SB431542 и 500 нМ LDN 193189 на лунку (см. Таблицу материалов).
- Ежедневно меняйте среду со свежеприготовленным носителем E6 с добавлением 2 мкМ XAV939, 10 мкМ SB431542 и 500 нМ LDN 193189.
ПРИМЕЧАНИЕ: К 6-му дню (DIV6) ЭБ должны иметь диаметр 550-600 мкм и быть готовыми к дальнейшей дифференциации.
7. Дифференциация и созревание органоидов
ПРИМЕЧАНИЕ: Все носители должны быть подогреты к RT.
- Примерно при DIV7 проверьте, достигли ли все ЭБ диаметра 550-600 мкм, и отобразите гладкий и четкий край (рис. 2B); на этом этапе они готовы к встраиванию во внеклеточный матрикс (ECM).
ПРИМЕЧАНИЕ: Работайте в стерильной среде. - Подготовьте вложенные листы с ямочками из термопластичной герметизирующей пленки (см. Таблицу материалов), поместив лист пленки (длиной около 4 дюймов) на пустую коробку P200. Используя коническую пробирку объемом 15 мл или микроцентрифужную пробирку объемом 500 мкл, аккуратно вдавите лист пленки в отверстия, чтобы сделать 12 углублений. Сбрызните пленочный лист 70% этанолом и дайте ему высохнуть внутри проточного колпака при включенном ультрафиолетовом свете не менее 30 минут.
- Разморозьте достаточное количество матрицы базальной мембраны (Matrigel, см. Таблицу материалов) на льду и поместите ее внутрь проточного колпака.
ПРИМЕЧАНИЕ: Для каждого ЭБ требуется примерно 30 мкл неразбавленной мембранной матрицы. Всегда держите мембранную матрицу ниже 4 °C, чтобы предотвратить ее гелеобразование. Также рекомендуются предварительно охлажденные наконечники для пипеток, поскольку они замедляют полимеризацию матрицы в наконечнике во время пипетирования, тем самым уменьшая потери материала. - Используя широкопроходный наконечник P200, перенесите по одному EB на каждую ямочку и удалите как можно больше носителя с помощью обычного наконечника пипетки. Будьте внимательны, чтобы не дать EB высохнуть. Используя обычный наконечник P200, добавьте ~ 30 мкл неразбавленной мембранной матрицы к каждому органоиду, убедившись, что EB находится в центре капли.
- После того, как все ЭБ встроены в матрицу, поместите лист пленки, содержащий ЭБ, в стерильную чашку Петри.
ПРИМЕЧАНИЕ: При желании небольшая чашка Петри, наполненная стерильной водой, может быть помещена в большую чашку Петри рядом с пленочным листом, чтобы предотвратить испарение.- Перенесите чашку в инкубатор и инкубируйте при 37 °C в увлажненной атмосфере с 5% CO2 в течение примерно 10 минут, чтобы мембранная матрица затвердела.
- Для каждого набора из 12 встроенных органоидов приготовьте 5 мл дифференцировочных сред с B27 без витамина А (таблица 1) в одну лунку 6-луночного планшета ULA. Предварительно разогрейте тарелку до 37 °C в инкубаторе.
- По окончании времени инкубации перенесите встроенные ЭБ на 6-луночную пластину ULA, взяв лист пленки и выдвинув углубления с обратной стороны листа. При необходимости возьмите 1 мл из лунки и нанесите его пипеткой на лист, чтобы капли отделились от пленки.
ПРИМЕЧАНИЕ: Важные морфологические изменения можно увидеть через 1 день после встраивания; ЭБ переходят от гладких краев к выпуклым выступам, образующим почки (рис. 2C). - Через 2 дня (DIV9) выполните смену полуносителя. Будьте осторожны, чтобы не аспирировать и не повредить капли мембранного матрикса в процессе.
- Еще через 2 дня (DIV11) выполните полную смену носителя, дополнив среду 3 мкМ CHIR99021 (см. Таблицу материалов).
- При DIV14 смените среду на дифференцировочную среду с B27 с витамином А (табл. 1) для постепенного увеличения размера органоидов.
- В DIV16 поместите лунку на орбитальный шейкер при 90 об/мин внутри инкубатора. Меняйте носитель каждые 2 дня.
- Каждые 40 ДЕЛ разбавляйте 500 мкл мембранной матрицы на каждые 50 мл среды для получения дополнительных питательных веществ в среде.
Результаты
Интеграция волокон PLGA, встраивание ямочек и перемешивание приводит к надежной генерации церебральных органоидов, что позволяет поддерживать культуры, полученные из iPSC, в течение длительных периодов времени (рис. 1).
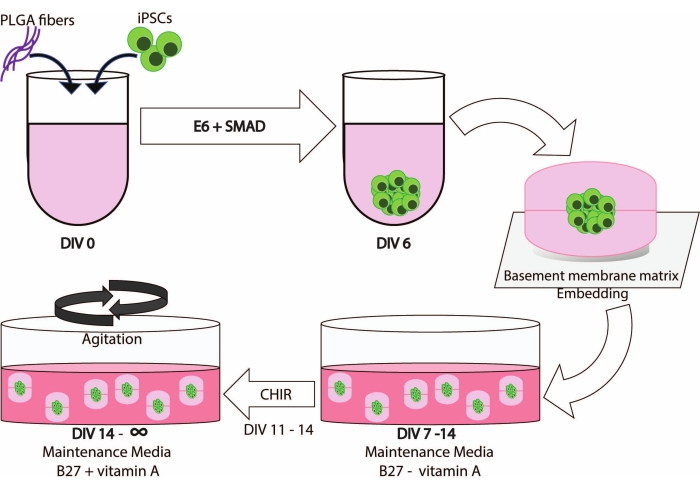
Рисунок 1: Схематическая иллюстрация рабочего процесса и временной шкалы этого метода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Начальный период нейронной индукции сопоставим с ранее опубликованными процедурами11. Эмбриоидные тела (EB) начинаются как круглые агрегаты (рис. 2B) с белыми или прозрачными краями. По мере того, как БЭ изменяется с среды нейронной индукции на среду для поддержания нейронов в DIV7, выступы и почки появляются в течение 24 часов из круговой ткани (рис. 2C). Кроме того, по мере того, как органоид продолжает расти, площадь поверхности волокна PLGA помогает органоиду удлиняться (рис. 2D). Во время созревания края органоида должны оставаться нетронутыми, так как это хороший признак здоровых клеток и развития; в противном случае должны быть обеспечены дополнительные питательные вещества13 (рис. 2Е). Росту органоидов дополнительно способствует перемешивание органоидной культуры, так как это улучшает перфузию питательных веществ.
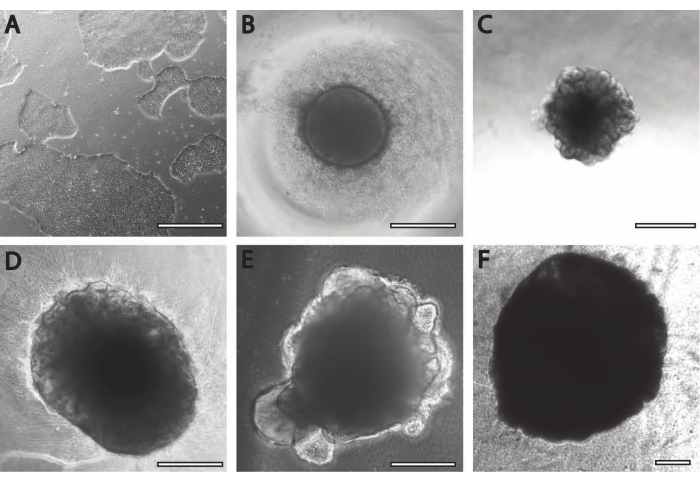
Рисунок 2: Дифференциация и созревание церебральных органоидов. (A) Репрезентативное изображение культуры ИПСК при слиянии 70-80%. (B) Были получены эмбриоидные тела (БЭ) и индуцировано образование нейроэпителия до DIV7. Затем БЭ встраивались в мембранный матрикс и далее дифференцировались в сторону церебральных органоидов. (C) Органоиды в DIV10 демонстрируют отчетливые почкования. Органоиды могут быть дополнительно созревать в мембранной матрице с использованием либо (D) углубления, либо (E) сэндвич-встраивания, показанного здесь на DIV30. (F) Долгосрочная культура показывает, что церебральные органоиды растут до значительных размеров (DIV70). Масштабная линейка = 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Размеры и внешняя морфология органоида дополняются сложной архитектурой внутри органоида. После фиксации ткани на DIV7 после первого этапа дифференцировки клетки EB экспрессируют SOX2 — фактор транскрипции бокса HMG, который выступает маркером для мультипотентных нейральных стволовых клеток21, а также парный белковый бокс Pax-6, указывающий на нейронные клетки-предшественники (рис. 3). Незрелые нейроны, отмеченные TuJ1 (класс III β-тубулином)22 , уже можно увидеть разбросанными по всей ткани.
На этом этапе становится очевидным пример самоорганизации, через которую проходят эти органоиды. Организация радиальных структур, называемых розетками, аналогична нервной трубке, с клетками SOX2+ в центрерозетки 21 и PAX6 по направлению к периферии розетки. Эти розетки дают начало нейронам, когда они мигрируют. Эти излучающие клетки изначально дважды положительны для маркера нейральных стволовых / клеток-предшественников Nestin23 и глиального фибриллярного кислого белка (GFAP), аналогично радиальной глии, обнаруженной в нейрогенных областях мозга in vivo . По мере того, как эти мигрирующие нейроны созревают, цитоскелетные маркеры отражают это изменение22. Маркер нейронной дифференцировки на ранней стадии TuJ1 22 виден во внутреннем круге розетки и переходит к ассоциированному с микротрубочками белку 2 (MAP2 )24, нейрон-специфическому маркеру созревания на периферии.
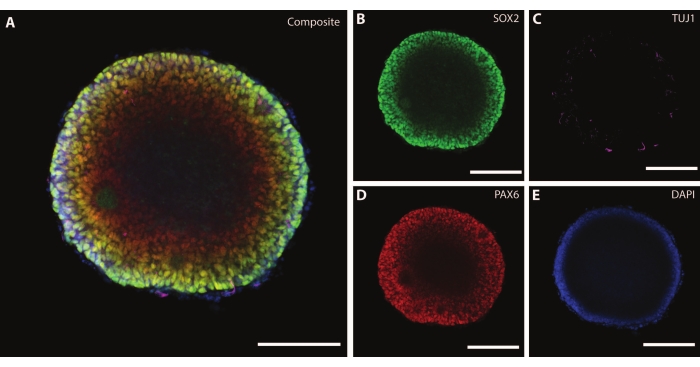
Рисунок 3: Эмбриоидные тела в DIV7 демонстрируют структурную организацию и незрелые характеристики. Иммуногистохимическое изображение БЭ в DIV7. (A) Составное изображение БЭ, демонстрирующее (B) нейронные розетки SOX2+, (C) незрелые нейроны (TUJ1), разбросанные по всей EB, (D) нейронные клетки-предшественники (PAX6) и (E) ядра, визуализированные с помощью DAPI. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
По мере старения органоидов организация и маркеры развивающихся нейронов начинают воспроизводить физиологические условия. При DIV30 можно наблюдать множество розеток, дающих начало нейрогенным областям, эквивалентным развивающемуся мозгу25. К DIV60 эти нейрогенные области SOX2+ отсутствуют и заменяются зрелыми MAP2 и NeuN26, маркером дифференцировки нейронов, и положительными нейронами (рис. 4 и рис. 5).
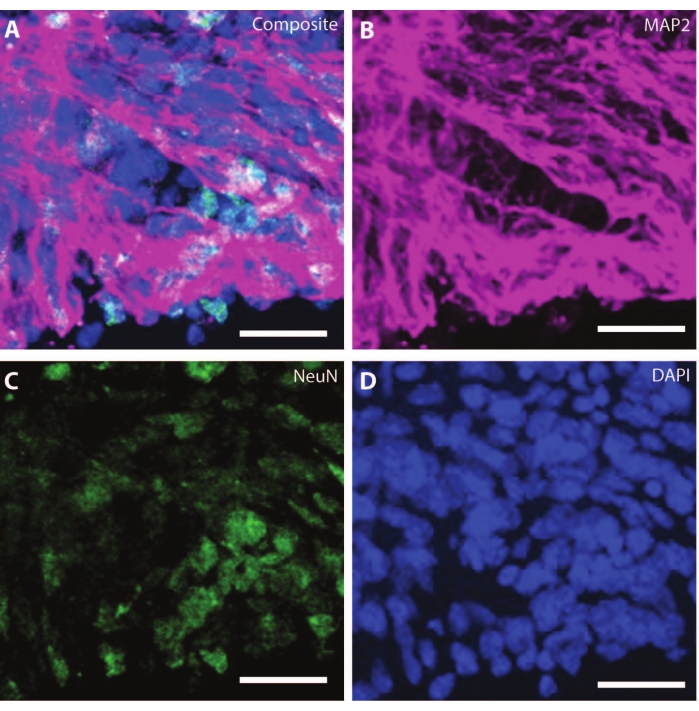
Рисунок 4: Органоиды в DIV120 демонстрируют характеристику зрелых нейронов. Иммуногистохимическое изображение среза органоида в DIV 120. (A) Составное изображение среза, показывающее зрелые нейронные маркеры (B) MAP2 (фиолетовый) и (C) NeuN (зеленый). (D) Ядра были визуализированы с помощью DAPI. Масштабная линейка = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
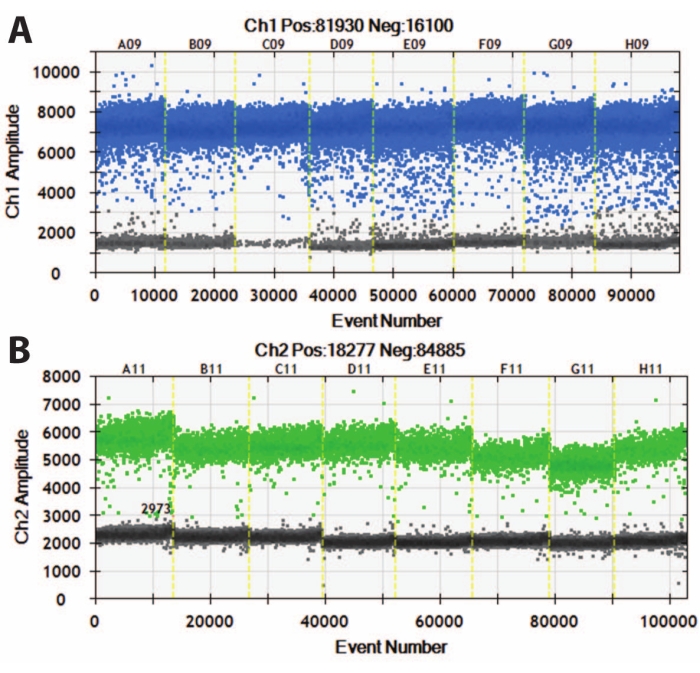
Рисунок 5: Цифровая капельная ПЦР органоидов DIV120. Цифровые графики капельной ПЦР, показывающие абсолютное значение экспрессии (A) MAP2 (вверху, синий) и (B) NeuN (внизу, зеленый). Желтые линии разделяют различные линии iPSC (A, B, C и т. Д.), А органоиды были объединены вместе. N = 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Эти цитоскелетные маркеры можно использовать в сочетании с другими постмитотическими маркерами (такими как даблкортин27 и синапсин28) для зондирования синаптической пластичности и других возрастных снижений (рис. 6), а также дополнительной мозговой ткани, такой как астроциты и глия (рис. 7).
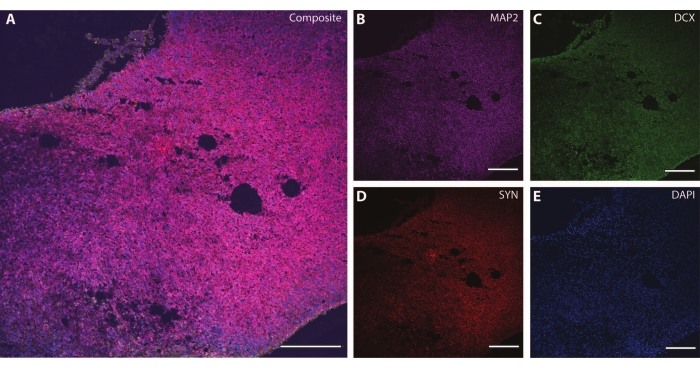
Рисунок 6: Пример синаптического терминального анализа. Иммуногистохимическое изображение среза органоида на DIV 120. (A) Составное изображение среза, окрашенного для (B) MAP2, (C) даблкортина (DCX) и (D) синапсина I (SYN). (E) Ядра были визуализированы с помощью DAPI. Масштабная линейка = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
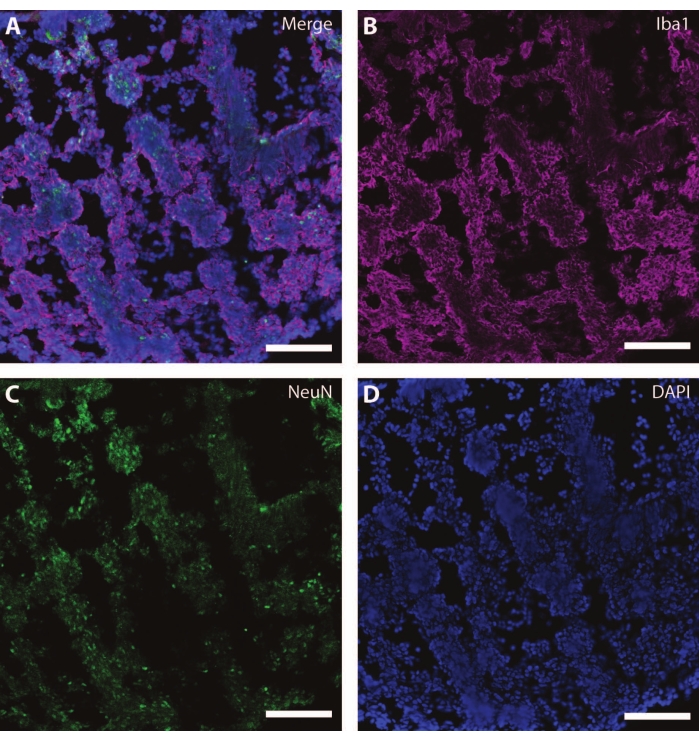
Рисунок 7: Признаки развития глии. Иммуногистохимическое изображение среза органоида на DIV 120. (A) Составное изображение среза, окрашенного для (B) ионизированной кальций-связывающей молекулы адаптера 1 (Iba1) и (C) NeuN. (D) Ядра были визуализированы с помощью DAPI. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагент | Окончательная концентрация | Объем (всего 50 мл) |
| ДМЭМ-Ф12 | 50% | 25 мл |
| Нейробазальная среда | 50% | 25 мл |
| Доплата N2 (100x) | 1x | 0,25 мл |
| Добавка B27 -/+ Витамин А (50x) | В 0,5 раза | 0,5 мл |
| Инсулин | 0.25% | 12,5 мкл |
| GlutaMAX (100x) | 1x | 0,5 мл |
| MEM-NEAA (100x) | В 0,5 раза | 0,25 мл |
| HEPES (1 м) | 10 мМ | 0,5 мл |
| Антибиотик/антимикотик (100x) | 1x | 0,5 мл |
| 2-β-меркаптоэтанол | 50 мкМ | 17,5 мкл |
| *ПРИМЕЧАНИЕ: некоторые DMEM-F12 уже содержат GlutaMAX, нет необходимости добавлять дополнительные. | ||
Таблица 1: Состав дифференцирующих сред, использованных в настоящем исследовании.
Обсуждение
Стандартизированное образование БЭ является критическим шагом в воспроизводимом превращении плюрипотентных стволовых клеток в органоиды мозга. Силовая агрегация стволовых клеток в отдельные ткани может варьироваться в зависимости от геометрии вогнутых лунок, плотности посева и обработки лунок. Хотя современный метод ссылается на диапазон диаметров 500-600 мкм через 6 дней, эти диаметры не исключают других диаметров правильного образования органоидов, так как многие другие диаметры оказались успешными. Однако было показано, что различные диаметры влияют на скорость дифференциации и успех29. В целях воспроизводимости настоятельно рекомендуются вариации диаметра менее 50 мкм20. Кроме того, количество дней нейронной индукции может быть увеличено с 6 до 10 дней, чтобы позволить БЭ расти в диаметре, поскольку было показано, что использование ингибиторов SMAD эффективно продуцирует и поддерживает образование нейроэпителия уже после 5 дней воздействия30. В отсутствие ингибиторов SMAD нейронная индукция может давать противоречивые результаты, требуя более длительных периодов индукции. Ингибиторы SMAD, приведенные в этой работе, являются наиболее эффективными, но другие малые молекулы дорсоморфина и TGF-β могут быть использованы в их эффективной концентрации.
Матрица базальной мембраны обеспечивает отличный субстрат для роста и может применяться по-разному. Раннее использование матрицы включало базальную мембрану в качестве лунного покрытия31. Однако использование матрицы для встраивания тканей показало улучшение дифференцировки и созревания в этих тканях32. Было показано, что для органоидов использование матрицы улучшает дифференцировку ЭБ в органоиды, способствует созреванию и продлевает периоды культивирования33. В то время как органоиды все еще могут быть сформированы без матрицы, поскольку многие группы стремились создать культуру тканей без матрицы 34,35, исследования показали, что органоиды, встроенные в матрицу, имеют более высокую вероятность длительного времени культивирования и требуют меньшего обслуживания36. Ямочный метод встраивания обеспечивает равномерное покрытие поверхности органоида, обеспечивая аналогичную диффузию, доступ к питательным веществам и воспроизводимую дифференцировку. В качестве альтернативы можно использовать закладку купола для полной инкапсуляции органоидов37.
Перенос ЭБ в углубления мембранной матрицы является критическим шагом. Хотя наконечник пипетки объемом 1 мл имеет достаточно широкое отверстие для переноса ЭБ, наконечник объемом 200 мкл предпочтительнее для удобства переноса. Наконечники объемом 200 мкл необходимо обрезать, чтобы создать достаточно большое отверстие, обеспечивающее гладкий край для снижения напряжения сдвига при пипетировании. В качестве альтернативы существуют широкопроходные наконечники объемом 200 мкл для удобства переноса. Пипетирование необходимо проводить медленно, так как быстрое пипетирование может нарушить периферию органоидов и помешать правильному росту. Особое внимание должно быть уделено обеспечению достаточного количества среды для обеспечения питательными веществами. Слишком маленькая среда рискует высушить органоид, вызвав некроз. Перенос ЭБ со слишком большим количеством питательных сред может привести к тому, что матрица будет слишком разбавлена и не сможет надежно инкапсулировать органоид. В идеале матрица не должна быть разбавлена более чем на 50%, чтобы обеспечить ее полимеризацию и функционировать в качестве ECM для ЭБ. Если встраивание не увенчалось успехом, ЭБ может быть восстановлен и повторно инкапсулирован. Повторная инкапсуляция в свежую матрицу может быть выполнена в любой точке, чтобы обеспечить органоиду дополнительную поддержку.
Подобно встраиванию матрицы для строительных лесов, волокна PLGA обеспечивают дополнительную поддержку трехмерного роста. Первоначально включенные для получения удлиненных органоидов и увеличения площадиповерхности 38, включение волокон PLGA постепенно было идентифицировано как дополнительный инструмент для улучшения дифференциации и созревания органоидов39. По мере того, как все больше лабораторий стремятся сократить использование матрицы или полностью отказаться от нее, самоорганизующиеся свойства органоидов, поддерживаемые включенными волокнами, обеспечивают достаточные леса для создания и дифференцировки трехмерных тканей39. Здесь оба метода были объединены, чтобы увеличить шансы на долгосрочное выращивание38,39. Включение волокон во время начальной агрегации имеет решающее значение, так как они не могут быть введены на более поздней стадии. После центрифугирования проверка того, что пара волокон находится среди агрегированных ячеек, гарантирует, что волокно включено в EB. Если это не удается, мягкая аспирация скважины и повторное центрифугирование должны обеспечить перемешивание.
Еще одним важным шагом в обслуживании органоидов является внедрение орбитального шейкера для лучшей перфузии среды. В ранних итерациях органоидных протоколов вращающийся биореактор использовался для создания перемешивания11. Орбитальный шейкер при 90 об/мин обеспечивает достаточное перемешивание, не разрушая матричную каплю и не повреждая морфологию органоидов. Некоторые группы воздерживаются от использования матричных лесов, но сохраняют перемешивание шейкера, чтобы обеспечить подходящую среду34. Как и во всех протоколах, скорость вращения должна регулироваться в зависимости от шейкера, чтобы уменьшить величину напряжения сдвига. Если было выбрано купольное встраивание, можно было бы использовать наклонный шейкер для уменьшения величины напряжения сдвига11,34.
Взятые вместе, интеграция нескольких выбранных методов обеспечивает надежный метод образования органоидов, полученных из iPSC. Существует несколько способов создания и поддержания органоидов, но многие из них ориентированы на ранние траектории дифференциации. В этой работе несколько различных методов были объединены для культивирования органоидов в течение длительных периодов времени, после фазы дифференцировки и в период созревания, когда могут начать развиваться фенотипы старения. Включение этих методов позволяет обеспечить длительное созревание без необходимости использования экзогенных биологических факторов для поддержания культур, сохраняя самоорганизацию и естественное прогрессирование старения.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана Нидерландской инициативой «Орган-на-чипе», проектом NWO Gravitation (024.003.001), финансируемым Министерством образования, культуры и науки правительства Нидерландов. D.C.B. с благодарностью признает финансовую поддержку Consejo Nacional de Ciencia y Tecnología (CONACyT) в виде докторской стипендии.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-β-Mercaptoethanol | Thermo Fisher Scientific | 31350010 | |
| 4′,6-Diamidino-2-phenylindoledihydrochloride (DAPI) | Invitrogen | D1306 | 1:4000 |
| 6-well Clear Flat Bottom CELLSTAR Cell Culture Multiwell Plate | Greiner Bio-One | 657185 | |
| 6-well Clear Flat Bottom Ultra-Low Attachment Well Plate | Corning | 3471 | |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Fisher Scientific | 136101 | |
| Accutase | Sigma-Aldrich | 46964 | cell detachment solution |
| Antibiotic-Antimycotic (100x) | Gibco | 15240062 | |
| B27 Suppement (with Vitamin A) (50x) | Gibco | 17504044 | |
| B27 Supplement (minus Vitamin A) (50x) | Gibco | 12587010 | |
| BD Vacutainer™ Glass Mononuclear Cell Preparation (CPT) Tubes | Thermo Fisher Scientific | 02-685-125 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Centrifuge | Eppendorf | 5810 R | With plate holders |
| CHIR99021 | Selleck Chemicals | S2924 | |
| CytoTune Sendai Reprogramming Vector | Thermo Fisher Scientific | A1378001 | |
| ddPCR primers | human | MAPT | Bio-Rad | dHsaCPE192234 | |
| ddPCR primers | human | RBFOX3 (NeuN) | Bio-Rad | dHsaCPE5052108 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320074 | |
| Doublecortin (DCX) | Santa Cruz Biotechnology | SC-8066 | 1:500 |
| Dulbecco’s phosphate buffered saline (DPBS) | Thermo Fisher Scientific | 14190144 | no calcium, no magnesium |
| Eppendorf cups, 1.5 mL | Eppendorf | 0030 125.215 | |
| Essential 6 | Gibco | A1516401 | |
| Essential 8 | Gibco | A1517001 | |
| Ethylenediaminetetraacetic acid (EDTA) | Invitrogen | 15575020 | |
| Falcon tubes, 15 mL, conical | Greiner Bio-One | 188271-N | |
| Formaldehyde | Sigma-Aldrich | 252549 | 37% Stock solution, diluted to 4% in PBS |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413202 | |
| GlutaMax (100x) | Gibco | 35050038 | |
| Hemacytometer cell counter | Hausser scientific | 1490 | |
| HEPES Buffer | Thermo Fisher Scientific | 15-630-080 | |
| Insulin | Sigma-Aldrich | I9278 | |
| LDN 193189 | StemCell Technologies | 72147 | |
| MAP2 | Abcam | ab32454 | 1:200 |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free | Corning | 356230 | basement membrane matrix |
| MEM-Non Essential Amino Acid Solution (MEM-NEAA; 100x) | Thermo Fisher Scientific | 11140050 | |
| Multilabel Counter Victor 3 Plate Reader | Perkin Elmer | 1420 | luminometer |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| N-2 Supplement (100x) | Thermo Fisher Scientific | 17502-048 | |
| NeuN | Millipore | MAB377 | 1:500 |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | |
| Oct-3/4 Antibody (C-10) Alexa Fluor 647 | Santa Cruz Biotechnology | sc-5279 AF647 | 1:100 |
| Parafilm | Bemis | PM-996 | thermoplastic film sheet |
| PAX6 | Thermo Fisher Scientific | 42-6600 | 1:200 |
| Penicillin/Streptomycin | Gibco | 15070063 | |
| Poly(lactic-co-glycolic acid) (PLGA) microfilaments | Ethicon | J463 | |
| QX200 Droplet digital PCR system | Bio-Rad | 1864001 | |
| ROCK inhibitor (Y27632) | Selleck Chemicals | S1049 | |
| SB431542 | R&D Systems | 1614/50 | |
| SOX2 Monoclonal Antibody (Btjce), Alexa Fluor 488, eBioscience | Invitrogen | 53-9811-80 | 1:100 |
| Synapsin I (SYN) | Calbiochem | 574777 | 1:200 |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| TUJ1 | Santa Cruz Biotechnology | sc-80005 | Beta-3-tubulin; 1:500 |
| XAV939 | Tocris Bioscience | 3748 |
Ссылки
- Liu, G. H., et al. Aging Atlas: a multi-omics database for aging biology. Nucleic Acids Research. 49, 825-830 (2021).
- Ferrucci, L., et al. Measuring biological aging in humans: A quest. Cell. 19 (2), 13080 (2020).
- Mertens, J., Reid, D., Lau, S., Kim, Y., Gage, F. H. Aging in a dish: iPSC-derived and directly induced neurons for studying brain aging and age-related neurodegenerative diseases. Annu Rev Genet. 52, 271-293 (2018).
- Mertens, J., et al. Age-dependent instability of mature neuronal fate in induced neurons from Alzheimer's patients. Cell Stem Cell. 28 (9), 1533-1548 (2021).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1141-1154 (2018).
- Fang, E. F., et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease. Nature Neuroscience. 22 (3), 401-412 (2019).
- Hu, J. L., Todhunter, M. E., LaBarge, M. A., Gartner, Z. J. Opportunities for organoids as new models of aging. Journal of Cell Biology. 217 (1), 39-50 (2018).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Gonzalez, C., et al. Modeling amyloid beta and tau pathology in human cerebral organoids. Molecular Psychiatry. 23 (12), 2363-2374 (2018).
- Yoon, S. -. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Muratore, C. R., Srikanth, P., Callahan, D. G., Young-Pearse, T. L. Comparison and optimization of hiPSC forebrain cortical differentiation protocols. PLoS ONE. 9 (8), 105807 (2014).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2020).
- Goto-Silva, L., et al. Computational fluid dynamic analysis of physical forces playing a role in brain organoid cultures in two different multiplex platforms. BMC Developmental Biology. 19 (1), 1-10 (2019).
- Sommer, A. G., et al. Generation of human induced pluripotent stem cells from peripheral blood using the STEMCCA lentiviral vector. Journal of Visualized Experiments. (68), e4327 (2012).
- Beers, J., et al. A cost-effective and efficient reprogramming platform for large-scale production of integration-free human induced pluripotent stem cells in chemically defined culture. Scientific Reports. 5 (1), 1-9 (2015).
- Wakao, S., et al. Morphologic and gene expression criteria for identifying human induced pluripotent stem cells. PLoS ONE. 7 (12), e48677 (2012).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2022).
- Choy Buentello, D., Koch, L. S., Trujillo-De Santiago, G., Alvarez, M. M., Broersen, K. Use of standard U-bottom and V-bottom well plates to generate neuroepithelial embryoid bodies. PLOS ONE. 17 (5), 0262062 (2022).
- Ellis, P., et al. SOX2, a persistent marker for multipotential neural stem cells derived from embryonic stem cells, the embryo or the adult. Developmental Neuroscience. 26 (2-4), 148-165 (2004).
- Lee, S., et al. TuJ1 (class III β-tubulin) expression suggests dynamic redistribution of follicular dendritic cells in lymphoid tissue. European Journal of Cell Biology. 84 (2-3), 453-459 (2005).
- Suzuki, S., Namiki, J., Shibata, S., Mastuzaki, Y., Okano, H. The neural stem/progenitor cell marker nestin is expressed in proliferative endothelial cells, but not in mature vasculature. Journal of Histochemistry and Cytochemistry. 58 (8), 721-730 (2010).
- Soltani, M. H., et al. Microtubule-associated protein 2, a marker of neuronal differentiation, induces mitotic defects, inhibits growth of melanoma cells, and predicts metastatic potential of cutaneous melanoma. The American Journal of Pathology. 166 (6), 1841-1850 (2005).
- Wilson, P. G., Stice, S. S. Development and differentiation of neural rosettes derived from human embryonic stem cells. Stem Cell Reviews. 2 (1), 67-77 (2006).
- Gusel'nikova, V. V., Korzhevskiy, D. E. NeuN as a neuronal nuclear antigen and neuron differentiation marker. Acta Naturae. 7 (25), 42-47 (2015).
- Rao, M. S., Hattiangady, B., Shetty, A. K. The window and mechanisms of major age-related decline in the production of new neurons within the dentate gyrus of the hippocampus. Aging Cell. 5 (6), 545-558 (2006).
- Meng, L., et al. A synapsin I cleavage fragment contributes to synaptic dysfunction in Alzheimer's disease. Aging Cell. 21 (5), 13619 (2022).
- Moon, S. H., et al. Optimizing human embryonic stem cells differentiation efficiency by screening size-tunable homogenous embryoid bodies. Biomaterials. 35 (23), 5987-5997 (2014).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Lee, S. -. W., et al. Optimization of Matrigel-based culture for expansion of neural stem cells. Animal Cells and Systems. 19 (3), 175-180 (2015).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: The matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Hocevar, S. E., Liu, L., Duncan, R. K. Matrigel is required for efficient differentiation of isolated, stem cell-derived otic vesicles into inner ear organoids. Stem Cell Research. 53, 102295 (2021).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Communications Biology. 4 (1), 1-15 (2021).
- Kaiser, A., Kale, A., Novozhilova, E., Olivius, P. The effects of Matrigel® on the survival and differentiation of a human neural progenitor dissociated sphere culture. The Anatomical Record. 303 (3), 441-450 (2020).
- Kakni, P., et al. Intestinal organoid culture in polymer film-based microwell arrays. Advanced Biosystems. 4 (10), 2000126 (2020).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Tejchman, A., Znój, A., Chlebanowska, P., Frączek-Szczypta, A., Majka, M. Carbon fibers as a new type of scaffold for midbrain organoid development. International Journal of Molecular Sciences. 21 (17), 5959 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены