Method Article
Fabrication de tissus robustes pour la culture à long terme d’organoïdes cérébraux dérivés de CSPi pour la recherche sur le vieillissement
Dans cet article
Résumé
Le présent protocole fournit une procédure étape par étape pour la génération, le maintien et le vieillissement reproductibles d’organoïdes cérébraux dérivés de cellules souches pluripotentes induites par l’homme (CSPi). Cette méthode permet de cultiver et de faire mûrir des organoïdes cérébraux pendant de longues périodes, ce qui facilite la modélisation des processus impliqués dans le vieillissement cérébral et la pathogenèse liée à l’âge.
Résumé
Les modèles animaux et cellulaires actuellement disponibles ne récapitulent pas complètement la complexité des changements qui se produisent dans le cerveau humain vieillissant. Un développement récent de procédures décrivant la génération d’organoïdes cérébraux humains, dérivés de cellules souches pluripotentes induites par l’homme (CSPi), a le potentiel de transformer fondamentalement la capacité de modéliser et de comprendre le vieillissement du cerveau humain et les processus pathogènes connexes. Ici, un protocole optimisé pour la génération, le maintien, le vieillissement et la caractérisation des organoïdes cérébraux dérivés de l’iPSC humaine est présenté. Ce protocole peut être mis en œuvre pour générer des organoïdes cérébraux de manière reproductible et sert de guide étape par étape, incorporant les dernières techniques qui améliorent la maturation organoïde et le vieillissement en culture. Des questions spécifiques liées à la maturation organoïde, à la nécrose, à la variabilité et aux effets des lots sont abordées. Ensemble, ces avancées technologiques permettront de modéliser le vieillissement cérébral chez les organoïdes issus d’une variété de donneurs humains jeunes et âgés, ainsi que chez les personnes atteintes de troubles cérébraux liés à l’âge, permettant ainsi l’identification des mécanismes physiologiques et pathogènes du vieillissement cérébral humain.
Introduction
Les modèles de maladies vieillissantes sont devenus de plus en plus pertinents à mesure que l’espérance de vie humaine continue d’augmenter. Des études génomiques à grande échelle ont révélé des populations âgées présentant une dérégulation des processus moléculaires et des changements génétiques affectant la qualité de vie1. Le processus de vieillissement se caractérise par une perte générale de fonctionnalité de l’organisme, y compris une perte de la fonction cognitive, un risque accru de troubles neurodégénératifs et une foule de maladies chroniques2.
Les techniques actuelles de culture cellulaire ne représentent pas de manière appropriée la nature multifactorielle du vieillissement, car ces dysfonctionnements ne peuvent pas être correctement reproduits en utilisant des mutations, des toxines ou des infections3. Les modèles animaux qui explorent le processus de vieillissement sont souvent associés à de longs temps d’expérimentation et à des coûts élevés, mais apportent également des considérations éthiques. L’utilisation de cellules souches pluripotentes induites (CSPi) de patients peut élucider les mécanismes moléculaires qui sous-tendent la progression de la maladie, car les CSPi permettent le développement naturel des cellules dans les tissus matures3. Les CSPi sont devenues le cheval de bataille de nombreux laboratoires qui étudient les maladies neurodégénératives, car la reprogrammation cellulaire des cellules récoltées ne semble pas effacer les empreintes de la maladie ou du vieillissement des donneurs4. Ces empreintes récapitulent les phénotypes cellulaires qui ont été démontrés dans des modèles humains et animaux, ce qui rend les CSPi appropriées pour examiner la détérioration cellulaire individuelle du tissu cérébral très dense 5,6. Les organoïdes dérivés de l’IPSC sont devenus le modèle prééminent pour la culture tridimensionnelle de tissus, permettant des interactions intercellulaires plus complexes et une meilleure récapitulation développementale. Bien que principalement utilisés pour les données sur le développement, les organoïdes ont été de plus en plus utilisés pour la modélisation des maladies, en particulier les modèles d’inflammation, de neurodégénérescence et de vieillissement7. S’appuyant sur des études antérieures sur les CSPi, les organoïdes conservent les phénotypes de la maladie et les phénotypes cellulaires dans le contexte physiologique des connexions réseau tissulaires 8,9. Cependant, la culture de tissus tridimensionnels de certaines dimensions peut être difficile, en particulier pendant de longues périodes.
Ce travail présente une méthode détaillée pour la génération reproductible d’organoïdes cérébraux qui permet au tissu de mûrir considérablement en taille pendant de plus longues périodes. La création d’organoïdes cérébraux est restée relativement standardisée, adoptant des méthodes de plusieurs protocoles importants10,11. Cependant, plusieurs modifications ont été suggérées pour améliorer la différenciation et la maintenance. Ces méthodes alternatives comprennent l’utilisation de facteurs neurogènes pour améliorer la différenciation neuronale12, des échafaudages supplémentaires pour améliorer l’échange de nutriments favorisant la longévité cellulaire 13 et une agitation de stress à faible intensité pour une culture et une croissance prolongées14. Ces améliorations ont été incorporées dans cette méthode pour développer des organoïdes matures capables d’exprimer des phénotypes neurodégénératifs et vieillissants.
Protocole
Les études sur les patients ont été approuvées par le comité d’examen institutionnel. Tous les participants ont signé un consentement éclairé écrit et un consentement du dépôt pour permettre la réutilisation de leurs données et de leurs échantillons biologiques. Les lignes de la CSPi ont été générées conformément aux lignes directrices de la CISR et de l’établissement. La figure 1 illustre une vue d’ensemble schématique du flux de travail de ce protocole.
1. Reprogrammation et maintenance des CSPi
- Prélever 8 mL du sang du sujet (patient âgé ou malade; 65 ans et plus) dans des tubes de préparation cellulaire (CPT) contenant du citrate de sodium ou dans des tubes EDTA ou héparinisés.
- Centrifuger à 1 800 x g pendant 30 min à température ambiante (RT) pour recueillir la pastille contenant uniquement du sang périphérique et pas de sérum15.
- Utiliser des vecteurs de reprogrammation spécialisés selon le protocole du fabricant (voir le tableau des matières) pour obtenir desCSPi 16.
- Cellules de culture iPSC dans des plaques de culture à 6 puits recouvertes de matrice basale à 6 puits sans lactose déshydrogénase et exemptes de virus d’élévation de lactose déshydrogénase (voir le tableau des matériaux) à 37 °C dans une atmosphère humidifiée contenant 5 % de CO2.
- Maintenir les CSPi dans les milieux E8 pendant 3-4 jours afin d’éviter la surpopulation ou la différenciation spontanée.
- Valider la pluripotence des lignées iPSC à l’aide de marqueurs immunofluorescents (étape 2) et tester les mycoplasmes (étape 3).
2. Coloration de la pluripotence
- Pour conserver les solutions et les anticorps, ensemencer les cellules sur des plaques de culture enrobées (étape 1.4) de 24 puits 3 à 4 jours avant l’analyse. Aspirer le milieu avec une pipette et fixer les cellules avec 4% de formaldéhyde dans une solution saline tamponnée au phosphate (1x PBS) pendant 15-20 minutes à TA.
- Laver les cellules 3x avec 1x PBS et perméabiliser avec 0,1% Triton-X 100 dans 1% d’albumine sérique bovine (BSA) dans PBS pendant au moins 15 min, mais pas plus de 1 h à TA.
- Laver 3x avec 1x PBS et bloquer avec 5% BSA dans PBS pendant 30 min à TA.
- Laver à nouveau 3x avec 1x PBS et ajouter les anticorps Sox2 et Oct3/4 (dilution 1:100; voir le tableau des matériaux), et la coloration nucléique DAPI dans 1% BSA (dilution 1:4 000) pendant une nuit à 4 °C. Envelopper dans du papier d’aluminium pour protéger de la lumière.
- Lavez 3x avec 1x PBS et laissez les cellules dans PBS. Image avec un microscope à fluorescence à un grossissement de 10-20x. S’assurer que les marqueurs de pluripotence Sox2 et Oct3/4 sont localisés dans les noyaux des cellules17,18.
3. Analyse des mycoplasmes
REMARQUE : Reportez-vous au protocole du kit de détection (voir le tableau des matériaux) pour connaître les étapes détaillées de l’exécution et de l’analyse des essais. Le kit de détection fournit le réactif, le substrat et le tampon de dosage pour les tests de mycoplasmes.
- Avant de passer les cellules ou le milieu rafraîchissant, prélever 2-3 mL de milieu de culture cellulaire dans un tube à centrifuger et enduire en granulés les cellules ou les débris à 200 x g pendant 5 minutes à TA. Conservez le surnageant à 4 °C pendant ≤5 jours. Incuber les cellules avec le milieu pendant au moins 24 heures pour assurer un signal détectable.
- Ajouter 100 μL de surnageant cellulaire à un tube neuf ou à un puits d’une plaque de 96 puits à paroi blanche (fond opaque recommandé, voir le tableau des matériaux). Reconstituer le réactif et le substrat dans le tampon de dosage et équilibrer pendant 15 min à TA.
- Ajouter 100 μL du réactif à l’échantillon et incuber pendant 5 min à TA. Mesurer la luminescence avec un luminomètre (mesure #1).
- Ajouter 100 μL du substrat à l’échantillon et incuber pendant 10 min à TA. Mesurer la luminescence (mesure #2).
- Déterminer la contamination par mycoplasmes par le rapport de mesure #2 à #1. Reportez-vous au manuel de la trousse pour l’interprétation des résultats.
4. Préparation de microfilaments
- Commencer la préparation des microfilaments poly(acide lactique-co-glycolique) (PLGA, voir tableau des matériaux) en effilochant le brin de suture avec l’extrémité émoussée d’un scalpel. Stérilisez légèrement la fibre effilochée avec de l’éthanol à 70%.
- Au microscope et à l’aide d’une règle, commencez à couper la fibre PLGA en fragments de brins de 500 μm à 1 mm de long. Coupez environ 25 mm de la fibre au total. Conservez les filaments dans un tube de 15 mL avec une solution antibiotique-antimycotique de 1 mL.
- Dans la hotte, diluer la solution fibreuse avec 10 ml de DMEM/F-12 (tableau 1). Vortex bien mélanger la solution.
REMARQUE: Travailler dans une hotte de flux de culture cellulaire dans un environnement stérile.
- Dans la hotte, diluer la solution fibreuse avec 10 ml de DMEM/F-12 (tableau 1). Vortex bien mélanger la solution.
- Ajouter 20 μL de la solution fibreuse à trois corps embryoïdes (EB) formant des puits d’une plaque de 96 puits. En microscopie à fond clair, compter et faire la moyenne des fibres par puits. Diluer ou concentrer en moyenne 5 à 10 microfilaments PLGA par puits. Préparez chaque puits de cette manière.
- Les puits sont maintenant prêts à être ensemencés avec des cellules. Conservez la plaque à température ambiante jusqu’à ce qu’on en ait besoin ou à 4 °C pour le lendemain.
5. Formation du corps embryoïde (EB)
REMARQUE: Tous les milieux et solutions doivent être chauffés à RT.
- Une fois que les CSPi ont atteint une confluence de 70 % à 80 % (figure 2A), elles sont prêtes à être passées et utilisées pour la formation d’EB. Vérifiez les cellules avec un microscope à un grossissement de 10x-20x. S’assurer que les colonies présentent des zones minimales (<10%) de différenciation spontanée.
- Aspirez le milieu avec une pipette et lavez les cellules une fois avec DPBS. Dissocier les colonies en ajoutant 500 μL de solution de décollement cellulaire (voir le tableau des matières) ou 0,5 mM d’acide éthylènediaminetétraacétique (EDTA) et incuber pendant 3-5 min à 37 °C.
REMARQUE: Travailler dans une hotte de flux de culture cellulaire dans un environnement stérile. - Recueillir les cellules libérées en ajoutant 1 mL de milieu E8 frais dans chaque puits et pipeter doucement jusqu’à ce que toutes les cellules soient détachées.
- Transférer 1,5 mL de suspension cellulaire dans un tube de 15 mL et ajouter 1 mL de média E8 frais pour atteindre un volume total de 2,5 mL.
- Centrifuger à 290 x g pendant 3 min à RT.
- Aspirer le surnageant à l’aide d’une pipette, remettre en suspension la pastille cellulaire dans 1 mL de milieu Essential 6 (E6, voir le tableau des matières) supplémenté en inhibiteur de ROCK 50 μM, et compter les cellules à l’aide d’un hémocytomètre19.
- Préparer une suspension cellulaire de 60 000 à 90 000 cellules/mL, selon la densité d’ensemencement souhaitée, dans un milieu E6 additionné de 50 μM d’inhibiteur de ROCK (voir le tableau des matières).
- Ajouter 150 μL de la suspension cellulaire dans chaque puits d’une plaque ULA de 96 puits (ou d’une plaque concavepréparée 20). Ensemencez 9 000 à 11 000 cellules par puits.
- Centrifuger la plaque pour forcer-agréger les cellules à 290 x g pendant 1 min à TA. Placer la plaque dans l’incubateur à 37 °C dans une atmosphère humidifiée avec 5% de CO2.
6. Induction neuroépithéliale
- Après 24 h, aspirer soigneusement 120 μL du média à l’aide d’une pipette. Assurez-vous de ne pas aspirer l’EB en abaissant l’extrémité de la pipette trop loin dans le puits.
- Ajouter 150 μL de milieu E6 (à TA) complété par 2 μM de XAV939 et les inhibiteurs SMAD : 10 μM de SB431542 et 500 nM de LDN 193189 par puits (voir Tableau des matériaux).
- Changez le milieu quotidiennement avec des milieux E6 fraîchement préparés complétés par 2 μM de XAV939, 10 μM de SB431542 et 500 nM de LDN 193189.
NOTE: Au jour 6 (DIV6), les EB doivent avoir un diamètre de 550 à 600 μm et être prêts pour une différenciation supplémentaire.
7. Différenciation et maturation organoïdes
REMARQUE: Tous les médias doivent être chauffés à RT.
- À environ DIV7, vérifier si tous les EB ont atteint un diamètre de 550-600 μm et présentent un bord lisse et clair (figure 2B); à ce stade, ils sont prêts à être intégrés dans une matrice extracellulaire (ECM).
REMARQUE: Travailler dans un environnement stérile. - Préparez des feuilles d’encastrement alvéolées à partir du film d’étanchéité thermoplastique (voir le tableau des matériaux) en plaçant une feuille de film (environ 4 pouces de long) sur une boîte P200 vide. À l’aide d’un tube conique de 15 ml ou d’un tube microcentrifuge de 500 μL, pressez doucement la feuille de film dans les trous pour obtenir 12 fossettes. Vaporisez la feuille de film avec de l’éthanol à 70% et laissez-la sécher à l’intérieur de la hotte d’écoulement avec la lumière UV allumée pendant au moins 30 minutes.
- Décongeler une quantité suffisante de matrice membranaire basale (Matrigel, voir Tableau des matériaux) sur la glace et la placer à l’intérieur de la hotte.
NOTE: Par EB, environ 30 μL de matrice membranaire non diluée sont nécessaires. Maintenez toujours la matrice membranaire en dessous de 4 °C pour l’empêcher de gélifier. Les pointes de pipettes pré-refroidies sont également recommandées car elles ralentissent la matrice de polymériser dans la pointe pendant le pipetage, réduisant ainsi la perte de matière. - À l’aide d’une pointe P200 de grand alésage, transférer un EB sur chaque fossette et retirer autant de média que possible avec une pointe de pipette normale. Veillez à ne pas laisser sécher les EB. À l’aide d’un embout P200 régulier, ajoutez ~30 μL de matrice membranaire non diluée à chaque organoïde, en vous assurant que l’EB est au centre de la gouttelette.
- Une fois que tous les EB sont incorporés dans la matrice, placez la feuille de film contenant les EB dans une boîte de Petri stérile.
REMARQUE: En option, une petite boîte de Petri remplie d’eau stérile peut être placée dans la plus grande boîte de Petri à côté de la feuille de film pour éviter l’évaporation.- Transférer la capsule dans un incubateur et incuber à 37 °C dans une atmosphère humidifiée avec 5% de CO2 pendant environ 10 min pour laisser la matrice membranaire se solidifier.
- Pour chaque ensemble de 12 organoïdes intégrés, préparer 5 mL de milieu de différenciation avec B27 sans vitamine A (tableau 1) dans un puits d’une plaque ULA à 6 puits. Préchauffer la plaque à 37 °C dans un incubateur.
- Une fois le temps d’incubation terminé, transférez les EB incorporés sur la plaque ULA 6 puits en prenant la feuille de film et en poussant les fossettes à l’arrière de la feuille. Si nécessaire, prélever 1 mL du puits et le pipeter sur la feuille pour aider les gouttelettes à se détacher du film.
NOTE: Des changements morphologiques importants peuvent être observés 1 jour après l’incorporation; Les EB vont d’avoir des bords lisses à des protubérances bombées formant des bourgeons (Figure 2C). - Après 2 jours (DIV9), effectuez un changement de demi-média. Veillez à ne pas aspirer ou endommager les gouttelettes de la matrice membranaire dans le processus.
- Après 2 jours supplémentaires (DIV11), effectuez un changement complet du milieu, en complétant le milieu avec 3 μM de CHIR99021 (voir le tableau des matériaux).
- À DIV14, changer le milieu pour différencier les milieux avec B27 avec de la vitamine A (tableau 1) pour une augmentation progressive de la taille des organoïdes.
- À DIV16, placer la plaque de puits sur un agitateur orbital à 90 tr/min à l’intérieur d’un incubateur. Changez le support tous les 2 jours.
- Tous les 40 DIV, diluer 500 μL de la matrice membranaire pour chaque 50 mL de milieu pour obtenir des nutriments supplémentaires dans le milieu.
Résultats
L’intégration des fibres PLGA, de l’encastrement des fossettes et de l’agitation conduit à une génération robuste d’organoïdes cérébraux qui permet de maintenir les cultures dérivées des CSPi pendant de longues périodes (Figure 1).
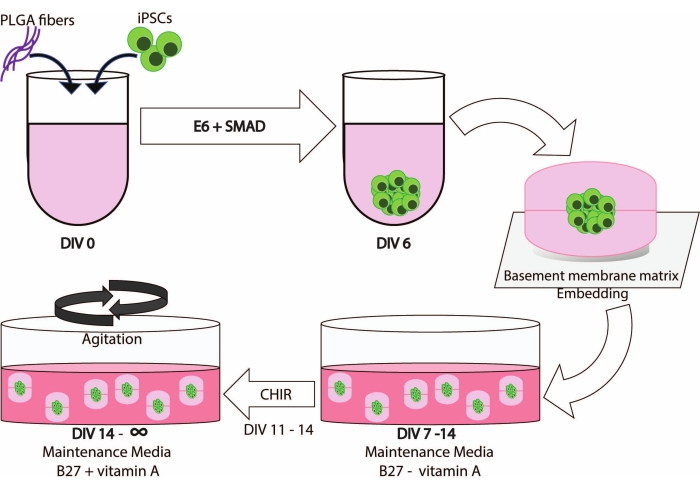
Figure 1 : Illustration schématique du flux de travail et de la chronologie de cette méthode. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La période initiale d’induction neuronale est comparable aux procédures précédemment publiées11. Les corps embryoïdes (EB) commencent par des agrégats circulaires (Figure 2B) avec des bords blancs ou transparents. Au fur et à mesure que l’EB passe du milieu d’induction neuronale au milieu d’entretien neuronal à DIV7, les saillies et les bourgeons émergent dans les 24 heures du tissu circulaire (Figure 2C). De plus, à mesure que l’organoïde continue de croître, la surface de la fibre PLGA aide l’organoïde à s’allonger (Figure 2D). Pendant la maturation, les bords de l’organoïde doivent rester intacts, car c’est un bon signe de cellules saines et de développement; sinon, des éléments nutritifs supplémentaires doivent être fournis13 (figure 2E). La croissance des organoïdes est encore facilitée par l’agitation de la culture organoïde, car cela améliore la perfusion avec les nutriments.
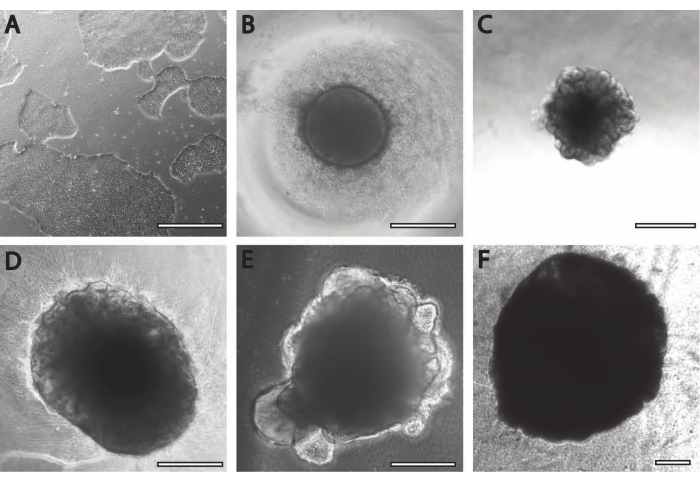
Figure 2 : Différenciation et maturation des organoïdes cérébraux. (A) Image représentative d’une culture de CSPi à 70%-80% de confluence. (B) Des corps embryoïdes (EB) ont été générés et la formation neuroépithéliale a été induite jusqu’à DIV7. Les EB ont ensuite été intégrés dans la matrice membranaire et différenciés davantage en organoïdes cérébraux. (C) Organoïdes à DIV10 présentant des formations bourgeonnantes distinctes. Les organoïdes peuvent être affinés davantage dans la matrice membranaire en utilisant soit (D) fossette, soit (E) enrobage sandwich, ici montré à DIV30. (F) La culture à long terme montre que les organoïdes cérébraux atteignent des tailles significatives (DIV70). Barre d’échelle = 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les dimensions et la morphologie externe de l’organoïde sont complétées par une architecture complexe à l’intérieur de l’organoïde. Après avoir fixé le tissu à DIV7 après la première étape de différenciation, les cellules de l’EB expriment SOX2, un facteur de transcription en boîte HMG qui agit comme marqueur pour les cellules souches neuralesmultipotentes 21, ainsi que la boîte de protéines appariée Pax-6, indiquant les cellules progénitrices neurales (Figure 3). Des neurones immatures marqués par TuJ1 (classe III β-tubuline)22 sont déjà visibles dispersés dans tout le tissu.
À ce stade, un exemple de l’auto-organisation que ces organoïdes traversent devient évident. L’organisation des structures radiales, appelées rosettes, est analogue au tube neural, avec des cellules SOX2+ dans le centre de la rosette21 et PAX6 vers la périphérie de la rosette. Ces rosettes donnent naissance à des neurones lors de leur migration. Ces cellules rayonnantes sont initialement doublement positives pour le marqueur des cellules souches neurales / progénitrices Nestin23 et la protéine acide fibrillaire gliale (GFAP), similaires à la glie radiale trouvée dans les zones neurogènes du cerveau in vivo . Au fur et à mesure que ces neurones migrateurs mûrissent, les marqueurs cytosquelettiques reflètent ce changement22. Le marqueur de différenciation neuronale TuJ1 22 à un stade précoce est visible dans le cercle interne de la rosette et se déplace vers la protéine 2 associée aux microtubules (MAP2 )24, un marqueur de maturation spécifique au neurone à la périphérie.
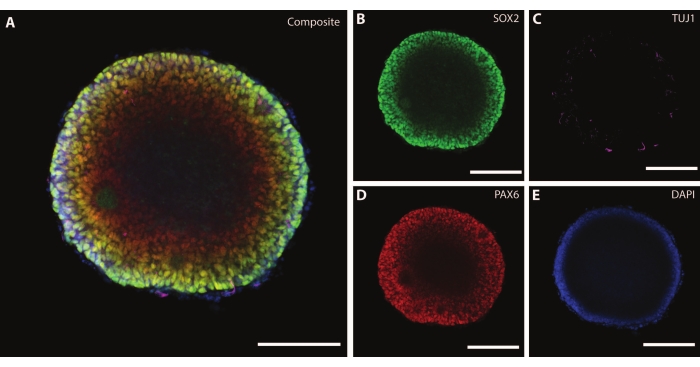
Figure 3 : Les corps embryoïdes à DIV7 montrent une organisation structurelle et une caractérisation immature. Image immunohistochimique à monture entière d’un EB à DIV7. (A) Une image composite de l’EB montrant (B) des rosettes neuronales SOX2+, (C) des neurones immatures (TUJ1) dispersés dans l’EB, (D) des cellules progénitrices neurales (PAX6) et (E) des noyaux visualisés par DAPI. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
À mesure que les organoïdes vieillissent, l’organisation et les marqueurs des neurones en développement commencent à reproduire les conditions physiologiques. A DIV30, de nombreuses rosettes donnant naissance à des régions neurogènes équivalentes au cerveau en développement peuvent être observées25. Par DIV60, ces régions neurogènes SOX2+ sont inexistantes et sont remplacées par MAP2 et NeuN26 matures, un marqueur de différenciation neuronale, et des neurones positifs (Figure 4 et Figure 5).
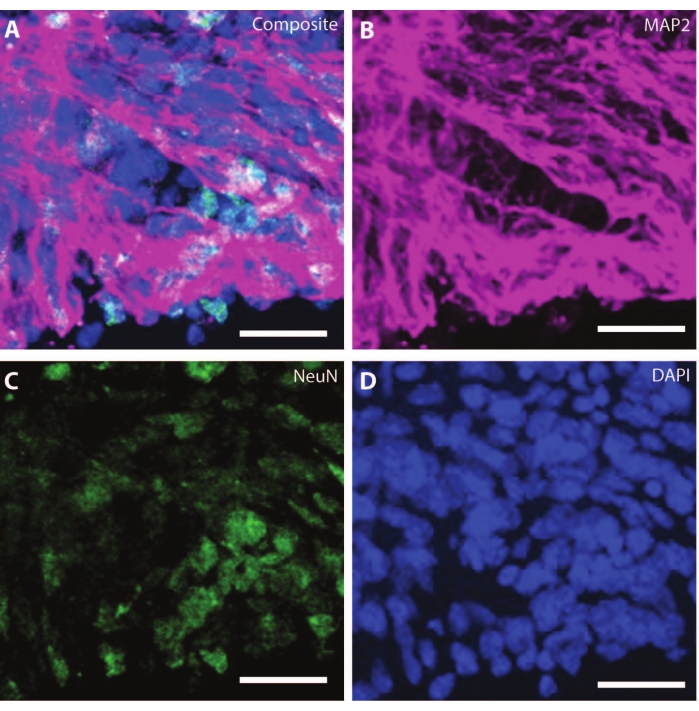
Figure 4 : Les organoïdes de DIV120 montrent une caractérisation neuronale mature. Image immunohistochimique d’une coupe organoïde à DIV 120. (A) Une image composite de la section montrant les marqueurs neuronaux matures de (B) MAP2 (violet) et (C) NeuN (vert). (D) Les noyaux ont été visualisés par DAPI. Barre d’échelle = 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
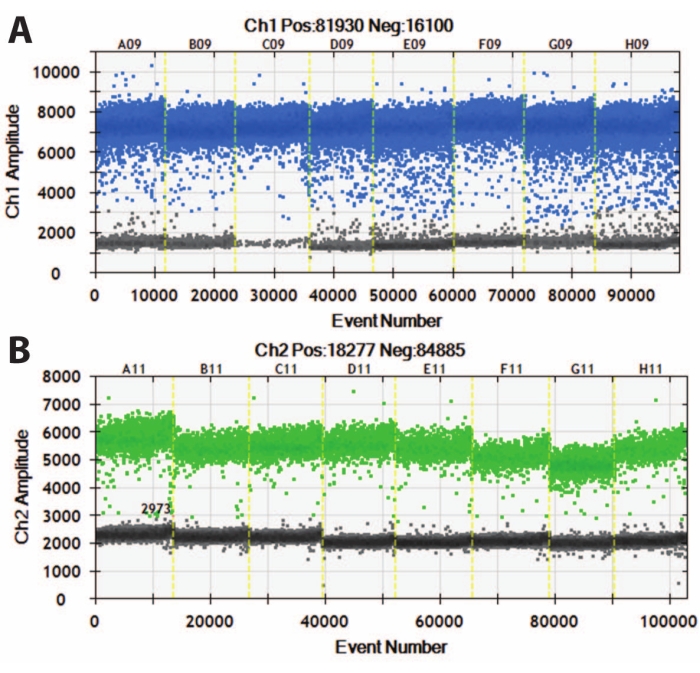
Figure 5 : PCR par gouttelettes numériques des organoïdes DIV120. Graphiques PCR par gouttelettes numériques montrant la valeur d’expression absolue de (A) MAP2 (en haut, bleu) et (B) NeuN (en bas, vert). Des lignes jaunes coupées séparent différentes lignes iPSC (A, B, C, etc.) et les organoïdes ont été regroupés ensemble. N = 5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ces marqueurs cytosquelettiques peuvent être utilisés en conjonction avec d’autres marqueurs post-mitotiques (comme la doublecortine27 et la synapsine28) pour sonder la plasticité synaptique et d’autres déclins liés à l’âge (Figure 6), ainsi que d’autres tissus cérébraux comme les astrocytes et la glie (Figure 7).
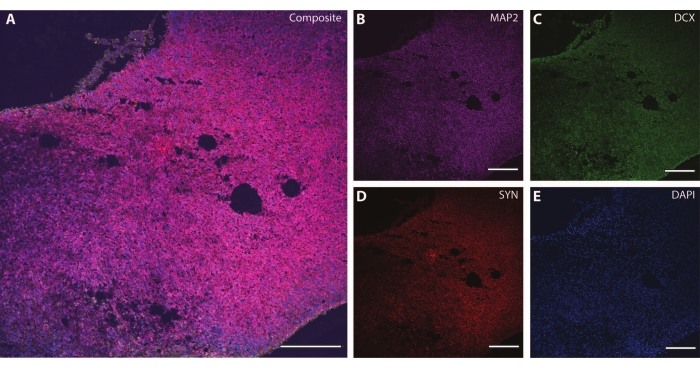
Figure 6 : Exemple d’analyse terminale synaptique. Image immunohistochimique d’une section de l’organoïde à DIV 120. (A) Une image composite de la section colorée pour (B) MAP2, (C) doublecortine (DCX) et (D) synapsine I (SYN). (E) Les noyaux ont été visualisés par DAPI. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
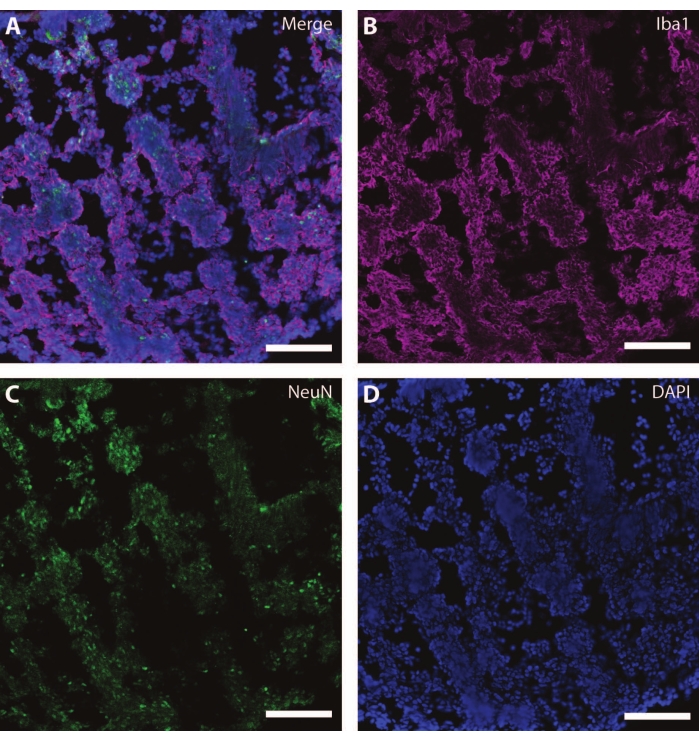
Figure 7 : Signes de développement glial. Image immunohistochimique d’une section de l’organoïde à DIV 120. (A) Une image composite de la section colorée pour (B) la molécule ionisée d’adaptateur liant le calcium 1 (Iba1) et (C) NeuN. (D) Les noyaux ont été visualisés par DAPI. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Concentration finale | Volume (50 mL au total) |
| DMEM-F12 | 50% | 25 mL |
| Milieu neurobasal | 50% | 25 mL |
| Supplément N2 (100x) | 1x | 0,25 mL |
| Supplément B27 -/+ Vitamine A (50x) | 0,5x | 0,5 mL |
| Insuline | 0.25% | 12,5 μL |
| GlutaMAX (100x) | 1x | 0,5 mL |
| MEM-NEAA (100x) | 0,5x | 0,25 mL |
| HEPES (1 M) | 10 mM | 0,5 mL |
| Antibiotique/Antimycotique (100x) | 1x | 0,5 mL |
| 2-β-mercaptoéthanol | 50 μM | 17,5 μL |
| *REMARQUE: certains DMEM-F12 contiennent déjà du GlutaMAX, pas besoin d’en ajouter d’autres. | ||
Tableau 1 : Composition des milieux de différenciation utilisés dans la présente étude.
Discussion
La formation standardisée d’EB est une étape critique dans la conversion reproductible de cellules souches pluripotentes en organoïdes cérébraux. L’agrégation de force des cellules souches en tissus singuliers peut varier en fonction de la géométrie des puits concaves, de la densité d’ensemencement et du traitement du puits. Bien que la méthode actuelle cite une plage de diamètres de 500 à 600 μm après 6 jours, ces diamètres n’excluent pas d’autres diamètres de formation organoïde appropriée, car de nombreux autres diamètres ont fait leurs preuves. Cependant, il a été démontré que les diamètres variables influencent les taux de différenciation et le succès29. Pour des raisons de reproductibilité, des variations de diamètre inférieures à 50 μm sont fortement recommandées20. De plus, le nombre de jours d’induction neuronale peut être prolongé de 6 à 10 jours pour permettre aux EB de croître en diamètre, car il a été démontré que l’utilisation d’inhibiteurs de la SMAD produit et maintient efficacement la formation de neuroépithéliums après seulement 5 jours d’exposition30. En l’absence d’inhibiteurs de la SMAD, l’induction neuronale peut donner des résultats incohérents, nécessitant des périodes d’induction plus longues. Les inhibiteurs de la SMAD cités dans ce travail sont les plus efficaces, mais d’autres petites molécules de dorsomorphine et de TGF-β peuvent être utilisées à leur concentration efficace.
La matrice membranaire basale fournit un excellent substrat pour la croissance et peut être administrée différemment. Les premières utilisations de la matrice comprenaient la membrane basale comme revêtement de puits31. Cependant, l’utilisation de la matrice pour l’encastrement des tissus a montré qu’elle améliorait la différenciation et la maturation de ces tissus32. Pour les organoïdes, il a été démontré que l’utilisation de la matrice améliore la différenciation EB en organoïdes, favorise la maturation et prolonge les périodes de culture33. Alors que les organoïdes peuvent encore être formés sans la matrice, comme de nombreux groupes se sont efforcés d’accomplir une culture tissulaire sans matrice 34,35, des études ont montré que les organoïdes intégrés dans la matrice ont un risque plus élevé de temps de culture prolongés et nécessitent moins d’entretien36. La méthode d’encastrement par fossette fournit une couverture égale de la surface organoïde, assurant une diffusion similaire, un accès aux nutriments et une différenciation reproductible. Alternativement, l’incorporation de dôme peut être utilisée pour encapsuler complètement les organoïdes37.
Le transfert des EB dans les fossettes de la matrice membranaire est une étape critique. Bien qu’une pointe de pipette de 1 mL ait une ouverture suffisamment large pour transférer les EB, une pointe de 200 μL est préférable pour faciliter le transfert. Les pointes de 200 μL doivent être coupées pour créer une ouverture suffisamment grande, assurant un bord lisse pour réduire les contraintes de cisaillement lors du pipetage. Alternativement, des pointes de 200 μL de grand calibre existent pour faciliter le transfert. Le pipetage doit être fait lentement, car un pipetage rapide pourrait perturber la périphérie organoïde et entraver une croissance adéquate. Une attention particulière doit être portée pour s’assurer qu’un milieu suffisant est transféré pour fournir des nutriments. Trop peu de milieu court le risque de dessécher l’organoïde, provoquant une nécrose. Le transfert de l’EB avec trop de milieux de culture peut entraîner une trop dilution de la matrice et ne pas encapsuler l’organoïde de manière sûre. Idéalement, la matrice ne doit pas être diluée de plus de 50% pour assurer sa polymérisation et sa fonction d’ECM pour les EB. Si l’incorporation échoue, l’EB peut être récupéré et réencapsulé. La réencapsulation dans la nouvelle matrice peut être effectuée à tout moment pour fournir à l’organoïde un support supplémentaire.
Semblables à l’intégration matricielle pour les échafaudages, les fibres PLGA fournissent un support supplémentaire pour la croissance tridimensionnelle. Incorporées à l’origine pour produire des organoïdes allongés et augmenter la surface38, l’incorporation de fibres PLGA a progressivement été identifiée comme un outil supplémentaire pour améliorer la différenciation et la maturation organoïdes39. Alors que de plus en plus de laboratoires cherchent à réduire l’utilisation de la matrice ou à l’abolir complètement, les propriétés auto-organisatrices des organoïdes soutenus par les fibres incorporées fournissent suffisamment d’échafaudages pour la création et la différenciation de tissus tridimensionnels39. Ici, les deux méthodes ont été combinées pour augmenter les chances de culture à long terme38,39. L’incorporation de fibres lors de l’agrégation initiale est essentielle, car elles peuvent ne pas être introduites à un stade ultérieur. Après la centrifugation, vérifier que quelques fibres sont parmi les cellules agrégées garantira qu’une fibre est incorporée dans l’EB. En cas d’échec, une aspiration douce du puits et une recentrifugation devraient assurer le mélange.
Une autre étape critique dans la maintenance des organoïdes est l’introduction d’un agitateur orbital pour une meilleure perfusion des milieux. Dans les premières itérations de protocoles organoïdes, un bioréacteur rotatif a été utilisé pour créer de l’agitation11. Un agitateur orbital à 90 tr/min fournit une agitation suffisante sans détruire la gouttelette de la matrice ni endommager la morphologie organoïde. Certains groupes s’abstiennent d’utiliser l’échafaudage matriciel mais conservent l’agitation du shaker pour fournir un environnement approprié34. Comme pour tous les protocoles, la vitesse des rotations doit être ajustée en fonction de l’agitateur pour réduire la quantité de contrainte de cisaillement. Si un encastrement de dôme était choisi, un agitateur incliné pourrait être utilisé pour réduire la quantité de contrainte de cisaillement11,34.
Prises ensemble, l’intégration de plusieurs techniques sélectionnées fournit une méthode robuste de formation organoïde dérivée de l’iPSC. Il existe plusieurs façons de créer et de maintenir des organoïdes, mais beaucoup d’entre elles se concentrent sur les trajectoires de différenciation précoces. Dans ce travail, plusieurs techniques différentes ont été combinées pour cultiver des organoïdes pendant de longues périodes, au-delà de la phase de différenciation et dans une période de maturation où les phénotypes vieillissants peuvent commencer à se développer. L’intégration de ces techniques permet une maturation prolongée sans avoir besoin de facteurs biologiques exogènes pour maintenir les cultures, en conservant l’auto-organisation et la progression naturelle du vieillissement.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’Initiative néerlandaise d’organes sur puce, un projet de gravitation NWO (024.003.001) financé par le ministère de l’Éducation, de la Culture et des Sciences du gouvernement des Pays-Bas. D.C.B. remercie le Consejo Nacional de Ciencia y Tecnología (CONACyT) pour son soutien financier sous la forme d’une bourse de doctorat.
matériels
| Name | Company | Catalog Number | Comments |
| 2-β-Mercaptoethanol | Thermo Fisher Scientific | 31350010 | |
| 4′,6-Diamidino-2-phenylindoledihydrochloride (DAPI) | Invitrogen | D1306 | 1:4000 |
| 6-well Clear Flat Bottom CELLSTAR Cell Culture Multiwell Plate | Greiner Bio-One | 657185 | |
| 6-well Clear Flat Bottom Ultra-Low Attachment Well Plate | Corning | 3471 | |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Fisher Scientific | 136101 | |
| Accutase | Sigma-Aldrich | 46964 | cell detachment solution |
| Antibiotic-Antimycotic (100x) | Gibco | 15240062 | |
| B27 Suppement (with Vitamin A) (50x) | Gibco | 17504044 | |
| B27 Supplement (minus Vitamin A) (50x) | Gibco | 12587010 | |
| BD Vacutainer™ Glass Mononuclear Cell Preparation (CPT) Tubes | Thermo Fisher Scientific | 02-685-125 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Centrifuge | Eppendorf | 5810 R | With plate holders |
| CHIR99021 | Selleck Chemicals | S2924 | |
| CytoTune Sendai Reprogramming Vector | Thermo Fisher Scientific | A1378001 | |
| ddPCR primers | human | MAPT | Bio-Rad | dHsaCPE192234 | |
| ddPCR primers | human | RBFOX3 (NeuN) | Bio-Rad | dHsaCPE5052108 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320074 | |
| Doublecortin (DCX) | Santa Cruz Biotechnology | SC-8066 | 1:500 |
| Dulbecco’s phosphate buffered saline (DPBS) | Thermo Fisher Scientific | 14190144 | no calcium, no magnesium |
| Eppendorf cups, 1.5 mL | Eppendorf | 0030 125.215 | |
| Essential 6 | Gibco | A1516401 | |
| Essential 8 | Gibco | A1517001 | |
| Ethylenediaminetetraacetic acid (EDTA) | Invitrogen | 15575020 | |
| Falcon tubes, 15 mL, conical | Greiner Bio-One | 188271-N | |
| Formaldehyde | Sigma-Aldrich | 252549 | 37% Stock solution, diluted to 4% in PBS |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413202 | |
| GlutaMax (100x) | Gibco | 35050038 | |
| Hemacytometer cell counter | Hausser scientific | 1490 | |
| HEPES Buffer | Thermo Fisher Scientific | 15-630-080 | |
| Insulin | Sigma-Aldrich | I9278 | |
| LDN 193189 | StemCell Technologies | 72147 | |
| MAP2 | Abcam | ab32454 | 1:200 |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free | Corning | 356230 | basement membrane matrix |
| MEM-Non Essential Amino Acid Solution (MEM-NEAA; 100x) | Thermo Fisher Scientific | 11140050 | |
| Multilabel Counter Victor 3 Plate Reader | Perkin Elmer | 1420 | luminometer |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| N-2 Supplement (100x) | Thermo Fisher Scientific | 17502-048 | |
| NeuN | Millipore | MAB377 | 1:500 |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | |
| Oct-3/4 Antibody (C-10) Alexa Fluor 647 | Santa Cruz Biotechnology | sc-5279 AF647 | 1:100 |
| Parafilm | Bemis | PM-996 | thermoplastic film sheet |
| PAX6 | Thermo Fisher Scientific | 42-6600 | 1:200 |
| Penicillin/Streptomycin | Gibco | 15070063 | |
| Poly(lactic-co-glycolic acid) (PLGA) microfilaments | Ethicon | J463 | |
| QX200 Droplet digital PCR system | Bio-Rad | 1864001 | |
| ROCK inhibitor (Y27632) | Selleck Chemicals | S1049 | |
| SB431542 | R&D Systems | 1614/50 | |
| SOX2 Monoclonal Antibody (Btjce), Alexa Fluor 488, eBioscience | Invitrogen | 53-9811-80 | 1:100 |
| Synapsin I (SYN) | Calbiochem | 574777 | 1:200 |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| TUJ1 | Santa Cruz Biotechnology | sc-80005 | Beta-3-tubulin; 1:500 |
| XAV939 | Tocris Bioscience | 3748 |
Références
- Liu, G. H., et al. Aging Atlas: a multi-omics database for aging biology. Nucleic Acids Research. 49, 825-830 (2021).
- Ferrucci, L., et al. Measuring biological aging in humans: A quest. Cell. 19 (2), 13080 (2020).
- Mertens, J., Reid, D., Lau, S., Kim, Y., Gage, F. H. Aging in a dish: iPSC-derived and directly induced neurons for studying brain aging and age-related neurodegenerative diseases. Annu Rev Genet. 52, 271-293 (2018).
- Mertens, J., et al. Age-dependent instability of mature neuronal fate in induced neurons from Alzheimer's patients. Cell Stem Cell. 28 (9), 1533-1548 (2021).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1141-1154 (2018).
- Fang, E. F., et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease. Nature Neuroscience. 22 (3), 401-412 (2019).
- Hu, J. L., Todhunter, M. E., LaBarge, M. A., Gartner, Z. J. Opportunities for organoids as new models of aging. Journal of Cell Biology. 217 (1), 39-50 (2018).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Gonzalez, C., et al. Modeling amyloid beta and tau pathology in human cerebral organoids. Molecular Psychiatry. 23 (12), 2363-2374 (2018).
- Yoon, S. -. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Muratore, C. R., Srikanth, P., Callahan, D. G., Young-Pearse, T. L. Comparison and optimization of hiPSC forebrain cortical differentiation protocols. PLoS ONE. 9 (8), 105807 (2014).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2020).
- Goto-Silva, L., et al. Computational fluid dynamic analysis of physical forces playing a role in brain organoid cultures in two different multiplex platforms. BMC Developmental Biology. 19 (1), 1-10 (2019).
- Sommer, A. G., et al. Generation of human induced pluripotent stem cells from peripheral blood using the STEMCCA lentiviral vector. Journal of Visualized Experiments. (68), e4327 (2012).
- Beers, J., et al. A cost-effective and efficient reprogramming platform for large-scale production of integration-free human induced pluripotent stem cells in chemically defined culture. Scientific Reports. 5 (1), 1-9 (2015).
- Wakao, S., et al. Morphologic and gene expression criteria for identifying human induced pluripotent stem cells. PLoS ONE. 7 (12), e48677 (2012).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2022).
- Choy Buentello, D., Koch, L. S., Trujillo-De Santiago, G., Alvarez, M. M., Broersen, K. Use of standard U-bottom and V-bottom well plates to generate neuroepithelial embryoid bodies. PLOS ONE. 17 (5), 0262062 (2022).
- Ellis, P., et al. SOX2, a persistent marker for multipotential neural stem cells derived from embryonic stem cells, the embryo or the adult. Developmental Neuroscience. 26 (2-4), 148-165 (2004).
- Lee, S., et al. TuJ1 (class III β-tubulin) expression suggests dynamic redistribution of follicular dendritic cells in lymphoid tissue. European Journal of Cell Biology. 84 (2-3), 453-459 (2005).
- Suzuki, S., Namiki, J., Shibata, S., Mastuzaki, Y., Okano, H. The neural stem/progenitor cell marker nestin is expressed in proliferative endothelial cells, but not in mature vasculature. Journal of Histochemistry and Cytochemistry. 58 (8), 721-730 (2010).
- Soltani, M. H., et al. Microtubule-associated protein 2, a marker of neuronal differentiation, induces mitotic defects, inhibits growth of melanoma cells, and predicts metastatic potential of cutaneous melanoma. The American Journal of Pathology. 166 (6), 1841-1850 (2005).
- Wilson, P. G., Stice, S. S. Development and differentiation of neural rosettes derived from human embryonic stem cells. Stem Cell Reviews. 2 (1), 67-77 (2006).
- Gusel'nikova, V. V., Korzhevskiy, D. E. NeuN as a neuronal nuclear antigen and neuron differentiation marker. Acta Naturae. 7 (25), 42-47 (2015).
- Rao, M. S., Hattiangady, B., Shetty, A. K. The window and mechanisms of major age-related decline in the production of new neurons within the dentate gyrus of the hippocampus. Aging Cell. 5 (6), 545-558 (2006).
- Meng, L., et al. A synapsin I cleavage fragment contributes to synaptic dysfunction in Alzheimer's disease. Aging Cell. 21 (5), 13619 (2022).
- Moon, S. H., et al. Optimizing human embryonic stem cells differentiation efficiency by screening size-tunable homogenous embryoid bodies. Biomaterials. 35 (23), 5987-5997 (2014).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Lee, S. -. W., et al. Optimization of Matrigel-based culture for expansion of neural stem cells. Animal Cells and Systems. 19 (3), 175-180 (2015).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: The matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Hocevar, S. E., Liu, L., Duncan, R. K. Matrigel is required for efficient differentiation of isolated, stem cell-derived otic vesicles into inner ear organoids. Stem Cell Research. 53, 102295 (2021).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Communications Biology. 4 (1), 1-15 (2021).
- Kaiser, A., Kale, A., Novozhilova, E., Olivius, P. The effects of Matrigel® on the survival and differentiation of a human neural progenitor dissociated sphere culture. The Anatomical Record. 303 (3), 441-450 (2020).
- Kakni, P., et al. Intestinal organoid culture in polymer film-based microwell arrays. Advanced Biosystems. 4 (10), 2000126 (2020).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Tejchman, A., Znój, A., Chlebanowska, P., Frączek-Szczypta, A., Majka, M. Carbon fibers as a new type of scaffold for midbrain organoid development. International Journal of Molecular Sciences. 21 (17), 5959 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon