Method Article
Yaşlanma Araştırmaları için iPSC Kaynaklı Beyin Organoidlerinin Uzun Süreli Kültürü için Sağlam Doku Üretimi
Bu Makalede
Özet
Mevcut protokol, insan kaynaklı pluripotent kök hücrelerden (iPSC'ler) türetilen serebral organoidlerin çoğaltılabilir üretimi, bakımı ve yaşlanması için adım adım bir prosedür sunmaktadır. Bu yöntem, beyin yaşlanması ve yaşa bağlı patogenezde yer alan süreçlerin modellenmesini kolaylaştıran serebral organoidlerin uzun süreler boyunca kültürlenmesini ve olgunlaşmasını sağlar.
Özet
Şu anda mevcut olan hayvan ve hücresel modeller, yaşlanan insan beyninde meydana gelen değişikliklerin karmaşıklığını tam olarak özetlememektedir. İnsan kaynaklı pluripotent kök hücrelerden (iPSC'ler) türetilen insan serebral organoidlerinin neslini tanımlayan prosedürlerin yeni bir gelişimi, insan beyninin yaşlanmasını ve ilgili patojenik süreçleri modelleme ve anlama yeteneğini temel olarak dönüştürme potansiyeline sahiptir. Burada, insan iPSC türevi serebral organoidlerin üretilmesi, sürdürülmesi, yaşlanması ve karakterize edilmesi için optimize edilmiş bir protokol sunulmaktadır. Bu protokol, beyin organoidlerini tekrarlanabilir bir şekilde üretmek için uygulanabilir ve kültürde organoid olgunlaşması ve yaşlanması ile sonuçlanan en son teknikleri içeren adım adım bir rehber görevi görür. Organoid olgunlaşma, nekroz, değişkenlik ve toplu etkilerle ilgili spesifik konular ele alınmaktadır. Birlikte ele alındığında, bu teknolojik gelişmeler, çeşitli genç ve yaşlı insan donörlerinden türetilen organoidlerde ve ayrıca yaşa bağlı beyin bozukluklarından muzdarip bireylerde beyin yaşlanmasının modellenmesine izin verecek ve insan beyni yaşlanmasının fizyolojik ve patojenik mekanizmalarının tanımlanmasına izin verecektir.
Giriş
Yaşlanma hastalığı modelleri, insan yaşam beklentisi artmaya devam ettikçe giderek daha alakalı hale gelmiştir. Büyük ölçekli genomik çalışmalar, moleküler süreçlerin düzensizliği ve yaşam kalitesini etkileyen genetik değişiklikler ile yaşlı popülasyonları ortaya çıkarmıştır1. Yaşlanma süreci, bilişsel işlev kaybı, nörodejeneratif bozukluklar için artmış risk ve bir dizi kronik hastalık2 dahil olmak üzere organizmanın genel işlevsellik kaybı ile karakterizedir.
Mevcut hücre kültürü teknikleri, yaşlanmanın çok faktörlü doğasını uygun şekilde temsil etmemektedir, çünkü bu işlev bozuklukları mutasyonlar, toksinler veya enfeksiyonlar kullanılarak düzgün bir şekilde çoğaltılamaz3. Yaşlanma sürecini araştıran hayvan modelleri genellikle uzun deneysel süreler ve yüksek maliyetlerle ilişkilidir, ancak aynı zamanda etik hususları da beraberinde getirir. Hastalardan indüklenmiş pluripotent kök hücrelerin (iPSC'ler) kullanılması, iPSC'lerin hücrelerin olgun dokuya doğal gelişimine izin vermesi nedeniyle hastalığın ilerlemesinin altında yatan moleküler mekanizmaları aydınlatabilir3. iPSC'ler, nörodejeneratif bozuklukları araştıran birçok laboratuvarın çalışan atı haline gelmiştir, çünkü hasat edilen hücrelerin hücresel olarak yeniden programlanması, donörlerin hastalık veya yaşlanma izlerini silmiyor gibi görünmektedir4. Bu izler, insan ve hayvan modellerinde gösterilen hücresel fenotipleri özetleyerek, iPSC'leri oldukça yoğun beyin dokusunun bireysel hücresel bozulmasını incelemek için uygun hale getirir 5,6. IPSC türevli organoidler, dokunun üç boyutlu kültürlenmesi için önde gelen model haline gelmiş, daha karmaşık hücreden hücreye etkileşimlere ve gelişmiş bir gelişimsel özetlemeye olanak sağlamıştır. Öncelikle gelişimsel veriler için kullanılmasına rağmen, organoidler hastalık modellemesine, özellikle inflamasyon, nörodejenerasyon ve yaşlanma modellerine giderek daha fazla uygulanmaktadır7. Önceki iPSC çalışmalarına dayanarak, organoidler hastalık fenotiplerini ve hücresel fenotipleri doku benzeri ağ bağlantılarının fizyolojik bağlamında tutar 8,9. Bununla birlikte, belirli boyutlardaki üç boyutlu dokuyu kültürlemek, özellikle uzun süreler boyunca zor olabilir.
Bu çalışma, dokunun daha uzun süreler boyunca büyük ölçüde olgunlaşmasını sağlayan serebral organoidlerin tekrarlanabilir üretimi için ayrıntılı bir yöntem sunmaktadır. Serebral organoid oluşumu nispeten standartlaştırılmış kalmıştır ve birkaç önemli protokolden yöntemler benimsenmiştir10,11. Bununla birlikte, gelişmiş farklılaştırma ve bakım için çeşitli değişiklikler önerilmiştir. Bu alternatif yöntemler arasında nöral farklılaşmayı arttırmak için nörojenik faktörlerin kullanılması12, hücresel uzun ömürlülüğü teşvik eden gelişmiş besin değişimi için ek iskeleler 13 ve uzun süreli kültür ve büyüme için düşük saf stres ajitasyonu14 bulunmaktadır. Bu gelişmeler, nörodejeneratif ve yaşlanma fenotiplerini eksprese edebilen olgun organoidler geliştirmek için bu yönteme dahil edilmiştir.
Protokol
Hasta çalışmaları Kurumsal Gözden Geçirme Kurulu tarafından onaylanmıştır. Tüm katılımcılar, verilerinin ve biyoörneklerinin yeniden kullanılmasına izin vermek için yazılı bilgilendirilmiş onam ve depo onayı imzaladılar. iPSC hatları IRB ve kurumsal yönergelere uygun olarak oluşturulmuştur. Şekil 1 , bu protokolün iş akışına şematik bir genel bakış göstermektedir.
1. iPSC yeniden programlama ve bakım
- Deneğin kanının 8 mL'sini (yaşlı veya hastalık hastası; 65 yaş ve üstü) sodyum sitrat içeren hücre hazırlama tüplerine (CPT) veya EDTA veya heparinize tüplere toplayın.
- Sadece periferik kan içerenve serum içermeyen pelet toplamak için oda sıcaklığında (RT) 30 dakika boyunca 1.800 x g'de santrifüj yapın.
- iPSC'lerielde etmek için üreticinin protokolüne göre özel yeniden programlama vektörleri kullanın (bkz.
- Besleyici içermeyen, laktoz dehidrogenaz yükseltici virüs (LDEV) içermeyen azaltılmış büyüme faktörü bazal membran matrisindeki kültür iPSC'leri, %5 CO2 ile nemlendirilmiş bir atmosferde 37 °C'de Essential 8 (E8) ortamında (bakınız Malzeme Tablosu) 6 kuyucuklu kültür plakaları kaplıdır.
- Aşırı kalabalık veya kendiliğinden farklılaşmayı önlemek için iPSC'leri E8 ortamında 3-4 gün boyunca saklayın.
- İmmünofloresan belirteçleri kullanarak iPSC hatlarının pluripotensini doğrulayın (adım 2) ve mikoplazmayı test edin (adım 3).
2. Pluripotens boyama
- Çözeltileri ve antikorları korumak için, hücreleri analizden 3-4 gün önce kaplanmış (adım 1.4) 24 kuyucuklu kültür plakalarına tohumlayın. Ortamı bir pipetle aspire edin ve hücreleri RT'de 15-20 dakika boyunca fosfat tamponlu salin (1x PBS) içinde% 4 formaldehit ile sabitleyin.
- Hücreleri 1x PBS ile 3x yıkayın ve PBS'de% 1 sığır serum albümininde (BSA) % 0.1 Triton-X 100 ile en az 15 dakika, ancak RT'de 1 saatten fazla olmamak üzere geçirgenleştirin.
- RT'de 30 dakika boyunca 1x PBS ile 3x yıkayın ve PBS'de% 5 BSA ile bloke edin.
- 1x PBS ile tekrar 3x yıkayın ve Sox2 ve Oct3/4 antikorlarını (1:100 seyreltme; bakınız Malzeme Tablosu) ve nükleik boya DAPI'yi gece boyunca 4 °C'de %1 BSA'da (1:4.000 seyreltme) ekleyin. Işıktan korumak için alüminyum folyoya sarın.
- 1x PBS ile 3x yıkayın ve hücreleri PBS'de bırakın. 10-20x büyütmede floresan mikroskobu ile görüntü. Pluripotens belirteçleri Sox2 ve Oct3/4'ün17,18 hücrelerinin çekirdeğinde lokalize olduğundan emin olun.
3. Mikoplazma testi
NOT: Ayrıntılı tahlil yürütme ve analiz adımları için tespit kitinin protokolüne bakın (bkz. Tespit kiti, mikoplazma testi için reaktif, substrat ve tahlil tamponu sağlar.
- Hücreleri veya tazeleyici ortamı geçmeden önce, bir santrifüj tüpünde 2-3 mL hücre kültürü ortamı toplayın ve RT'de 5 dakika boyunca 200 x g'de herhangi bir hücreyi veya döküntüyü pelet edin. süpernatantı ≤5 gün boyunca 4 ° C'de saklayın. Algılanabilir bir sinyal sağlamak için hücreleri en az 24 saat boyunca ortamla inkübe edin.
- Taze bir tüpe veya beyaz duvarlı 96 delikli bir plakanın kuyucuğuna 100 μL hücre süpernatantı ekleyin (opak taban önerilir , bkz. Reaktifi ve substratı tahlil tamponunda yeniden oluşturun ve RT'de 15 dakika boyunca dengeleyin.
- Numuneye 100 μL reaktif ekleyin ve RT'de 5 dakika inkübe edin. lüminesansı bir luminometre ile ölçün (ölçüm #1).
- Numuneye 100 μL substrat ekleyin ve RT'de 10 dakika boyunca inkübe edin. lüminesansı ölçün (ölçüm #2).
- Mikoplazma kontaminasyonunu ölçüm #2 ila #1 oranına göre belirleyin. Sonuçların yorumlanması için kitin kılavuzuna bakın.
4. Mikrofilament preparatı
- Poli (laktik-ko-glikolik asit) (PLGA, bakınız Malzeme Tablosu) mikrofilamentlerinin hazırlanmasına, dikiş ipliğini bir neşterin kör ucuyla yıpratarak başlayın. Yıpranmış elyafı% 70 etanol ile hafifçe kısırlaştırın.
- Mikroskop altında ve bir cetvel kullanarak, PLGA lifini 500 μm ila 1 mm uzunluğunda iplikçiklerden oluşan parçalar halinde kesmeye başlayın. Toplamda elyafın yaklaşık 25 mm'sini kesin. Filamentleri 1 mL antibiyotik-antimikotik çözelti ile 15 mL'lik bir tüpte tutun.
- Davlumbazda, fiber çözeltisini 10 mL DMEM / F-12 ile seyreltin (Tablo 1). Çözeltiyi karıştırmak için vorteks kuyusu.
NOT: Steril bir ortamda hücre kültürü akış davlumbazında çalışın.
- Davlumbazda, fiber çözeltisini 10 mL DMEM / F-12 ile seyreltin (Tablo 1). Çözeltiyi karıştırmak için vorteks kuyusu.
- Lif çözeltisinin 20 μL'sini, 96 delikli bir plakanın kuyucuklarını oluşturan üç embriyoid cisimcise (EB) ekleyin. Parlak alan mikroskobu altında, kuyu başına lifleri sayın ve ortalamasını alın. Kuyu başına ortalama 5-10 PLGA mikrofilamente seyreltin veya konsantre edin. Her kuyuyu bu şekilde hazırlayın.
- Kuyular artık hücrelerle tohumlanmaya hazır. Plakayı ihtiyaç duyulana kadar oda sıcaklığında veya ertesi gün için 4 ° C'de saklayın.
5. Embriyoid Cisim (EB) oluşumu
NOT: Tüm medya ve çözümler RT'ye ısıtılmalıdır.
- iPSC'ler %70-%80 akıcılığa ulaştığında (Şekil 2A), EB oluşumu için geçişe ve kullanılmaya hazırdırlar. Hücreleri mikroskopla 10x-20x büyütmede kontrol edin. Kolonilerin minimal (%<10) spontan farklılaşma alanları gösterdiğinden emin olun.
- Ortamı bir pipetle aspire edin ve hücreleri bir kez DPBS ile yıkayın. 500 μL hücre ayrılma çözeltisi (bakınız Malzeme Tablosu) veya 0.5 mM etilendiamintetraasetik asit (EDTA) ekleyerek kolonileri ayırın ve 37 ° C'de 3-5 dakika inkübe edin.
NOT: Steril bir ortamda hücre kültürü akış davlumbazında çalışın. - Her bir kuyucuğa 1 mL taze E8 ortamı ekleyerek serbest bırakılan hücreleri toplayın ve tüm hücreler ayrılana kadar yavaşça pipet yapın.
- 1,5 mL'lik hücre süspansiyonunu 15 mL'lik bir tüpe aktarın ve toplam 2,5 mL'lik hacme ulaşmak için 1 mL'lik yeni bir E8 ortamı daha ekleyin.
- RT'de 3 dakika boyunca 290 x g'de santrifüj.
- Süpernatantı bir pipetle aspire edin, hücre peletini 50 μM ROCK inhibitörü ile desteklenmiş 1 mL Essential 6 (E6, Malzeme Tablosuna bakınız) ortamında yeniden askıya alın ve bir hemositometre19 kullanarak hücreleri sayın.
- İstenilen tohumlama yoğunluğuna bağlı olarak, 50 μM ROCK inhibitörü ile desteklenmiş E6 ortamında 60.000-90.000 hücre/mL'lik bir hücre süspansiyonu hazırlayın (bkz.
- 96 delikli bir ULA plakasının (veya hazırlanmış bir içbükey plaka 20'nin) her bir kuyucuğuna150 μL hücre süspansiyonu ekleyin. Kuyu başına 9.000-11.000 hücre tohumlayın.
- RT'de 1 dakika boyunca hücreleri 290 x g'de zorla toplamak için plakayı santrifüjleyin. plakayı% 5 CO2 ile nemlendirilmiş bir atmosferde 37 ° C'de inkübatöre yerleştirin.
6. Nöroepitelyal indüksiyon
- 24 saat sonra, ortamın 120 μL'sini bir pipetle dikkatlice aspire edin. Pipet ucunu kuyunun çok uzağına indirerek EB'yi aspire etmediğinizden emin olun.
- 2 μM XAV939 ve SMAD inhibitörleri ile desteklenmiş 150 μL E6 ortamı (RT'de) ekleyin: kuyu başına 10 μM SB431542 ve 500 nM LDN 193189 (bkz.
- 2 μM XAV939, 10 μM SB431542 ve 500 nM LDN 193189 ile desteklenmiş taze hazırlanmış E6 ortamı ile ortamı günlük olarak değiştirin.
NOT: 6. günde (DIV6), EB'lerin çapı 550-600 μm olmalı ve daha fazla farklılaşmaya hazır olmalıdır.
7. Organoid farklılaşma ve olgunlaşma
NOT: Tüm medyanın RT'ye ısıtılması gerekir.
- Yaklaşık DIV7'de, tüm EB'lerin 550-600 μm çapa ulaşıp ulaşmadığını kontrol edin ve pürüzsüz ve net bir kenar görüntüleyin (Şekil 2B); Bu aşamada, hücre dışı bir matrise (ECM) gömülmeye hazırdırlar.
NOT: Steril bir ortamda çalışın. - Boş bir P200 kutusuna bir film tabakası (yaklaşık 4 inç uzunluğunda) yerleştirerek termoplastik sızdırmazlık filminden çukurlu gömme tabakaları hazırlayın (bkz. 15 mL'lik bir konik tüp veya 500 μL'lik bir mikrosantrifüj tüpü kullanarak, 12 çukur oluşturmak için film tabakasını yavaşça deliklere bastırın. Film tabakasına %70 etanol püskürtün ve UV ışığı açıkken akış davlumbazının içinde en az 30 dakika kurumasını bekleyin.
- Yeterli miktarda bazal membran matrisini (Matrigel, bakınız Malzeme Tablosu) buz üzerinde çözün ve akış başlığının içine yerleştirin.
NOT: EB başına yaklaşık 30 μL seyreltilmemiş membran matrisine ihtiyaç vardır. Jelleşmesini önlemek için membran matrisini daima 4 °C'nin altında tutun. Önceden soğutulmuş pipet uçları, pipetleme sırasında matrisin uçtaki polimerleşmesini yavaşlattığı ve böylece malzeme kaybını azalttığı için de önerilir. - Geniş delikli bir P200 ucu kullanarak her bir çukura bir EB aktarın ve normal bir pipet ucuyla mümkün olduğunca fazla ortamı çıkarın. EB'lerin kurumasına izin vermemeye dikkat edin. Normal bir P200 ucu kullanarak, her organoide ~ 30 μL seyreltilmemiş membran matrisi ekleyin ve EB'nin damlacığın merkezinde olmasını sağlayın.
- Tüm EB'ler matrise gömüldükten sonra, EB'leri içeren film tabakasını steril bir Petri kabına yerleştirin.
NOT: İsteğe bağlı olarak, buharlaşmayı önlemek için steril suyla doldurulmuş küçük bir Petri kabı, film tabakasının yanındaki daha büyük Petri kabına yerleştirilebilir.- Çanağı bir inkübatöre aktarın ve membran matrisinin katılaşmasını sağlamak için yaklaşık 10 dakika boyunca% 5 CO2 ile nemlendirilmiş bir atmosferde 37 ° C'de inkübe edin.
- Her 12 gömülü organoid seti için, ULA 6 delikli bir plakanın bir kuyucuğunda A vitamini içermeyen B27 ile 5 mL farklılaşma ortamı hazırlayın (Tablo 1). Plakayı bir inkübatörde önceden 37 ° C'ye ısıtın.
- Kuluçka süresi bittiğinde, film tabakasını alarak ve çukurları tabakanın arkasından iterek gömülü EB'leri ULA 6 delikli plakaya aktarın. Gerekirse, kuyudan 1 mL alın ve damlacıkların filmden ayrılmasına yardımcı olmak için tabakaya pipetleyin.
NOT: Önemli morfolojik değişiklikler gömmeden 1 gün sonra görülebilir; EB'ler pürüzsüz kenarlara sahip olmaktan, tomurcukları oluşturan şişkin çıkıntılara dönüşür (Şekil 2C). - 2 gün sonra (DIV9), yarı ortam değişikliği gerçekleştirin. İşlemde membran matrisi damlacıklarını aspire etmemeye veya zarar vermemeye dikkat edin.
- 2 gün sonra (DIV11), medyayı 3 μM CHIR99021 ile tamamlayarak tam bir ortam değişikliği gerçekleştirin (bkz.
- DIV14'te, organoid boyutunda kademeli bir artış için medyayı A vitamini ile B27 ile farklılaşma ortamına değiştirin (Tablo 1).
- DIV16'da, kuyu plakasını bir inkübatörün içinde 90 rpm'de yörüngesel bir çalkalayıcıya yerleştirin. Medyayı her 2 günde bir değiştirin.
- Her 40 DIV'de, ortamdaki ek besinler için her 50 mL ortam için membran matrisinin 500 μL'sini seyreltin.
Sonuçlar
PLGA liflerinin, çukur gömmenin ve ajitasyonun entegre edilmesi, iPSC türevi kültürlerin uzun süre korunmasını sağlayan sağlam bir serebral organoid nesline yol açar (Şekil 1).
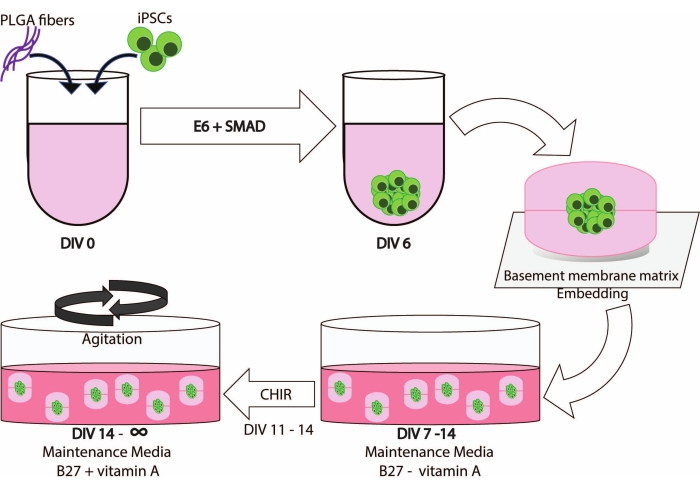
Şekil 1: Bu yöntemin iş akışının ve zaman çizelgesinin şematik gösterimi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
İlk nöral indüksiyon periyodu daha önce yayınlanmış prosedürlerle karşılaştırılabilir11. Embriyoid cisimler (EB) beyaz veya şeffaf kenarlı dairesel agregalar olarak başlar (Şekil 2B). EB, DIV7'de nöral indüksiyon ortamından nöral bakım ortamına dönüştüğünde, dairesel dokudan 24 saat içinde çıkıntılar ve tomurcuklanmalar ortaya çıkar (Şekil 2C). Ayrıca, organoid büyümeye devam ettikçe, PLGA lifinin yüzey alanı organoidin uzamasına yardımcı olur (Şekil 2D). Olgunlaşma sırasında, organoidin kenarlarının, sağlıklı hücrelerin ve gelişimin iyi bir işareti olduğu için bozulmadan kalması gerekir; aksi takdirde ek besin maddeleri sağlanmalıdır13 (Şekil 2E). Organoidlerin büyümesi, organoid kültürün ajitasyonu ile daha da kolaylaştırılır, çünkü bu, besinlerle perfüzyonu iyileştirir.
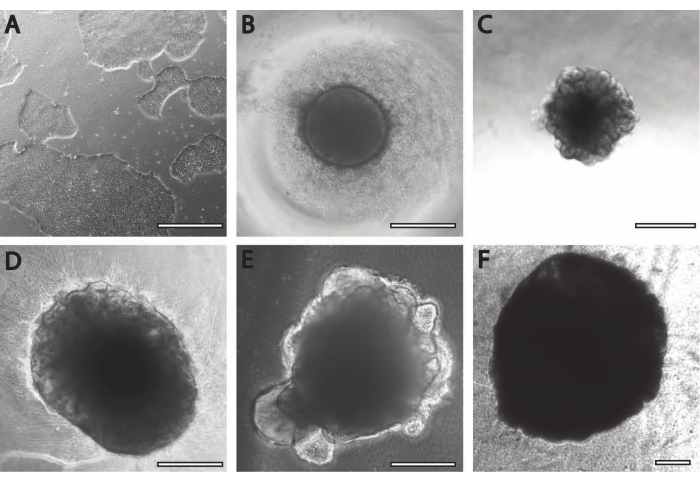
Şekil 2: Serebral organoidlerin farklılaşması ve olgunlaşması . (A) Bir iPSC kültürünün %70-%80 akıcılıkta temsili görüntüsü. (B) Embriyoid cisimler (EB'ler) üretildi ve DIV7'ye kadar nöroepitel oluşumu indüklendi. EB'ler daha sonra membran matrisine gömüldü ve serebral organoidlere doğru daha da farklılaştı. (C) DIV10'da farklı tomurcuklanma oluşumları gösteren organoidler. Organoidler, burada DIV30'da gösterilen (D) çukur veya (E) sandviç gömme kullanılarak membran matrisinde daha da olgunlaştırılabilir. (F) Uzun süreli kültür, serebral organoidlerin önemli boyutlara (DIV70) büyüdüğünü gösterir. Ölçek çubuğu = 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Organoidin boyutları ve dış morfolojisi, organoidin içindeki karmaşık bir mimari ile tamamlanmaktadır. Farklılaşmanın ilk aşamasından sonra dokuyu DIV7'de sabitledikten sonra, EB hücreleri, multipotent nöral kök hücreler21 için bir belirteç görevi gören bir HMG kutusu transkripsiyon faktörü olan SOX2'yi ve nöral progenitör hücreleri gösteren eşleştirilmiş protein kutusu Pax-6'yı eksprese eder (Şekil 3). TuJ1 (sınıf III β-tübülin)22 ile işaretlenmiş olgunlaşmamış nöronlar zaten doku boyunca dağılmış olarak görülebilir.
Bu aşamada, bu organoidlerin içinden geçtiği öz-örgütlenmenin bir örneği belirginleşir. Rozet adı verilen radyal yapıların organizasyonu, rozet merkezi21'deki SOX2 + hücreleri ve rozet çevresine doğru PAX6 ile nöral tüpe benzer. Bu rozetler, göç ederken nöronlara yol açar. Bu yayılan hücreler başlangıçta nöral kök / progenitör hücre belirteci Nestin23 ve glial fibriler asidik protein (GFAP) için, in vivo beynin nörojenik bölgelerinde bulunan radyal glia'ya benzer şekilde çift pozitiftir. Bu göç eden nöronlar olgunlaştıkça, sitoiskelet belirteçleri bu değişikliği yansıtır22. Erken evre nöral farklılaşma belirteci TuJ1 22, rozetin iç çemberinde görülebilir ve periferde nörona özgü bir olgunlaşma belirteci olan mikrotübül ile ilişkili protein 2'ye (MAP2 ) 24'e kayar.
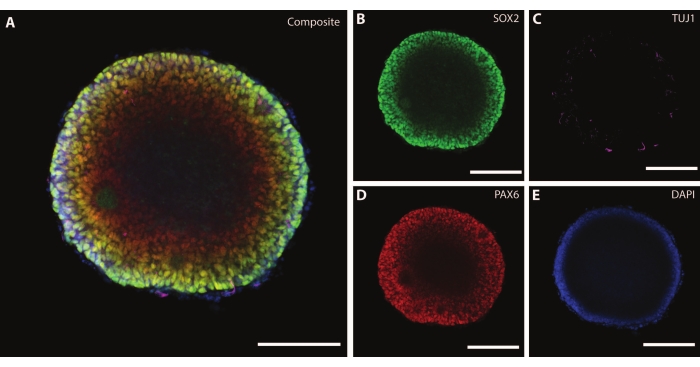
Şekil 3: DIV7'deki embriyoid cisimler yapısal organizasyonu ve olgunlaşmamış karakterizasyonu göstermektedir. DIV7'de bir EB'nin tüm montaj immünohistokimya görüntüsü. (A) (B) SOX2+ nöral rozetleri, (C) EB boyunca dağılmış olgunlaşmamış nöronları (TUJ1), (D) nöral progenitör hücreleri (PAX6) ve DAPI tarafından görselleştirilen (E) çekirdekleri gösteren EB'nin kompozit görüntüsü. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Organoidler yaşlandıkça, gelişmekte olan nöronların organizasyonu ve belirteçleri fizyolojik koşulları çoğaltmaya başlar. DIV30'da, gelişmekte olan beyne eşdeğer nörojenik bölgelere yol açan birçok rozet gözlemlenebilir25. DIV60 ile, bu SOX2 + nörojenik bölgeler mevcut değildir ve olgun MAP2 ve NeuN26, bir nöron farklılaşma belirteci ve pozitif nöronlar ile değiştirilir (Şekil 4 ve Şekil 5).
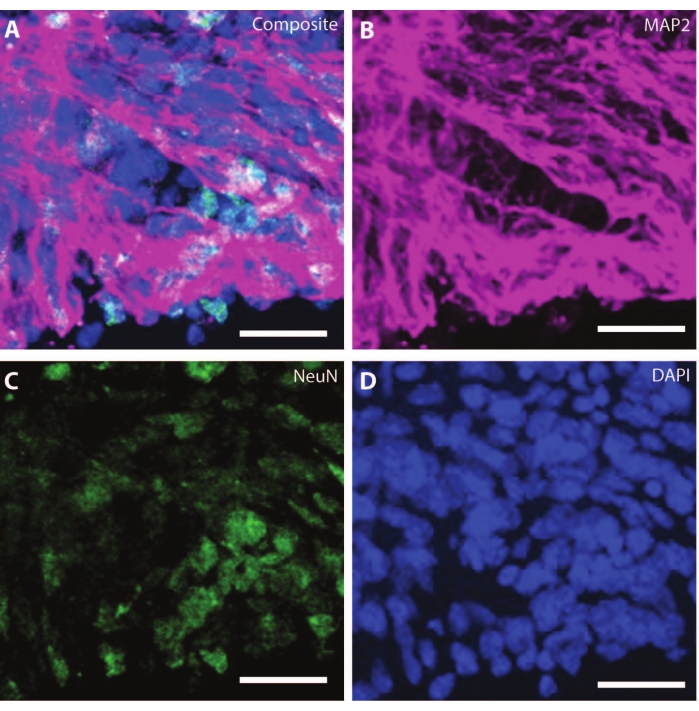
Şekil 4: DIV120'deki organoidler olgun nöronal karakterizasyon göstermektedir. DIV 120'de bir organoid kesitin immünohistokimya görüntüsü. (A) (B) MAP2 (mor) ve (C) NeuN'nin (yeşil) olgun nöronal belirteçlerini gösteren bölümün kompozit görüntüsü. (D) Çekirdekler DAPI tarafından görselleştirildi. Ölçek çubuğu = 20 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
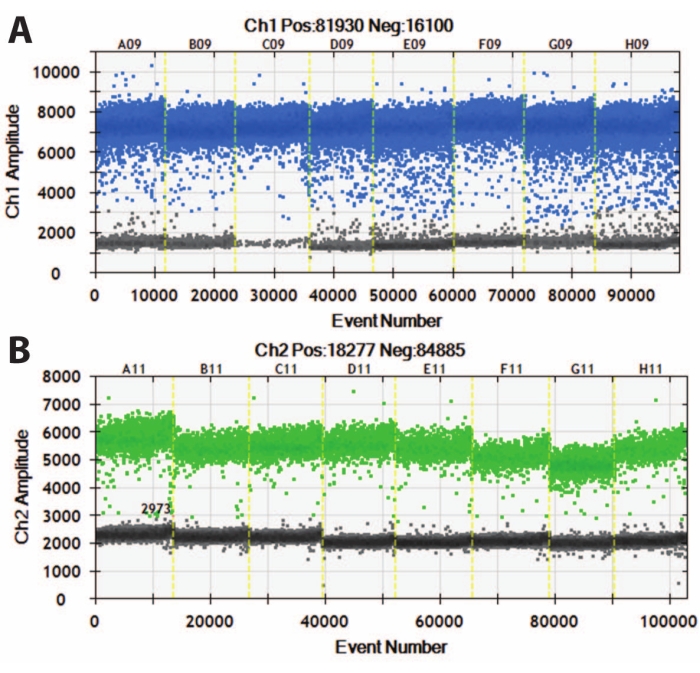
Şekil 5: DIV120 organoidlerinin dijital damlacık PCR'si. (A) MAP2 (üstte, mavi) ve (B) NeuN'nin (altta, yeşil) mutlak ifade değerini gösteren dijital damlacık PCR grafikleri. Kesilmiş sarı çizgiler farklı iPSC çizgilerini (A, B, C, vb.) ayırır ve organoidler bir araya getirilmiştir. N = 5. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Bu sitoiskelet belirteçleri, sinaptik plastisite ve yaşa bağlı diğer düşüşleri (Şekil 6) ve astrositler ve glia gibi ek beyin dokularını araştırmak için diğer post-mitotik belirteçlerle (doublecortin27 ve synapsin28 gibi) birlikte kullanılabilir (Şekil 7).
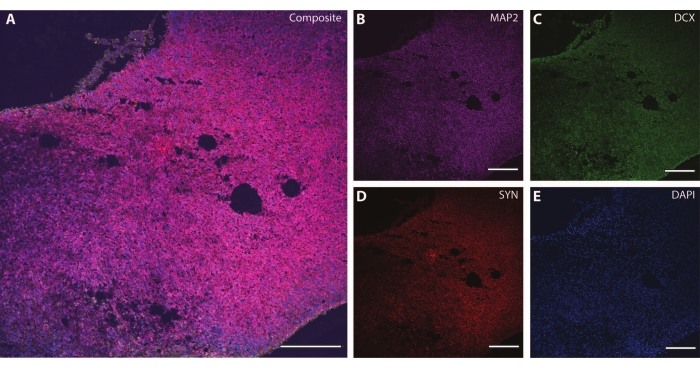
Şekil 6: Sinaptik terminal analizi örneği. DIV 120'de organoidin bir bölümünün immünohistokimya görüntüsü. (A) (B) MAP2, (C) doublecortin (DCX) ve (D) synapsin I (SYN) için boyanmış bölümün kompozit görüntüsü. (E) Çekirdekler DAPI tarafından görselleştirildi. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
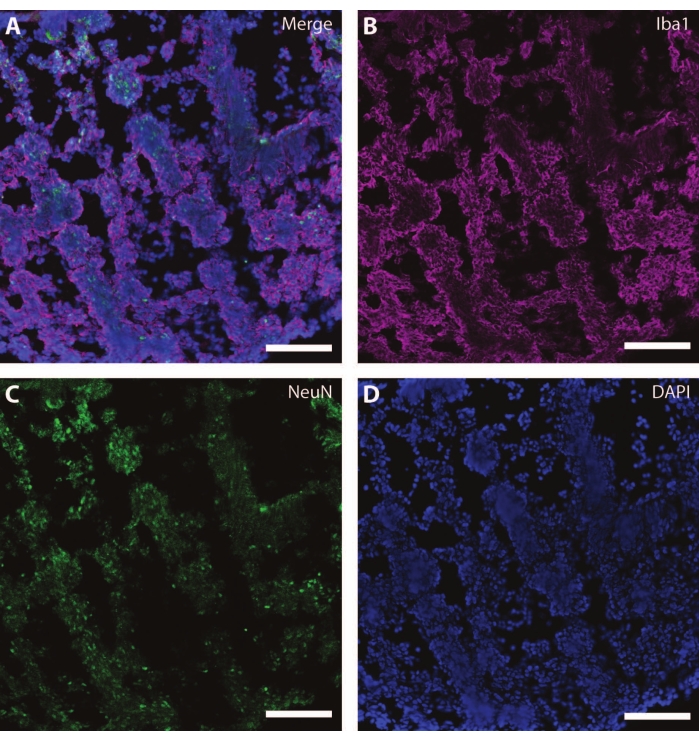
Şekil 7: Glial gelişimin kanıtı. DIV 120'de organoidin bir bölümünün immünohistokimya görüntüsü. (A) (B) iyonize kalsiyum bağlayıcı adaptör molekülü 1 (Iba1) ve (C) NeuN için boyanmış bölümün kompozit görüntüsü. (D) Çekirdekler DAPI tarafından görselleştirildi. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Reaktif | Son Konsantrasyon | Hacim (toplam 50 mL) |
| DMEM-F12 | 50% | 25 mL |
| Nörobazal Ortam | 50% | 25 mL |
| N2 Ek Hizmeti (100x) | 1 adet | 0,25 milyon L |
| B27 Takviyesi -/+ A Vitamini (50x) | 0,5x | 0,5 milyon L |
| Insülin | 0.25% | 12,5 μL |
| GlutaMAX (100x) | 1 adet | 0,5 milyon L |
| MEM-NEAA (100x) | 0,5x | 0,25 milyon L |
| HEPES (1 M) | 10 mM | 0,5 milyon L |
| Antibiyotik/Antimikotik (100x) | 1 adet | 0,5 milyon L |
| 2-β-merkaptoetanol | 50 μM | 17,5 μL |
| * NOT: Bazı DMEM-F12 zaten GlutaMAX içerir, ek eklemeye gerek yoktur. | ||
Tablo 1: Bu çalışmada kullanılan farklılaşma ortamının bileşimi.
Tartışmalar
EB'lerin standartlaştırılmış oluşumu, pluripotent kök hücrelerin beyin organoidlerine çoğaltılabilir dönüşümünde kritik bir adımdır. Kök hücrelerin tekil dokulara kuvvet toplanması, içbükey kuyucukların geometrisine, tohumlama yoğunluğuna ve iyi muameleye bağlı olarak değişebilir. Mevcut yöntem, 6 gün sonra 500-600 μm'lik bir çap aralığına işaret etse de, bu çaplar, diğer birçok çapın başarılı olduğu kanıtlandığı gibi, uygun organoid oluşumunun diğer çaplarını dışlamaz. Bununla birlikte, değişen çapların farklılaşma oranlarını ve başarıyı etkilediği gösterilmiştir29. Tekrarlanabilirlik amacıyla, 50 μm'nin altındaki çap değişimleri şiddetle tavsiye edilir20. Ek olarak, nöral indüksiyon günlerinin sayısı, EB'lerin çapının büyümesine izin vermek için 6 ila 10 gün arasında uzatılabilir, çünkü SMAD inhibitörlerinin kullanımının, sadece 5 günlük maruziyetten sonra nöroepitel oluşumunu verimli bir şekilde ürettiği ve sürdürdüğü gösterilmiştir30. SMAD inhibitörlerinin yokluğunda, nöral indüksiyon tutarsız sonuçlar verebilir ve daha uzun indüksiyon süreleri gerektirir. Bu çalışmada belirtilen SMAD inhibitörleri en etkili olanlardır, ancak diğer dorsomorfin ve TGF-β küçük moleküller etkili konsantrasyonlarında kullanılabilir.
Bazal membran matrisi, büyüme için mükemmel bir substrat sağlar ve farklı şekilde uygulanabilir. Matrisin erken kullanımları, bazal membranı bir kuyu kaplaması olarak içeriyordu31. Bununla birlikte, dokuyu gömmek için matrisin kullanılmasının, bu dokularda farklılaşmayı ve olgunlaşmayı iyileştirdiği gösterilmiştir32. Organoidler için, matrisin kullanımının EB'nin organoidlere farklılaşmasını iyileştirdiği, olgunlaşmayı teşvik ettiği ve kültür periyotlarını uzattığı gösterilmiştir33. Organoidler matriks olmadan hala oluşturulabilirken, birçok grup matrikssiz bir doku kültürü elde etmek için çaba sarf ettiğinden 34,35, çalışmalar matrikse gömülü organoidlerin uzun kültür süreleri için daha yüksek bir şansa sahip olduğunu ve daha az bakım gerektirdiğini bulmuştur36. Gamze gömme yöntemi, organoid yüzeyin eşit şekilde kaplanmasını sağlayarak benzer difüzyon, besin maddelerine erişim ve tekrarlanabilir farklılaşma sağlar. Alternatif olarak, organoidleri tamamen kapsüllemek için kubbe gömme kullanılabilir37.
EB'lerin membran matris çukurlarına aktarılması kritik bir adımdır. 1 mL'lik bir pipet ucu EB'leri aktarmak için yeterince geniş bir açıklığa sahip olsa da, aktarım kolaylığı için 200 μL'lik bir uç tercih edilir. Pipetleme sırasında kayma stresini azaltmak için pürüzsüz bir kenar sağlayan yeterince büyük bir açıklık oluşturmak için 200 μL uçların kesilmesi gerekir. Alternatif olarak, aktarım kolaylığı için geniş delikli 200 μL uçlar mevcuttur. Hızlı pipetleme organoid çevresini bozabileceğinden ve düzgün büyümeyi engelleyebileceğinden pipetleme yavaş yapılmalıdır. Besin sağlamak için yeterli ortamın aktarıldığından emin olmak için özel dikkat gösterilmelidir. Çok az ortam, organoidin kuruması ve nekroza neden olma riskini taşır. EB'yi çok fazla kültür ortamıyla aktarmak, matrisin çok seyreltilmesine ve organoidin güvenli bir şekilde kapsüllenememesine neden olabilir. İdeal olarak, matris, polimerizasyonunu sağlamak ve EB'ler için bir ECM olarak işlev görmek için% 50'den fazla seyreltilmemelidir. Gömme başarısız olursa, EB kurtarılabilir ve yeniden kapsüllenebilir. Taze matriste yeniden kapsülleme, organoide ek destek sağlamak için herhangi bir noktada yapılabilir.
İskele için matris gömmeye benzer şekilde, PLGA lifleri üç boyutlu büyüme için ek destek sağlar. Başlangıçta uzatılmış organoidler üretmek ve yüzey alanı38'i arttırmak için dahil edilen PLGA liflerinin dahil edilmesi, organoid farklılaşmasını ve olgunlaşmasını iyileştirmek için ek bir araç olarak aşamalı olarak tanımlanmıştır39. Daha fazla laboratuvar matrisin kullanımını azaltmaya veya tamamen ortadan kaldırmaya çalıştıkça, birleştirilmiş lifler tarafından desteklenen organoidlerin kendi kendini organize eden özellikleri, üç boyutlu doku oluşturma ve farklılaşma için yeterli iskele sağlar39. Burada, uzun vadeli kültür şansını artırmak için her iki yöntem birleştirildi38,39. İlk toplama sırasında liflerin dahil edilmesi kritiktir, çünkü bunlar daha sonraki bir aşamada tanıtılmayabilir. Santrifüjlemeden sonra, birkaç lifin toplanmış hücreler arasında olup olmadığını kontrol etmek, bir lifin EB'ye dahil edilmesini sağlayacaktır. Başarılı olmazsa, kuyunun nazik bir şekilde aspire edilmesi ve yeniden santrifüjleme karıştırmayı sağlamalıdır.
Organoid bakımında bir diğer kritik adım, daha iyi ortam perfüzyonu için bir orbital çalkalayıcının kullanılmasıdır. Organoid protokollerin erken yinelemelerinde, ajitasyon11'i oluşturmak için dönen bir biyoreaktör kullanıldı. 90 rpm'de bir orbital çalkalayıcı, matris damlacığını tahrip etmeden veya organoid morfolojiye zarar vermeden yeterli ajitasyon sağlar. Bazı gruplar matris iskelesini kullanmaktan kaçınır, ancak uygun bir ortam sağlamak için çalkalayıcı ajitasyonunu korurlar34. Tüm protokollerde olduğu gibi, kayma gerilimi miktarını azaltmak için çalkalayıcıya bağlı olarak rotasyonların hızı ayarlanmalıdır. Bir kubbe gömme seçilirse, kesme gerilmesi miktarınıazaltmak için eğimli bir çalkalayıcı kullanılabilir 11,34.
Birlikte ele alındığında, seçilen birkaç tekniğin entegrasyonu, iPSC kaynaklı organoid oluşumunun sağlam bir yöntemini sağlar. Organoidleri yaratmanın ve sürdürmenin birkaç yolu vardır, ancak birçoğu erken farklılaşma yörüngelerine odaklanır. Bu çalışmada, kültür organoidlerine uzun süreler, farklılaşma fazını geçmiş ve yaşlanma fenotiplerinin gelişmeye başlayabileceği bir olgunlaşma döneminde birçok farklı teknik birleştirilmiştir. Bu tekniklerin dahil edilmesi, kültürleri korumak için eksojen biyolojik faktörlere ihtiyaç duymadan, kendi kendini organize etmeyi ve yaşlanmanın doğal ilerlemesini koruyarak uzun süreli olgunlaşmaya izin verir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Hollanda hükümetinin Eğitim, Kültür ve Bilim Bakanlığı tarafından finanse edilen bir NWO Yerçekimi projesi (024.003.001) olan Hollanda Çip Üzerinde Organ Girişimi tarafından desteklenmiştir. DCB, Consejo Nacional de Ciencia y Tecnología'nın (CONACyT) doktora bursu şeklindeki finansal desteğini şükranla kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-β-Mercaptoethanol | Thermo Fisher Scientific | 31350010 | |
| 4′,6-Diamidino-2-phenylindoledihydrochloride (DAPI) | Invitrogen | D1306 | 1:4000 |
| 6-well Clear Flat Bottom CELLSTAR Cell Culture Multiwell Plate | Greiner Bio-One | 657185 | |
| 6-well Clear Flat Bottom Ultra-Low Attachment Well Plate | Corning | 3471 | |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Fisher Scientific | 136101 | |
| Accutase | Sigma-Aldrich | 46964 | cell detachment solution |
| Antibiotic-Antimycotic (100x) | Gibco | 15240062 | |
| B27 Suppement (with Vitamin A) (50x) | Gibco | 17504044 | |
| B27 Supplement (minus Vitamin A) (50x) | Gibco | 12587010 | |
| BD Vacutainer™ Glass Mononuclear Cell Preparation (CPT) Tubes | Thermo Fisher Scientific | 02-685-125 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Centrifuge | Eppendorf | 5810 R | With plate holders |
| CHIR99021 | Selleck Chemicals | S2924 | |
| CytoTune Sendai Reprogramming Vector | Thermo Fisher Scientific | A1378001 | |
| ddPCR primers | human | MAPT | Bio-Rad | dHsaCPE192234 | |
| ddPCR primers | human | RBFOX3 (NeuN) | Bio-Rad | dHsaCPE5052108 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320074 | |
| Doublecortin (DCX) | Santa Cruz Biotechnology | SC-8066 | 1:500 |
| Dulbecco’s phosphate buffered saline (DPBS) | Thermo Fisher Scientific | 14190144 | no calcium, no magnesium |
| Eppendorf cups, 1.5 mL | Eppendorf | 0030 125.215 | |
| Essential 6 | Gibco | A1516401 | |
| Essential 8 | Gibco | A1517001 | |
| Ethylenediaminetetraacetic acid (EDTA) | Invitrogen | 15575020 | |
| Falcon tubes, 15 mL, conical | Greiner Bio-One | 188271-N | |
| Formaldehyde | Sigma-Aldrich | 252549 | 37% Stock solution, diluted to 4% in PBS |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413202 | |
| GlutaMax (100x) | Gibco | 35050038 | |
| Hemacytometer cell counter | Hausser scientific | 1490 | |
| HEPES Buffer | Thermo Fisher Scientific | 15-630-080 | |
| Insulin | Sigma-Aldrich | I9278 | |
| LDN 193189 | StemCell Technologies | 72147 | |
| MAP2 | Abcam | ab32454 | 1:200 |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free | Corning | 356230 | basement membrane matrix |
| MEM-Non Essential Amino Acid Solution (MEM-NEAA; 100x) | Thermo Fisher Scientific | 11140050 | |
| Multilabel Counter Victor 3 Plate Reader | Perkin Elmer | 1420 | luminometer |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| N-2 Supplement (100x) | Thermo Fisher Scientific | 17502-048 | |
| NeuN | Millipore | MAB377 | 1:500 |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | |
| Oct-3/4 Antibody (C-10) Alexa Fluor 647 | Santa Cruz Biotechnology | sc-5279 AF647 | 1:100 |
| Parafilm | Bemis | PM-996 | thermoplastic film sheet |
| PAX6 | Thermo Fisher Scientific | 42-6600 | 1:200 |
| Penicillin/Streptomycin | Gibco | 15070063 | |
| Poly(lactic-co-glycolic acid) (PLGA) microfilaments | Ethicon | J463 | |
| QX200 Droplet digital PCR system | Bio-Rad | 1864001 | |
| ROCK inhibitor (Y27632) | Selleck Chemicals | S1049 | |
| SB431542 | R&D Systems | 1614/50 | |
| SOX2 Monoclonal Antibody (Btjce), Alexa Fluor 488, eBioscience | Invitrogen | 53-9811-80 | 1:100 |
| Synapsin I (SYN) | Calbiochem | 574777 | 1:200 |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| TUJ1 | Santa Cruz Biotechnology | sc-80005 | Beta-3-tubulin; 1:500 |
| XAV939 | Tocris Bioscience | 3748 |
Referanslar
- Liu, G. H., et al. Aging Atlas: a multi-omics database for aging biology. Nucleic Acids Research. 49, 825-830 (2021).
- Ferrucci, L., et al. Measuring biological aging in humans: A quest. Cell. 19 (2), 13080 (2020).
- Mertens, J., Reid, D., Lau, S., Kim, Y., Gage, F. H. Aging in a dish: iPSC-derived and directly induced neurons for studying brain aging and age-related neurodegenerative diseases. Annu Rev Genet. 52, 271-293 (2018).
- Mertens, J., et al. Age-dependent instability of mature neuronal fate in induced neurons from Alzheimer's patients. Cell Stem Cell. 28 (9), 1533-1548 (2021).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1141-1154 (2018).
- Fang, E. F., et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease. Nature Neuroscience. 22 (3), 401-412 (2019).
- Hu, J. L., Todhunter, M. E., LaBarge, M. A., Gartner, Z. J. Opportunities for organoids as new models of aging. Journal of Cell Biology. 217 (1), 39-50 (2018).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Gonzalez, C., et al. Modeling amyloid beta and tau pathology in human cerebral organoids. Molecular Psychiatry. 23 (12), 2363-2374 (2018).
- Yoon, S. -. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Muratore, C. R., Srikanth, P., Callahan, D. G., Young-Pearse, T. L. Comparison and optimization of hiPSC forebrain cortical differentiation protocols. PLoS ONE. 9 (8), 105807 (2014).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2020).
- Goto-Silva, L., et al. Computational fluid dynamic analysis of physical forces playing a role in brain organoid cultures in two different multiplex platforms. BMC Developmental Biology. 19 (1), 1-10 (2019).
- Sommer, A. G., et al. Generation of human induced pluripotent stem cells from peripheral blood using the STEMCCA lentiviral vector. Journal of Visualized Experiments. (68), e4327 (2012).
- Beers, J., et al. A cost-effective and efficient reprogramming platform for large-scale production of integration-free human induced pluripotent stem cells in chemically defined culture. Scientific Reports. 5 (1), 1-9 (2015).
- Wakao, S., et al. Morphologic and gene expression criteria for identifying human induced pluripotent stem cells. PLoS ONE. 7 (12), e48677 (2012).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2022).
- Choy Buentello, D., Koch, L. S., Trujillo-De Santiago, G., Alvarez, M. M., Broersen, K. Use of standard U-bottom and V-bottom well plates to generate neuroepithelial embryoid bodies. PLOS ONE. 17 (5), 0262062 (2022).
- Ellis, P., et al. SOX2, a persistent marker for multipotential neural stem cells derived from embryonic stem cells, the embryo or the adult. Developmental Neuroscience. 26 (2-4), 148-165 (2004).
- Lee, S., et al. TuJ1 (class III β-tubulin) expression suggests dynamic redistribution of follicular dendritic cells in lymphoid tissue. European Journal of Cell Biology. 84 (2-3), 453-459 (2005).
- Suzuki, S., Namiki, J., Shibata, S., Mastuzaki, Y., Okano, H. The neural stem/progenitor cell marker nestin is expressed in proliferative endothelial cells, but not in mature vasculature. Journal of Histochemistry and Cytochemistry. 58 (8), 721-730 (2010).
- Soltani, M. H., et al. Microtubule-associated protein 2, a marker of neuronal differentiation, induces mitotic defects, inhibits growth of melanoma cells, and predicts metastatic potential of cutaneous melanoma. The American Journal of Pathology. 166 (6), 1841-1850 (2005).
- Wilson, P. G., Stice, S. S. Development and differentiation of neural rosettes derived from human embryonic stem cells. Stem Cell Reviews. 2 (1), 67-77 (2006).
- Gusel'nikova, V. V., Korzhevskiy, D. E. NeuN as a neuronal nuclear antigen and neuron differentiation marker. Acta Naturae. 7 (25), 42-47 (2015).
- Rao, M. S., Hattiangady, B., Shetty, A. K. The window and mechanisms of major age-related decline in the production of new neurons within the dentate gyrus of the hippocampus. Aging Cell. 5 (6), 545-558 (2006).
- Meng, L., et al. A synapsin I cleavage fragment contributes to synaptic dysfunction in Alzheimer's disease. Aging Cell. 21 (5), 13619 (2022).
- Moon, S. H., et al. Optimizing human embryonic stem cells differentiation efficiency by screening size-tunable homogenous embryoid bodies. Biomaterials. 35 (23), 5987-5997 (2014).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Lee, S. -. W., et al. Optimization of Matrigel-based culture for expansion of neural stem cells. Animal Cells and Systems. 19 (3), 175-180 (2015).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: The matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Hocevar, S. E., Liu, L., Duncan, R. K. Matrigel is required for efficient differentiation of isolated, stem cell-derived otic vesicles into inner ear organoids. Stem Cell Research. 53, 102295 (2021).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Communications Biology. 4 (1), 1-15 (2021).
- Kaiser, A., Kale, A., Novozhilova, E., Olivius, P. The effects of Matrigel® on the survival and differentiation of a human neural progenitor dissociated sphere culture. The Anatomical Record. 303 (3), 441-450 (2020).
- Kakni, P., et al. Intestinal organoid culture in polymer film-based microwell arrays. Advanced Biosystems. 4 (10), 2000126 (2020).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Tejchman, A., Znój, A., Chlebanowska, P., Frączek-Szczypta, A., Majka, M. Carbon fibers as a new type of scaffold for midbrain organoid development. International Journal of Molecular Sciences. 21 (17), 5959 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır