このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
静的法と動的法を組み合わせたアプローチによる有機ペルオキシ酸の乳バイオフィルム根絶効果評価
要約
このプロトコルは、酪農産業におけるバイオフィルムを根絶するための有機ペルオキシ酸の有効性を評価するための静的方法と動的方法を組み合わせたアプローチについて説明しています。このアプローチは、バイオフィルムを制御するための新しい生物学的または化学的製剤の有効性を試験するためにも使用され得る。
要約
乳製品業界におけるバイオフィルムの存在は、加工工場で頻繁に使用されるほとんどの定置洗浄(CIP)手順に対する耐性が高いため、安全でない変化した乳製品の生産につながる可能性があるため、大きな懸念事項です。したがって、酪農業界向けの新しいバイオフィルム制御戦略を開発することが不可欠です。このプロトコルは、有機ペルオキシ酸の有効性を評価することを目的としています 静的方法と動的方法の組み合わせを使用して、乳製品バイオフィルムを根絶するための有機ペルオキシ酸(過酢酸、過プロピオン酸、および過乳酸および市販の過酢酸ベースの消毒剤)。すべての消毒剤は、静的ハイスループットスクリーニング法である最小バイオフィルム根絶濃度(MBEC)アッセイを使用して、単一または混合バイオフィルムのいずれかで最も強力なバイオフィルム産生細菌でテストされました。推奨濃度の消毒剤との接触時間5分は、単一バイオフィルムと混合バイオフィルムの両方を根絶することに成功しました。現在、米国疾病対策センター(CDC)のバイオフィルムリアクター(in situ 条件を模倣する動的方法)を使用してこれらの観察を確認するための研究が進行中です。このタイプのバイオリアクターは、ほとんどの産業機器および表面を構成するステンレス鋼の表面の使用を可能にする。反応器からの予備的な結果は、バイオフィルムに対する有機ペルオキシ酸の有効性を確認するようです。この研究で説明されている組み合わせたアプローチは、バイオフィルムを制御し、微生物を根絶するための新しい生物学的または化学的製剤を開発およびテストするために使用できます。
概要
酪農産業は、毎年約9,000万hLの牛乳を生産する10,500以上の酪農場があるカナダを含む、世界の主要な産業部門です1。加工工場を含む酪農業界で課せられた厳格な衛生要件にもかかわらず、牛乳は微生物にとって優れた培養培地を構成するため、乳製品には腐敗微生物や病原性微生物などの微生物が含まれている可能性があります。これらの病原体はさまざまな病気を引き起こす可能性があります。たとえば、 サルモネラ 菌と リステリア菌は 、それぞれ胃腸炎と髄膜炎を引き起こす可能性があります2。腐敗微生物は、ガス、細胞外酵素、または酸を生成することにより、乳製品の品質と官能特性に影響を与える可能性があります3。牛乳の外観と色も、例えば シュードモナス 属4によって変更される可能性があります。
これらの微生物のいくつかは、ステンレス鋼を含むさまざまな表面にバイオフィルムを形成することができます。このようなバイオフィルムは、機器の表面での微生物の持続と増殖を可能にし、したがって乳製品の汚染を可能にします5。バイオフィルムは、熱伝達を妨げ、機器の腐食を加速させる能力があるためにも問題があり、機器の早期交換につながり、したがって経済的損失につながります6。
定置洗浄(CIP)手順により、食品業界は微生物の増殖を制御できます。これらの手順には、水酸化ナトリウム、硝酸、および場合によっては次亜塩素酸と過酢酸を含む消毒剤の順次使用が含まれます7,8。次亜塩素酸は微生物に対して非常に効果的ですが、天然有機物とも反応し、有毒な副産物の形成を引き起こします9。過酢酸は有害な副産物を生成しません10;ただし、食品業界におけるバイオフィルムに対するその有効性は非常に変動します10,11。最近、ペルプロピオン酸およびペル乳酸を含む他のペルオキシ酸がそれらの抗菌活性について研究されており、それらはバイオフィルムにおける微生物増殖の制御のための優れた代替手段であるように思われる12,13。
そこで本研究では,有機ペルオキシ酸(過酢酸,過プロピオン酸,過乳酸,過乳酸,過酢酸系消毒剤)の乳用バイオフィルム除菌効果を,最小バイオフィルム消去濃度(MBEC)アッセイ,静的ハイスループットスクリーニング法,およびin situ 模倣動的手法である米国疾病対策センター(CDC)バイオフィルムリアクターと組み合わせたアプローチを用いて,乳用バイオフィルムを除菌する有効性を評価することを目的とした。 条件。MBECアッセイは、以下、プロトコルにおいて「バイオフィルムマイクロタイタープレート」と呼ばれる。ここに提示されたプロトコルと代表的な結果は、有機ペルオキシ酸の有効性と、乳製品産業における微生物バイオフィルムを制御するためのそれらの潜在的な用途を示しています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
この記事に含まれる作業には、バイオセーフティレベル2のラボが必要であり、ラバル大学の機関バイオセーフティ委員会によって以前に承認されています(プロジェクト番号119689)。
注: 図1 のフローチャートは、バイオフィルムを根絶するための有機ペルオキシ酸の有効性を評価するために使用された静的アプローチと動的アプローチを組み合わせた方法論の要約を表しています。
1.材料の準備
- 微生物分離株
- 使用の15分前に生物学的安全キャビネット(BSC)の電源を入れ、70%(v / v)アルコール溶液で洗浄します。
- BSCが無菌になったら、試験する微生物分離物のバイアル(この研究ではシュードモナスアゾトフォルマン スまたは ブレブンディモナスベシクラリス )、接種ループ、10 mLの滅菌トリプシン大豆ブロス(TSB)で満たされた15 mLチューブ、およびボルテックスミキサーを置きます。BSCに配置する前に、すべての材料をアルコールで消毒してください。
- 微生物分離物のバイアルをボルテックスして培養物を均質化する。
- 20 μLの微生物分離物を15 mLチューブに含まれる10 mLの滅菌TSBに無菌的に移し、160 rpmで攪拌しながら30°Cで16〜24時間インキュベートします。
注意: B. besicularis は、病原性生物の取り扱いに必要なガイドラインに従って、封じ込めレベル2の実験室で使用する必要があります。.ハンドラーは適切な訓練を受け、安全メガネ、手袋、コートを着用する必要があります。
- 消毒 剤
- 有機ペルオキシ酸溶液(60 mL)を調製するには、24 mLの過酸化水素と36 mLの酸(酢酸、プロピオン酸、または乳酸)を250 mLの三角フラスコに加えます。次に、事前定義された容量の10 M硫酸を追加します(過酢酸の場合は655 μL、過プロピオン酸の場合は635 μL、または過乳酸の場合は715 μL)。フラスコを軽く振って混合し、フラスコをケミカルフード内に設置した30°Cの水浴に入れます。フラスコを2日間インキュベートし、毎朝穏やかに混合します。
注意: 市販の過酢酸ベースの消毒剤( 材料の表を参照)は、メーカーから直接提供されました。
注意: 消毒剤は化学フードの下で使用する必要があります。実験中は安全メガネと手袋を着用する必要があります。消毒剤の詳細については、各製品安全データシートを参照してください。 - 下記のように過酸化水素の滴定を行う。
- 空の300 mLビーカーを分析天びんの上に置き( 材料の表を参照)、スケールを風袋引きします。ビーカーに約0.23 gの消毒剤を量り、追加された正確な重量を書き留めます。ビーカーに冷たい1N硫酸溶液100 gを加え、ビーカーに磁気攪拌子を加えて、攪拌プレートに置きます。
- 完全に均質化されるまで溶液を攪拌します。次に、フェロイン指示薬溶液(H2O中0.1重量%)をビーカーに3滴加え、溶液がサーモンピンク色から水色に変わるまで0.1 N硫酸セリウム溶液で滴定します。添加する硫酸セリウム溶液の量に注意してください。
- 次の式を使用して過酸化水素の割合を計算します。
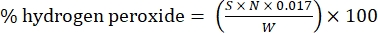 式 (1)
式 (1)
ここで、S は添加した硫酸セリウム溶液の体積、N は硫酸セリウム溶液の正規度 (0.1 N)、W はサンプルの重量 (~0.2300 g)、0.017 = (1 mol H2O 2/2 mol Ce) × (34.0147 g H 2 O 2 /1 mol H 2 O)2 × (1 L/1,000 mL)
- 下記のように有機ペルオキシ酸の滴定を行う。
- 20 mLの7.5%(w / v)ヨウ化カリウム溶液をビーカーに加えます。溶液の青色が淡褐色/オレンジ色に変わり始めるまで、0.1 Nチオ硫酸ナトリウム溶液でゆっくりと滴定します。
- 2 mLのデンプン溶液(H2O中に1 wt%)をビーカーに加え、溶液が黒からオレンジに変わるまで0.1 Nチオ硫酸ナトリウム溶液で滴定します。使用したチオ硫酸ナトリウム溶液の容量に注意してください。
- 次の式で有機ペルオキシ酸の割合を計算します。
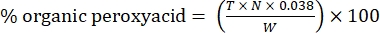 式 (2)
式 (2)
ここで、T は使用したチオ硫酸ナトリウム溶液の体積、N はチオ硫酸ナトリウム溶液の正規度 (0.1 N)、W はサンプルの重量 (~0.2300g)、0.038 = (1 mol CH 3 COOOH/1 mol I 2) × (1 mol I 2/2 mol S2 O 3) × (76.06 g/1 mol CH3COOOH) × (1 L/1,000 mL)
注意: 手順1.2.2と手順1.2.3をさらに2つのサンプルで繰り返して、各テストを3回で実行します。
- 有機ペルオキシ酸溶液(60 mL)を調製するには、24 mLの過酸化水素と36 mLの酸(酢酸、プロピオン酸、または乳酸)を250 mLの三角フラスコに加えます。次に、事前定義された容量の10 M硫酸を追加します(過酢酸の場合は655 μL、過プロピオン酸の場合は635 μL、または過乳酸の場合は715 μL)。フラスコを軽く振って混合し、フラスコをケミカルフード内に設置した30°Cの水浴に入れます。フラスコを2日間インキュベートし、毎朝穏やかに混合します。
2.単一および混合バイオフィルムの形成
- バイオフィルムマイクロタイタープレート
- 細菌培養物(20 μLの菌株+ 10 mLのTSB培地、ステップ1.1.4で調製)を含むチューブをボルテックスします。トリプシン大豆寒天培地(TSA)上で段階希釈とプレーティングを行い、一晩培養の菌体数(cfu)を測定します。次に、100 μLの培養液を10 mLの滅菌TSB培地(最終濃度約2 x 107 cfu/mL)に無菌的に移します。
注:バイオリアクターでのアッセイでは、100 μLの容量の微生物分離物を100 mLの滅菌TSBに移します。 - チューブを渦巻きます。各細菌について、希釈した細菌培養物をマルチチャンネルピペットを使用して3連でバイオフィルムマイクロタイタープレート(ウェルあたり150 μL)に移します。150 μLのTSB培地を3つの新しいウェルにロードし、コントロールとして使用します。バイオフィルムマイクロタイタープレート( 材料の表を参照)を攪拌せずに30°Cで24時間インキュベートします。
注:混合バイオフィルムアッセイの場合は、各懸濁液75 μLを追加して、総容量150 μLにします。バイオフィルムマイクロタイタープレートは、その蓋にペグを含み、その上にバイオフィルムが形成される。
- 細菌培養物(20 μLの菌株+ 10 mLのTSB培地、ステップ1.1.4で調製)を含むチューブをボルテックスします。トリプシン大豆寒天培地(TSA)上で段階希釈とプレーティングを行い、一晩培養の菌体数(cfu)を測定します。次に、100 μLの培養液を10 mLの滅菌TSB培地(最終濃度約2 x 107 cfu/mL)に無菌的に移します。
- バイオリアクター
- 製造元の指示に従ってバイオリアクターの部品を洗浄および風乾し( 材料の表を参照)、以下に説明するようにリアクターの準備に進みます。
- まず、磁気バーでホルダーに取り付けられた1Lガラスビーカー(バイオリアクター)の内側にフラットブレードを置き、バイオリアクターの蓋の内側に取り付けられたプラスチックバーを使用してセットアップを直立位置に維持します。
- ドライバーを使用してステンレス鋼のクーポンまたはスライド( 材料の表を参照)をポリプロピレン棒に置き、ノッチに位置合わせピンを配置せずに蓋の穴に挿入して、滅菌中に蒸気を逃がします。
- すべてのバイオリアクターベントをアルミホイルで覆い、残りの機器、すなわちチューブL / S 18(ID = 7.9 mm)とL / S 16(ID = 3.1 mm)、ガラスフローブレーク、コンテナキャップ、ドライバー、鉗子、および0.2μmフィルターをアルミホイルで包みます。
注意: シリコンチューブ( 材料表を参照)を中型コンテナキャップの内面にあるバーブに挿入します。 - オートクレーブに設置したバイオリアクターをドライサイクルで121°C、20分間行います。
- バイオリアクター内でバイオフィルム形成をバッチモードで行う(第1工程)。
- BSCでは、チューブL / S 18の一方の端をバイオリアクターの出口注ぎ口に接続し、もう一方の端をアルミホイルで包んで無菌性を維持します。
- バイオリアクターの蓋からクーポンまたはスライドホルダーを1つ取り外し、滅菌済みの50 mLチューブに入れます。その後、バイオリアクターのビーカーに340 mLの300 mg/L TSB培地を、50 mLの血清学的ピペットを使用してロッドが占めていた穴を通して満たします。
- バイオリアクター内の培養液に、5 mL ピペットを使用して 1 mL の細菌溶液 (~108 cfu/mL の P. azotoformans) を接種し、ロッドを元の位置に戻します。すでに蓋の穴に配置されているロッドを、ピンがそれぞれのノッチに収まるように配置します。
- バイオリアクターの蓋にある最小直径のチューブの端に0.2μmのバクテリアエアパージフィルターを配置します。同じ直径の他のチューブは、金属製のスクリューキャップまたはしっかりと閉じるシリコンプラグで恒久的に差し込まれたままになります。
- バイオリアクターを30°Cに設定した加熱プレート上に24時間置き、130rpmで攪拌します。
注:複数種のバイオフィルム形成には、等量の異なる細菌培養物を使用して、接種材料の総容量1mLを取得します。
- 連続フローモードでバイオリアクター内でバイオフィルム形成を行う(第2工程)。
- 18 Lの滅菌蒸留水を含むカーボイをBSCに入れ、1,000 mg/L TSB培養液2 Lを加えて最終濃度100 mg/Lを得ます。
- 2本のチューブが接続されている滅菌キャップで容器を覆います。1つ目は、キャップの内面に固定されたシリコンチューブで、媒体をポンピングするために使用されます。2番目のチューブ(L / S 16)は、液体がバイオリアクターに向かって流れるように外部ポートに接続されています。培地容器の蓋にある2番目のチューブに0.2μmのフィルターを置きます。
- この2番目のチューブを蠕動ポンプに接続し、もう一方の端をガラスフローブレークに結合し、ガラスフローブレークをバイオリアクター蓋の大きなチューブに挿入します。
- 別の20Lカーボイを使用して、バイオリアクターから廃液を収集します。バイオリアクター出口注ぎ口に接続されたチューブの端を廃棄物容器のキャップに取り付けます。この容器の蓋にあるチューブに0.2μmのフィルターを挿入します。
- 蠕動ポンプを11.3 mL / minの流量で始動し、システムを24時間稼働させます。
注:バイオリアクターでのバイオフィルム形成中に使用された培地またはミルクの流量(11.3 mL / min)は、340 mL(リアクター内の液体の体積に相当)を30分の滞留時間で割ることによって決定されました。
- 細菌バイオフィルムを回収します。
- 蠕動ポンプをオフにし、バイオリアクターの攪拌と加熱を停止します。
- バイオリアクターから各ロッドを慎重に取り外し、クーポンまたはスライドを40 mLのPBSで3回すすぎ、浮遊細菌を除去します。その後、適切なドライバーを使用して、クーポンまたはスライドを40 mLのPBSを含む滅菌済みの50 mLコニカルチューブに解放します。チューブを30秒間ボルテックスし、超音波処理器浴に配置されたラックに移し、40kHzでチューブを30秒間超音波処理します(これには110Wの電力が必要です)。この操作を3回繰り返します。
- 40 mLのバイオフィルム懸濁液を滅菌50 mLコニカルチューブに集め、クーポンまたはスライドを2 mLの滅菌PBS溶液ですすいでください。このすすぎ液を回収し、すでに採取したバイオフィルム懸濁液に加えます。
- バイオフィルム中の生菌を列挙する:得られたバイオフィルム懸濁液を使用して、10倍の段階希釈を行い、次に10-5および10-6希釈液の100 μLをTSAに3連でプレートします。プレートを30°Cで24時間インキュベートします。寒天プレートに存在するコロニーの数を数え、次の式を使用してASTM E2562-1714に従ってクーポンとスライド(生存固着菌)の細菌密度を計算します。
 式 (3)
式 (3)
ここで、 X はコロニー形成単位(CFU)の数、 B は播種された容量(0.1 mL)、 V はバイオフィルムが懸濁している容量(ストック溶液)、 A はバイオフィルムで覆われたクーポンまたはスライドの表面、 D は希釈係数です。
- 製造元の指示に従ってバイオリアクターの部品を洗浄および風乾し( 材料の表を参照)、以下に説明するようにリアクターの準備に進みます。
3. 有機ペルオキシ酸のバイオフィルム除菌効果の定量的評価
- バイオフィルムマイクロタイタープレート
- 200 μLのリン酸緩衝生理食塩水(1x PBS)を96ウェルマイクロプレートの3つのウェルに加えます。
- ペグ上に形成されたバイオフィルムを含むバイオフィルムマイクロプレートの蓋を、PBSを含む96ウェルマイクロプレートに10秒間移し、バイオフィルムを洗浄し、浮遊細菌を除去します。
- 必要な濃度で消毒剤を準備します(例:.、25 ppm、50 ppm、500 ppm、1,000 ppm、5,000 ppm、10,000 ppm、および25,000 ppmの活性物質)。
注:すべての希釈は、滅菌蒸留水を使用して無菌的に行われます。 - 各濃度の消毒剤200 μLを、新しい96ウェルマイクロタイタープレートのウェルに3連で加えます。バイオフィルムマイクロタイタープレートの蓋を消毒剤を含むこの96ウェルマイクロタイタープレートに移し、プレートを室温で所望の曝露時間インキュベートします。
- 200 μLのDey-Engley中和ブロスを新しい96ウェルマイクロタイタープレートのウェルに加えます。バイオフィルムマイクロタイタープレートの蓋を中和ブロスを含む96ウェルマイクロタイタープレートに移す。マイクロタイタープレートをパラフィルムで密封し、40kHzのバス超音波処理装置に30分間入れます。
- 30分後、超音波処理器からマイクロタイタープレートを取り外し、パラフィルムを取り外します。超音波処理後に剥離したバイオフィルムを含む96ウェルプレートの最初の列から新しい96ウェルマイクロタイタープレートの最初の列に100μLを移します。
- 180 μLの滅菌1x PBSを、最初の行を除いて、新しい96ウェルマイクロプレート(ステップ3.1.6で調製)のウェルに追加します。1列目のバイオフィルム溶液20 μLを、180 μLの1x PBSを含む2列目のウェルに移します(2列目、希釈率:10−1)。次に、2列目に含まれる液体20 μLを、1x PBSの180 μLを含む次の列のウェルに移します(行3、希釈:10−2)。同じ手順を繰り返して、10-5から10-7の間の希釈を取得します。
- 100 μLの希釈液をTSAに接種し、各細菌の増殖に必要なパラメータに従ってプレートをインキュベートします。
- インキュベーション後、cfusを数え、各ペグのlog10密度と各消毒剤濃度でのlog10の減少を次の式で計算します。
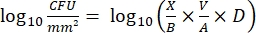 式 (4)
式 (4)
ここで、 X はスポットでカウントされたコロニー形成単位、 B は播種された容量(0.01 mL)、 V はウェル容量(0.20 mL)、 A はペグ表面積(46.63 mm2)、 D は希釈率です。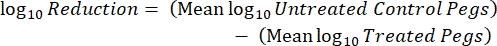 式 (5)
式 (5) - 独立した日に各実験を3回繰り返します。
注:「バイオフィルムを根絶する消毒剤の最小濃度」、またはMBECは、細菌の増殖を示さない最低消毒剤濃度に対応します。
- バイオリアクター
注意: ASTM規格E2871-1915 の手順に従って、 P.アゾトフォルマンス PFlA1を使用してこのテストを実行します。- ステップ2.2で説明したように、バイオリアクター内のクーポン上にバイオフィルムを形成することから始めます。次に、クーポンを保持しているロッドを取り外し、30 mLのPBSを含む円錐形のチューブ内ですすぎます。
- ドライバーを使用して各クーポンを滅菌済みの50 mLコニカルチューブにドロップし、コントロールに適した有機ペルオキシ酸溶液またはPBSを4 mL追加します。5分間インキュベートしてから、36 mLのデイエングレー中和ブロスを加えます。30秒間渦を巻き、次に超音波処理器浴を使用して30秒間40kHzで超音波処理します。このプロセスを3回繰り返し、バイオフィルム懸濁液を得る。
- 同様に、他のすべてのロッドをすすぎ、クーポンからバイオフィルムを回収します。TSA培地上でバイオフィルム懸濁液およびプレート0.1 mLの段階希釈を行います。プレートを30°Cで24時間インキュベートします。
- インキュベーション後、cfusを数え、次の式を使用して、各クーポンのバイオフィルム密度(式6)、処理と対照を含む同じロッドからの3つのクーポンの各セットの平均対数密度(LD)(式7)、および消毒剤の対数減少(式8)を計算します。
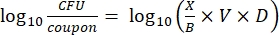 式 (6)
式 (6)
ここで、 X はカウントされたコロニー形成単位/クーポンの平均、 B はメッキされた容量(0.1 mL)、 V は消毒剤またはPBSと中和剤(40 mL)の容量、 D は希釈液です。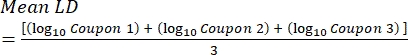 式 (7)
式 (7)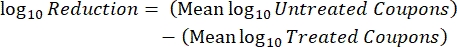 式 (8)
式 (8)
4. 有機ペルオキシ酸のバイオフィルム除菌効果の定性的評価
注:消毒剤で処理した後(ステップ3.1.1からステップ3.1.5)、静的法でバイオフィルムマイクロタイタープレートのペグ上に形成された P.アゾトフォルマンス バイオフィルムを調製し、走査型電子顕微鏡および共焦点顕微鏡での観察によって分析した。
- 走査型電子顕微鏡(SEM)
- 200 μLの1x PBSを96ウェルマイクロプレートの3ウェルに加えます。蓋をバイオフィルムマイクロタイタープレート(ステップ3.1.5)からPBSを含む96ウェルマイクロプレートに移し、室温で10秒間放置して、Dey-Engley中和ブロスを除去します。
- 滅菌したニードルノーズプライヤーを使用して、バイオフィルムマイクロタイタープレートからペグを取り外します。各ペグをフードの下の空のバイアルに入れ、一次固定液(0.1 M Naカコジル酸バッファーpH 7.5中の5%グルタルアルデヒド)を各バイアルに追加します。各バイアルにキャップをし、4°Cで24時間インキュベートします。
- インキュベーション後、固定液をピペットでデカントし、すべての液体廃棄物を適切な容器に捨てます。各バイアルのキャップを外し、フードに入れて72時間風乾します。
- 各スタブの平らな上面にエポキシ樹脂(材料表を参照)を塗布することにより、サンプルをアルミニウムスタブ(材料表を参照)に取り付けます。次に、鉗子でペグをスタブに慎重に取り付けます。
- EMS950x + 350sゴールドスパッタ(材料表を参照)で、2 x 10-1バールのアルゴン圧力と20mAの電流で4分間サンプルを金属化します。金に露出していないペグの側面を銀の塗料で塗装して、適切な接地を行います(材料の表を参照)。
- SEMコントロールユーザーインターフェイスバージョン6.28を使用して、走査型電子顕微鏡で画像を取得します( 材料表を参照)。本研究で用いた加速電圧は15kVで、倍率は300倍と2,000倍とした。
- 共焦点顕微鏡
- 200 μLの1x PBSを96ウェルマイクロタイタープレートの3ウェルに追加します。蓋をバイオフィルムマイクロプレートからPBSを含む96ウェルプレートに移し、10秒間放置してDey-Engley中和ブロスを除去します。
- 1 mLの滅菌水に3 μLの緑色蛍光染色剤と3 μLの赤色蛍光染色剤( 材料表を参照)を加えて、蛍光染色剤の溶液を調製します。
- 200 μLの染色液を96ウェルマイクロタイタープレートの1ウェルに加えます。蓋をバイオフィルムマイクロタイタープレートから染色液の入った96ウェルプレートに移します。バイオフィルムマイクロタイタープレートをアルミホイルで覆い、サンプルを室温で20〜30分間インキュベートします。
- 200 μLの滅菌水を96ウェルマイクロプレートのウェルに加えます。その後、蓋をバイオフィルムマイクロプレートから水の入った96穴マイクロプレートに移し、観察するまで放置する。
- 63x/1.40オイルDIC対物レンズを備えた共焦点レーザー走査型顕微鏡( 材料表を参照)を使用して、ペグ上に形成されたバイオフィルムを視覚化します。関連するソフトウェアを使用して画像を取得します( 材料表を参照)。緑色蛍光染色剤に用いた蛍光励起波長は、赤色蛍光染色剤に用いた蛍光励起波長はそれぞれ482nm、490nmであった。
注意: 最良の結果を得るには、ペグをカットして60 mmのペトリ皿に入れ、皿に滅菌水を入れます。
Access restricted. Please log in or start a trial to view this content.
結果
SEM分析は、バイオフィルムマイクロプレートペグ上に P.アゾトフォルマンス PFl1Aによって生成されたバイオフィルムの存在を示しています(図2A)。3次元的なバイオフィルム構造を観察することができます。 P. azotoformans PFl1Aは、96ウェルマイクロタイタープレートを使用して強力なバイオフィルム生産者(A570 > 1.5)として以前に同定されました
Access restricted. Please log in or start a trial to view this content.
ディスカッション
MBECアッセイ(バイオフィルムマイクロプレートアッセイ)は、ASTM17によって標準的なバイオフィルム除菌試験として認められた最初の方法でした。私たちの研究と他の人は、このアッセイを使用するときに2つの重要なステップがあることを示しています:超音波処理ステップ(時間と電力)と消毒剤治療時間18。スチュワートとパーカーはまた、微生物種、バイ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利益相反がないことを宣言します。
謝辞
本研究は、ケベック州産業研究協会(CRIBIQ)(2016-049-C22)、アグロプール、サニマークグループ、カナダ自然科学工学研究評議会(NSERC)(RDCPJ516460-17)の支援を受けました。原稿の批判的なレビューをしてくれたテレサ・パニコニに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
参考文献
- Canada's dairy industry at a glance. Canadian Dairy Information Centre. , Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017).
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. Science et technologie du lait. 3rd edn. , Les Presses de l'Université Laval. Quebec. (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934(2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921(2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM International. ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2562-17.html (2017).
- ASTM International. ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2871-19.html (2019).
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181(2022).
- ASTM International. ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2799-17.html (2022).
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020(2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264(2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212(2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592(2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885(2020).
- Goeres, D. M., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. Simoes, M., Borges, A., Chaves Simoes, L. , Academic Press. Cambridge, MA. 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved