Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der Wirksamkeit organischer Peroxysäuren zur Elimination von Milchbiofilmen unter Verwendung eines Ansatzes, der statische und dynamische Methoden kombiniert
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen Ansatz, der statische und dynamische Methoden kombiniert, um die Wirksamkeit organischer Peroxysäuren zur Beseitigung von Biofilmen in der Milchindustrie zu bewerten. Dieser Ansatz kann auch verwendet werden, um die Wirksamkeit neuer biologischer oder chemischer Formulierungen zur Bekämpfung von Biofilmen zu testen.
Zusammenfassung
Das Vorhandensein von Biofilmen in der Milchindustrie ist von großer Bedeutung, da sie aufgrund ihrer hohen Beständigkeit gegen die meisten Clean-in-Place-Verfahren (CIP), die häufig in Verarbeitungsbetrieben verwendet werden, zur Herstellung unsicherer und veränderter Milchprodukte führen können. Daher ist es unerlässlich, neue Strategien zur Biofilmkontrolle für die Milchindustrie zu entwickeln. Dieses Protokoll zielt darauf ab, die Wirksamkeit organischer Peroxysäuren (Peressigsäure, Perpropionsäure und Permilchsäure sowie ein kommerzielles Desinfektionsmittel auf Peressigsäurebasis) zur Beseitigung von Milchbiofilmen mit einer Kombination aus statischen und dynamischen Methoden zu bewerten. Alle Desinfektionsmittel wurden an den stärksten Biofilm-produzierenden Bakterien entweder in einem einzelnen oder einem gemischten Biofilm unter Verwendung des MBEC-Assays (Minimum Biofilm eradication Concentration), einer statischen Hochdurchsatz-Screening-Methode, getestet. Eine Kontaktzeit von 5 Minuten mit den Desinfektionsmitteln in den empfohlenen Konzentrationen beseitigte erfolgreich sowohl die einzelnen als auch die gemischten Biofilme. Derzeit laufen Studien, um diese Beobachtungen mit dem Biofilmreaktor des Center for Disease Control (CDC), einer dynamischen Methode zur Nachahmung von In-situ-Bedingungen , zu bestätigen. Diese Art von Bioreaktor ermöglicht die Verwendung einer Edelstahloberfläche, die die meisten industriellen Geräte und Oberflächen ausmacht. Die vorläufigen Ergebnisse des Reaktors scheinen die Wirksamkeit organischer Peroxysäuren gegen Biofilme zu bestätigen. Der in dieser Studie beschriebene kombinierte Ansatz kann verwendet werden, um neue biologische oder chemische Formulierungen zur Bekämpfung von Biofilmen und zur Ausrottung von Mikroorganismen zu entwickeln und zu testen.
Einleitung
Die Milchindustrie ist ein wichtiger Industriezweig weltweit, auch in Kanada, wo es mehr als 10.500 Milchviehbetriebe gibt, die jedes Jahr fast 90 Millionen hl Milch produzieren1. Trotz der strengen Hygieneanforderungen in der Milchindustrie, auch in Verarbeitungsbetrieben, stellt Milch ein hervorragendes Nährmedium für Mikroorganismen dar, und daher enthalten Milchprodukte wahrscheinlich Mikroorganismen, einschließlich Verderb oder pathogener Mikroorganismen. Diese Krankheitserreger können verschiedene Krankheiten verursachen; Zum Beispiel können Salmonella sp. und Listeria monocytogenes Gastroenteritis bzw. Meningitisverursachen 2. Verderbnisfördernde Mikroorganismen können die Qualität und die organoleptischen Eigenschaften von Milchprodukten beeinträchtigen, indem sie Gase, extrazelluläre Enzyme oder Säuren produzieren3. Auch das Aussehen und die Farbe der Milch können verändert sein, z.B. durch Pseudomonas spp.4.
Einige dieser Mikroorganismen können Biofilme auf verschiedenen Oberflächen, einschließlich Edelstahl, bilden. Solche Biofilme ermöglichen die Persistenz und Vermehrung von Mikroorganismen auf der Oberfläche der Geräte und damit die Kontamination der Milchprodukte5. Biofilme sind auch problematisch, da sie die Wärmeübertragung behindern und die Korrosion der Geräte beschleunigen können, was zu einem vorzeitigen Austausch der Geräte und damit zu wirtschaftlichen Verlusten führt6.
Clean-in-Place-Verfahren (CIP) ermöglichen es der Lebensmittelindustrie, das Wachstum von Mikroorganismen zu kontrollieren. Diese Verfahren beinhalten die sequentielle Verwendung von Natriumhydroxid, Salpetersäure und manchmal Desinfektionsmitteln, die hypochlorige Säure und Peressigsäure 7,8 enthalten. Obwohl hypochlorige Säure hochwirksam gegen Mikroorganismen ist, reagiert sie auch mit natürlichen organischen Stoffen, was zur Bildung toxischer Nebenprodukte führt9. Peressigsäure erzeugt keine schädlichen Nebenprodukte10; Seine Wirksamkeit gegen Biofilme in der Lebensmittelindustrie ist jedoch sehr unterschiedlich10,11. In jüngster Zeit wurden andere Peroxysäuren, einschließlich Perpropion- und Permilchsäuren, auf ihre antimikrobielle Aktivität untersucht, und sie scheinen eine gute Alternative für die Kontrolle des mikrobiellen Wachstums in Biofilmen zu sein12,13.
Daher zielte diese Studie darauf ab, die Wirksamkeit organischer Peroxysäuren (Peressigsäure, Perpropionsäure und Permilchsäure sowie ein Desinfektionsmittel auf Peressigsäurebasis) zur Beseitigung von Milchbiofilmen unter Verwendung eines Ansatzes zu bewerten, der den MBEC-Assay (Minimum Biofilm eradication Concentration), eine statische Hochdurchsatz-Screening-Methode und den Biofilmreaktor des Center for Disease Control (CDC), eine dynamische Methode, die in situ nachahmt Bedingungen. Der MBEC-Assay wird im Folgenden im Protokoll als "Biofilm-Mikrotiterplatten" bezeichnet. Das hier vorgestellte Protokoll und die repräsentativen Ergebnisse belegen die Wirksamkeit organischer Peroxysäuren und ihre mögliche Anwendung zur Bekämpfung mikrobieller Biofilme in der Milchindustrie.
Protokoll
Die in diesem Artikel enthaltenen Arbeiten erfordern ein Labor der Biosicherheitsstufe 2 und wurden zuvor vom institutionellen Biosicherheitsausschuss der Université Laval genehmigt (Projektnummer 119689).
HINWEIS: Das Flussdiagramm in Abbildung 1 stellt eine Zusammenfassung der Methodik dar, die statische und dynamische Ansätze kombiniert, die zur Bewertung der Wirksamkeit organischer Peroxysäuren zur Beseitigung von Biofilmen verwendet wurde.
1. Vorbereitung der Materialien
- Mikrobielle Isolate
- Schalten Sie die biologische Sicherheitswerkbank (BSC) 15 Minuten vor Gebrauch ein und reinigen Sie sie mit einer 70%igen (v/v) Alkohollösung.
- Sobald der BSC steril ist, legen Sie eine Durchstechflasche mit dem zu testenden mikrobiellen Isolat (Pseudomonas azotoformans oder Brevundimonas vesicularis in dieser Studie), eine Impfschleife, ein 15-ml-Röhrchen, das mit 10 ml steriler tryptischer Sojabrühe (TSB) gefüllt ist, und einen Vortex-Mischer. Desinfizieren Sie vor dem Einlegen in die BSC alle Materialien mit Alkohol.
- Wirbeln Sie die Durchstechflasche mit mikrobiellem Isolat, um die Kultur zu homogenisieren.
- Aseptisch werden 20 μl des mikrobiellen Isolats in 10 ml steriles TSB in einem 15-ml-Röhrchen überführt und bei 30 °C für 16-24 h unter Rühren bei 160 U/min inkubiert.
ACHTUNG: B. vesicularis muss in einem Labor der Sicherheitsstufe 2 gemäß den Richtlinien für den Umgang mit pathogenen Organismen verwendet werden. Der Hundeführer muss ordnungsgemäß geschult sein und eine Schutzbrille, Handschuhe und einen Mantel tragen.
- Desinfektionsmittel
- Zur Herstellung der organischen Peroxysäurelösung (60 ml) werden 24 ml Wasserstoffperoxid und 36 ml Säure (Essig-, Propion- oder Milchsäure) in einen 250-ml-Erlenmeyerkolben gegeben. Fügen Sie dann ein vordefiniertes Volumen von 10 M Schwefelsäure hinzu (655 μl für Peressigsäure, 635 μl für Perpropionsäure oder 715 μl für Permilchsäure). Schütteln Sie den Kolben vorsichtig, um ihn zu mischen, und stellen Sie den Kolben in ein 30 °C warmes Wasserbad, das in der chemischen Haube aufgestellt ist. Inkubieren Sie den Kolben 2 Tage lang und mischen Sie ihn jeden Morgen sanft.
HINWEIS: Das handelsübliche Desinfektionsmittel auf Peressigsäurebasis (siehe Materialtabelle) wurde direkt vom Hersteller zur Verfügung gestellt.
ACHTUNG: Die Desinfektionsmittel müssen unter einer chemischen Haube verwendet werden. Für die Dauer des Versuchs müssen Schutzbrillen und Handschuhe getragen werden. Weitere Informationen zu den Desinfektionsmitteln entnehmen Sie bitte dem jeweiligen Sicherheitsdatenblatt. - Führen Sie die Titration von Wasserstoffperoxid wie unten beschrieben durch.
- Stellen Sie ein leeres 300-ml-Becherglas auf eine Analysenwaage (siehe Materialtabelle) und tarieren Sie die Waage. Wiegen Sie ca. 0,23 g Desinfektionsmittel in das Becherglas und notieren Sie sich das genaue Gewicht. 100 g kalte 1 N Schwefelsäurelösung in das Becherglas geben, einen magnetischen Rührstab in das Becherglas geben und auf eine Rührplatte legen.
- Lassen Sie die Lösung rühren, bis sie vollständig homogenisiert ist. Geben Sie dann drei Tropfen einer Ferroin-Indikatorlösung (0,1 Gew.-% in H2O) in das Becherglas und titrieren Sie mit 0,1 N Cersulfatlösung, bis die Lösung von einer lachsrosa Farbe in eine hellblaue Farbe übergeht. Beachten Sie das Volumen der zugesetzten Cersulfatlösung.
- Berechnen Sie den Prozentsatz von Wasserstoffperoxid mit der folgenden Formel:
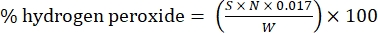 Gl. (1)
Gl. (1)
wobei S das Volumen der zugesetzten Cersulfatlösung ist, N die Normalität der Cersulfatlösung (0,1 N), W das Gewicht der Probe (~0,2300 g) und 0,017 = (1 mol H2O 2/2 mol Ce) × (34,0147 g H2O2 /1mol H2O)2 × (1 L/1.000 ml)
- Führen Sie die Titration der organischen Peroxysäuren wie unten beschrieben durch.
- 20 ml 7,5%ige (w/v) Kaliumiodidlösung in ein Becherglas geben. Langsam mit 0,1 N Natriumthiosulfatlösung titrieren, bis sich die blaue Farbe der Lösung hellbraun/orange färbt.
- 2 ml Stärkelösung (1 Gew.-% in H2O) in das Becherglas geben und mit 0,1 N Natriumthiosulfatlösung titrieren, bis die Lösung von schwarz nach orange übergeht. Beachten Sie das Volumen der verwendeten Natriumthiosulfatlösung.
- Berechnen Sie den Prozentsatz der organischen Peroxysäure mit der folgenden Formel:
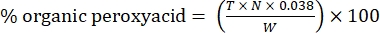 Gl. (2)
Gl. (2)
wobei T das Volumen der verwendeten Natriumthiosulfatlösung, N die Normalität der Natriumthiosulfatlösung (0,1 N), W das Gewicht der Probe (~0,2300 g) und 0,038 = (1 mol CH 3 COOOH/1 mol I 2) × (1 mol I 2/2 mol S2 O 3) × (76,06 g/1 mol CH 3COOOH) × (1 l/1.000 ml)
HINWEIS: Wiederholen Sie Schritt 1.2.2 und Schritt 1.2.3 mit zwei weiteren Proben, um jeden Test in dreifacher Ausfertigung durchzuführen.
- Zur Herstellung der organischen Peroxysäurelösung (60 ml) werden 24 ml Wasserstoffperoxid und 36 ml Säure (Essig-, Propion- oder Milchsäure) in einen 250-ml-Erlenmeyerkolben gegeben. Fügen Sie dann ein vordefiniertes Volumen von 10 M Schwefelsäure hinzu (655 μl für Peressigsäure, 635 μl für Perpropionsäure oder 715 μl für Permilchsäure). Schütteln Sie den Kolben vorsichtig, um ihn zu mischen, und stellen Sie den Kolben in ein 30 °C warmes Wasserbad, das in der chemischen Haube aufgestellt ist. Inkubieren Sie den Kolben 2 Tage lang und mischen Sie ihn jeden Morgen sanft.
2. Bildung von einzelnen und gemischten Biofilmen
- Biofilm-Mikrotiterplatten
- Wirbeln Sie das Röhrchen mit der Bakterienkultur (20 μl des Stammes + 10 ml TSB-Medium, hergestellt in Schritt 1.1.4). Führen Sie eine serielle Verdünnung und Beschichtung von tryptischem Sojaagar (TSA) durch, um die Bakterienzellzahl (KBE) der Nachtkultur zu bestimmen. Anschließend werden 100 μl der Kultur aseptisch in 10 ml steriles TSB-Medium überführt (für eine Endkonzentration von ca. 2 x 10,7 KBE/ml).
HINWEIS: Für den Assay mit dem Bioreaktor wird ein Volumen von 100 μl des mikrobiellen Isolats in 100 ml steriles TSB überführt. - Wirbeln Sie die Röhre. Für jedes Bakterium wird die verdünnte Bakterienkultur mit einer Mehrkanalpipette dreifach auf die Biofilm-Mikrotiterplatte (150 μl pro Well) übertragen. Laden Sie 150 μl TSB-Medium in drei neue Vertiefungen, die als Kontrollen dienen. Die Biofilm-Mikrotiterplatte (siehe Materialtabelle) wird bei 30 °C für 24 h ohne Rühren inkubiert.
ANMERKUNG: Bei gemischten Biofilm-Assays werden 75 μl jeder Suspension für ein Gesamtvolumen von 150 μl hinzugefügt. Die Biofilm-Mikrotiterplatte enthält in ihren Deckeln Stifte, auf denen sich die Biofilme bilden.
- Wirbeln Sie das Röhrchen mit der Bakterienkultur (20 μl des Stammes + 10 ml TSB-Medium, hergestellt in Schritt 1.1.4). Führen Sie eine serielle Verdünnung und Beschichtung von tryptischem Sojaagar (TSA) durch, um die Bakterienzellzahl (KBE) der Nachtkultur zu bestimmen. Anschließend werden 100 μl der Kultur aseptisch in 10 ml steriles TSB-Medium überführt (für eine Endkonzentration von ca. 2 x 10,7 KBE/ml).
- Bioreaktor
- Reinigen und trocknen Sie die Teile des Bioreaktors (siehe Materialtabelle) gemäß den Anweisungen des Herstellers an der Luft und bereiten Sie den Reaktor wie unten beschrieben vor.
- Legen Sie zunächst die flache Klinge in den 1-Liter-Glasbecher (Bioreaktor), der mit einem Magnetstab an seiner Halterung befestigt ist, und halten Sie den Aufbau mit Hilfe der Kunststoffstange, die an der Innenseite des Bioreaktordeckels angebracht ist, in aufrechter Position.
- Legen Sie die Edelstahlcoupons oder Objektträger (siehe Materialtabelle) mit dem Schraubendreher auf ihre Polypropylenstäbe und führen Sie sie in die Löcher im Deckel ein, ohne die Ausrichtungsstifte in die Kerben zu stecken, damit der Dampf während der Sterilisation entweichen kann.
- Decken Sie alle Entlüftungsöffnungen des Bioreaktors mit Aluminiumfolie ab und wickeln Sie den Rest der Ausrüstung, nämlich die Schläuche L/S 18 (ID = 7,9 mm) und L/S 16 (ID = 3,1 mm), den Glasdurchflussbruch, die Behälterkappen, die Schraubendreher, die Pinzette und die 0,2-μm-Filter mit Aluminiumfolie ein.
HINWEIS: Führen Sie den Silikonschlauch (siehe Materialtabelle) in den Widerhaken ein, der sich auf der Innenfläche des mittleren Behälterdeckels befindet. - Autoklavieren Sie den Bioreaktor, der in einem Trockenzyklus bei 121 °C für 20 Minuten eingerichtet wurde.
- Führen Sie die Biofilmbildung im Bioreaktor im Batch-Modus durch (erster Schritt).
- Verbinden Sie in einem BSC ein Ende des Schlauchs L/S 18 mit dem Auslassauslauf des Bioreaktors und halten Sie das andere Ende in Aluminiumfolie eingewickelt, um die Sterilität zu erhalten.
- Nehmen Sie einen Gutschein- oder Objektträgerhalter vom Deckel des Bioreaktors und legen Sie ihn in ein steriles 50-ml-Röhrchen. Anschließend wird das Becherglas des Bioreaktors mit 340 ml 300 mg/l TSB-Medium durch das Loch, das vom Stab besetzt war, mit einer serologischen 50-ml-Pipette gefüllt.
- Beimpfen Sie das Nährmedium im Bioreaktor mit 1 ml der Bakterienlösung (~108 KBE/ml P. azotoformans) mit einer 5-ml-Pipette durch dieselbe Öffnung, die zuvor verwendet wurde, und setzen Sie den Stab dann wieder in seine ursprüngliche Position ein. Positionieren Sie die Stangen, die bereits in den Deckellöchern platziert sind, so, dass die Stifte in ihre jeweiligen Kerben passen.
- Platzieren Sie einen 0,2 μm bakteriellen Luftspülfilter am Ende des Röhrchens mit dem kleinsten Durchmesser, das sich auf dem Deckel des Bioreaktors befindet. Der andere Schlauch mit gleichem Durchmesser bleibt mit einem Metall-Schraubverschluss oder einem fest schließenden Silikonstopfen dauerhaft verschlossen.
- Stellen Sie den Bioreaktor für 24 h über die auf 30 °C eingestellte Heizplatte und rühren Sie bei 130 U/min.
HINWEIS: Verwenden Sie für die Bildung von Biofilmen mit mehreren Spezies ein gleiches Volumen der verschiedenen Bakterienkulturen, um ein Gesamtvolumen von 1 ml für das Inokulum zu erhalten.
- Führen Sie die Biofilmbildung im Bioreaktor im kontinuierlichen Durchflussmodus durch (zweiter Schritt).
- Legen Sie einen Ballon mit 18 l sterilem destilliertem Wasser in die BSC und fügen Sie 2 l 1.000 mg/l TSB-Nährmedium hinzu, um eine Endkonzentration von 100 mg/l zu erhalten.
- Decken Sie den Behälter mit seiner sterilen Kappe ab, an die zwei Röhrchen angeschlossen sind. Der erste ist ein Silikonschlauch, der an der Innenseite der Kappe befestigt ist und zum Pumpen des Mediums verwendet wird. Das zweite Rohr (L/S 16) ist mit dem externen Anschluss verbunden, damit die Flüssigkeit zum Bioreaktor fließen kann. Setzen Sie einen 0,2-μm-Filter in das zweite Röhrchen auf dem Deckel des Mediumbehälters ein.
- Verbinden Sie dieses zweite Rohr mit der Peristaltikpumpe und verbinden Sie das andere Ende mit dem Glasstrombruch, der dann in den größeren Schlauch auf dem Bioreaktordeckel eingeführt wird.
- Verwenden Sie einen weiteren 20-Liter-Ballon, um das Abwasser aus dem Bioreaktor aufzufangen. Befestigen Sie das Ende des Röhrchens, das mit dem Auslauf des Bioreaktors verbunden ist, an der Kappe des Abfallbehälters. Setzen Sie einen 0,2-μm-Filter in das Röhrchen ein, das sich auf dem Deckel dieses Behälters befindet.
- Starten Sie die Schlauchpumpe mit einer Durchflussrate von 11,3 ml/min und lassen Sie das System 24 Stunden lang laufen.
ANMERKUNG: Die Durchflussrate (11,3 ml/min) des Nährmediums oder der Milch, die während der Biofilmbildung im Bioreaktor verwendet wurde, wurde bestimmt, indem 340 ml (was dem Volumen der Flüssigkeit im Reaktor entspricht) durch die Verweilzeit von 30 min dividiert wurde.
- Stellen Sie den bakteriellen Biofilm wieder her.
- Schalten Sie die Peristaltikpumpe aus und hören Sie auf, den Bioreaktor zu rühren und zu erhitzen.
- Entfernen Sie vorsichtig jeden Stab aus dem Bioreaktor und spülen Sie die Coupons oder Objektträger 3x in 40 ml PBS aus, um planktonische Bakterien zu entfernen. Geben Sie anschließend die Coupons oder Objektträger mit einem geeigneten Schraubendreher in sterile konische 50-ml-Röhrchen mit 40 ml PBS frei. Wirbeln Sie die Röhren 30 s lang, übertragen Sie sie auf ein Gestell in einem Ultraschallbad und beschallen Sie die Röhren 30 s lang bei 40 kHz (was 110 W Leistung erfordert). Wiederholen Sie diesen Vorgang 3x.
- Sammeln Sie die 40-ml-Biofilmsuspensionen in sterilen konischen 50-ml-Röhrchen und spülen Sie dann die Coupons oder Objektträger mit 2 ml steriler PBS-Lösung ab. Gewinnen Sie diese Spülflüssigkeit zurück und fügen Sie sie der bereits gesammelten Biofilmsuspension hinzu.
- Zählen Sie die lebensfähigen Bakterien im Biofilm auf: Führen Sie mit der erhaltenen Biofilmsuspension 10-fache serielle Verdünnungen durch und geben Sie dann 100 μl der 10-5 - und 10-6-Verdünnungen dreifach auf TSA. Inkubieren Sie die Platten bei 30 °C für 24 h. Zählen Sie die Anzahl der auf den Agarplatten vorhandenen Kolonien und berechnen Sie die Bakteriendichte auf den Coupons und Objektträgern (lebensfähige sitzende Bakterien) gemäß ASTM E2562-1714 nach folgender Formel:
 Gl. (3)
Gl. (3)
wobei X die Anzahl der koloniebildenden Einheiten (KBE), B das plattierte Volumen (0,1 ml), V das Volumen ist, in dem der Biofilm suspendiert ist (die Stammlösung), A die Oberfläche des vom Biofilm bedeckten Kupons oder Objektträgers ist und D der Verdünnungsfaktor ist.
- Reinigen und trocknen Sie die Teile des Bioreaktors (siehe Materialtabelle) gemäß den Anweisungen des Herstellers an der Luft und bereiten Sie den Reaktor wie unten beschrieben vor.
3. Quantitative Bewertung der Wirksamkeit organischer Peroxysäuren zur Eraminierung von Biofilmen
- Biofilm-Mikrotiterplatten
- Geben Sie 200 μl phosphatgepufferte Kochsalzlösung (1x PBS) in drei Vertiefungen einer 96-Well-Mikrotiterplatte.
- Übertragen Sie den Deckel der Biofilm-Mikroplatte mit Biofilmen, die sich auf den Stiften gebildet haben, für 10 s auf die 96-Well-Mikroplatte, die das PBS enthält, um die Biofilme zu waschen und planktonische Bakterien zu eliminieren.
- Bereiten Sie die Desinfektionsmittel in den erforderlichen Konzentrationen vor (z. B. 25 ppm, 50 ppm, 500 ppm, 1.000 ppm, 5.000 ppm, 10.000 ppm und 25.000 ppm Wirkstoff).
HINWEIS: Alle Verdünnungen werden aseptisch mit sterilem destilliertem Wasser hergestellt. - Geben Sie 200 μl jeder Desinfektionsmittelkonzentration in dreifacher Ausfertigung in die Vertiefungen einer neuen 96-Well-Mikrotiterplatte. Übertragen Sie den Deckel der Biofilm-Mikrotiterplatte auf diese 96-Well-Mikrotiterplatte, die die Desinfektionsmittel enthält, und inkubieren Sie die Platte bei Raumtemperatur für die gewünschte Einwirkzeit.
- Geben Sie 200 μl Dey-Engley-Neutralisierungsbrühe in die Vertiefungen einer neuen 96-Well-Mikrotiterplatte. Übertragen Sie den Deckel der Biofilm-Mikrotiterplatte auf die 96-Well-Mikrotiterplatte, die die neutralisierende Brühe enthält. Versiegeln Sie die Mikrotiterplatte mit Parafilm und legen Sie sie für 30 Minuten bei 40 kHz in das Bad-Ultraschallgerät.
- Entfernen Sie nach 30 Minuten die Mikrotiterplatte aus dem Ultraschallgerät und entfernen Sie den Parafilm. Übertragen Sie 100 μl von der ersten Säule der 96-Well-Platte, die die nach der Beschallung abgelösten Biofilme enthält, in die erste Reihe einer neuen 96-Well-Mikrotiterplatte.
- 180 μl steriles 1x PBS werden in die Vertiefungen der neuen 96-Well-Mikrotiterplatte (hergestellt in Schritt 3.1.6) mit Ausnahme der ersten Reihe gegeben. 20 μl der Biofilmlösung werden aus der ersten Reihe in die Vertiefungen in der zweiten Reihe überführt, die 180 μl 1x PBS enthalten (Reihe 2, Verdünnung: 10−1). Anschließend werden 20 μl der in der zweiten Reihe enthaltenen Flüssigkeit in die Vertiefungen in der nächsten Reihe überführt, die 180 μl 1x PBS enthalten (Reihe 3, Verdünnung: 10−2). Wiederholen Sie den gleichen Vorgang, um Verdünnungen zwischen 10−5 und 10−7 zu erhalten.
- Inokulieren Sie 100 μl der Verdünnungen mit TSA und inkubieren Sie die Platten gemäß den Parametern, die für das Wachstum jedes Bakteriums erforderlich sind.
- Zählen Sie nach der Inkubation die KCUs und berechnen Sie die logarithmische 10-Dichte für jeden Peg und die logarithmische10-Reduktion bei jeder Desinfektionsmittelkonzentration mit den folgenden Gleichungen:
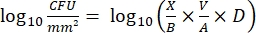 Gl. (4)
Gl. (4)
wobei X die koloniebildenden Einheiten ist, die im Spot gezählt werden, B das überzogene Volumen (0,01 ml), V das Wellvolumen (0,20 ml), A die Stiftoberfläche (46,63 mm2) und D die Verdünnung ist.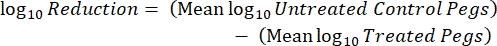 Gl. (5)
Gl. (5) - Wiederholen Sie jedes Experiment 3x an unabhängigen Tagen.
HINWEIS: Die "Mindestkonzentration an Desinfektionsmittel, die den Biofilm beseitigt" oder MBEC, entspricht der niedrigsten Desinfektionsmittelkonzentration, die kein Bakterienwachstum zeigt.
- Bioreaktor
HINWEIS: Das Verfahren der ASTM-Norm E2871-1915 wird befolgt, um diesen Test mit P. azotoformans PFlA1 durchzuführen.- Beginnen Sie mit der Bildung der Biofilme auf den Coupons im Bioreaktor, wie in Schritt 2.2 beschrieben. Entfernen Sie dann den Stab, der die Coupons hält, und spülen Sie ihn in einem konischen Röhrchen mit 30 ml PBS aus.
- Lassen Sie jeden Coupon mit einem Schraubendreher in ein steriles konisches 50-ml-Röhrchen fallen und fügen Sie dann 4 ml der entsprechenden organischen Peroxysäurelösung oder PBS für die Kontrolle hinzu. 5 Minuten inkubieren und dann 36 ml Dey-Engley-Neutralisierungsbrühe hinzufügen. 30 s lang vorwirbeln und dann 30 s lang mit einem Ultraschallbad bei 40 kHz beschallen. Wiederholen Sie den Vorgang 3x, um die Biofilmsuspension zu erhalten.
- Spülen Sie in ähnlicher Weise alle anderen Stäbchen aus und holen Sie die Biofilme aus den Coupons zurück. Führen Sie serielle Verdünnungen der Biofilmsuspension und der Platte 0,1 ml auf TSA-Medium durch. Inkubieren Sie die Platten bei 30 °C für 24 h.
- Zählen Sie nach der Inkubation die KFUs und berechnen Sie dann die Biofilmdichte für jeden Coupon (Gl. 6), die mittlere Log-Dichte (LD) für jeden Satz von drei Coupons aus demselben Stab, einschließlich behandelt und kontrolliert (Gl. 7), und die Log-Reduktion für das Desinfektionsmittel (Gl. 8) unter Verwendung der folgenden Gleichungen:
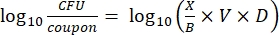 Gl. (6)
Gl. (6)
wobei X der Mittelwert der gezählten koloniebildenden Einheiten/Kupon, B das plattierte Volumen (0,1 ml), V das Volumen des Desinfektionsmittels oder PBS plus Neutralisator (40 ml) und D die Verdünnung ist.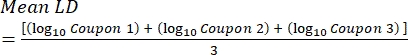 Gl. (7)
Gl. (7)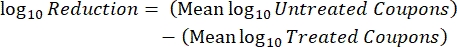 Gl. (8)
Gl. (8)
4. Qualitative Bewertung der Wirksamkeit organischer Peroxysäuren zur Eraminierung von Biofilmen
ANMERKUNG: Nach der Behandlung mit den Desinfektionsmitteln (Schritt 3.1.1 bis Schritt 3.1.5) wurden die P. azotoformans-Biofilme , die sich bei der statischen Methode auf den Stiften der Biofilm-Mikrotiterplatte bildeten, präpariert und durch Beobachtung an Rasterelektronen- und konfokalen Mikroskopen analysiert.
- Rasterelektronenmikroskopie (REM)
- Geben Sie 200 μl 1x PBS in drei Vertiefungen einer 96-Well-Mikroplatte. Übertragen Sie den Deckel von der Biofilm-Mikrotiterplatte (Schritt 3.1.5) auf die 96-Well-Mikrotiterplatte, die PBS enthält, und lassen Sie ihn 10 s lang bei Raumtemperatur, um die Dey-Engley-Neutralisationsbrühe zu entfernen.
- Entfernen Sie die Stifte mit einer sterilisierten Nadelzange von der Biofilm-Mikrotiterplatte. Legen Sie jeden Stift in eine leere Durchstechflasche unter einer Haube und geben Sie primäres Fixiermittel (5% Glutaraldehyd in 0,1 M Na Cacodylatpuffer pH 7,5) in jede Durchstechflasche. Verschließen Sie jede Durchstechflasche und inkubieren Sie sie 24 h lang bei 4 °C.
- Dekantieren Sie das Fixiermittel nach der Inkubation mit einer Pipette und entsorgen Sie alle flüssigen Abfälle in einem geeigneten Behälter. Entfernen Sie die Kappen jeder Durchstechflasche und legen Sie sie in eine Haube, um sie 72 Stunden lang an der Luft zu trocknen.
- Montieren Sie die Proben auf Aluminiumstummeln (siehe Materialtabelle), indem Sie Epoxidharz (siehe Materialtabelle) auf die flache Oberseite jedes Stummels auftragen. Befestigen Sie dann die Stifte vorsichtig mit einer Pinzette an den Stummeln.
- Metallisieren Sie die Proben mit einem EMS950x + 350s Gold-Sputter (siehe Materialtabelle) für 4 min bei 2 x 10−1 bar Argondruck und 20 mA Strom. Führen Sie eine entsprechende Erdung durch, indem Sie die Seite des Stifts, die dem Gold nicht ausgesetzt ist, mit Silberfarbe bemalen (siehe Materialtabelle).
- Erfassen Sie Bilder mit einem Rasterelektronenmikroskop mit der REM-Steuerungsbenutzeroberfläche Version 6.28 (siehe Materialtabelle). Die in dieser Studie verwendete Beschleunigungsspannung betrug 15 kV und die Vergrößerungen betrugen 300x und 2.000x.
- Konfokale Mikroskopie
- Geben Sie 200 μl 1x PBS in drei Vertiefungen einer 96-Well-Mikrotiterplatte. Übertragen Sie den Deckel von der Biofilm-Mikroplatte auf die 96-Well-Platte, die das PBS enthält, und lassen Sie ihn 10 s lang stehen, um die Dey-Engley-Neutralisationsbrühe zu entfernen.
- Bereiten Sie Lösungen von fluoreszierenden Farbstoffen vor, indem Sie 3 μl grün fluoreszierende Färbung und 3 μl rot fluoreszierende Färbung (siehe Materialtabelle) zu 1 ml sterilem Wasser geben.
- Geben Sie 200 μl Färbelösung in eine Vertiefung einer 96-Well-Mikrotiterplatte. Übertragen Sie den Deckel von der Biofilm-Mikrotiterplatte auf die 96-Well-Platte, die die Färbelösung enthält. Decken Sie die Biofilm-Mikrotiterplatte mit Aluminiumfolie ab und inkubieren Sie die Probe 20-30 Minuten lang bei Raumtemperatur.
- Geben Sie 200 μl sterilisiertes Wasser in die Vertiefungen einer 96-Well-Mikrotiterplatte. Übertragen Sie dann den Deckel von der Biofilm-Mikroplatte auf die 96-Well-Mikroplatte, die das Wasser enthält, und lassen Sie ihn bis zur Beobachtung stehen.
- Visualisieren Sie die auf den Stiften gebildeten Biofilme mit einem konfokalen Laser-Scanning-Mikroskop (siehe Materialtabelle) mit einem 63x/1,40 Öl-DIC-Objektiv. Erfassen Sie die Bilder mit der zugehörigen Software (siehe Materialtabelle). Die Fluoreszenzanregungswellenlängen, die für die grünen und roten Fluoreszenzfärbungen verwendet wurden, betrugen 482 nm bzw. 490 nm.
HINWEIS: Um die besten Ergebnisse zu erzielen, schneiden Sie den Stift ab, legen Sie ihn in eine 60-mm-Petrischale und füllen Sie die Schale mit sterilem Wasser.
Ergebnisse
Die REM-Analyse zeigt das Vorhandensein von Biofilmen, die von P. azotoformans PFl1A produziert werden, auf den Biofilm-Mikroplattenstiften (Abbildung 2A). Es kann eine dreidimensionale Biofilmstruktur beobachtet werden. Der P. azotoformans PFl1A wurde zuvor unter Verwendung von 96-Well-Mikrotiterplatten12 als starker Biofilmproduzent (A570 > 1,5) identifiziert.
Darüber hinaus schien der PFl1A-Biofilm von P...
Diskussion
Der MBEC-Assay (Biofilm Microplate Assay) war die erste Methode, die von der ASTM17 als Standard-Biofilm-Eradikationstest anerkannt wurde. Unsere und andere Studien haben gezeigt, dass es bei der Verwendung dieses Assays zwei kritische Schritte gibt: den Beschallungsschritt (Zeit und Leistung) und die Behandlungszeit des Desinfektionsmittels18. Stewart und Parker schlugen auch andere Parameter vor, die das Ergebnis des Assays beeinflussen könnten, wie z. B. die mikrobielle...
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Diese Forschung wurde vom Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ) (2016-049-C22), Agropur, Groupe Sani Marc und dem Natural Sciences and Engineering Research Council of Canada (NSERC) (RDCPJ516460-17) unterstützt. Wir danken Teresa Paniconi für die kritische Durchsicht des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
Referenzen
- Canada's dairy industry at a glance. Canadian Dairy Information Centre Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017)
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. . Science et technologie du lait. 3rd edn. , (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934 (2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921 (2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International Available from: https://www.astm.org/e2562-17.html (2017)
- ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International Available from: https://www.astm.org/e2871-19.html (2019)
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181 (2022).
- ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International Available from: https://www.astm.org/e2799-17.html (2022)
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020 (2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264 (2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212 (2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592 (2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885 (2020).
- Goeres, D. M., Simoes, M., Borges, A., Chaves Simoes, L., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. , 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten