È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione dell'efficacia dei perossiacidi organici per l'eradicazione dei biofilm lattiero-caseari utilizzando un approccio che combina metodi statici e dinamici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un approccio che combina metodi statici e dinamici per valutare l'efficacia dei perossiacidi organici per l'eradicazione dei biofilm nell'industria lattiero-casearia. Questo approccio può anche essere utilizzato per testare l'efficacia di nuove formulazioni biologiche o chimiche per il controllo dei biofilm.
Abstract
La presenza di biofilm nell'industria lattiero-casearia è fonte di grande preoccupazione, in quanto possono portare alla produzione di prodotti lattiero-caseari non sicuri e alterati a causa della loro elevata resistenza alla maggior parte delle procedure CIP (clean-in-place) frequentemente utilizzate negli impianti di lavorazione. Pertanto, è imperativo sviluppare nuove strategie di controllo del biofilm per l'industria lattiero-casearia. Questo protocollo ha lo scopo di valutare l'efficacia dei perossiacidi organici (acidi peracetico, perpropionico e perlattico e un disinfettante commerciale a base di acido peracetico) per l'eradicazione dei biofilm lattiero-caseari utilizzando una combinazione di metodi statici e dinamici. Tutti i disinfettanti sono stati testati sui batteri produttori di biofilm più forti in un biofilm singolo o misto utilizzando il test MBEC (minimum biofilm eradication concentration), un metodo di screening statico ad alto rendimento. Un tempo di contatto di 5 minuti con i disinfettanti alle concentrazioni raccomandate ha eliminato con successo sia il biofilm singolo che quello misto. Sono attualmente in corso studi per confermare queste osservazioni utilizzando il reattore biofilm del Center for Disease Control (CDC), un metodo dinamico per imitare le condizioni in situ . Questo tipo di bioreattore consente l'uso di una superficie in acciaio inossidabile, che costituisce la maggior parte delle attrezzature e delle superfici industriali. I risultati preliminari del reattore sembrano confermare l'efficacia dei perossiacidi organici contro i biofilm. L'approccio combinato descritto in questo studio può essere utilizzato per sviluppare e testare nuove formulazioni biologiche o chimiche per il controllo dei biofilm e l'eradicazione dei microrganismi.
Introduzione
L'industria lattiero-casearia è un importante settore industriale in tutto il mondo, anche in Canada, dove ci sono più di 10.500 aziende lattiero-casearie che producono quasi 90 milioni di hl di latte ogni anno1. Nonostante i severi requisiti igienici imposti nell'industria lattiero-casearia, compresi gli impianti di trasformazione, il latte costituisce un ottimo terreno di coltura per i microrganismi e, pertanto, è probabile che i prodotti lattiero-caseari contengano microrganismi, inclusi microrganismi patogeni o deterioranti. Questi agenti patogeni possono causare varie malattie; ad esempio, Salmonella sp. e Listeria monocytogenes possono causare gastroenterite e meningite, rispettivamente2. I microrganismi di deterioramento possono influenzare la qualità e le proprietà organolettiche dei prodotti lattiero-caseari producendo gas, enzimi extracellulari o acidi3. Anche l'aspetto e il colore del latte possono essere alterati, ad esempio da Pseudomonas spp.4.
Alcuni di questi microrganismi possono formare biofilm su diverse superfici, incluso l'acciaio inossidabile. Tali biofilm consentono la persistenza e la moltiplicazione dei microrganismi sulla superficie dell'apparecchiatura e, quindi, la contaminazione dei prodotti lattiero-caseari5. I biofilm sono problematici anche a causa della loro capacità di impedire il trasferimento di calore e accelerare la corrosione delle apparecchiature, portando alla sostituzione prematura dell'apparecchiatura e, quindi, a perdite economiche6.
Le procedure CIP (clean-in-place) consentono all'industria alimentare di controllare la crescita dei microrganismi. Queste procedure prevedono l'uso sequenziale di idrossido di sodio, acido nitrico e, talvolta, disinfettanti contenenti acido ipocloroso e acido peracetico 7,8. Sebbene l'acido ipocloroso sia altamente efficace contro i microrganismi, reagisce anche con la materia organica naturale, causando la formazione di sottoprodotti tossici9. L'acido peracetico non genera sottoprodotti nocivi10; Tuttavia, la sua efficacia contro i biofilm nell'industria alimentare è molto variabile10,11. Recentemente, altri perossiacidi, tra cui gli acidi perpropionici e perlattici, sono stati studiati per la loro attività antimicrobica, e sembrano essere una buona alternativa per il controllo della crescita microbica nei biofilm12,13.
Pertanto, questo studio mirava a valutare l'efficacia dei perossiacidi organici (acido peracetico, perpropionico e perlattico e un disinfettante a base di acido peracetico) per l'eradicazione dei biofilm lattiero-caseari utilizzando un approccio che combina il saggio MBEC (minimum biofilm eradication concentration), un metodo di screening statico ad alta produttività e il reattore biofilm del Center for Disease Control (CDC), un metodo dinamico che imita in situ . Condizioni. Il test MBEC è di seguito denominato "piastre di microtitolazione a biofilm" nel protocollo. Il protocollo qui presentato e i risultati rappresentativi dimostrano l'efficacia dei perossiacidi organici e la loro potenziale applicazione per il controllo dei biofilm microbici nell'industria lattiero-casearia.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il lavoro contenuto in questo articolo richiede un laboratorio di livello di biosicurezza 2 ed è stato precedentemente approvato (numero di progetto 119689) dal comitato istituzionale di biosicurezza dell'Université Laval.
NOTA: Il diagramma di flusso nella Figura 1 rappresenta una sintesi della metodologia che combina approcci statici e dinamici utilizzata per valutare l'efficacia dei perossiacidi organici per l'eradicazione dei biofilm.
1. Preparazione dei materiali
- Isolati microbici
- Accendere l'armadio di sicurezza biologica (BSC) 15 minuti prima dell'uso e pulirlo con una soluzione alcolica al 70% (v/v).
- Una volta che la BSC è sterile, posizionare un flaconcino dell'isolato microbico da testare (Pseudomonas azotoformans o Brevundimonas vesicularis in questo studio), un ciclo di inoculazione, un tubo da 15 mL riempito con 10 mL di brodo di soia triptico sterile (TSB) e un miscelatore a vortice. Prima del posizionamento nella BSC, disinfettare tutti i materiali con alcool.
- Vortice la fiala di isolato microbico per omogeneizzare la coltura.
- Trasferire asetticamente 20 μL dell'isolato microbico in 10 mL di TSB sterile contenuto in una provetta da 15 mL e incubarlo a 30 °C per 16-24 h agitando a 160 rpm.
AVVERTENZA: B. vesicularis deve essere utilizzato in un laboratorio di livello di contenimento 2 in conformità con le linee guida richieste per la manipolazione di organismi patogeni. Il conduttore deve essere adeguatamente addestrato e deve indossare occhiali di sicurezza, guanti e un cappotto.
- Disinfettanti
- Per preparare la soluzione di perossiacido organico (60 mL), aggiungere 24 mL di perossido di idrogeno e 36 mL di acido (acido acetico, propionico o lattico) in un matraccio di Erlenmeyer da 250 mL. Quindi, aggiungere un volume predefinito di acido solforico 10 M (655 μL per l'acido peracetico, 635 μL per l'acido perpropionico o 715 μL per l'acido perlattico). Agitare delicatamente il matraccio per mescolare e metterlo in un bagnomaria a 30 °C allestito all'interno del cappuccio chimico. Incubare il matraccio per 2 giorni, mescolando delicatamente ogni mattina.
NOTA: Il disinfettante commerciale a base di acido peracetico (vedi Tabella dei materiali) è stato fornito direttamente dal produttore.
ATTENZIONE: I disinfettanti devono essere utilizzati sotto una cappa chimica. Gli occhiali e i guanti di sicurezza devono essere indossati per tutta la durata dell'esperimento. Per ulteriori informazioni sui disinfettanti, fare riferimento alla rispettiva scheda di sicurezza dei materiali. - Eseguire la titolazione del perossido di idrogeno come descritto di seguito.
- Posizionare un becher vuoto da 300 mL su una bilancia analitica (vedere Tabella dei materiali) e tarare la bilancia. Pesare circa 0,23 g di disinfettante nel becher e annotare il peso esatto aggiunto. Aggiungere 100 g di soluzione fredda di acido solforico 1 N nel becher, aggiungere una barra di agitazione magnetica nel becher e posizionarla su una piastra di agitazione.
- Lasciare mescolare la soluzione fino alla completa omogeneizzazione. Quindi, aggiungere tre gocce di una soluzione indicatrice di ferroina (0,1% in peso in H2O) nel becher e titolare con una soluzione di solfato di cerio 0,1 N fino a quando la soluzione passa da un colore rosa salmone a un colore azzurro. Si noti il volume della soluzione di solfato di cerio aggiunto.
- Calcola la percentuale di perossido di idrogeno usando la seguente formula:
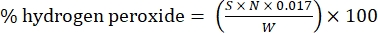 Eq. (1)
Eq. (1)
dove S è il volume della soluzione di solfato di cerio aggiunta, N è la normalità della soluzione di solfato di cerio (0,1 N), W è il peso del campione (~0,2300 g) e 0,017 = (1 mol H 2 O 2/2 mol Ce) × (34,0147 g H 2 O 2 /1 mol H 2 O)2 × (1 L/1.000 ml)
- Eseguire la titolazione dei perossiacidi organici come descritto di seguito.
- Aggiungere 20 mL di soluzione di ioduro di potassio al 7,5% (p/v) in un becher. Titolare lentamente con una soluzione di tiosolfato di sodio 0,1 N fino a quando il colore blu della soluzione inizia a diventare marrone chiaro / arancione.
- Aggiungere 2 mL di soluzione di amido (1% peso in H2O) nel becher e titolare con una soluzione di tiosolfato di sodio 0,1 N fino a quando la soluzione passa da nera ad arancione. Notare il volume della soluzione di tiosolfato di sodio utilizzata.
- Calcolare la percentuale di perossiacido organico con la seguente formula:
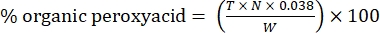 Eq. (2)
Eq. (2)
dove T è il volume della soluzione di tiosolfato di sodio utilizzata, N è la normalità della soluzione di tiosolfato di sodio (0,1 N), W è il peso del campione (~0,2300 g) e 0,038 = (1 mol CH 3 COOOH/1 mol I 2) × (1 mol I 2/2 mol S2 O 3) × (76,06 g/1 mol CH3 COOOH) × (1 L/1.000 mL)
NOTA: ripetere i passaggi 1.2.2 e 1.2.3 con altri due campioni per eseguire ogni test in triplice copia.
- Per preparare la soluzione di perossiacido organico (60 mL), aggiungere 24 mL di perossido di idrogeno e 36 mL di acido (acido acetico, propionico o lattico) in un matraccio di Erlenmeyer da 250 mL. Quindi, aggiungere un volume predefinito di acido solforico 10 M (655 μL per l'acido peracetico, 635 μL per l'acido perpropionico o 715 μL per l'acido perlattico). Agitare delicatamente il matraccio per mescolare e metterlo in un bagnomaria a 30 °C allestito all'interno del cappuccio chimico. Incubare il matraccio per 2 giorni, mescolando delicatamente ogni mattina.
2. Formazione di biofilm singoli e misti
- Piastre per microtitolazione a biofilm
- Vortice il tubo contenente la coltura batterica (20 μL del ceppo + 10 mL di terreno TSB, preparato al punto 1.1.4). Eseguire la diluizione seriale e la placcatura su agar di soia triptico (TSA) per determinare la conta delle cellule batteriche (cfu) della coltura notturna. Quindi, trasferire asetticamente 100 μL della coltura in 10 mL di terreno sterile TSB (per una concentrazione finale di circa 2 x 107 ufc/ml).
NOTA: Per il test con il bioreattore, un volume di 100 μL dell'isolato microbico viene trasferito in 100 mL di TSB sterile. - Vortice il tubo. Per ciascun batterio, trasferire la coltura batterica diluita nella piastra del microfilm del biofilm (150 μL per pozzetto) in triplice copia utilizzando una pipetta multicanale. Caricare 150 μL di terreno TSB in tre nuovi pozzi che fungano da controlli. Incubare la piastra del microfilm del biofilm (vedi Tabella dei materiali) a 30 °C per 24 ore senza agitazione.
NOTA: Per i saggi a biofilm misto, aggiungere 75 μL di ciascuna sospensione per un volume totale di 150 μL. La piastra del microtitolo del biofilm contiene pioli nei suoi coperchi, su cui si formano i biofilm.
- Vortice il tubo contenente la coltura batterica (20 μL del ceppo + 10 mL di terreno TSB, preparato al punto 1.1.4). Eseguire la diluizione seriale e la placcatura su agar di soia triptico (TSA) per determinare la conta delle cellule batteriche (cfu) della coltura notturna. Quindi, trasferire asetticamente 100 μL della coltura in 10 mL di terreno sterile TSB (per una concentrazione finale di circa 2 x 107 ufc/ml).
- Bioreattore
- Pulire e asciugare all'aria le parti del bioreattore (vedi Tabella dei materiali) seguendo le istruzioni del fabbricante e procedere alla preparazione del reattore come descritto di seguito.
- In primo luogo, posizionare la lama piatta all'interno del becher di vetro da 1 litro (bioreattore), che è fissato al suo supporto da una barra magnetica, e mantenere la configurazione in posizione verticale per mezzo della barra di plastica attaccata sul lato interno del coperchio del bioreattore.
- Posizionare i tagliandi o le guide in acciaio inossidabile (vedi Tabella dei materiali) sulle loro aste di polipropilene usando il cacciavite e inserirli nei fori del coperchio, senza posizionare i loro perni di allineamento nelle tacche, per consentire al vapore di fuoriuscire durante la sterilizzazione.
- Coprire tutte le bocchette del bioreattore con un foglio di alluminio e avvolgere il resto dell'apparecchiatura, vale a dire il tubo L / S 18 (ID = 7,9 mm) e L / S 16 (ID = 3,1 mm), il taglio del flusso di vetro, i tappi del contenitore, i cacciaviti, le pinze e i filtri da 0,2 μm, con un foglio di alluminio.
NOTA: Inserire il tubo di silicone (vedere la tabella dei materiali) nella sbavatura situata sulla superficie interna del tappo del contenitore medio. - Autoclavare il bioreattore installato a ciclo secco a 121 °C per 20 min.
- Eseguire la formazione di biofilm nel bioreattore in modalità batch (primo passo).
- In un BSC, collegare un'estremità del tubo L / S 18 al beccuccio di uscita del bioreattore e tenere l'altra estremità avvolta in un foglio di alluminio per preservare la sterilità.
- Rimuovere un coupon o un portavetrino dal coperchio del bioreattore e metterlo in un tubo sterile da 50 ml. Successivamente, riempire il becher del bioreattore con 340 mL di mezzo TSB da 300 mg/L attraverso il foro occupato dall'asta utilizzando una pipetta sierologica da 50 ml.
- Inoculare il terreno di coltura nel bioreattore con 1 mL della soluzione batterica (~108 ufc/mL di P. azotoformans) utilizzando una pipetta da 5 mL attraverso lo stesso orifizio utilizzato in precedenza, quindi riportare l'asta nella sua posizione originale. Posizionare le aste che sono già posizionate nei fori del coperchio in modo che i perni si adattino alle rispettive tacche.
- Posizionare un filtro antispurgo dell'aria batterica da 0,2 μm all'estremità del tubo con il diametro più piccolo, che si trova sul coperchio del bioreattore. L'altro tubo dello stesso diametro rimane permanentemente tappato con un tappo a vite metallico o un tappo in silicone che si chiude ermeticamente.
- Posizionare il bioreattore per 24 ore sopra la piastra riscaldante impostata a 30 °C e agitare a 130 giri/min.
NOTA: Per la formazione di biofilm multispecie, utilizzare un volume uguale delle diverse colture batteriche per ottenere un volume totale di 1 mL per l'inoculo.
- Eseguire la formazione di biofilm nel bioreattore in modalità flusso continuo (seconda fase).
- Introdurre una carboy contenente 18 L di acqua distillata sterile nella BSC e aggiungere 2 L di terreno di coltura TSB da 1.000 mg/L per ottenere una concentrazione finale di 100 mg/L.
- Coprire il contenitore con il suo cappuccio sterile, a cui sono collegati due tubi. Il primo è un tubo di silicone fissato sulla faccia interna del tappo e viene utilizzato per pompare il mezzo. Il secondo tubo (L/S 16) è collegato alla porta esterna per consentire al liquido di fluire verso il bioreattore. Posizionare un filtro da 0,2 μm nel secondo tubo sul coperchio del contenitore medio.
- Collegare questo secondo tubo alla pompa peristaltica e unire l'altra estremità alla rottura del flusso di vetro, che viene quindi inserita nel tubo più grande sul coperchio del bioreattore.
- Utilizzare un'altra carboy da 20 litri per raccogliere l'effluente dal bioreattore. Attaccare l'estremità del tubo collegato al beccuccio di uscita del bioreattore al tappo del contenitore dei rifiuti. Inserire un filtro da 0,2 μm nel tubo disponibile sul coperchio di questo contenitore.
- Avviare la pompa peristaltica con una portata di 11,3 ml/min e lasciare il sistema in funzione per 24 ore.
NOTA: La portata (11,3 ml/min) del terreno di coltura o del latte utilizzato durante la formazione del biofilm nel bioreattore è stata determinata dividendo 340 mL (che corrisponde al volume del liquido all'interno del reattore) per il tempo di permanenza di 30 min.
- Recuperare il biofilm batterico.
- Spegnere la pompa peristaltica e smettere di mescolare e riscaldare il bioreattore.
- Rimuovere con attenzione ogni asta dal bioreattore e sciacquare i tagliandi o i vetrini 3x in 40 ml di PBS per eliminare i batteri planctonici. Successivamente, rilasciare i tagliandi o i vetrini in tubi conici sterili da 50 ml contenenti 40 ml di PBS utilizzando un cacciavite appropriato. Vortice i tubi per 30 s, trasferirli su un rack posto in un bagno sonicatore e sonicare i tubi a 40 kHz per 30 s (che richiede 110 W di potenza). Ripetere questa operazione 3 volte.
- Raccogliere le sospensioni di biofilm da 40 ml in tubi conici sterili da 50 ml, quindi risciacquare i coupon o i vetrini con 2 ml di soluzione PBS sterile. Recuperare questo liquido di risciacquo e aggiungerlo alla sospensione di biofilm già raccolta.
- Enumerare i batteri vitali nel biofilm: con la sospensione del biofilm ottenuta, eseguire diluizioni seriali 10 volte e quindi placcare 100 μL delle diluizioni 10−5 e 10−6 su TSA in triplice copia. Incubare le piastre a 30 °C per 24 ore. Contare il numero di colonie presenti sulle piastre di agar e calcolare la densità batterica sui tagliandi e sui vetrini (batteri sessili vitali) secondo ASTM E2562-1714 utilizzando la seguente formula:
 Eq. (3)
Eq. (3)
dove X è il numero di unità formanti colonie (CFU), B è il volume placcato (0,1 ml), V è il volume in cui il biofilm è sospeso (la soluzione madre), A è la superficie del coupon o del vetrino coperto dal biofilm e D è il fattore di diluizione.
- Pulire e asciugare all'aria le parti del bioreattore (vedi Tabella dei materiali) seguendo le istruzioni del fabbricante e procedere alla preparazione del reattore come descritto di seguito.
3. Valutazione quantitativa dell'efficacia dei perossiacidi organici per l'eradicazione dei biofilm
- Piastre per microtitolazione a biofilm
- Aggiungere 200 μL di soluzione salina tamponata con fosfato (1x PBS) in tre pozzetti di una micropiastra da 96 pozzetti.
- Trasferire il coperchio della micropiastra del biofilm, con i biofilm che si sono formati sui pioli, sulla micropiastra a 96 pozzetti contenente il PBS per 10 s al fine di lavare i biofilm ed eliminare i batteri planctonici.
- Preparare i disinfettanti alle concentrazioni richieste (ad esempio, 25 ppm, 50 ppm, 500 ppm, 1.000 ppm, 5.000 ppm, 10.000 ppm e 25.000 ppm di sostanza attiva).
NOTA: Tutte le diluizioni sono effettuate asetticamente utilizzando acqua distillata sterile. - Aggiungere 200 μL di ogni concentrazione di disinfettante nei pozzetti di una nuova piastra di microtitolazione a 96 pozzetti in triplice copia. Trasferire il coperchio della piastra del microtitolo del biofilm su questa piastra di microtitolazione a 96 pozzetti contenente i disinfettanti e incubare la piastra a temperatura ambiente per il tempo di esposizione desiderato.
- Aggiungere 200 μL di brodo neutralizzante Dey-Engley ai pozzetti di una nuova piastra di microtitolazione a 96 pozzetti. Trasferire il coperchio della piastra del microtitolo del biofilm sulla piastra del microtitolo a 96 pozzetti contenente il brodo neutralizzante. Sigillare la piastra del titolo con parafilm e posizionarla nel sonicatore da bagno a 40 kHz per 30 minuti.
- Dopo 30 minuti, rimuovere la piastra del titolo dal sonicatore e rimuovere il parafilm. Trasferire 100 μL dalla prima colonna della piastra a 96 pozzetti contenente i biofilm staccati dopo la sonicazione alla prima fila di una nuova piastra di microtitolazione a 96 pozzetti.
- Aggiungere 180 μL di 1x PBS sterile ai pozzetti della nuova micropiastra da 96 pozzetti (preparata al punto 3.1.6), ad eccezione della prima fila. Trasferire 20 μL della soluzione di biofilm dalla prima fila ai pozzetti nella seconda fila contenente 180 μL di 1x PBS (fila 2, diluizione: 10−1). Quindi, trasferire 20 μL del liquido contenuto nella seconda fila ai pozzetti nella fila successiva contenente 180 μL di 1x PBS (fila 3, diluizione: 10−2). Ripetere la stessa procedura per ottenere diluizioni tra 10−5 e 10−7.
- Inoculare 100 μL delle diluizioni su TSA e incubare le piastre secondo i parametri richiesti per la crescita di ciascun batterio.
- Dopo l'incubazione, contare i cfu e calcolare la densità log 10 per ogni piolo e la riduzione log10 ad ogni concentrazione di disinfettante con le seguenti equazioni:
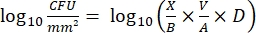 Eq. (4)
Eq. (4)
dove X è l'unità formante le colonie contate nello spot, B è il volume placcato (0,01 ml), V è il volume del pozzo (0,20 ml), A è l'area della superficie del piolo (46,63 mm2) e D è la diluizione.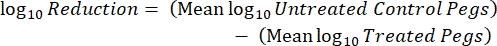 Eq. (5)
Eq. (5) - Ripeti ogni esperimento 3 volte in giorni indipendenti.
NOTA: La "concentrazione minima di disinfettante che elimina il biofilm", o MBEC, corrisponde alla più bassa concentrazione di disinfettante che non mostra crescita batterica.
- Bioreattore
NOTA: La procedura dello standard ASTM E2871-1915 è seguita per eseguire questo test con P. azotoformans PFlA1.- Iniziare formando i biofilm sui tagliandi nel bioreattore, come descritto al punto 2.2. Quindi, rimuovere l'asta che contiene i tagliandi e sciacquarla all'interno di un tubo conico contenente 30 ml di PBS.
- Rilasciare ogni coupon in un tubo conico sterile da 50 ml utilizzando un cacciavite, quindi aggiungere 4 ml della soluzione perossiacida organica appropriata o PBS per il controllo. Incubare per 5 minuti, quindi aggiungere 36 ml di brodo neutralizzante Dey-Engley. Vortice per 30 s, quindi sonicare a 40 kHz per 30 s usando un bagno sonicatore. Ripetere il processo 3 volte per ottenere la sospensione del biofilm.
- Allo stesso modo, sciacquare tutte le altre aste e recuperare i biofilm dai coupon. Eseguire diluizioni seriali della sospensione del biofilm e piastra 0,1 mL su supporto TSA. Incubare le piastre a 30 °C per 24 ore.
- Dopo l'incubazione, contare il cfus, quindi calcolare la densità del biofilm per ogni tagliando (Eq. 6), la densità logaritmica media (LD) per ogni serie di tre tagliandi della stessa barra, inclusi trattamento e controllo (Eq. 7), e la riduzione logaritmica per il disinfettante (Eq. 8) utilizzando le seguenti equazioni:
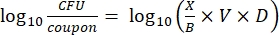 Eq. (6)
Eq. (6)
dove X è la media delle unità formanti colonie contate/cedola, B è il volume placcato (0,1 ml), V è il volume del disinfettante o PBS più neutralizzatore (40 ml) e D è la diluizione.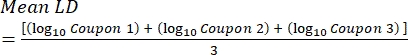 Eq. (7)
Eq. (7)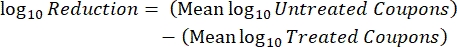 Eq. (8)
Eq. (8)
4. Valutazione qualitativa dell'efficacia dei perossiacidi organici per l'eradicazione dei biofilm
NOTA: Dopo essere stati trattati con i disinfettanti (dal punto 3.1.1 al punto 3.1.5), i biofilm di P. azotoformans che si sono formati sui pioli della piastra del microfilm nel metodo statico sono stati preparati e analizzati mediante osservazione su microscopi elettronici e confocali a scansione.
- Microscopia elettronica a scansione (SEM)
- Aggiungere 200 μL di 1x PBS a tre pozzetti di una micropiastra da 96 pozzetti. Trasferire il coperchio dalla piastra del microtitolo del biofilm (fase 3.1.5) alla micropiastra a 96 pozzetti contenente PBS e lasciarlo a temperatura ambiente per 10 s per eliminare il brodo neutralizzante Dey-Engley.
- Rimuovere i pioli dalla piastra del microtitolo del biofilm utilizzando pinze per naso ad ago sterilizzate. Introdurre ciascun piolo in un flaconcino vuoto sotto un cappuccio e aggiungere fissativo primario (glutaraldeide al 5% in tampone cacodilato 0,1 M Na pH 7,5) a ciascun flaconcino. Tappare ogni flaconcino e incubarlo a 4 °C per 24 ore.
- Dopo l'incubazione, decantare il fissativo con una pipetta e gettare tutti i rifiuti liquidi in un contenitore appropriato. Rimuovere i tappi di ciascun flaconcino e metterli in un cappuccio ad asciugare all'aria per 72 ore.
- Montare i campioni su mozziconi di alluminio (vedi Tabella dei materiali) applicando resina epossidica (vedi Tabella dei materiali) sulla superficie superiore piana di ciascun tronco. Quindi, applicare con attenzione i pioli ai mozziconi con una pinza.
- Metallizzare i campioni con uno sputter d'oro EMS950x + 350s (vedi Tabella dei materiali) per 4 minuti a 2 x 10−1 bar di pressione dell'argon e 20 mA di corrente. Eseguire la messa a terra appropriata dipingendo il lato del piolo non esposto all'oro con vernice argentata (vedi Tabella dei materiali).
- Acquisire immagini su un microscopio elettronico a scansione utilizzando l'interfaccia utente di controllo SEM versione 6.28 (vedere Tabella dei materiali). La tensione di accelerazione utilizzata in questo studio era di 15 kV e gli ingrandimenti erano 300x e 2.000x.
- Microscopia confocale
- Aggiungere 200 μL di 1x PBS a tre pozzetti di una piastra di microtitolazione a 96 pozzetti. Trasferire il coperchio dalla micropiastra del biofilm alla piastra a 96 pozzetti contenente il PBS e lasciarlo per 10 s per eliminare il brodo neutralizzante Dey-Engley.
- Preparare soluzioni di macchie fluorescenti aggiungendo 3 μL di colorante fluorescente verde e 3 μL di colorante fluorescente rossa (vedere Tabella dei materiali) a 1 mL di acqua sterile.
- Aggiungere 200 μL di soluzione colorante in un pozzetto di una piastra di microtitolazione a 96 pozzetti. Trasferire il coperchio dalla piastra del microtitolo del biofilm alla piastra a 96 pozzetti contenente la soluzione colorante. Coprire la piastra del microtitolo del biofilm con un foglio di alluminio e incubare il campione per 20-30 minuti a temperatura ambiente.
- Aggiungere 200 μL di acqua sterilizzata nei pozzetti di una micropiastra da 96 pozzetti. Quindi, trasferire il coperchio dalla micropiastra del biofilm alla micropiastra a 96 pozzetti contenente l'acqua e lasciarlo fino all'osservazione.
- Visualizza i biofilm formati sui pioli usando un microscopio a scansione laser confocale (vedi Tabella dei materiali) con un obiettivo DIC dell'olio 63x/1.40. Acquisire le immagini utilizzando il software associato (vedere Tabella dei materiali). Le lunghezze d'onda di eccitazione della fluorescenza utilizzate per le macchie fluorescenti verdi e rosse erano rispettivamente di 482 nm e 490 nm.
NOTA: Per ottenere i migliori risultati, tagliare e posizionare il piolo in una piastra di Petri da 60 mm e riempire il piatto con acqua sterile.
Access restricted. Please log in or start a trial to view this content.
Risultati
L'analisi SEM mostra la presenza di biofilm prodotti da P. azotoformans PFl1A sui picchetti della micropiastra del biofilm (Figura 2A). Si può osservare una struttura tridimensionale del biofilm. Il P. azotoformans PFl1A è stato precedentemente identificato come un forte produttore di biofilm (A570 > 1.5) utilizzando piastre di microtitolazione a 96 pozzetti12.
Inoltre, il biofilm PFl1A di P. azotoformans<...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il test MBEC (biofilm microplate assay) è stato il primo metodo ad essere riconosciuto come test standard di eradicazione del biofilm dall'ASTM17. Il nostro studio e altri hanno dimostrato che ci sono due passaggi critici quando si utilizza questo test: la fase di sonicazione (tempo e potenza) e il tempo di trattamento disinfettante18. Stewart e Parker hanno anche suggerito altri parametri che potrebbero influenzare l'esito del test, come la specie microbica, l'età del bi...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questa ricerca è stata sostenuta dal Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ) (2016-049-C22), Agropur, Groupe Sani Marc e dal Natural Sciences and Engineering Research Council of Canada (NSERC) (RDCPJ516460-17). Ringraziamo Teresa Paniconi per la critica recensione del manoscritto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
Riferimenti
- Canada's dairy industry at a glance. Canadian Dairy Information Centre. , Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017).
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. Science et technologie du lait. 3rd edn. , Les Presses de l'Université Laval. Quebec. (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934(2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921(2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM International. ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2562-17.html (2017).
- ASTM International. ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2871-19.html (2019).
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181(2022).
- ASTM International. ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International. , West Conshohocken, PA. Available from: https://www.astm.org/e2799-17.html (2022).
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020(2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264(2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212(2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592(2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885(2020).
- Goeres, D. M., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. Simoes, M., Borges, A., Chaves Simoes, L. , Academic Press. Cambridge, MA. 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon