Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка эффективности органических пероксикислот для уничтожения молочных биопленок с использованием подхода, сочетающего статические и динамические методы
В этой статье
Резюме
Этот протокол описывает подход, сочетающий статические и динамические методы для оценки эффективности органических пероксикислот для уничтожения биопленок в молочной промышленности. Этот подход также может быть использован для проверки эффективности новых биологических или химических составов для контроля биопленок.
Аннотация
Наличие биопленок в молочной промышленности вызывает серьезную озабоченность, поскольку они могут привести к производству небезопасных и измененных молочных продуктов из-за их высокой устойчивости к большинству процедур безразборной мойки (CIP), часто используемых на перерабатывающих предприятиях. Поэтому крайне важно разработать новые стратегии борьбы с биопленкой для молочной промышленности. Этот протокол направлен на оценку эффективности органических пероксикислот (надуксусной, перпропионовой и пермолочной кислот и коммерческого дезинфицирующего средства на основе перуксусной кислоты) для уничтожения молочных биопленок с использованием комбинации статических и динамических методов. Все дезинфицирующие средства были протестированы на самых сильных бактериях, продуцирующих биопленку, в одной или смешанной биопленке с использованием анализа минимальной концентрации эрадикации биопленки (MBEC), статического метода скрининга с высокой пропускной способностью. Время контакта 5 минут с дезинфицирующими средствами в рекомендуемых концентрациях успешно уничтожило как одиночные, так и смешанные биопленки. В настоящее время продолжаются исследования, чтобы подтвердить эти наблюдения с использованием биопленочного реактора Центра по контролю за заболеваниями (CDC), динамического метода имитации условий in situ . Этот тип биореактора позволяет использовать поверхность из нержавеющей стали, которая составляет большинство промышленного оборудования и поверхностей. Предварительные результаты, полученные на реакторе, по-видимому, подтверждают эффективность органических пероксикислот против биопленок. Комбинированный подход, описанный в этом исследовании, может быть использован для разработки и тестирования новых биологических или химических составов для контроля биопленок и уничтожения микроорганизмов.
Введение
Молочная промышленность является основным промышленным сектором во всем мире, в том числе в Канаде, где насчитывается более 10 500 молочных ферм, производящих почти 90 миллионов гл молока вгод1. Несмотря на строгие гигиенические требования, предъявляемые в молочной промышленности, в том числе на перерабатывающих предприятиях, молоко является отличной питательной средой для микроорганизмов, и, таким образом, молочные продукты могут содержать микроорганизмы, в том числе порчу или патогенные микроорганизмы. Эти возбудители могут вызывать различные заболевания; например, Salmonella sp. и Listeria monocytogenes могут вызывать гастроэнтерит и менингит соответственно2. Микроорганизмы, вызывающие порчу, могут влиять на качество и органолептические свойства молочных продуктов, производя газы, внеклеточные ферменты или кислоты3. Внешний вид и цвет молока также могут быть изменены, например, Pseudomonas spp.4.
Некоторые из этих микроорганизмов могут образовывать биопленки на различных поверхностях, в том числе на нержавеющей стали. Такие биопленки обеспечивают стойкость и размножение микроорганизмов на поверхности оборудования и, таким образом, загрязнение молочных продуктов5. Биопленки также проблематичны из-за их способности препятствовать теплопередаче и ускорять коррозию оборудования, что приводит к преждевременной замене оборудования и, следовательно, к экономическим потерям6.
Процедуры безразборной мойки (CIP) позволяют пищевой промышленности контролировать рост микроорганизмов. Эти процедуры включают последовательное использование гидроксида натрия, азотной кислоты и, иногда, дезинфицирующих средств, содержащих хлорноватистую кислоту и надуксусную кислоту 7,8. Хотя хлорноватистая кислота очень эффективна против микроорганизмов, она также вступает в реакцию с природным органическим веществом, вызывая образование токсичных побочных продуктов9. Надуксусная кислота не выделяет вредных побочных продуктов10; Однако его эффективность против биопленок в пищевой промышленности сильно варьирует10,11. В последнее время другие пероксикислоты, включая перпропионовую и пермолочную кислоты, были изучены на предмет их антимикробной активности, и они, по-видимому, являются хорошей альтернативой для контроля роста микробов в биопленках12,13.
Таким образом, это исследование было направлено на оценку эффективности органических пероксикислот (надуксусной, перпропионовой и пермолочной кислот и дезинфицирующего средства на основе перуксусной кислоты) для уничтожения молочных биопленок с использованием подхода, сочетающего анализ минимальной концентрации эрадикации биопленки (MBEC), статический высокопроизводительный метод скрининга и реактор биопленки Центра по контролю за заболеваниями (CDC), динамический метод, имитирующий in situ условия. Анализ MBEC в дальнейшем упоминается в протоколе как «микротитровальные планшеты с биопленкой». Представленный здесь протокол и репрезентативные результаты демонстрируют эффективность органических пероксикислот и их потенциальное применение для контроля микробных биопленок в молочной промышленности.
протокол
Работа, содержащаяся в этой статье, требует наличия лаборатории 2-го уровня биобезопасности и была ранее одобрена (проект No 119689) институциональным комитетом по биобезопасности Университета Лаваля.
ПРИМЕЧАНИЕ: Блок-схема на рисунке 1 представляет собой краткое изложение методологии, сочетающей статический и динамический подходы, которая использовалась для оценки эффективности органических пероксикислот для уничтожения биопленок.
1. Подготовка материалов
- Микробные изоляты
- Включите шкаф биологической безопасности (BSC) за 15 минут до использования и очистите его 70% (об./об.) спиртовым раствором.
- После того, как BSC станет стерильным, поместите флакон с микробным изолятом для тестирования (Pseudomonas azotoformans или Brevundimonas vesicularis в этом исследовании), инокуляционную петлю, пробирку объемом 15 мл, заполненную 10 мл стерильного триптического соевого бульона (TSB), и вихревой миксер. Перед помещением в БСК продезинфицируйте все материалы спиртом.
- Встряхните флакон с микробным изолятом, чтобы гомогенизировать культуру.
- Асептически переносят 20 мкл микробного изолята в 10 мл стерильного БСЭ, содержащегося в пробирке объемом 15 мл, и инкубируют при 30 °С в течение 16-24 ч при перемешивании при 160 об/мин.
ВНИМАНИЕ: B. vesicularis следует использовать в лаборатории уровня сдерживания 2 в соответствии с рекомендациями, необходимыми для обращения с патогенными организмами. Дрессировщик должен быть надлежащим образом обучен и должен носить защитные очки, перчатки и пальто.
- Дезинфицирующие средства
- Чтобы приготовить раствор органической пероксикислоты (60 мл), добавьте 24 мл перекиси водорода и 36 мл кислоты (уксусной, пропионовой или молочной кислоты) в колбу Эрленмейера объемом 250 мл. Затем добавьте заранее определенный объем 10 М серной кислоты (655 мкл для надуксусной кислоты, 635 мкл для перпропионовой кислоты или 715 мкл для пермолочной кислоты). Осторожно встряхните колбу, чтобы она перемешалась, и поставьте колбу на водяную баню с температурой 30 °C, установленную внутри химического колпака. Инкубируйте колбу в течение 2 дней, каждое утро аккуратно перемешивая.
ПРИМЕЧАНИЕ: Коммерческое дезинфицирующее средство на основе надуксусной кислоты (см. Таблицу материалов) было предоставлено непосредственно производителем.
ВНИМАНИЕ: Дезинфицирующие средства следует использовать под химическим колпаком. На время эксперимента необходимо носить защитные очки и перчатки. Для получения дополнительной информации о дезинфицирующих средствах, пожалуйста, обратитесь к соответствующему паспорту безопасности материала. - Выполните титрование перекиси водорода, как описано ниже.
- Поместите пустой стакан объемом 300 мл на аналитические весы (см. Таблицу материалов) и затарите весы. Взвесьте примерно 0,23 г дезинфицирующего средства в стакан и отметьте точный добавленный вес. Добавьте в стакан 100 г холодного раствора серной кислоты 1 Н, добавьте в стакан магнитную мешалку и поместите ее на мешалку.
- Дайте раствору перемешаться до полной гомогенизации. Затем добавьте три капли раствора ферроина-индикатора (0,1 мас.% в H2O) в стакан и титруйте 0,1 Н раствором сульфата церия до тех пор, пока раствор не изменится с лососево-розового цвета на светло-голубой. Обратите внимание на объем добавленного раствора сульфата церия.
- Рассчитайте процентное содержание перекиси водорода по следующей формуле:
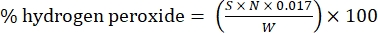 Уравнение (1)
Уравнение (1)
где S - объем добавленного раствора сульфата церия, N - нормальность раствора сульфата церия (0,1 N), W - масса образца (~0,2300 г) и 0,017 = (1 моль H 2 O 2/2 моль Ce) × (34,0147 г H 2 O 2 /1 моль H 2 O)2× (1 л / 1,000 мл)
- Выполните титрование органических пероксикислот, как описано ниже.
- Добавьте 20 мл 7,5% (мас./об.) раствора йодида калия в стакан. Медленно титруйте 0,1 Н раствором тиосульфата натрия до тех пор, пока синий цвет раствора не станет бледно-коричневым/оранжевым.
- Добавьте 2 мл раствора крахмала (1 мас.% в H2O) в стакан и титруйте 0,1 Н раствором тиосульфата натрия до тех пор, пока раствор не изменится с черного на оранжевый. Обратите внимание на объем используемого раствора тиосульфата натрия.
- Рассчитайте процентное содержание органической пероксикислоты по следующей формуле:
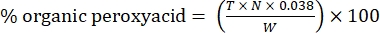 Уравнение (2)
Уравнение (2)
где T - объем используемого раствора тиосульфата натрия, N - нормальность раствора тиосульфата натрия (0,1 N), W - масса образца (~0,2300 г) и 0,038 = (1 моль CH 3 COOOH / 1 моль I 2) × (1 моль I 2/2 моль S2 O 3) × (76,06 г / 1 моль CH3COOOH) × (1 л / 1,000 мл)
ПРИМЕЧАНИЕ: Повторите шаги 1.2.2 и 1.2.3 с еще двумя образцами для выполнения каждого теста в трех экземплярах.
- Чтобы приготовить раствор органической пероксикислоты (60 мл), добавьте 24 мл перекиси водорода и 36 мл кислоты (уксусной, пропионовой или молочной кислоты) в колбу Эрленмейера объемом 250 мл. Затем добавьте заранее определенный объем 10 М серной кислоты (655 мкл для надуксусной кислоты, 635 мкл для перпропионовой кислоты или 715 мкл для пермолочной кислоты). Осторожно встряхните колбу, чтобы она перемешалась, и поставьте колбу на водяную баню с температурой 30 °C, установленную внутри химического колпака. Инкубируйте колбу в течение 2 дней, каждое утро аккуратно перемешивая.
2. Формирование одиночных и смешанных биопленок
- Биопленочные микротитровальные планшеты
- Встряхните пробирку, содержащую бактериальную культуру (20 мкл штамма + 10 мл среды TSB, приготовленной на этапе 1.1.4). Выполните серийное разведение и нанесение покрытия на триптический соевый агар (TSA), чтобы определить количество бактериальных клеток (КОЕ) ночной культуры. Затем асептически переносят 100 мкл культуры в 10 мл стерильной среды БСЭ (для конечной концентрации приблизительно 2 х 107 КОЕ/мл).
ПРИМЕЧАНИЕ: Для анализа с биореактором объем 100 мкл микробного изолята переносят в 100 мл стерильного БСЭ. - Вихревая трубка. Для каждой бактерии перенесите разбавленную бактериальную культуру в планшет микротитра биопленки (150 мкл на лунку) в трех экземплярах с помощью многоканальной пипетки. Загрузите 150 мкл среды БСЭ в три новые скважины, которые будут использоваться в качестве контрольных скважин. Инкубируйте планшет микротитра биопленки (см. Таблицу материалов) при 30 ° C в течение 24 ч без перемешивания.
ПРИМЕЧАНИЕ: Для смешанных анализов биопленки добавьте 75 мкл каждой суспензии для общего объема 150 мкл. Микротитровальная пластина биопленки содержит в крышках колышки, на которых образуются биопленки.
- Встряхните пробирку, содержащую бактериальную культуру (20 мкл штамма + 10 мл среды TSB, приготовленной на этапе 1.1.4). Выполните серийное разведение и нанесение покрытия на триптический соевый агар (TSA), чтобы определить количество бактериальных клеток (КОЕ) ночной культуры. Затем асептически переносят 100 мкл культуры в 10 мл стерильной среды БСЭ (для конечной концентрации приблизительно 2 х 107 КОЕ/мл).
- Биореактор
- Очистите и высушите на воздухе части биореактора (см. Таблицу материалов) в соответствии с инструкциями производителя и приступайте к подготовке реактора, как описано ниже.
- Во-первых, поместите плоское лезвие внутрь стеклянного стакана (биореактора) объемом 1 л, который прикреплен к его держателю с помощью магнитного стержня, и поддерживайте установку в вертикальном положении с помощью пластикового стержня, прикрепленного к внутренней стороне крышки биореактора.
- Поместите купоны или слайды из нержавеющей стали (см. Таблицу материалов) на их полипропиленовые стержни с помощью отвертки и вставьте их в отверстия в крышке, не помещая их выравнивающие штифты в выемки, чтобы пар выходил во время стерилизации.
- Закройте все вентиляционные отверстия биореактора алюминиевой фольгой и оберните алюминиевой фольгой остальное оборудование, а именно трубки L/S 18 (ID = 7,9 мм) и L/S 16 (ID = 3,1 мм), разрыв потока стекла, крышки контейнеров, отвертки, щипцы и фильтры 0,2 мкм.
ПРИМЕЧАНИЕ: Вставьте силиконовую трубку (см. Таблицу материалов) в зазубрину, расположенную на внутренней поверхности крышки среднего контейнера. - Автоклав биореактор устанавливают в сухом цикле при 121 °C в течение 20 мин.
- Проведите формирование биопленки в биореакторе в периодическом режиме (первый этап).
- В BSC подсоедините один конец трубки L/S 18 к выходному патрубку биореактора, а другой конец держите завернутым в алюминиевую фольгу для сохранения стерильности.
- Извлеките один купон или держатель слайда из крышки биореактора и поместите его в стерильную пробирку объемом 50 мл. После этого заполните стакан биореактора 340 мл среды TSB 300 мг/л через отверстие, которое было занято стержнем, с помощью серологической пипетки объемом 50 мл.
- Инокулируют питательную среду в биореакторе 1 мл бактериального раствора (~ 108 КОЕ/мл P. azotoformans) с помощью пипетки объемом 5 мл через то же отверстие, которое использовалось ранее, а затем поместите стержень обратно в исходное положение. Расположите стержни, которые уже помещены в отверстия крышки, так, чтобы штифты вошли в соответствующие выемки.
- Поместите бактериальный фильтр продувки воздуха 0,2 мкм на конец трубки с наименьшим диаметром, который расположен на крышке биореактора. Другая трубка того же диаметра остается постоянно закупоренной металлической завинчивающейся крышкой или силиконовой заглушкой, которая плотно закрывается.
- Поместите биореактор на 24 часа над нагревательной пластиной, установленной при температуре 30 °C, и перемешайте при 130 об/мин.
ПРИМЕЧАНИЕ: Для образования многовидовой биопленки используйте равный объем различных бактериальных культур, чтобы получить общий объем 1 мл для инокулята.
- Проведите формирование биопленки в биореакторе в режиме непрерывного потока (вторая стадия).
- Поместите бутылку, содержащую 18 л стерильной дистиллированной воды, в BSC и добавьте 2 л 1000 мг/л питательной среды TSB для получения конечной концентрации 100 мг/л.
- Накройте емкость ее стерильной крышкой, к которой подсоединяются две трубки. Первый представляет собой силиконовую трубку, закрепленную на внутренней поверхности колпачка и используемую для перекачки среды. Вторая трубка (L/S 16) соединена с внешним портом, чтобы жидкость могла течь к биореактору. Поместите фильтр 0,2 мкм во вторую трубку на крышке контейнера для среднего размера.
- Подсоедините эту вторую трубку к перистальтическому насосу и присоедините другой конец к разрыву потока стекла, который затем вставляется в большую трубку на крышке биореактора.
- Используйте еще 20-литровый контейнер для сбора сточных вод из биореактора. Прикрепите конец трубки, соединенной с выходным носиком биореактора, к крышке контейнера для отходов. Вставьте фильтр 0.2 мкм в трубку, расположенную на крышке этого контейнера.
- Запустите перистальтический насос с расходом 11,3 мл/мин и оставьте систему работать на 24 часа.
ПРИМЕЧАНИЕ: Расход (11,3 мл/мин) питательной среды или молока, используемого при образовании биопленки в биореакторе, определяли путем деления 340 мл (что соответствует объему жидкости в реакторе) на время пребывания 30 мин.
- Восстановите бактериальную биопленку.
- Выключите перистальтический насос и прекратите перемешивание и нагрев биореактора.
- Осторожно извлеките каждый стержень из биореактора и промойте купоны или предметные стекла 3 раза в 40 мл PBS, чтобы уничтожить планктонные бактерии. После этого отпустите купоны или слайды в стерильные конические пробирки объемом 50 мл, содержащие 40 мл PBS, с помощью соответствующей отвертки. Вихревите трубки в течение 30 с, переносите их на стойку, помещенную в ванну с ультразвуковым аппаратом, и обрабатывайте ультразвуком трубки на частоте 40 кГц в течение 30 с (для чего требуется мощность 110 Вт). Повторите эту операцию 3 раза.
- Соберите суспензии биопленки объемом 40 мл в стерильные конические пробирки объемом 50 мл, а затем промойте купоны или предметные стекла 2 мл стерильного раствора PBS. Восстановите эту жидкость для полоскания и добавьте ее в уже собранную суспензию биопленки.
- Перечислите жизнеспособные бактерии в биопленке: С полученной суспензией биопленки выполняют 10-кратные серийные разведения, а затем пластинчатые 100 мкл 10−5 и 10−6 разведения на АСП в трех экземплярах. Инкубировать пластины при 30 °C в течение 24 часов. Подсчитайте количество колоний, присутствующих на агаровых пластинах, и рассчитайте плотность бактерий на купонах и предметных стеклах (жизнеспособные сидячие бактерии) в соответствии с ASTM E2562-1714 , используя следующую формулу:
 Уравнение (3)
Уравнение (3)
где X - количество колониеобразующих единиц (КОЕ), B - объем покрытия (0,1 мл), V - объем, в котором суспендирована биопленка (исходный раствор), A - поверхность купона или предметного стекла, покрытая биопленкой, и D - коэффициент разбавления.
- Очистите и высушите на воздухе части биореактора (см. Таблицу материалов) в соответствии с инструкциями производителя и приступайте к подготовке реактора, как описано ниже.
3. Количественная оценка эффективности органических пероксикислот для уничтожения биопленок
- Биопленочные микротитровальные планшеты
- Добавьте 200 мкл фосфатно-буферного физиологического раствора (1x PBS) в три лунки 96-луночной микропластины.
- Перенесите крышку микропланшета с биопленками, образовавшимися на колышках, на 96-луночную микропланшет, содержащий PBS, на 10 с, чтобы промыть биопленки и уничтожить планктонные бактерии.
- Приготовьте дезинфицирующие средства в требуемых концентрациях (например, 25 ppm, 50 ppm, 500 ppm, 1000 ppm, 5000 ppm, 10 000 ppm и 25 000 ppm активного вещества).
ПРИМЕЧАНИЕ: Все разведения производятся асептически с использованием стерильной дистиллированной воды. - Добавьте по 200 мкл каждой концентрации дезинфицирующего средства в лунки новой 96-луночной микротитровальной пластины в трех экземплярах. Перенесите крышку микротитровальной пластины с биопленкой на эту 96-луночную микротитровальную пластину, содержащую дезинфицирующие средства, и инкубируйте планшет при комнатной температуре в течение желаемого времени экспозиции.
- Добавьте 200 мкл нейтрализующего бульона Дей-Энгли в лунки новой 96-луночной микротитровальной пластины. Перенесите крышку пластины биопленочного микротитра на 96-луночную микротитровальную пластину, содержащую нейтрализующий бульон. Запечатайте микротитровальную пластину парапленкой и поместите ее в ультразвуковой аппарат для ванны с частотой 40 кГц на 30 минут.
- Через 30 минут извлеките микротитровальную пластину из ультразвукового аппарата и удалите парапленку. Перенесите 100 мкл из первой колонки 96-луночной пластины, содержащей биопленки, отделенные после обработки ультразвуком, в первый ряд новой 96-луночной микротитровальной пластины.
- Добавьте 180 мкл стерильного 1x PBS в лунки новой 96-луночной микропланшеты (приготовленной на шаге 3.1.6), за исключением первого ряда. Перенесите 20 мкл раствора биопленки из первого ряда в лунки во втором ряду, содержащие 180 мкл 1x PBS (ряд 2, разведение: 10−1). Затем перелейте 20 мкл жидкости, содержащейся во втором ряду, в лунки в следующем ряду, содержащие 180 мкл 1x PBS (ряд 3, разведение: 10−2). Повторите ту же процедуру для получения разведений между 10−5 и 10−7.
- Инокулируют 100 мкл разведений на TSA и инкубируют планшеты в соответствии с параметрами, необходимыми для роста каждой бактерии.
- После инкубации подсчитайте КОЕ и рассчитайте плотность log 10 для каждого колышка и снижение log10 при каждой концентрации дезинфицирующего средства с помощью следующих уравнений:
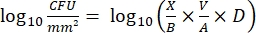 Уравнение (4)
Уравнение (4)
где X - колониеобразующие единицы, подсчитанные в пятне, B - объем покрытия (0,01 мл), V - объем лунки (0,20 мл), A - площадь поверхности колышка (46,63 мм2) и D - разбавление.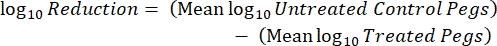 Уравнение (5)
Уравнение (5) - Повторяйте каждый эксперимент 3 раза в независимые дни.
ПРИМЕЧАНИЕ: «Минимальная концентрация дезинфицирующего средства, уничтожающего биопленку», или MBEC, соответствует самой низкой концентрации дезинфицирующего средства, которая не показывает роста бактерий.
- Биореактор
ПРИМЕЧАНИЕ: Процедура стандарта ASTM E2871-1915 соблюдается для проведения этого теста с P. azotoformans PFlA1.- Начните с формирования биопленок на купонах в биореакторе, как описано в шаге 2.2. Затем снимите стержень, на котором держатся купоны, и промойте его внутри конической трубки, содержащей 30 мл PBS.
- Опустите каждый купон в стерильную коническую пробирку объемом 50 мл с помощью отвертки, а затем добавьте 4 мл соответствующего раствора органической пероксикислоты или PBS для контроля. Инкубировать в течение 5 мин, а затем добавить 36 мл нейтрализующего бульона Дей-Энгли. Вихрь в течение 30 с, а затем обработка ультразвуком на частоте 40 кГц в течение 30 с с использованием ультразвуковой ванны. Повторите процесс 3 раза, чтобы получить суспензию биопленки.
- Точно так же промойте все остальные стержни и извлеките биопленки из купонов. Проводят серийные разведения биопленочной суспензии и планшета 0,1 мл на среде TSA. Инкубировать пластины при 30 °C в течение 24 часов.
- После инкубации подсчитайте КОЕ, а затем рассчитайте плотность биопленки для каждого купона (уравнение 6), среднюю логарифмическую плотность (LD) для каждого набора из трех купонов из одного и того же стержня, включая обработанный и контрольный (уравнение 7), и логарифмическое сокращение для дезинфицирующего средства (уравнение 8) с использованием следующих уравнений:
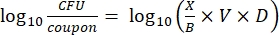 Уравнение (6)
Уравнение (6)
где X - среднее значение подсчитанных колониеобразующих единиц / купона, B - объем покрытия (0,1 мл), V - объем дезинфицирующего средства или PBS плюс нейтрализатор (40 мл), а D - разбавление.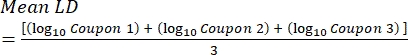 Уравнение (7)
Уравнение (7)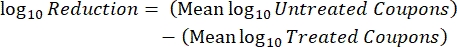 Уравнение (8)
Уравнение (8)
4. Качественная оценка эффективности органических пероксикислот для уничтожения биопленок
ПРИМЕЧАНИЕ: После обработки дезинфицирующими средствами (этап 3.1.1 - этап 3.1.5) биопленки P. azotoformans , которые образовались на колышках микротитровальной пластины биопленки статическим методом, были получены и проанализированы путем наблюдения на сканирующем электронном и конфокальных микроскопах.
- Сканирующая электронная микроскопия (СЭМ)
- Добавьте 200 мкл 1x PBS в три лунки 96-луночной микропланшета. Перенесите крышку с пластины микротитра биопленки (этап 3.1.5) на 96-луночную микропланшет, содержащую PBS, и оставьте ее при комнатной температуре на 10 с, чтобы удалить нейтрализующий бульон Дей-Энгли.
- Удалите колышки из микротитровальной пластинки биопленки с помощью стерилизованных плоскогубцев. Поместите каждый колышек в пустой флакон под колпаком и добавьте первичный фиксатор (5% глутарового альдегида в буфере 0,1 М какодилата натрия pH 7,5) в каждый флакон. Закройте каждый флакон крышкой и выдерживайте при температуре 4 °C в течение 24 часов.
- После инкубации сцедите фиксатор пипеткой и выбросьте все жидкие отходы в соответствующую емкость. Снимите крышки с каждого флакона и поместите их в колпак для сушки на воздухе в течение 72 часов.
- Установите образцы на алюминиевые заглушки (см. Таблицу материалов), нанеся эпоксидную смолу (см. Таблицу материалов) на плоскую верхнюю поверхность каждой заглушки. Затем аккуратно прикрепите колышки к пням щипцами.
- Металлизируйте образцы золотым напылением EMS950x + 350s (см. Таблицу материалов) в течение 4 мин при давлении аргона 2 x 10−1 бар и токе 20 мА. Выполните соответствующее заземление, покрасив сторону колышка, не подверженную воздействию золота, серебряной краской (см. Таблицу материалов).
- Получение изображений на сканирующем электронном микроскопе с помощью пользовательского интерфейса управления SEM версии 6.28 (см. Таблицу материалов). Напряжение ускорения, используемое в этом исследовании, составляло 15 кВ, а увеличение - 300-кратное и 2000-кратное.
- Конфокальная микроскопия
- Добавьте 200 мкл 1x PBS в три лунки 96-луночной микротитровальной пластины. Перенесите крышку с микропланшета с биопленкой на 96-луночную пластину, содержащую PBS, и оставьте на 10 с, чтобы удалить нейтрализующий бульон Дея-Энгли.
- Готовят растворы флуоресцентных красителей, добавляя 3 мкл зеленого флуоресцентного красителя и 3 мкл красного флуоресцентного красителя (см. Таблицу материалов) к 1 мл стерильной воды.
- Добавьте 200 мкл окрашивающего раствора в одну лунку 96-луночной микротитровальной пластины. Перенесите крышку с пластины микротитра биопленки на 96-луночную пластину, содержащую окрашивающий раствор. Накройте пластину микротитра биопленки алюминиевой фольгой и инкубируйте образец в течение 20-30 минут при комнатной температуре.
- Добавьте 200 мкл стерилизованной воды в лунки 96-луночной микропланшета. Затем перенесите крышку с микропланшета с биопленкой на микропланшет с 96 лунками, содержащий воду, и оставьте его до наблюдения.
- Визуализируйте биопленки, сформированные на колышках, с помощью конфокального лазерного сканирующего микроскопа (см. Таблицу материалов) с 63x/1,40 масляным ДВС-объективом. Получите изображения с помощью соответствующего программного обеспечения (см. Таблицу материалов). Длины волн возбуждения флуоресценции, используемые для зеленых и красных флуоресцентных красителей, составляли 482 нм и 490 нм соответственно.
ПРИМЕЧАНИЕ: Для достижения наилучших результатов вырежьте и поместите колышек в чашку Петри диаметром 60 мм и залейте чашку стерильной водой.
Результаты
Анализ SEM показывает наличие биопленок, продуцируемых P. azotoformans PFl1A, на колышках микропланшетов биопленки (рис. 2A). Можно наблюдать трехмерную структуру биопленки. P. azotoformans PFl1A ранее был идентифицирован как сильный продуцент биопленки (A570 > 1,5) с использован?...
Обсуждение
Анализ MBEC (анализ микропланшетов биопленки) был первым методом, который был признан стандартным тестом на эрадикацию биопленки ASTM17. Наше исследование и другие показали, что при использовании этого анализа есть два критических этапа: этап обработки ультразвуком (время и мо?...
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Это исследование было поддержано Консорциумом исследований и инноваций в области биопроцессов в промышленности Квебека (CRIBIQ) (2016-049-C22), Agropur, Groupe Sani Marc и Советом по естественным наукам и инженерным исследованиям Канады (NSERC) (RDCPJ516460-17). Благодарим Терезу Паникони за критическую рецензию на рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
Ссылки
- Canada's dairy industry at a glance. Canadian Dairy Information Centre Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017)
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. . Science et technologie du lait. 3rd edn. , (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934 (2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921 (2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International Available from: https://www.astm.org/e2562-17.html (2017)
- ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International Available from: https://www.astm.org/e2871-19.html (2019)
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181 (2022).
- ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International Available from: https://www.astm.org/e2799-17.html (2022)
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020 (2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264 (2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212 (2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592 (2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885 (2020).
- Goeres, D. M., Simoes, M., Borges, A., Chaves Simoes, L., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. , 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены