Method Article
シロイヌナズナの高分解能単粒in in vivo花粉水和バイオアッセイ
要約
ここでは、シロイヌナズナの花粉水分補給プロファイルを測定するための改善された方法について説明します。新しい方法は、より高い解像度を提供し、非侵襲的であり、再現性が高いです。このプロトコルは、受粉の初期段階を規制するプロセスをより細かく解剖するための新しいツールを表しています。
要約
顕花植物の有性生殖は、花粉粒と柱頭表面との間の最初の相互作用を必要とし、そこで相互作用するパートナー間で分子対話が確立される。さまざまな種にわたる研究により、一連の分子チェックポイントが花粉と柱頭の相互作用を調節して、互換性のある、一般的に種内花粉のみが受精に成功することを保証することが明らかになりました。モデル植物 シロイヌナズナのような「乾いた柱頭」を持つ種では、受粉後最初の接合前適合性チェックポイントは花粉水分補給の確立です。
受粉のこの段階は厳しく規制されており、花粉粒からの信号が柱頭からの水分の放出を誘発し、花粉の水和を可能にします。花粉の水和を経時的に正確に測定および追跡する能力は、生殖におけるこの重要なステップの調節を理解することを目的とした実験計画の鍵となります。公開されたプロトコルは、親植物から切り取られ、液体または固体培地で維持され、大量受粉された花を頻繁に利用します。
この論文では、個々のA.タリアナ花粉粒の分ごとの水和追跡を可能にする非侵襲的なin vivo受粉バイオアッセイについて説明します。このアッセイは再現性が高く、花粉の水和プロファイルの非常に微妙な変動を検出できるため、受粉を調節する経路に影響を与える変異体の分析に適しています。このプロトコルは、バルク受粉について説明したものよりも長いですが、それが提供する精度と再現性は、そのin vivoの性質とともに、受粉表現型の詳細な解剖に理想的です。
概要
被子植物の有性生殖の成功は、通常、個体内または個体間で、葯から柱頭への種内花粉粒の移動(すなわち受粉)に依存しています。受容的な花への花粉粒のこの移動は、通常、花粉媒介者または非生物的要因によって媒介されます。そのため、これはまた、自然条件下での異種特異的花粉の沈着を頻繁にもたらします。いくつかの例外を除いて、異種特異的花粉による受粉の進行は進化的に不利であり、交配の機会を失うことによって生殖適応度を低下させ、結果として生じるハイブリッド子孫のほとんどは適切に発達しないか、不妊になります1。したがって、メカニズムは、「互換性のない」異種特異的花粉2による受粉をブロックするように進化しました。したがって、互換性のある花粉の迅速な認識は、多くの顕花植物における有性生殖の初期段階において間違いなく最も重要なプロセスです。
柱頭が「乾燥」型であるアブラナ科では、一連の分子チェックポイントが受粉を調節する生殖過程の複数の段階で作用し、互換性のある花粉のみが成功します。花粉の水和は最も重要なチェックポイントの1つです(図1)、水和に失敗した花粉は進行して花粉管を生成し、その後、女性の配偶体に精子を届けることができません。多くの場合、互換性のない穀物はこの最初の受粉チェックポイントを通過できず、したがって柱頭の水にアクセスできません3。アブラナ科のメンバーの間では、花粉の認識が急速に起こり、雌しべ4,5への花粉粒の付着から数分以内に適合性が確立されます。近年、多くの進歩が見られ、主要な受粉チェックポイントを制御する分子メカニズムが理解され始めています。
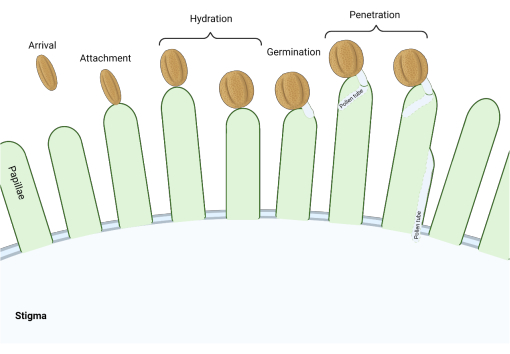
図1:互換性のある受粉中の主要なイベントの概要。花粉の水和や花粉管の発芽などのこれらの段階は、互換性のある受粉を行うためにうまくナビゲートされなければならない受粉の「チェックポイント」でもあります。この図は、アブラナ科の種に典型的な「ドライ」タイプの柱頭を表しています2,20。この図の拡大版を表示するには、ここをクリックしてください。
「自己」花粉が認識され拒絶されるアブラナ属の自己不和合和性(SI)システムに関する先駆的な研究は、アブラナ科の花粉-柱頭認識のパラダイムを確立しました6,7,8,9,10。アブラナ属とその近縁種のSIは、花粉の表面と柱頭の原形質膜に存在する「認識」タンパク質によって媒介され、相互作用すると花粉拒絶を引き起こします。SI花粉除去は、基底花粉-柱頭適合性システムの破壊によって機能し、互換性のある花粉の知覚によって完全に活性化されると、柱頭による標的分泌をもたらし、花粉の水分補給を促進します(花粉適合性メカニズムのレビューについては、11,12を参照)。SIの例では、花粉媒介性リガンドは小さなシステインリッチタンパク質であるS遺伝子座システインリッチ(SCR/SP11)であり、柱頭受容体はS遺伝子座受容体キナーゼ(SRK)です。
最近、システインに富む小さな花粉媒介タンパク質の別のグループであるシロイヌナズナでは、花粉コートタンパク質クラスB(AtPCP-Bs)が、花粉の水和の活性化を通じて花粉受容の重要な調節因子であることが判明しました13。AtPCP-Bsのスティグマ受容体および下流調節経路の態様も最近記載されている14、15。興味深いことに、花粉媒介性および花粉水和のスティグマシグナル伝達メディエーター(AtPCP-Bを含む)をコードする遺伝子の突然変異研究では、花粉の水和チェックポイントへの完全なブロックを持つ植物を生成することができませんでした。これは、他の複数の、まだ発見されていない要因が花粉の水和の調節に役割を果たしていることを強く示唆しています。Wangら13によって最初に記述された方法に基づいて、ここでは、候補変異体A.thaliana系統における微妙な花粉水和欠陥の同定に適した改良された高分解能in vivoバイオアッセイについて説明します。
プロトコル
1.植物の成長と花の準備
- A. thaliana種子を0.1%アガロースまたは滅菌水で4°Cで3日間、または乾燥種子として-20°Cで16〜24時間層別化します(uNASC、パーソナルコミュニケーション)。
- 成層した種子を堆肥の鉢に移し、環境的に制御された成長チャンバーに入れます。蛍光管(130 μmol m-2 s-1)によって提供される16:8時間の明:暗光周期で植物を繁殖させます。温度を21±2°C、相対湿度約40%に維持します。
- 花粉供与者とレシピエントの植物は、他の適切な「防除」植物系統とともに一緒に播種され、同期開花を確実にします。花序が十分に確立されるまで、約6週間植物を繁殖させます。
- 去勢のためのバイオアッセイを実施する1日前に花粉レシピエント植物でステージ12の花芽を選択する16,17-これらは、翌日に開花と葯裂開を完了する未開封の花芽です18。
注:主花序で生成される最初の3つの花は、通常、異常な繁殖行動を示すため、避けてください。利用可能で研究に適した場合は、葯が成熟しない A.タリアナ (アクセッションCol-0)pA9-バルナーゼラインなどの雄の無菌植物系統を使用してください19。 - 花粉レシピエントの花を去勢するには、植物を鉢に入れて横に置きます。去勢される花に近い領域で、実体解剖顕微鏡の下で所定の位置にあるスライドガラスに植物の茎をテープで留めます。
- 先端の細かい鉗子を使用して、花芽を慎重に開き、花びらと葯をすべて取り除きます。雌しべに損傷がなく、柱頭に汚染された花粉がないことを確認してください。
注:雄の無菌植物系統は去勢を必要としません。 - 植物を成長室に戻し、去勢された花が他の植物や異物と接触しないようにします。
2. 花粉水和アッセイ-生データ取得
- 翌朝、成長室から植物を取り除きます。花粉受容植物を横向きに置き、柱頭をはっきりと画像化できるように、倒立顕微鏡のステージ(図2)に花を置きます。
- マスキングテープのストリップを使用して茎をスライドガラスに固定することにより、画像化する花の位置を固定します。温度を18°C〜25°C、相対湿度を60%未満に維持します。
注:pA9-バルナーゼ雄性無菌植物系統の場合、花が開き、花びらが視野を妨げない朝にアッセイを実行するのが最適です。 - 次に、花粉供与体植物から健康で開いたばかりの花を取り除きます。解剖顕微鏡の下に置き、葯にそっと触れて、きれいな細い先端の鉗子の先端にいくつかの花粉粒を集めます(図3A)。短い棒にテープで留められたまつげも、花粉を集めて移動するための効果的なツールです(図3C)。
- 鉗子の先端に花粉粒の単層が形成されるまで、花粉粒が収穫された花の花弁に軽く触れて、鉗子から余分な花粉を取り除きます。
注意: 先端の細かい鉗子の先端にある花粉粒の単層は、後続のステップでの単一穀物の移動を大幅に促進します。また、この手法により鉗子上に1粒の花粉粒を得ることも可能である(補足映像S1)。 - 花粉受容植物に戻り、低倍率対物レンズ(例えば、10倍対物レンズ; 図3B)、受粉する柱頭に倒立顕微鏡を集中させる。
- 鉗子の腕の間の開口部に沿って鉗子を持ち(図4)、受粉していない(「処女」)柱頭乳頭細胞に注意深く近づきます。
注:鉗子を保持するこの方法は、器用さを助け、握手の影響を軽減することがわかりました。マイクロマニピュレーターは、経験の浅いユーザーや、単一の花粉粒を手で正確に塗布するのが難しいユーザーに使用できます。 - 柱頭に移すために鉗子に適切に配置された花粉粒を選択してください。選択した花粉粒がその表面に軽く接触するまで、受粉していない柱頭乳頭細胞に近づき続けます。鉗子をゆっくりと引き出し、花粉の付着を確認します(図5)。
注:補足ビデオS1と補足ビデオS2は、鉗子に単一および複数の花粉粒が存在する状態でこのステップを示しています。 - 花粉粒が赤道軸がはっきりと見え、焦点が合うように向けられていることを確認してください。すぐに高倍率の対物レンズ(20倍など)に切り替えて、花粉粒の画像をキャプチャします。この第1の画像はT=0である。さらに 1 分間隔で合計 10 分間の画像をキャプチャし続けます。
- 必要に応じてフォーカスを調整して、花粉粒または柱頭の小さな動きに対応します。部屋の周囲温度と相対湿度を2分ごとに記録して、実験反復間の将来の比較を可能にします。
- すべての画像がキャプチャされたら、メーカー独自の形式やTIFFなどのロスレス形式で保存します。
注:サンプリングされた花粉粒ごとに11枚の画像があります(補足図S1)。ほとんどの独自の画像取得ソフトウェアの自動/手動タイムラプス取得設定は、各時系列の整理を容易にする便利な機能です。 - 追加の花粉粒について、手順2.4〜2.9を繰り返します。ほぼ同数のコントロール(野生型[WT])と実験的受粉のデータを取得します。

図2:花粉水和バイオアッセイに利用される装置のセットアップ。 この例では、pA9-バルナーゼ雄性無菌植物系統が花粉受容者であった。植物を鉢の中に横向きに置き、茎を顕微鏡のステージに配置されたスライドガラスにテープで留めました。機械的ストレスを軽減し、植物の位置決めを支援するために、植木鉢を支えるために調整可能なプラットフォームが使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
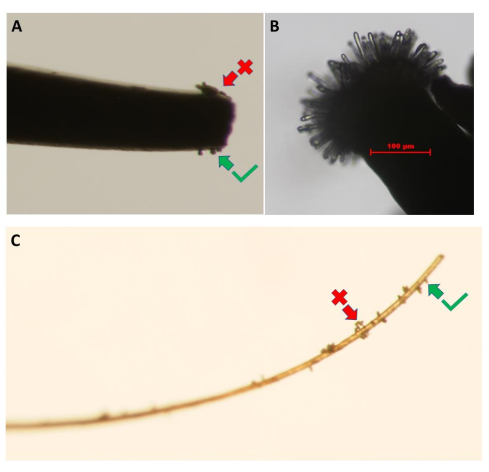
図3:花粉供与体の花からの花粉粒の採取。 画像は、(A)先端の細かい鉗子と(C)まつげの使用を示しています。花粉の塊(赤い矢印)は、花粉粒の単層が得られるまで、ドナーの花の花弁に軽く触れて取り除く必要があります(緑の矢印)。(B)花粉水和バイオアッセイに適した発達段階に達した、受粉していない A.タリアナ (Col-0)pA9-バルナーゼ雄の無菌系統の柱頭の高解像度画像。スケールバー = 100 μm (B)。 この図の拡大版を表示するには、ここをクリックしてください。
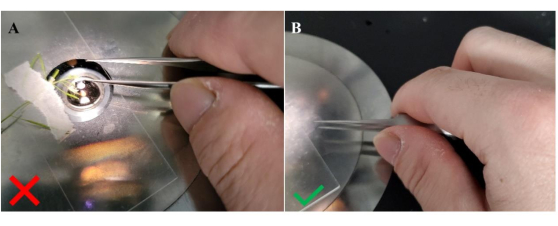
図4:花粉をレシピエントスティグマに移す際の鉗子の保持方法 。 (A)鉗子を保持するための誤った向き。(B)鉗子を保持するための正しい向き。この構成で鉗子を横に保持すると、鉗子の腕の間の親指の位置によって示されるように、受粉していない柱頭乳頭への花粉粒の移動を容易にするための安定性が向上します。 この図の拡大版を表示するには、ここをクリックしてください。
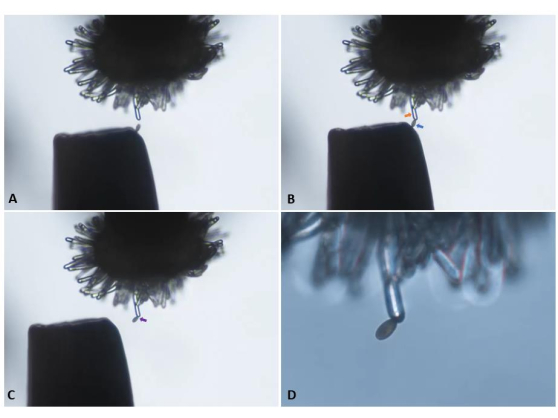
図5:pA9-バルナーゼ雄性無菌植物の受粉していない(「処女」)柱頭細胞への一対の鉗子の先端からの単一の花粉粒の移動 。 (A)乳頭細胞への慎重なアプローチ。(B)適切な位置の花粉粒(青い矢印)の乳頭細胞への付着(オレンジ色の矢印)。(C)鉗子の引き抜きと花粉の付着の目視確認(紫色矢印)。パネル A〜C は、10倍の対物レンズ(10.5 mmの作動距離、0.25の開口数)で撮影され、 補足ビデオS1で提示されたビデオクリップから得られたスナップショットです。(D)20倍の対物レンズ(作動距離2.1mm、開口0.5)に移行し、時系列での画像キャプチャを開始します。 この図の拡大版を表示するには、ここをクリックしてください。
3. 花粉水和アッセイ測定
- 花粉の水和速度を、花粉粒の半短軸(図6)の長さ(赤道半径)の経時変化として定義し、変化率として表します(式[1])。
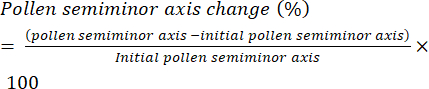 (1)
(1) - 画像解析ソフトを用いて、実験系列の各花粉粒の半短軸値を記録します。
注意: この測定オプションの名前は、「回転楕円」や「5点楕円」などのソフトウェアによって異なります。 - 測定する他のすべての花粉粒について、手順3.1〜3.2を繰り返します。一貫性を保つために、同じ程度のデジタルズームと同じアプローチを適用して、データセット 内のすべての 測定値に「花粉境界」を定義します。
- 時系列のすべての測定が完了したら、各画像スタックの生の半短軸の値をスプレッドシートにエクスポートし、画像スタックごとの列にデータを表示します。各植物系統の分析に少なくとも15の水和花粉粒からのデータが含まれていることを確認してください(補足表S1)。
- 少数の花粉粒が水和に失敗したり、予想よりも大幅にゆっくりと水和したりすることは珍しくありません。これらの「不発」穀物は、穀物と乳頭細胞の間の不十分な接触の結果であるか、花粉の生存率に関連している可能性があります。実験計画で必要でない限り、これらを探してデータセットから除外します。
- プラントラインごとの各時点の平均値を計算します。対応のない t検定と一元配置分散分析を使用して、各時点でのWTおよび変異株からの水分補給データの統計分析を行います。 複数のt検定を使用して、複数の時点にわたるWT系統と変異株の平均を同時に比較します。
注:XYプロットは、比較される植物系統間の花粉水和の全体的な傾向を視覚化するのにも非常に役立ちます。
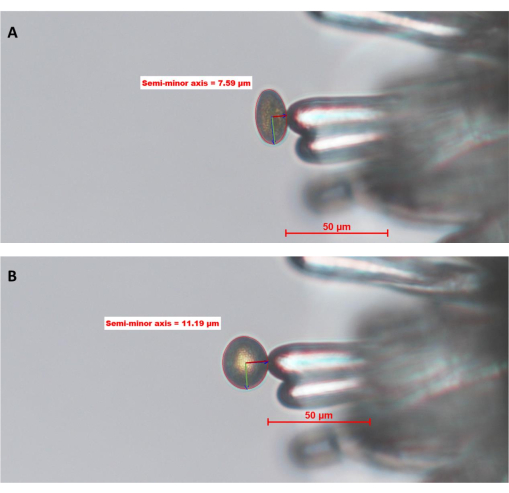
図6: A.タリアナ の柱頭乳頭細胞で水和するWT花粉粒(Col-0;pA9-バルナーゼ雄性無菌系統)。 (A)時点0、0(0マップ)および(B)10マップ。花粉粒の周りの赤い円は、オペレーターが画像解析ソフトを使って定義・描いた「花粉境界」です。花粉の内側の緑と濃い赤の線は、それぞれ半長軸と半短軸を表しています。半短軸の長さは、花粉の水和の程度を計算するために使用されます。このデータセットの完全な時系列は、 補足図S1にあります。画像は20倍の対物レンズ(作動距離2.1 mm、絞り数0.5)で撮影しました。スケールバー = 50 μm。略語:MAP =最小受粉後。 この図の拡大版を表示するには、ここをクリックしてください。
結果
このセクションでは、上記のように収集されたA . thalianaの花粉水分補給データの2つのセット例を紹介します。最初のデータセットは、WT植物の花粉水和時系列の3つの反復で構成され、各複製は異なる日に収集されます。各レプリケートには、18 個以上の個別の花粉粒値が含まれ、3 つのレプリケートすべてで合計 55 個の花粉粒が含まれます。反復間の平均の最小値と最大値は、すべての時点で3%以内でした(図7 および 補足表S1)。WT受粉に関するこれらの代表的なデータは、比較的少ないサンプル数および異なる日にわたってここで詳述した方法論を利用して得られる高度な一貫性を明確に示しています。
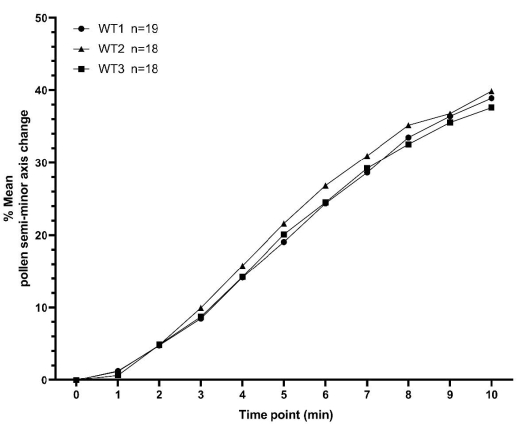
図7:10分間にわたる A.タリアナ 野生型花粉水和プロファイルの一貫性を示すXYプロット。 花粉の親は A.タリアナ のCol-0アクセッションであり、雌しべの親はpA9-バルナーゼ雄の不妊 A.タリアナ (Col-0)系統でした。データは、異なる日に収集された3つの独立したデータセットを表しており、高度な一貫性を示しています。箱とひげ図、およびこれらのデータセットの平均の統計分析は、補足図S2に示されています。各独立データセットで測定された花粉の数('n')は、図の構文(WT1/WT2/WT3)の横に表示されます。略語:WT =野生型。 この図の拡大版を表示するには、ここをクリックしてください。
第2のデータセットは、「ノックダウン」変異を生成する花粉コートタンパク質コード遺伝子にT−DNA挿入を有する植物系統について得られたものであり、本明細書では「KD変異体」という。突然変異花粉は、プロトコルに記載されているように、水和プロファイリングのためにpA9-バルナーゼ雄の無菌柱頭に沈着した。得られたデータ(図8)からわかるように、変異体とWT花粉は、最初の5分間にわたって区別できない水分補給プロファイルを持っていました。しかし、受粉後5-10分(MAP)では、変異花粉の平均半短軸変化がWT花粉に遅れをとり始め、10MAPで統計的に有意になった。この結果は、この花粉コートタンパク質が花粉の水和を媒介する役割を持っていることを示すだけでなく、花粉の水和を追跡するためのこの高分解能の単一穀物バイオアッセイの有用性をうまく示しています。この特定の例では、その感度は、花粉コートタンパク質コード遺伝子の「ノックダウン」の微妙な効果を検出することができました。
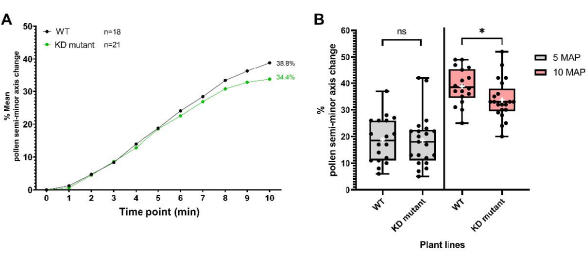
図8:WTおよび「ノックダウン」花粉コートタンパク質変異株(KD変異体)の花粉水和プロファイル 。 (A)WTおよび変異花粉の10分間にわたる水分補給プロファイル。花粉の親は、 A. thaliana のCol-0アクセッションと花粉コートタンパク質KD変異体(同じくCol-0バックグラウンド)でした。どちらの場合も、雌しべの親はpA9-バルナーゼ雄の不妊 A.タリアナ (Col-0)系統でした。(B)WTおよび変異花粉データセットの5 MAPおよび10 MAPにおける花粉の水和の程度(半短軸の変化率の観点から)を示す箱ひげ図およびひげ図。ひげはサンプルの最小値と最大値を表します。ボックスは、データセットの下位四分位数、中央値、および上位四分位数を表します。白い十字はデータセットの平均を表します。対応のない t検定分析は、花粉の水和の平均割合が10 MAPで2つの植物系統間で有意に異なることを示しています。1つのアスタリスクは 、p < 0.05(対応のない t検定)を示します。略語:WT =野生型;KD = ノックダウン;MAP =受粉後の最小。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:pA9-バルナーゼ雄性無菌植物の柱頭乳頭細胞で10分間にわたって水和するWT花粉粒のトリミングされた花粉水和バイオアッセイ時系列。 画像は1分間隔で撮影した。0 MAPと10 MAPの画像を 図6 (別売り)で使用した。スケールバー = 50 μm。略語:WT =野生型;MAP =受粉後の最小。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:図 7で説明した3つのWT花粉データセットの10分間にわたる花粉の水和の程度(半短軸の変化率の観点から)を示す箱ひげ図。 雌しべの親はpA9-バルナーゼ雄の不妊 A.タリアナ (Col-0)系統であった。ひげはサンプルの最小値と最大値を表します。ボックスは、データセットの下位四分位数 (下ヒンジ)、中央値 (中央ヒンジ)、および上位四分位数 (上ヒンジ) を表します。個々のデータポイントが表示されます。一元配置分散分析では、3 つのデータセット間の花粉水分補給値の平均割合が、10 分間にわたって統計的に有意に異ならなかったことが示されています。有意なしきい値は p < 0.05(一元配置分散分析)です。略語:WT =野生型。 このファイルをダウンロードするには、ここをクリックしてください。
補足表S1:図7(pA9-バルナーゼ雄無菌柱頭上のA.タリアナWT Col-0花粉)を構築するために使用された生花粉水和データ。このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオS1:鉗子の先端にある単一のWT(Col-0アクセッション)花粉粒を「処女」柱頭乳頭細胞(pA9-バルナーゼ男性無菌系統)に移す様子を示すビデオ。 ビデオのアクセシビリティを容易にするために、画質は意図的に低下しました。 このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオS2:鉗子の先端にある花粉粒の単層から「処女」柱頭乳頭細胞(pA9-バルナーゼ雄無菌系統)への単一のWT(Col-0アクセッション)花粉の移動を示すビデオ。 ビデオのアクセシビリティを容易にするために、画質は意図的に低下しました。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
開花植物にとって、有性生殖のごく初期の段階は間違いなく最も重要です。花粉と柱頭の相互作用のレベルでは、相互作用するパートナーの「適合性」を決定する分子決定が行われます。このような決定は、正しく行われれば、生殖適応度に影響を与える可能性のある資源の浪費を回避できます21。したがって、互換性のある花粉だけが受精を行うことを許可することは、よく適応した遺伝子型を維持するための重要な要素の1つであり、したがって種の進化的成功です。モデル植物 A. thaliana を用いた研究は、このプロセスの理解を深める上で非常に貴重でした。過去数十年にわたる多くの研究により、花粉が柱頭の水にアクセスして花粉の水和を可能にする最初の互換性「チェックポイント」で作用する花粉コートの要因の存在が明らかになりました13。花粉と柱頭の適合性を調節するメカニズムに関するこれらの最初の洞察にもかかわらず、このプロセスの理解にはまだ多くのギャップがあります。今日まで、花粉媒介性リガンドまたは柱頭受容体の変異体は、花粉の水和に影響を与えることが知られており、互換性のある受粉を完全にブロックすることはできず、他の未発見の花粉水和決定基の存在を示唆しています。ここで説明する花粉水和バイオアッセイは、目的の表現型を容易に観察できるため、受粉を調節する潜在的な変異体を研究するための最も簡単な手法の1つです。
花粉の水和を測定するための既存の方法論は、一般にバルク受粉を利用し、より少ない時点を報告する14,22,23、したがって、重要な微妙な水和プロファイル表現型を見逃す可能性がある。例えば、Wangらによる研究13は、私たちの研究室の他の花粉コートタンパク質変異体に関する研究(未発表の観察)とともに、変異体間の水和プロファイルの興味深い違いを明らかにしました。このような微妙な違いは、互換性のある受粉の根底にある調節メカニズムへの重要な手がかりを保持する可能性があります。
ここで説明する方法は、データセット内の変動を減らすための方法論的精度に重点を置いて、変異株とWT植物系統の間の比較的少数の測定値の取得に焦点を当てています。この方法は再現性が高いですが( 図7を参照)、温度と湿度が適切に制御されていると仮定すると、変動の可能性をさらに減らすために、同じ日にほぼ同数のWTと変異花粉の水和データを収集することが重要です。その後、必要に応じて異なる日にデータをプールできます。さらに、適切なWTコントロールプラントを選択することは、水和結果を正しく解釈するために不可欠です。花粉レシピエントの場合、WTコントロールと変異花粉粒の両方を受け取るために同じ植物ラインを使用する必要があります。
たとえば、T-DNA花粉変異株(図8に示す「KD」変異株など)を調査する際に、WT(対照)および変異体(実験的)花粉の両方の花粉受容者として、ビデオプロトコルにも搭載されているpA9-バルナーゼ雄性無菌植物株を使用します。去勢する必要のないそのような男性の無菌ラインからのデータと手動で去勢されたコントロールラインから収集されたデータの混合は、これらの柱頭が異なる動作をする可能性が高いため、避ける必要があります。同様に、去勢された変異株は、可能な限り去勢されたWT(対照)系統と組み合わせて使用 する必要があります。.研究中の植物の遺伝的背景を考慮するときも同じ注意が適用されるべきです。最も一般的なT-DNA変異体コレクションはCol-0バックグラウンドで生成されましたが、InraのFLAGコレクションなどの他のコレクションは、Wassilewskija(WS)の遺伝的背景24,25で利用できます。このような場合は、それぞれのエコタイプのWTプラントラインをコントロールとして使用することをお勧めします。
ここでは、花粉とスティグマの相互作用の最初の10分間の花粉水和に焦点を当てましたが、この方法は、より長い期間をカバーする水和プロファイルを包含するように適用することもできます。プロトコルの重要な特徴は、花が親植物に付着したままであることである-現在公開されているプロトコルは、典型的には、実験の期間中、組織を維持するために雌しべの切除および培地への配置を必要とする14、18、26。このような半in vivoアプローチが花粉の水和に影響を与えるか、実際にこのプロセスのin vivo調節を変化させることを示唆する直接的な証拠はありませんが、親植物からの花の切除が受粉に影響を与える可能性があると考えられます。したがって、このプロトコルは、植物の構造的完全性が維持される花粉-柱頭相互作用の研究のための真のin vivo環境を達成する。
単一の花粉粒を「処女」柱頭乳頭に移すことは、間違いなくこのプロトコルで説明されている最も困難な操作の1つです。誤って花粉粒のクラスターを転送することは珍しくありません。ただし、鉗子に花粉の単層のみが存在するようにすることで、これが発生する可能性を大幅に減らすことができます(図3A)(または単一の花粉粒; 図5)、および/または鉗子の先端で他の花粉粒から「突き出ている」ように、すでに配向している花粉粒を利用することによって。経験豊富なオペレーターは、約3分で単一の花粉の柱頭細胞への移動を正常に完了し、1時間で最大5つの花粉粒のデータを記録することができることがわかりました。したがって、2〜4日間にわたって、研究中の植物系統の意味のある統計分析に十分なデータを蓄積することができる。
ヒューマンエラーは、このプロトコルを利用した研究から得られたデータセットの分析における変動の最大の原因となる可能性があります。例えば、画像解析における「花粉境界」の定義は、個々の研究者の判断に委ねられています。したがって、同じデータセットであっても、異なる研究者によって行われた測定が変動を生成する可能性があります。可能な限り、サンプリング誤差を最小限に抑えるために、1人の研究者が測定を実行する必要があります。さらに、同じ演算子によるWTデータセットと変異データセットの分析を組み合わせると、「花粉境界」と演算子間の変動の潜在的に主観的な定義が否定されます。
結論として、モデル生物 A. thaliana の花粉水和プロファイルを測定するための洗練された正確な方法が説明されています。このプロトコルを利用することで、 一貫性の高いA. thaliana の花粉水分補給データを容易に取得できることを実証しました。異なる日に取得されたWT受粉のデータの3つの独立したバッチは、すべての時点で<3%の一貫した小さな偏差を示しました(図7 および 補足表S1)。ここで紹介するバイオアッセイは、既存のほとんどのプロトコルよりもわずかに複雑ですが、生成されたデータの分解能は優れており、互換性のある受粉を調節する経路に影響を与える新規変異体の同定と特性評価に適しています。
開示事項
著者には、宣言する利益相反はありません。
謝辞
この研究は、バース大学(バース大学、バース、英国、BA2 7AY)のY.-L.L.への大学院奨学金によって支援されました。 図1 は BioRender.com(https://biorender.com/)で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| pA9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | uNASC | N70000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
参考文献
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O'Malley, R. C., Barragan, C. C., Ecker, J. R. A user's guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved