Method Article
Ein hochauflösender Einzelkorn-In-vivo-Pollenhydratations-Bioassay für Arabidopsis thaliana
In diesem Artikel
Zusammenfassung
Eine verbesserte Methode zur Messung von Pollenhydratationsprofilen in Arabidopsis thaliana wird hier beschrieben. Die neue Methode bietet eine höhere Auflösung, ist nicht-invasiv und sehr gut reproduzierbar. Das Protokoll stellt ein neues Werkzeug dar, um die Prozesse, die die frühen Stadien der Bestäubung regulieren, genauer zu analysieren.
Zusammenfassung
Die sexuelle Fortpflanzung bei Blütenpflanzen erfordert eine anfängliche Interaktion zwischen dem Pollenkorn und der Narbenoberfläche, bei der ein molekularer Dialog zwischen den Interaktionspartnern hergestellt wird. Studien an einer Reihe von Arten haben gezeigt, dass eine Reihe von molekularen Kontrollpunkten die Interaktion zwischen Pollen und Narbe regulieren, um sicherzustellen, dass nur kompatible, in der Regel intraspezifische Pollen erfolgreich befruchtet werden können. Bei Arten, die eine "trockene Narbe" besitzen, wie z. B. die Modellpflanze Arabidopsis thaliana, ist der erste Kontrollpunkt für die präzygote Kompatibilität nach der Bestäubung die Etablierung der Pollenhydratation.
Diese Phase der Bestäubung ist streng reguliert, wobei Signale aus dem Pollenkorn die Freisetzung von Wasser aus der Narbe hervorrufen und so die Pollenhydratation ermöglichen. Die Fähigkeit, die Pollenhydratation im Laufe der Zeit genau zu messen und zu verfolgen, ist der Schlüssel für die Planung von Experimenten, die darauf abzielen, die Regulierung dieses kritischen Schritts der Fortpflanzung zu verstehen. In den veröffentlichten Protokollen werden häufig Blüten verwendet, die von der Mutterpflanze entfernt, auf flüssigen oder festen Medien gepflegt und in großen Mengen bestäubt wurden.
In dieser Arbeit wird ein nicht-invasiver, in vivo Bestäubungs-Bioassay beschrieben, der eine minutiöse Hydratationsverfolgung einzelner A. thaliana-Pollenkörner mit hoher Auflösung ermöglicht . Der Assay ist hochgradig reproduzierbar, in der Lage, sehr subtile Variationen von Pollenhydratationsprofilen zu erkennen, und eignet sich daher für die Analyse von Mutanten, die Signalwege beeinflussen, die die Bestäubung regulieren. Obwohl das Protokoll länger ist als die für Massenbestäubungen beschriebenen, ist es aufgrund seiner Präzision und Reproduzierbarkeit sowie seiner In-vivo-Natur ideal für die detaillierte Analyse von Bestäubungsphänotypen.
Einleitung
Eine erfolgreiche sexuelle Fortpflanzung bei Angiospermen beruht in der Regel auf der Übertragung intraspezifischer Pollenkörner von der Antheren auf die Narbe, entweder innerhalb oder zwischen Individuen (d. h. Bestäubung). Diese Übertragung von Pollenkörnern auf eine empfängliche Blüte wird in der Regel durch Bestäuber oder abiotische Faktoren vermittelt. Dies führt auch häufig zur Ablagerung heterospezifischer Pollen unter natürlichen Bedingungen. Mit wenigen Ausnahmen ist das Fortschreiten der Bestäubung durch heterospezifische Pollen evolutionär nachteilig, da sie die Fortpflanzungsfähigkeit durch verlorene Paarungsmöglichkeiten verringert, wobei sich die meisten daraus resultierenden Hybridnachkommen entweder nicht angemessen entwickeln oder steril sind1. So haben sich Mechanismen entwickelt, die die Bestäubung durch "inkompatible" heterospezifische Pollenblockieren 2. Die schnelle Erkennung kompatibler Pollen ist daher bei vielen Blütenpflanzen wohl der wichtigste Prozess in den frühen Stadien der sexuellen Fortpflanzung.
In der Familie der Kreuzblütengewächse, wo die Narben vom "trockenen" Typ sind, wirken eine Reihe von molekularen Kontrollpunkten in mehreren Stadien des Fortpflanzungsprozesses, die die Bestäubung regulieren, so dass nur kompatibler Pollen erfolgreich ist. Die Pollenhydratation ist einer der wichtigsten Kontrollpunkte (Abbildung 1), da Pollen, die nicht hydratisiert werden, nicht dazu fortschreiten können, einen Pollenschlauch zu produzieren und anschließend Spermien an den weiblichen Gametophyten abzugeben. Häufig passieren unverträgliche Körner diesen ersten Bestäubungskontrollpunkt nicht und erhalten daher keinen Zugang zu stigmatischem Wasser3. Bei Mitgliedern der Familie der Kreuzblütengewächse erfolgt die Erkennung von Pollen schnell, wobei die Kompatibilität innerhalb von Minuten nach dem Anheften des Pollenkorns an den Stempel hergestellt wird 4,5. In den letzten Jahren wurden große Fortschritte erzielt, und wir beginnen nun, die molekularen Mechanismen zu verstehen, die wichtige Kontrollpunkte bei der Bestäubung regulieren.
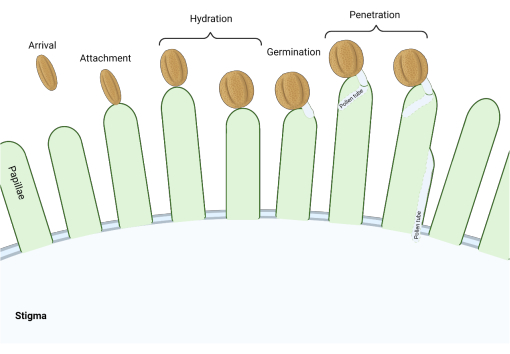
Abbildung 1: Überblick über die wichtigsten Ereignisse während der kompatiblen Bestäubung. Diese Phasen, wie z. B. die Pollenhydratation und die Keimung von Pollenschläuchen, sind ebenfalls "Kontrollpunkte" bei der Bestäubung, die erfolgreich umgangen werden müssen, um eine kompatible Bestäubung zu erreichen. Das Diagramm stellt eine "trockene" Typnarbe dar, die typisch für Arten aus der Familie der Kreuzblütlerist 2,20. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Bahnbrechende Forschungen über das Brassica-Selbstinkompatibilitätssystem (SI), bei dem "eigener" Pollen erkannt und zurückgewiesen werden, etablierten das Paradigma für die Erkennung von Pollen-Stigmata bei Brassicaceae 6,7,8,9,10. SI in Brassica und seinen Verwandten wird durch "Erkennungs"-Proteine vermittelt, die sich auf der Oberfläche von Pollen und an der stigmatischen Plasmamembran befinden und bei Wechselwirkung zur Pollenabstoßung führen. Die Abstoßung von SI-Pollen erfolgt durch eine Störung des basalen Pollen-Narben-Kompatibilitätssystems, das, wenn es vollständig durch die Wahrnehmung kompatibler Pollen aktiviert wird, zu einer gezielten Sekretion durch die Narbe führt und so die Pollenhydratation antreibt (für eine Überprüfung des Pollenkompatibilitätsmechanismus siehe11, 12). Im Beispiel von SI ist der pollengetragene Ligand ein kleines Cystein-reiches Protein, S-Locus Cystein-reich (SCR/SP11), und der stigmatische Rezeptor ist die S-Locus-Rezeptorkinase (SRK).
Kürzlich wurde in Arabidopsis thaliana eine weitere Gruppe kleiner Cystein-reicher pollengetragener Proteine, Pollenmantelproteinklasse B (AtPCP-Bs), als wichtige Regulatoren der Pollenakzeptanz durch die Aktivierung der Pollenhydratation identifiziert13. Stigmatische Rezeptoren der AtPCP-Bs und Aspekte des nachgeschalteten Regulationsweges wurden ebenfalls kürzlich beschrieben14,15. Interessanterweise haben Mutationsstudien von Genen, die potentielle pollengetragene und stigmatische Signalvermittler der Pollenhydratation kodieren (einschließlich AtPCP-Bs), keine Pflanzen erzeugt, die eine vollständige Blockade des Pollenhydratations-Checkpoints aufweisen. Dies deutet stark darauf hin, dass mehrere andere, noch unentdeckte Faktoren eine Rolle bei der Regulierung der Pollenhydratation spielen. Aufbauend auf der zuerst von Wang et al.13 beschriebenen Methode beschreiben wir hier einen verbesserten hochauflösenden in vivo Bioassay, der für die Identifizierung subtiler Pollenhydratationsdefekte in Kandidatenmutanten von A. thaliana geeignet ist.
Protokoll
1. Pflanzenwachstum und Vorbereitung der Blüten
- Stratifizieren Sie A. thaliana-Samen in 0,1%iger Agarose oder sterilem Wasser für 3 Tage bei 4 °C oder als trockenes Saatgut für 16-24 h bei -20 °C (uNASC, persönliche Mitteilung).
- Übertragen Sie die geschichteten Samen in Töpfe mit Kompost und stellen Sie sie in eine kontrollierte Wachstumskammer. Vermehren Sie Pflanzen mit einer 16:8 h, Hell:Dunkel-Photoperiode, die durch Leuchtstoffröhren (130 μmol m-2 s-1) bereitgestellt wird. Halten Sie die Temperatur bei 21 ± 2 °C bei ca. 40 % relativer Luftfeuchtigkeit.
- Stellen Sie sicher, dass Pollenspender- und Empfängerpflanzen zusammen mit anderen geeigneten "Kontroll"-Pflanzenlinien zusammen gesät werden, um eine synchrone Blüte zu gewährleisten. Vermehren Sie die Pflanzen etwa 6 Wochen lang, bis sich die Blütenstände gut etabliert haben.
- Wählen Sie 12 Blütenknospen der Pollenempfängerpflanze 1 Tag vor der Durchführung des Bioassays für die Entmannung 16,17 aus - dies sind ungeöffnete Blütenknospen, die am folgenden Tag die Blütenöffnung und die Antherendehiszenz abschließen18.
HINWEIS: Vermeiden Sie die ersten drei Blüten, die am Hauptblütenstand produziert werden, da diese typischerweise ein ungewöhnliches Fortpflanzungsverhalten aufweisen. Falls verfügbar und für die Studie geeignet, verwenden Sie eine männliche sterile Pflanzenlinie, wie z. B. die pA9-Barnase-Linie von A. thaliana (accession Col-0), bei der die Staubbeutel nicht reifen19. - Um die Blüten des Pollenempfängers zu entmannen, legen Sie die Pflanze in ihren Topf auf die Seite. Kleben Sie den Pflanzenstängel in der Nähe der Blüten, die entmannt werden sollen, auf einen Objektträger, der unter einem Stereo-Seziermikroskop in Position ist.
- Ziehen Sie die Blütenknospe mit einer Pinzette mit feiner Spitze vorsichtig auf und entfernen Sie alle Blütenblätter und Staubbeutel. Stellen Sie sicher, dass der Stempel unbeschädigt ist und dass die Narbe frei von kontaminierenden Pollen ist.
Anmerkungen: Männliche sterile Pflanzenlinien erfordern keine Entmannung. - Bringen Sie die Pflanzen zurück in die Wachstumskammer und stellen Sie sicher, dass die entmannten Blüten nicht mit anderen Pflanzen oder Fremdkörpern in Kontakt kommen.
2. Pollenhydratations-Assay-Rohdatenerfassung
- Nehmen Sie die Pflanzen am nächsten Morgen aus der Wachstumskammer. Legen Sie die Pollenempfängerpflanze auf die Seite und positionieren Sie die Blüte auf dem Tisch eines inversen Mikroskops (Abbildung 2), so dass die Narbe deutlich abgebildet werden kann.
- Fixieren Sie die Position der abzubildenden Blume, indem Sie den Stiel mit Klebeband auf einem Objektträger fixieren. Halten Sie die Temperatur zwischen 18 °C und 25 °C und die relative Luftfeuchtigkeit unter 60 %.
HINWEIS: Für die pA9-barnase männliche sterile Pflanzenlinie ist es optimal, den Test morgens durchzuführen, wenn sich die Blüten öffnen und die Blütenblätter das Sichtfeld nicht behindern. - Als nächstes entfernst du eine gesunde und frisch geöffnete Blüte von der Pollenspenderpflanze. Legen Sie es unter ein Präpariermikroskop und sammeln Sie ein paar Pollenkörner an der Spitze einer sauberen Pinzette mit feiner Spitze, indem Sie die Staubbeutel vorsichtig berühren (Abbildung 3A). Eine Wimper, die an einen kurzen Stab geklebt wird, ist ebenfalls ein wirksames Hilfsmittel zum Sammeln und Übertragen von Pollen (Abbildung 3C).
- Entfernen Sie überschüssigen Pollen von der Pinzette, indem Sie sie leicht gegen die Blütenblätter der Blüten berühren, von denen die Pollenkörner geerntet wurden, bis sich an der Spitze der Pinzette eine Monoschicht aus Pollenkörnern bildet.
Anmerkungen: Eine Monoschicht aus Pollenkörnern an der Spitze einer Pinzette mit feiner Spitze erleichtert den Einzelkorntransfer in nachfolgenden Schritten erheblich. Es ist auch möglich, mit dieser Technik ein einzelnes Pollenkorn auf der Pinzette zu erhalten (Ergänzungsvideo S1). - Kehren Sie zur Pollenempfängerpflanze zurück und verwenden Sie eine Objektivlinse mit geringer Leistung (z. B. 10-fach Objektiv; Abbildung 3B), fokussieren Sie das inverse Mikroskop auf die zu bestäubende Narbe.
- Halten Sie die Pinzette entlang der Öffnung zwischen den Armen der Pinzette (Abbildung 4) und nähern Sie sich vorsichtig einer unbestäubten ("jungfräulichen") stigmatischen Papillenzelle.
HINWEIS: Wir haben festgestellt, dass diese Methode zum Halten der Pinzette die Geschicklichkeit fördert und die Auswirkungen des Händeschüttelns reduziert. Ein Mikromanipulator kann für Benutzer verwendet werden, die weniger erfahren sind oder Schwierigkeiten haben, ein einzelnes Pollenkorn präzise von Hand aufzutragen. - Wählen Sie ein geeignetes Pollenkorn auf der Pinzette für die Übertragung auf die Narbe aus. Nähern Sie sich der unbestäubten Narbenpapillenzelle, bis das ausgewählte Pollenkorn leichten Kontakt mit ihrer Oberfläche hat. Ziehen Sie die Pinzette langsam zurück und bestätigen Sie die Pollenanhaftung (Abbildung 5).
HINWEIS: Das ergänzende Video S1 und das ergänzende Video S2 demonstrieren diesen Schritt sowohl mit einzelnen als auch mit mehreren Pollenkörnern, die auf der Pinzette vorhanden sind. - Achten Sie darauf, dass das Pollenkorn so ausgerichtet ist, dass seine Äquatorachse gut sichtbar und scharf ist. Wechseln Sie sofort zu einem Objektiv mit höherer Leistung (z. B. 20x) und nehmen Sie ein Bild des Pollenkorns auf. Dieses erste Bild ist T = 0. Nehmen Sie weitere Bilder in 1-Minuten-Intervallen für insgesamt 10 Minuten auf.
- Passen Sie den Fokus nach Bedarf an, um kleine Bewegungen im Pollenkorn oder in der Narbe zu berücksichtigen. Zeichnen Sie alle 2 Minuten die Umgebungstemperatur und die relative Luftfeuchtigkeit des Raums auf, um zukünftige Vergleiche zwischen experimentellen Wiederholungen zu ermöglichen.
- Sobald alle Bilder aufgenommen wurden, speichern Sie sie in einem verlustfreien Format, z. B. im proprietären Format des Herstellers oder als TIFFs.
HINWEIS: Pro Pollenkorn werden 11 Bilder aufgenommen (ergänzende Abbildung S1). Die automatisierten/manuellen Einstellungen für die Zeitrafferaufnahme in den meisten proprietären Bilderfassungsprogrammen sind nützliche Funktionen, um die Organisation der einzelnen Zeitreihen zu erleichtern. - Wiederholen Sie die Schritte 2.4 bis 2.9 für weitere Pollenkörner. Erfassen Sie Daten für eine nahezu gleiche Anzahl von Kontroll- (Wildtyp [WT]) und experimentellen Bestäubungen.

Abbildung 2: Geräteaufbau für den Pollenhydratations-Bioassay. In diesem Beispiel war eine männliche sterile pA9-Barnase-Pflanzenlinie der Pollenempfänger. Die Pflanze wurde in ihrem Topf auf die Seite gelegt und der Stiel an einen Glasobjektträger geklebt, der auf dem Tisch des Mikroskops positioniert war. Um die mechanische Belastung zu reduzieren und die Positionierung der Pflanze zu erleichtern, wurde eine verstellbare Plattform zur Abstützung des Pflanztopfes verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
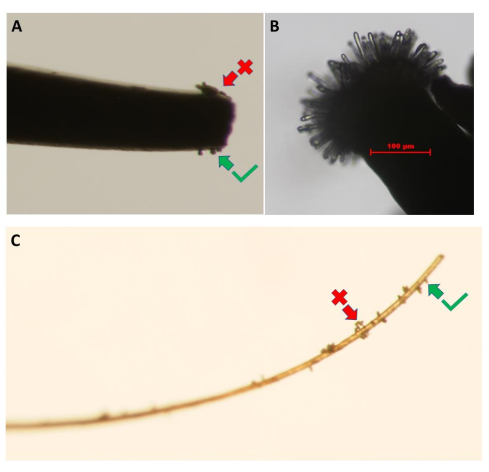
Abbildung 3: Sammlung von Pollenkörnern aus der Pollenspenderblüte. Die Bilder zeigen die Verwendung von (A) einer Pinzette mit feiner Spitze und (C) einem Stück Wimpern. Pollenklumpen (roter Pfeil) sollten durch leichtes Berühren der Blütenblätter der Spenderblüten entfernt werden, bis eine Monoschicht aus Pollenkörnern entsteht (grüner Pfeil). (B) Hochauflösendes Bild einer unbestäubten A. thaliana (Col-0) pA9-Barnase-Narbe der männlichen sterilen Linie, die das entsprechende Entwicklungsstadium für den Pollenhydratations-Bioassay erreicht hat. Maßstabsbalken = 100 μm (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
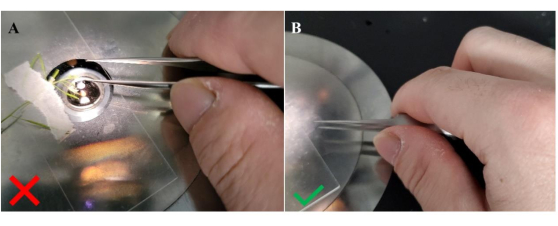
Abbildung 4: Verfahren zum Halten der Pinzette bei der Übertragung von Pollen auf die Empfängernarbe. (A) Falsche Ausrichtung zum Halten der Pinzette; (B) Richtige Ausrichtung zum Halten der Pinzette. Das seitliche Halten der Pinzette in dieser Konfiguration, was durch die Position des Daumens zwischen den Armen der Pinzette angezeigt wird, sorgt für eine größere Stabilität, um die Übertragung von Pollenkörnern auf unbestäubte Narbenpapillen zu erleichtern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
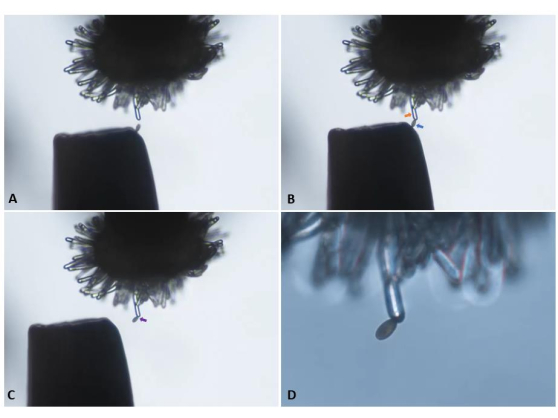
Abbildung 5: Übertragung eines einzelnen Pollenkorns von der Spitze einer Pinzette auf eine unbestäubte ("jungfräuliche") stigmatische Papillenzelle einer männlichen sterilen pA9-Barnase-Pflanze. (A) Sorgfältige Annäherung an die Papillenzelle. (B) Anheftung eines entsprechend positionierten Pollenkorns (blauer Pfeil) an die Papillenzelle (orangefarbener Pfeil). (C) Rückzug der Pinzette und visuelle Bestätigung des Pollenansatzes (violetter Pfeil). Die Panels A-C wurden mit einem 10-fachen Objektiv (10,5 mm Arbeitsabstand; 0,25 numerische Apertur) aufgenommen und sind Schnappschüsse, die aus dem im Ergänzungsvideo S1 präsentierten Videoclip abgeleitet wurden. (D) Übergang zu einem 20-fach-Objektiv (2,1 mm Arbeitsabstand; 0,5 numerische Apertur) zur Initiierung der Bildaufnahme in einer Zeitreihe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Pollenhydratations-Assay-Messungen
- Definieren Sie die Rate der Pollenhydratation als die Längenänderung der kleinen Halbachse (Abbildung 6) des Pollenkorns (d. h. des Äquatorradius) im Laufe der Zeit und stellen Sie sie als prozentuale Änderung dar (Gleichung [1]):
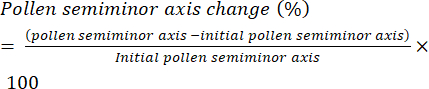 (1)
(1) - Zeichnen Sie mit einer Bildanalysesoftware die Werte der kleinen Halbachse für jedes Pollenkorn in der Versuchsreihe auf.
HINWEIS: Der Name dieser Messoption ist softwareabhängig, z. B. "Gedrehte Ellipse" oder "5-Punkt-Ellipse". - Wiederholen Sie die Schritte 3.1-3.2 für alle anderen zu messenden Pollenkörner. Wenden Sie aus Gründen der Konsistenz den gleichen Grad an Digitalzoom und den gleichen Ansatz zur Definition der "Pollengrenze" für alle Messungen in den Datensätzen an.
- Sobald alle Messungen für eine Zeitreihe abgeschlossen sind, exportieren Sie die Rohwerte der kleinen Halbachsen jedes Bildstapels in eine Tabelle und stellen Sie die Daten in Spalten pro Bildstapel dar. Es ist sicherzustellen, dass die Daten von mindestens 15 hydratisierten Pollenkörnern in die Analyse für jede Pflanzenlinie einbezogen werden (Ergänzungstabelle S1).
- Es ist nicht ungewöhnlich, dass eine kleine Anzahl von Pollenkörnern nicht oder deutlich langsamer hydratisiert wird als erwartet. Diese "Blindgänger"-Körner können das Ergebnis eines schlechten Kontakts zwischen dem Korn und der Papillenzelle sein oder mit der Lebensfähigkeit der Pollen zusammenhängen. Suchen Sie nach diesen und schließen Sie sie aus dem Datensatz aus, es sei denn, sie sind in ihrem Versuchsplan erforderlich.
- Berechnen Sie die Mittelwerte für jeden Zeitpunkt pro Anlagenlinie. Verwenden Sie ungepaarte t-Tests und einfaktorielle ANOVA für die statistische Analyse von Hydratationsdaten aus WT- und Mutantenlinien zu jedem Zeitpunkt. Verwenden Sie einen multiplen t-Test für den gleichzeitigen Vergleich der Mittelwerte zwischen WT- und Mutantenlinien über mehrere Zeitpunkte hinweg.
HINWEIS: XY-Diagramme sind auch sehr nützlich, um den Gesamttrend der Pollenhydratation zwischen den verglichenen Pflanzenlinien zu visualisieren.
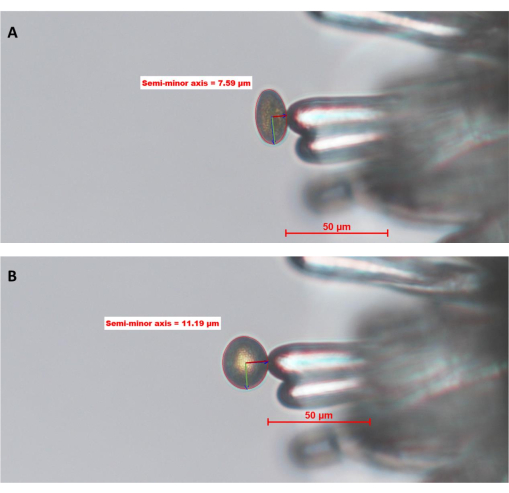
Abbildung 6: WT-Pollenkornhydratisierung auf einer stigmatischen Papillenzelle von A. thaliana (Col-0; pA9-Barnase männliche sterile Linie). (A) Zeitpunkt Null, 0 (0 MAP) und (B) 10 MAP. Der rote Kreis um das Pollenkorn ist die "Pollengrenze", die vom Bediener mit Hilfe einer Bildanalysesoftware definiert und gezeichnet wird. Die grünen und dunkelroten Linien im Inneren des Pollens stellen die große bzw. kleine Halbachse dar. Die Länge der kleinen Halbachse wird verwendet, um den Grad der Pollenhydratation zu berechnen. Eine vollständige Zeitreihe dieses Datensatzes finden Sie in der ergänzenden Abbildung S1. Das Bild wurde mit einem 20-fach Objektiv (2,1 mm Arbeitsabstand; 0,5 numerische Apertur) aufgenommen. Maßstabsbalken = 50 μm. Abkürzung: MAP = min-after-pollination. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
In diesem Abschnitt werden zwei Beispiele für Pollenhydratationsdaten vorgestellt, die wie oben beschrieben für A. thaliana erhoben wurden. Der erste Datensatz besteht aus drei Replikaten einer Pollenhydratations-Zeitreihe für WT-Pflanzen, wobei jedes Replikat an einem anderen Tag gesammelt wird. Jede Replikation enthält nicht weniger als 18 einzelne Pollenkornwerte, insgesamt 55 Pollenkörner in allen drei Replikationen. Die Minimal- und Maximalwerte für die Mittelwerte zwischen den Wiederholungen lagen für alle Zeitpunkte innerhalb von 3 % (Abbildung 7 und ergänzende Tabelle S1). Diese repräsentativen Daten für WT-Bestäubungen zeigen deutlich den hohen Grad an Konsistenz, der mit der hier beschriebenen Methodik für relativ geringe Probenzahlen und über verschiedene Tage hinweg erreicht werden kann.
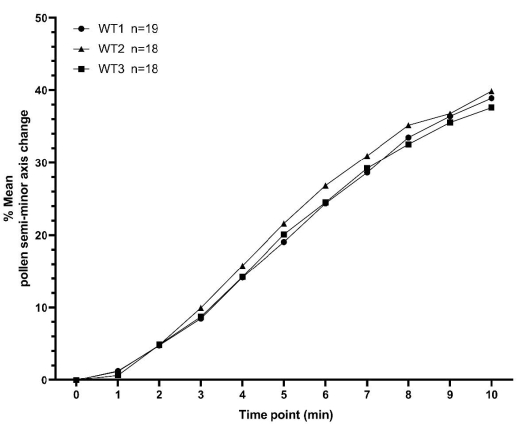
Abbildung 7: XY-Diagramm, das die Konsistenz der Hydratationsprofile von A. thaliana-Wildtyppollen über einen Zeitraum von 10 Minuten zeigt. Der Pollen-Elternteil war der Col-0-Zugang von A. thaliana und der Stempel-Elternteil war der pA9-barnase-männliche sterile A. thaliana (Col-0)-Stamm. Die Daten repräsentieren drei unabhängige Datensätze, die an unterschiedlichen Tagen erhoben wurden, und weisen ein hohes Maß an Konsistenz auf. Ein Box-and-Whisker-Diagramm und eine statistische Analyse der Mittelwerte für diese Datensätze sind in der ergänzenden Abbildung S2 dargestellt. Die Anzahl der gemessenen Pollen ('n') für jeden unabhängigen Datensatz wird neben der Syntax (WT1/WT2/WT3) in der Abbildung angezeigt. Abkürzung: WT = Wildtyp. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Der zweite Datensatz wurde für eine Pflanzenlinie erhalten, die eine T-DNA-Insertion in ein für Pollenhüllenproteine kodierendes Gen enthält, das eine "Knockdown"-Mutation erzeugt, die im Folgenden als "KD-Mutante" bezeichnet wird. Mutierte Pollen wurden auf pA9-barnase männlichen sterilen Narben abgelagert, um ein Hydratationsprofil zu erstellen, wie im Protokoll beschrieben. Wie aus den resultierenden Daten (Abbildung 8) ersichtlich ist, wiesen Mutanten- und WT-Pollen in den ersten 5 Minuten ununterscheidbare Hydratationsprofile auf. 5-10 Minuten nach der Bestäubung (MAP) begann jedoch die mittlere halbkleine Achsenänderung für mutierte Pollen hinter die von WT-Pollen zurückzufallen, wobei der Unterschied bei 10 MAP statistisch signifikant wurde. Dieses Ergebnis zeigt nicht nur, dass dieses Pollenhüllenprotein eine Rolle bei der Vermittlung der Pollenhydratation spielt, sondern veranschaulicht auch den Nutzen dieses hochauflösenden Einzelkorn-Bioassays zur Verfolgung der Pollenhydratation. In diesem speziellen Beispiel war seine Empfindlichkeit in der Lage, den subtilen Effekt eines "Knockdowns" eines Gens zu erkennen, das für das Pollenmantelprotein kodiert.
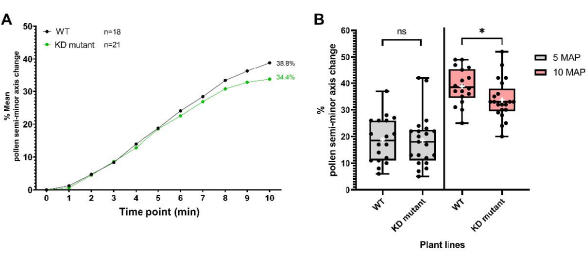
Abbildung 8: Pollenhydratationsprofile für WT und eine "knockdown"-Pollenmantelprotein-Mutantenlinie (KD-Mutante). (A) Hydratationsprofile über einen Zeitraum von 10 Minuten für WT und mutierten Pollen. Die Polleneltern waren der Col-0-Beitritt von A. thaliana und das Pollenhüllenprotein KD-Mutante (ebenfalls im Col-0-Hintergrund). In beiden Fällen war der Stempel die männliche sterile A. thaliana (Col-0) Linie pA9-barnase. (B) Box- und Whisker-Diagramme, die das Ausmaß der Pollenhydratation (in Bezug auf die prozentuale Änderung der kleinen Halbachse) bei 5 MAP und 10 MAP für WT- und mutierte Pollendatensätze zeigen. Whisker stellen die Minimal- und Maximalwerte der Stichprobe dar. Die Felder stellen das untere Quartil, den Median und das obere Quartil des Datasets dar. Weiße Kreuze stellen den Mittelwert des Datensatzes dar. Ungepaarte t-Test-Analysen zeigen, dass sich der mittlere Prozentsatz der Pollenhydratation zwischen den beiden Pflanzenlinien bei 10 MAP signifikant unterscheidet. Ein Sternchen zeigt p < 0,05 (ungepaarter t-Test) an. Abkürzungen: WT = Wildtyp; KD = Knockdown; MAP = min-nach-der Bestäubung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung S1: Eine Zeitreihe eines beschnittenen Pollenhydratations-Bioassays eines WT-Pollenkorns, das auf einer stigmatischen Papillenzelle einer pA9-Barnase-männlichen sterilen Pflanze über einen Zeitraum von 10 min hydratisiert. Die Bilder wurden in Abständen von 1 Minute aufgenommen. Die Bilder bei 0 MAP und 10 MAP wurden in Abbildung 6 (separat beigefügt) verwendet. Maßstabsbalken = 50 μm. Abkürzungen: WT = Wildtyp; MAP = min-nach-der Bestäubung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S2: Box- und Whisker-Diagramm, das das Ausmaß der Pollenhydratation (in Bezug auf die prozentuale Änderung der kleinen Halbachse) über einen Zeitraum von 10 Minuten für die drei in Abbildung 7 beschriebenen WT-Pollendatensätze zeigt. Der Stempel war die männliche sterile Linie von A. thaliana (Col-0) pA9-barnase. Whisker stellen die Minimal- und Maximalwerte der Stichprobe dar. Die Felder stellen das untere Quartil (unteres Scharnier), den Median (mittleres Scharnier) und das obere Quartil (oberes Scharnier) des Datasets dar. Einzelne Datenpunkte werden angezeigt. Die einfaktorielle ANOVA zeigt, dass sich der mittlere Prozentsatz der Pollenhydratationswerte zwischen den drei Datensätzen während des Zeitraums von 10 Minuten statistisch nicht signifikant voneinander unterschied. Der signifikante Schwellenwert liegt bei p < 0,05 (einfaktorielle ANOVA). Abkürzung: WT = Wildtyp. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle S1: Rohdaten zur Pollenhydratation, die zur Konstruktion von Abbildung 7 verwendet wurden (A. thaliana WT Col-0 Pollen auf pA9-barnase männliche sterile Narbe). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video S1: Ein Video, das die Übertragung eines einzelnen WT (Col-0-Akzessions)-Pollenkorns an der Spitze einer Pinzette auf eine "jungfräuliche" stigmatische Papillenzelle (pA9-Barnase männliche sterile Linie) demonstriert. Um die Zugänglichkeit des Videos zu erleichtern, wurde die Bildqualität absichtlich verringert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video S2: Ein Video, das die Übertragung eines einzelnen WT-Pollens (Col-0-Akzession) von einer Monoschicht von Pollenkörnern an der Spitze einer Pinzette auf eine "jungfräuliche" stigmatische Papillenzelle (pA9-Barnase männliche sterile Linie) demonstriert. Um die Zugänglichkeit des Videos zu erleichtern, wurde die Bildqualität absichtlich verringert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Bei Blütenpflanzen sind die sehr frühen Stadien der sexuellen Fortpflanzung wohl die wichtigsten. Auf der Ebene der Pollen-Stigma-Interaktion werden molekulare Entscheidungen getroffen, die die "Kompatibilität" der Interaktionspartner bestimmen. Solche Entscheidungen vermeiden, wenn sie richtig getroffen werden, die Verschwendung von Ressourcen, die sich auf die reproduktive Fitness auswirken könnten21. Daher ist es ein wichtiger Bestandteil, nur kompatible Pollen zur Befruchtung zuzulassen, um gut angepasste Genotypen und damit den evolutionären Erfolg von Arten zu erhalten. Die Forschung mit der Modellpflanze A. thaliana hat sich als äußerst wertvoll erwiesen, um unser Verständnis dieses Prozesses zu vertiefen. Eine Reihe von Studien in den letzten Jahrzehnten hat das Vorhandensein von Faktoren in der Pollenhülle gezeigt, die am ersten Kompatibilitäts-"Checkpoint" wirken, an dem der Pollen Zugang zu narbigmatischem Wasser erhält, um die Pollenhydratation zu ermöglichen13. Trotz dieser ersten Einblicke in die Mechanismen, die die Pollen-Stigma-Kompatibilität regulieren, gibt es noch viele Lücken in unserem Verständnis dieses Prozesses. Bis heute gibt es keine Mutanten von pollenübertragenen Liganden oder Narbenrezeptoren, von denen bekannt ist, dass sie die Pollenhydratation beeinflussen, die kompatible Bestäubung vollständig blockieren können, was auf das Vorhandensein anderer unentdeckter Pollenhydratationsdeterminanten hindeutet. Durch die Möglichkeit, den interessierenden Phänotyp leicht zu beobachten, ist der hier beschriebene Pollenhydratations-Bioassay eine der einfachsten Techniken, um potenzielle Mutanten zu untersuchen, die die Bestäubung regulieren.
Bestehende Methoden zur Messung der Pollenhydratation verwenden in der Regel Massenbestäubungen und melden weniger Zeitpunkte 14,22,23 und können daher wichtige Phänotypen des subtilen Hydratationsprofils übersehen. Zum Beispiel hat die Studie von Wang et al.13 zusammen mit der Arbeit an anderen Pollenhüllenproteinmutanten in unserem Labor (unveröffentlichte Beobachtungen) faszinierende Unterschiede in den Hydratationsprofilen zwischen Mutanten aufgedeckt. Solche feinen Unterschiede könnten wichtige Hinweise auf die Regulationsmechanismen liefern, die der kompatiblen Bestäubung zugrunde liegen.
Die hier beschriebene Methode konzentriert sich auf die Erfassung einer relativ kleinen Anzahl von Messungen zwischen mutierten und WT-Pflanzenlinien, wobei der Schwerpunkt auf methodischer Präzision liegt, um die Variation innerhalb der Datensätze zu reduzieren. Obwohl diese Methode sehr gut reproduzierbar ist (wie in Abbildung 7 dargestellt), ist es unter der Annahme, dass Temperatur und Luftfeuchtigkeit angemessen kontrolliert werden, wichtig, Hydratationsdaten für eine nahezu gleiche Anzahl von WT- und mutierten Pollen am selben Tag zu sammeln, um das Variationspotenzial weiter zu reduzieren. Bei Bedarf können die Daten dann über verschiedene Tage hinweg gepoolt werden. Darüber hinaus ist die Auswahl der geeigneten WT-Kontrollpflanzen entscheidend für die korrekte Interpretation der Hydratationsergebnisse. Für den Pollenempfänger sollte dieselbe Pflanzenlinie verwendet werden, um sowohl WT-Kontroll- als auch mutierte Pollenkörner zu erhalten.
Zum Beispiel verwenden wir bei der Untersuchung von T-DNA-Pollenmutantenlinien (wie der in Abbildung 8 beschriebenen 'KD'-Mutante) die männliche sterile Pflanzenlinie pA9-Barnase, die auch im Videoprotokoll vorgestellt wird, als Pollenempfänger sowohl für WT (Kontroll) als auch für mutierten (experimentellen) Pollen. Die Vermischung von Daten aus einer solchen männlichen sterilen Linie, die nicht entmannt werden muss, mit denen aus einer manuell entmannten Kontrolllinie sollte vermieden werden, da sich diese Narben wahrscheinlich anders verhalten. Ebenso sollten entmannte Mutantenlinien nach Möglichkeit in Verbindung mit einer entmannten WT-(Kontroll-)Linie verwendet werden. Die gleiche Vorsicht ist auch bei der Betrachtung des genetischen Hintergrunds der untersuchten Pflanzen geboten. Während die meisten populären T-DNA-Mutantensammlungen im Col-0-Hintergrund generiert wurden, sind andere, wie z.B. die FLAG-Sammlung des Institut national de la Recherche Agronomique (INRA), im genetischen Hintergrund von Wassilewskija (WS) verfügbar24,25. In solchen Fällen empfiehlt es sich, die WEA-Pflanzenlinien des jeweiligen Ökotyps als Steuerung zu verwenden.
Obwohl wir uns hier auf die Pollenhydratation in den ersten 10 Minuten der Pollen-Narben-Interaktion konzentriert haben, kann diese Methode auch so angepasst werden, dass sie Hydratationsprofile umfasst, die einen längeren Zeitraum abdecken. Ein wesentliches Merkmal des Protokolls ist, dass die Blüten an der Mutterpflanze befestigt bleiben – aktuelle Protokolle erfordern in der Regel die Entfernung des Stempels und die Platzierung in Medien, um das Gewebe für die Dauer des Experiments zu erhalten14,18,26. Obwohl es keine direkten Beweise dafür gibt, dass ein solcher Semi-in-vivo-Ansatz die Pollenhydratation beeinflusst oder sogar die In-vivo-Regulation dieses Prozesses verändert, ist es denkbar, dass das Entfernen der Blüten von der Mutterpflanze die Bestäubung beeinträchtigen könnte. Somit erreicht dieses Protokoll eine echte In-vivo-Umgebung für die Untersuchung der Pollen-Narben-Interaktion, in der die strukturelle Integrität der Pflanze erhalten bleibt.
Die Übertragung einzelner Pollenkörner auf "jungfräuliche" Narbenpapillen ist wohl eine der schwierigsten Operationen, die in diesem Protokoll beschrieben werden. Es ist nicht ungewöhnlich, dass Ansammlungen von Pollenkörnern irrtümlich übertragen werden. Die Wahrscheinlichkeit, dass dies geschieht, kann jedoch erheblich verringert werden, indem sichergestellt wird, dass nur eine Monoschicht Pollen auf der Pinzette vorhanden ist (Abbildung 3A) (oder auch nur ein einzelnes Pollenkorn; Abbildung 5) und/oder durch die Verwendung von Pollenkörnern, die bereits so ausgerichtet sind, dass sie an der Spitze der Pinzette aus anderen "herausragen". Wir haben herausgefunden, dass ein erfahrener Operateur die Übertragung eines einzelnen Pollens auf eine stigmatische Papillenzelle in etwa 3 Minuten erfolgreich abschließen und Daten für bis zu fünf Pollenkörner über einen Zeitraum von 1 Stunde aufzeichnen kann. So können über einen Zeitraum von 2-4 Tagen genügend Daten für eine aussagekräftige statistische Analyse der untersuchten Anlagenlinien gesammelt werden.
Menschliches Versagen ist möglicherweise die größte Variationsquelle bei der Analyse von Datensätzen, die aus Studien stammen, die dieses Protokoll verwenden. So hängt beispielsweise die Definition der "Pollengrenze" bei der Bildanalyse vom Ermessen des einzelnen Forschers ab. Daher besteht die Möglichkeit, dass Messungen, die von verschiedenen Forschern durchgeführt werden, selbst am selben Datensatz, zu Abweichungen führen können. Wo immer möglich, sollte ein einzelner Forscher die Messungen durchführen, um Fehler bei der Probenahme zu minimieren. Darüber hinaus negiert die Kopplung der Analyse von WT- und Mutantendatensätzen durch denselben Operator die potenziell subjektive Definition der "Pollengrenze" und der Interoperator-Variation.
Abschließend wird eine ausgeklügelte und dennoch genaue Methode zur Messung von Pollenhydratationsprofilen im Modellorganismus A. thaliana beschrieben. Wir haben gezeigt, dass durch die Verwendung dieses Protokolls hochkonsistente Pollenhydratationsdaten für A. thaliana leicht erfasst werden können. Drei unabhängige Datenbatches für WT-Bestäubungen, die an verschiedenen Tagen aufgenommen wurden, zeigten konsistente kleine Abweichungen von <3 % über alle Zeitpunkte hinweg (Abbildung 7 und ergänzende Tabelle S1). Obwohl der hier vorgestellte Bioassay etwas komplexer ist als die meisten existierenden Protokolle, ist die Auflösung der generierten Daten überlegen und eignet sich für die Identifizierung und Charakterisierung neuer Mutanten, die Signalwege beeinflussen, die kompatible Bestäubung regulieren.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Forschung wurde durch Postgraduiertenstipendien der University of Bath (University of Bath, Bath, UK, BA2 7AY) an Y.-L.L. und L.W. Abbildung 1 wurde mit BioRender.com (https://biorender.com/) erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| pA9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | uNASC | N70000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
Referenzen
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O'Malley, R. C., Barragan, C. C., Ecker, J. R. A user's guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten