このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自由呼吸法による肺構造MRIの自己依存性超短エコータイムイメージング
要約
超短エコー時間(UTE)磁気共鳴画像法(MRI)を使用して肺の高解像度構造画像を生成するためのプロトコルが説明されています。このプロトコルでは、自由呼吸中に単純なMRIパルスシーケンスを使用して画像を取得できます。
要約
肺の高品質なMRIは、組織密度が低く、MRI信号の弛緩が速く、呼吸や心臓の動きが課題となっています。これらの理由から、肺の構造イメージングは、ほぼ独占的にコンピューター断層撮影(CT)を使用して行われます。しかし、CTイメージングは電離放射線を照射するため、特定の脆弱な集団(小児科など)や研究用途にはあまり適していません。その代替案として、超短エコー時間(UTE)を用いたMRIが注目されています。この技術は、5~10分のスキャンの過程で自由呼吸中に実行できます。呼吸運動情報は画像と一緒にエンコードされます。この情報は、画像を「セルフゲート」するために使用できます。したがって、セルフゲーティングにより、高度なMRIパルスシーケンスプログラミングや呼吸ベローズの使用が不要になり、画像取得が簡素化されます。このプロトコルでは、肺の高品質UTE MRIを取得するための、シンプルで堅牢で計算効率の高い取得および再構成方法が提示されます。このプロトコルは、3T MRIスキャナーで使用するために開発されましたが、同じ原理を低い磁場強度で実装できます。このプロトコルには、3DラジアルUTE画像取得の推奨パラメータ設定と、異なる呼吸相での画像を生成するためのセルフゲート画像再構成の指示が含まれています。このプロトコルの実装により、ユーザーは、運動アーチファクトを最小限に抑えたり、最小限に抑えたりすることなく、肺の高解像度UTE画像を生成できます。これらの画像は、肺の構造を評価するために使用でき、さまざまな肺の状態における研究用途に実装することができます。
概要
肺構造の高解像度イメージングは、多くの肺疾患の診断精密検査の重要な部分です。通常、これはコンピュータ断層撮影(CT)イメージングを使用して行われ、これは肺の高解像度画像を生成するのに理想的です1。しかし、CTイメージングは微量ではない量の電離放射線を照射するため、定期的なリピートイメージング、複数の異なる呼吸相でのイメージング、または特定の集団(小児科など)のイメージングには適していません。磁気共鳴画像法(MRI)は、電離放射線のリスクがそれほど高くないため、このようなイメージングタスクに適しています。しかし、組織密度が低く、呼吸と心臓の動きがあり、信号の緩和が非常に速いため、MRIを使用して肺を画像化することは困難です2,3,4。
これらの課題を軽減できる MRI 技術の 1 つが、超短エコー時間 (UTE) MRI 4,5,6 です。UTE MRIでは、MRI信号は信号励起の直後にサンプリングされるため、高速信号緩和の影響が軽減されます。さらに、この手法では、k空間を中心から外側に向かってサンプリングするため、k空間の中心で大幅なオーバーサンプリングが発生します。このk空間の中心でのオーバーサンプリングにより、このイメージング手法は動きに対して堅牢になります。この運動に対する固有のロバスト性に加えて、k空間の中心の反復サンプリングは、呼吸運動に関する情報を符号化し、画像7,8,9の自己ゲーティングを可能にする。このセルフゲーティングは、さまざまな呼吸相での画像を生成するために使用できます。人間は呼気期の大部分を呼気期に費やするため、この期は取得される画像データが最も多いため、呼気終末の画像を生成するのが一般的です。
肺MRIにおける呼吸セルフゲーティングには、さまざまな戦略があります。最初に区別するのは、画像ベースと画像ベースです。k空間ベースのゲーティング10(図1)。イメージベースのゲーティングでは、イメージング データの小さな時間サブセットを再構築することで、高い時間分解能を持つ一連のイメージが生成されます。続いて、これらの画像における横隔膜の位置は、所与の画像投影10、11のセットに対する呼吸相を識別するために使用される。k空間ベースのゲーティングでは、k空間(「k0」)の中心からのデータが調べられます8、9、12。画像の信号強度は k0 でエンコードされるため、k0 ポイントの強度は呼吸によって変化します。したがって、投影は、k0 の強度に基づいて異なる呼吸相にビン化できます。画像ベースのゲーティングとk空間ベースのゲーティングの両方で、呼吸器相が類似する投影が画像再構成のためにグループ化されます。画像ベースのゲーティングは、呼吸相の推定における忠実度を向上させ、それによりぼやけが減少した画像を提供することが示唆されている10,13。
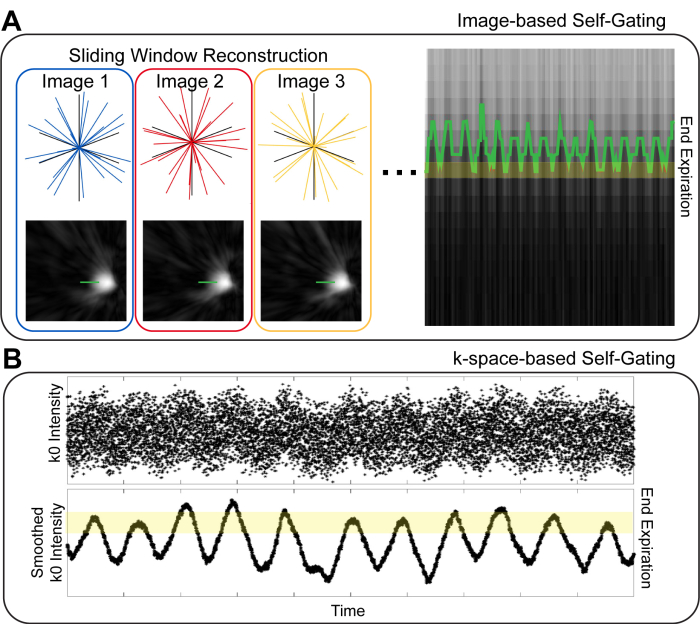
図1:画像ベースおよびk空間ベースのセルフゲーティング技術。 (A)画像ベースのゲーティングでは、全体のデータの時間的サブセットから、ダイアフラムを示す低空間分解能、高時間分解能の画像が生成されます。横隔膜上の線を使用して、呼吸運動を視覚化し、画像再構成のためにビニングすることができます。(B)k空間ベースのゲーティングでは、センターアウトK空間投影法(「k0」)の最初の点を使用して呼吸運動を視覚化します。k0 を平滑化すると、呼吸周期に基づく信号強度の差がはっきりと見え、さまざまな呼吸相を識別するために使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
画像およびk空間ベースのゲーティングは、ハードゲーティングまたはソフトゲーティング11,14のいずれかを使用して実行することができる。ハードゲーティングでは、目的の呼吸相に対応する突起のみが再構築されます。ただし、このように不要な投影を破棄すると、画像の信号対雑音比(SNR)が低下し、アンダーサンプリングアーティファクトが増加する可能性があります。これらの望ましくない影響は、ソフト ゲーティングを使用することで軽減できます。ソフトゲーティングでは、すべての投影が画像の再構成に使用されますが、望ましくない呼吸相からの投影は、最終的な画像への影響が少なくなるように重み付けされます。これにより、呼吸運動の影響を抑えながら、最小限のアーチファクトと高いSNRで画像を再構築することができます。
UTE MRI取得と取得後のセルフゲーティングを組み合わせることで、CTと同等ではないものの、CTイメージング6,15,16,17,18,19に近いコントラストと解像度を持つ高品質の画像を生成することができます。ここでは、肺構造の高品質画像を生成するために、UTE MRI画像を収集および再構成するための簡単なプロトコルが提供される。
このプロトコルは、主に3T MRIスキャナー用に書かれています。3Tは、研究用MRIに使用される最も一般的な電界強度です。1.5Tや最近利用可能になった0.55T20などの低磁界強度では、肺内の信号緩和が遅くなるため、肺内の画像品質と信号強度を向上させることができます。
このプロトコルと提供された画像再構成コードで明確さとシンプルさを提供するためにあらゆる試みがなされてきましたが、プロトコルでは、MRIスキャナーで適切なUTE MRIシーケンスを確立するために専任のMRI物理学者(または同様のMRI専門家)が必要になる可能性があります。MRI シーケンスは、センターアウト k 空間軌道を使用した 3D 非デカルト符号化戦略を実装する必要があります。例としては、3D放射状または3Dスパイラル(例えば、「FLORET」)21,22のイメージングシーケンスが含まれる。重要なことは、投影の順序は良好な時間的安定性を持つべきである:任意の時間のサブセットにわたって、投影はk空間の全範囲をカバーするべきである23。時間的安定性が良好な射影順序付け戦略の例としては、黄金平均法やハルトンランダム化アルキメデス螺旋があります。時間的安定性の低い射影順序付けを使用すると、取得後のセルフゲーティングではk空間の大きな領域が省略され、画像アーティファクトが発生します。最後に、シーケンスは<100μsのエコー時間(TE)を達成できる必要があります。3Tでの肺のT2*緩和時間は<1 ms24であるため、高品質の画像を生成するには、非常に短いTEを使用することが不可欠です。
プロトコル
すべてのヒト被験者イメージングは、KUMC IRBの承認を得て実施されました。書面によるインフォームドコンセントは、すべての参加者から得られました。この研究の画像は、一般的な技術開発プロトコルの下で取得され、包含/除外基準は意図的に広範でした。包含基準: 18≥歳。除外基準: MRI スクリーニング質問票への回答に基づく MRI 禁忌、および妊娠。この研究に使用した付属品と機器は、 資料の表に記載されています。
1. UTE画像取得
- イメージングシーケンスを準備します。イメージングシーケンスを 1 回準備し、この同じシーケンスをすべての参加者に使用します。
- 表1に従ってパラメータを設定します。
- MRIファントムをMRIの中心に置き、イメージングシーケンスを実行します。
注:このシーケンスには高速グラジエント性能と多くのRFパルスが必要なため、人間でテストする前にプロトコルセットアップを実行できることを確認することが重要です。
- 参加者をMRIの準備をします。機関標準の MRI 安全性スクリーニングを使用して、参加者が安全に MRI に参加できることを確認します。
- 参加者をMRIベッドに置き、チェストコイルを参加者の胴体に置きます。コイルを参加者のあごの近くに配置して、肺の頂点を完全に覆うようにします。
- 参加者をMRIスキャナーに移動します。ポジショニングランドマークを参加者の胸骨のすぐ下に配置します。
- ローカライザースキャンを収集して、参加者の肺がUTEスキャンの視野内にあることを確認します。UTEスキャンのジオメトリを動かさないでください。参加者の肺が視野内にない場合は、参加者を動かし、肺が完全に視野内に収まるまで追加のローカライザースキャンを収集します。
- UTE シーケンスを実行します。このシーケンス中、参加者は正常に呼吸することができます。
- スキャナーから生データをエクスポートします。使用するイメージングシーケンスに応じて、スキャナーはスキャナー上で画像を再構築する場合と再構築しない場合があります。提案されたレトロスペクティブ ゲーティング再構成では、スキャナーで画像が生成されているかどうかを判断するために、生のイメージング データが必要です。生データは大きくなることに注意してください (>10 GB)。
- k空間の軌跡(つまり、すべての生データポイントのk空間内の位置)をエクスポートまたは計算します。
注:一部のイメージングシーケンスでは、k空間の軌跡が生データと一緒にMRIスキャナーに保存され、直接エクスポートできます。他のイメージングシーケンスでは、イメージングパラメータに基づいてk空間の軌跡を計算する必要があります。
| パラメーター | 一般的な推奨設定 | ここで実装される設定 |
| イメージングシーケンス | センターアウト k 空間軌道を持つ 3D 非デカルト | 3D ラジアル (ゴールデンミーンズ投影法) の順序 |
| 視野 | 400 x 400 x 400 mm3 | 400 x 400 x 400 mm3 |
| マトリックスサイズ | 目標解像度の必要に応じて | 320 x 320 x 320 (等方性分解能 1.25 mm) |
| 帯域幅 | 必要に応じて、読み出し時間を 1.0 ミリ秒< | 888 Hz/ピクセル |
| テ | < 0.1 ミリ秒 | 0.07ミリ秒 |
| TRの | 最小値 (ターゲット 3 – 4 ミリ秒) | 3.5ミリ秒 |
| フリップ角度 | 約5° | 4.8° |
| 投影数 | 最低100,000人 | 1,35,386 |
| 画像の長さ | 最短5分 | 7分54秒 |
表1:UTEイメージングの推奨設定。 プロトコルのセットアップをガイドするために使用できる一般的な推奨設定が提供されます。代表的な結果として示されているように、データに使用された特定の推奨設定も提供されます。パラメーターの仕様は、帯域幅を除き、ベンダー間で一般的です。一部の主要な MRI ベンダーは、帯域幅を Hz/Pixel と指定しています。他の主要なMRIベンダーは、絶対帯域幅を指定しています。推奨される帯域幅 (888 Hz/ピクセル) は、284,160 Hz の絶対帯域幅に対応します。
2. 画像ベース呼吸ソフトゲーティングを用いたUTE画像再構成
注: 次の手順を完了するための MATLAB コードは、https://github.com/pniedbalski3/UTE_Reconstruction.
- データと k 空間の軌跡を MATLAB にインポートします。生の MRI データをインポートするためのコードは、すべての主要な MRI ベンダーで使用できます。
- 最初の 1000 個の投影を破棄して、データが定常磁化状態にあることを確認します。
注:使用するイメージングシーケンスにデータ取得前のダミースキャンが含まれている場合は、この手順をスキップできます。 - データの非常に小さなサブセットを使用して、低解像度のイメージを再構築します。
- 不均一な高速フーリエ変換を使用して、96 x 96 x 96 の行列サイズにイメージを再構築します。
- 0.6 秒から 0.8 秒のデータに対応する約 200 の投影法を使用します。
- すべてのコイル素子の画像と、最終的なコイル結合画像から画像を再構築して保存します。
- 結果のコイル結合画像で、ダイアフラムがはっきりと見える 冠状スライス を選択します。
注意: 提供されたコードは、ダイヤフラムを含むスライスを選択するようにユーザーに促します。 - このスライスを選択したら、このスライスの 個々のコイル 画像を表示し、ダイヤフラムを最もよく示す 1つまたは2つのコイル エレメントを選択します(図2)。
注意: 提供されたコードは、ユーザーにコイル要素を選択するように求めます。 - スライディングウィンドウを使用して画像を再構築し、~0.5秒の時間分解能で画像を生成します(図2)。
- 手順 2.4 で選択したコイル素子からのデータのみを再構築します。
注:すべてのコイル要素を再構築できますが、呼吸セルフゲーティングの目的でダイアフラムを視覚化するために必要なのは、ダイアフラムに最も近い要素のみです。図に最も近いコイル素子のみを再構築することで、再構築の時間と計算負荷を大幅に削減します。 - 最初の 200 個の投影法を使用して、不均一な高速フーリエ変換を使用して画像を再構築します (図 2)。ダイヤフラムが表示されているスライスのみを保存します(手順2.4で確認)。
注: 最終的には、最大 1500 枚の画像が生成されます。ダイヤフラムの位置を視覚化するために必要なのは2Dスライスのみであり、スライディングウィンドウの各ステップの3D画像を保存するのは法外な作業です。 - 100 投影法によるシフト (つまり、最初の画像は投影法 1 から 200 を使用して再構築されます。第2の画像は、投影法101〜300)を使用して再構成され、追加の画像を再構成し、ステップ2.4で選択されたスライスを格納する。
- すべての投影法を使用して画像を生成するまで続けます。
- 手順 2.4 で選択したコイル素子からのデータのみを再構築します。
- スライド ウィンドウの最初の画像で 横隔膜の上の線 を選択します。ラインが肺に5〜10ボクセル、横隔膜に5〜10ボクセル伸びるのに十分な長さであることを確認してください。
- すべての投影についてこの 呼吸ナビゲータ ーを表示して、呼吸運動を視覚化します。
- すべての呼吸ナビゲーターの横隔膜の位置を決定します。これにはさまざまな方法がありますが、簡単な方法は、大津の方法25 を使用して、暗い側(肺)と明るい側(横隔膜)を分けることです。
- 横隔膜の位置を使用して、投影を特定の呼吸器ビンに属するものとしてラベル付けします。特定の呼吸ナビゲーターが横隔膜を「位置 1」に表示している場合、そのナビゲーターの画像を生成するために使用される 200 個の投影法は「bin 1」に属します。
注: 画像は 100 投影が重なるスライディング ウィンドウを使用して生成されたため、一部の投影は複数のビンに属するとラベル付けされる場合があります。スライディング ウィンドウ画像の粗い空間解像度により、吸気から呼気までの全範囲をカバーする合計 ~4 ~ 6 個のビンが得られます。 - 再構築する ビン を選択するには、投影の数が最も多いビン (有効期限の終了に対応するビン) を決定します。
- あるいは、呼吸ナビゲーターの目視検査に基づいて、目的の呼吸相の画像を再構築します。
- ソフトゲートのウェイトを生成する14.
- 指数フィルターを使用して、1 次ビン内の投影に 1 の重みを提供し、異なる呼吸ビン内の投影に重みを大幅に減らします。
- Berkely Advanced Reconstruction Toolbox (BART; https://mrirecon.github.io/bart/)26,27 を使用して、目的の呼吸器ビンで高解像度の画像を再構築します。
注:BARTは、MRI画像再構成用の無料ツールボックスです。- 反復的な密度の組み合わせを使用して 、密度補正の重み を計算します。
- 密度補正ウェイトをソフトゲートウェイトでスケーリングします。
- 密度補正とソフトゲートウェイトに基づくデータのスケーリング
- 基本的な不均一な高速フーリエ変換 (NUFFT) を実行して、コイルの組み合わせを容易にします。
- NUFFT画像をグリッド化されたk空間に変換して、コイルの組み合わせに使用します。
- コイルの組み合わせ行列を生成し、それを使用して、生データとグリッド化された k 空間の両方のコイルを結合します。
- コイルの感度を推定します。
- 加重密度補償、コイル結合データ、およびコイル感度マップを使用して、圧縮されたセンス再構成を並列イメージングします。
- 最終的な画像を保存します。NIFTI形式は簡単に実装できます。画像をPACシステムにアップロードする場合は、DICOM形式が必要になる場合があります。
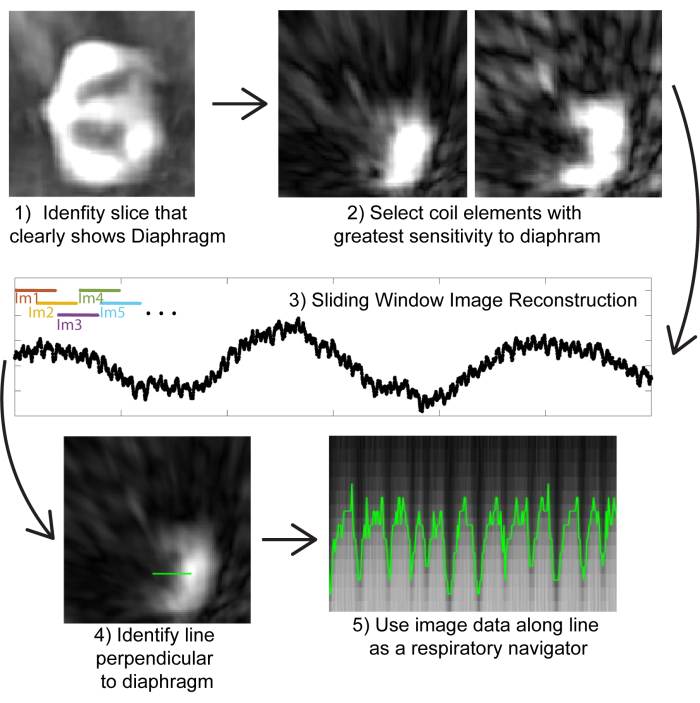
図2:画像ベースのセルフゲーティング。 (1)少数の投影から再構成された低解像度の画像(計算効率のため)を使用して、横隔膜がはっきりと見える冠状切片を特定します。(2) 個々のコイル素子の画像から、ダイヤフラムに最も近いコイル素子を選定します。(3)ダイアフラムに最も近いコイル要素のみのスライディングウィンドウ再構成を実行します(計算効率のため)。画像は、200 の投影のサブセット (~0.8 秒に対応) から生成できます。投影を重ねることで、画像で~0.5秒の疑似時間分解能を達成できます。(4)呼吸ナビゲーターとして使用する横隔膜に垂直な線を特定します。(5)この線上の画像データを視覚化すると、呼吸運動が示され、これを使用して画像をビン化できます。 この図の拡大版を表示するには、ここをクリックしてください。
3. k空間を用いた呼吸器ソフトゲーティングによるUTE画像再構成
- 手順2.1〜2.4を完了して、ダイヤフラムに最も近いコイルエレメントを識別できるようにします。
- 選択したコイル要素のすべての投影について、投影上の最初の点の絶対値を使用して、k0 の時系列トレースを生成します。これにより、呼吸波形を視覚化できます。
- 5000 投影のステップで、同じ k0 ポイント28 の平均信号強度で k0 を正規化します。これにより、時間の経過に伴う信号強度ドリフトが軽減され、予測を定量的にビン化する能力が向上します。
- 各 k0 ポイントに、吸気または呼気中に発生するものとしてラベルを付けます。
- k0 の時系列を平滑化し、導関数を使用してゲート トレース上の各点の傾きを評価します。
- 勾配の記号に基づいてインスピレーションポイントにラベルを付けます。正の傾きは呼気に対応し、負の傾きは吸気に対応します。
- 信号強度に基づくビンの投影。呼吸の深さは可変であるため、ビンの投影は、呼吸相の位置ではなく信号の振幅に基づいています。
注:これを達成するための簡単で迅速な方法は、k-meansクラスタリングを実装してさまざまな信号強度レベルを識別することです。 - エンド インスピレーションとエンド エクスピレーションの中間にあるビンの場合、ステップ 3.4 に基づいて、プロジェクションがインスピレーションと有効期限の間に発生するものとして識別します。
- ステップ 2.10 からステップ 2.13 で説明した手順に従って、イメージの再構築を完了します。
- 必要に応じて、呼気終了時だけでなく、すべての呼吸器ビンの画像を再構築します。
結果
代表的な結果(図3)は、 表1に示す設定を使用して生成されました。使用されるイメージング時間は、ほとんどの参加者が許容できる高品質の画像を提供します。
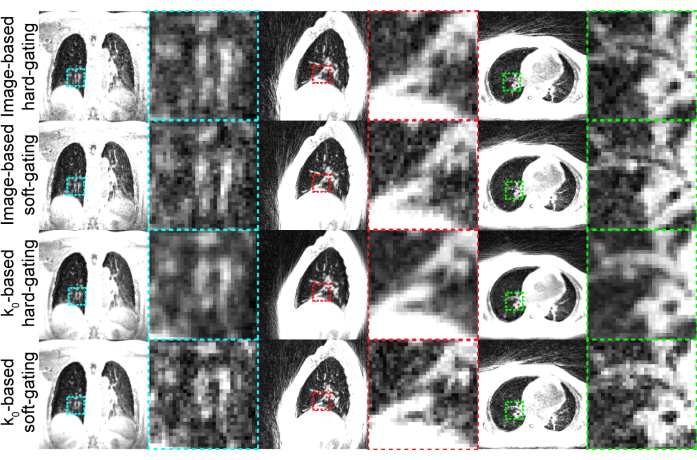
図3:生成された代表的なUTE...
ディスカッション
肺のUTEイメージングを行う場合、取得と再構成の両方の多くのバリエーションを使用して、肺の画像を生成できます。このプロトコルは、実装の容易さと計算効率に重点を置いています。3DラジアルUTEを使用したイメージングは比較的簡単で、イメージングシーケンスは通常、主要なMRIベンダーから入手可能です。MATLABベースのツールは、データ処理とセルフゲーテ?...
開示事項
Peter Niedbalskiは、National Scleroderma Foundation、American Heart Association、およびNIHから研究資金を受けています。彼は、過分極 129Xe MRI技術を開発する会社であるPolarean Imaging Plc.のコンサルタントです。
謝辞
このプロトコルの開発と代表的な結果として示された画像は、National Scleroderma Foundationによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Chest MRI Coil | Siemens, GE, Philips,, Other Clinical MRI Imaging Coil Vendor | N/A | A 26 - 32 channel Chest coil should be used |
| High Performance Workstation | HP, Apple, or other Computer Hardware company | N/A | A computer with a minimum of 64 GB of Memory is needed for image reconstruction |
| Matlab | Mathworks | R2016A or newer | A Matlab license is needed to run the provided computer code |
| MRI Phantom | Siemens, GE, Philips, or Other MRI Phantom Vendor | N/A | Any Phantom can be used to test the MRI sequence prior to its use in human subjects. |
| MRI Scanner | Siemens, GE, Philips, or Other Clinical MRI Scanner Vendor | N/A | The protocol was developed on a 3T scanner, but 1.5T or 0.55T would also work with minimal adaptation |
参考文献
- Raju, S., Ghosh, S., Mehta, A. C. Chest ct signs in pulmonary disease: A pictorial review. Chest. 151 (6), 1356-1374 (2017).
- Biederer, J., et al. MRI of the lung (2/3). Why, when, how. Insights Imaging. 3 (4), 355-371 (2012).
- Biederer, J., et al. MRI of the lung (3/3)-current applications and future perspectives. Insights Imaging. 3 (4), 373-386 (2012).
- Johnson, K. M., Fain, S. B., Schiebler, M. L., Nagle, S. Optimized 3D ultrashort echo time pulmonary MRI. Magn Reson Med. 70 (5), 1241-1250 (2013).
- Ma, W., et al. Ultra-short echo-time pulmonary MRI: Evaluation and reproducibility in COPD subjects with and without bronchiectasis. J Magn Reson Imaging. 41 (5), 1465-1474 (2015).
- Roach, D. J., et al. Ultrashort echo-time magnetic resonance imaging is a sensitive method for the evaluation of early cystic fibrosis lung disease. Ann Am Thorac Soc. 13 (11), 1923-1931 (2016).
- Tibiletti, M., et al. Multistage three-dimensional UTE lung imaging by image-based self-gating. Magn Reson Med. 75 (3), 1324-1332 (2016).
- Weick, S., et al. Dc-gated high-resolution three-dimensional lung imaging during free-breathing. J Magn Reson Imaging. 37 (3), 727-732 (2013).
- Fischer, A., et al. Self-gated non-contrast-enhanced functional lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Tibiletti, M., et al. Respiratory self-gated 3D UTE for lung imaging in small animal MRI. Magn Reson Med. 78 (2), 739-745 (2017).
- Jiang, W., et al. Motion robust high resolution 3D free-breathing pulmonary MRI using dynamic 3D image self-navigator. Magn Reson Med. 79 (6), 2954-2967 (2018).
- Higano, N. S., et al. Retrospective respiratory self-gating and removal of bulk motion in pulmonary UTE MRI of neonates and adults. Magn Reson Med. 77 (3), 1284-1295 (2016).
- Metze, P., et al. Non-uniform self-gating in 2D lung imaging. Front Phys. 10, (2022).
- Gandhi, D. B., et al. Comparison of weighting algorithms to mitigate respiratory motion in free-breathing neonatal pulmonary radial UTE-MRI. Biomed Phys Eng Express. 10 (3), 035030 (2024).
- Fauveau, V., et al. Performance of spiral UTE-MRI of the lung in post-covid patients. Magn Reson Imaging. 96, 135-143 (2023).
- Metz, C., et al. Comparison of diagnostic quality of 3D ultrashort-echo-time techniques for pulmonary magnetic resonance imaging in free-breathing. Acta Radiologica. 64 (5), 1851-1858 (2023).
- Periaswamy, G., et al. Comparison of ultrashort TE lung MRI and HRCT lungs for detection of pulmonary nodules in oncology patients. Indian J Radiol Imaging. 32 (04), 497-504 (2022).
- Darçot, E., et al. Comparison between magnetic resonance imaging and computed tomography in the detection and volumetric assessment of lung nodules: A prospective study. Frontiers in Medicine. 9, 858731 (2022).
- Dournes, G., et al. 3D ultrashort echo time MRI of the lung using stack-of-spirals and spherical k-space coverages: Evaluation in healthy volunteers and parenchymal diseases. J Magn Reson Imaging. 48 (6), 1489-1497 (2018).
- Campbell-Washburn, A. E. 2019 American Thoracic Society Bear Cage winning proposal: Lung imaging using high-performance low-field magnetic resonance imaging. Am J Respir Crit Care Med. 201 (11), 1333-1336 (2020).
- Robison, R. K., Anderson, A. G., Pipe, J. G. Three-dimensional ultrashort echo-time imaging using a FLORET trajectory. Magn Reson Med. 78 (3), 1038-1049 (2017).
- Willmering, M. M., Robison, R. K., Wang, H., Pipe, J. G., Woods, J. C. Implementation of the FLORET sequence for lung imaging. Magn Reson Med. 82 (3), 1091-1100 (2019).
- Chan, R. W., Ramsay, E. A., Cunningham, C. H., Plewes, D. B. Temporal stability of adaptive 3D radial MRI using multidimensional golden means. Magn Reson Med. 61 (2), 354-363 (2009).
- Yu, J., Xue, Y., Song, H. K. Comparison of lung T2* during free-breathing at 1.5 T and 3.0 T with ultrashort echo time imaging. Magn Reson Med. 66 (1), 248-254 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Martin Uecker, F. O., et al. Berkely advanced reconstruction toolbox. Proc Intl Soc Magn Reson Med. 23, 2486 (2015).
- . . Bart Toolbox for Computational Magnetic Resonance Imaging. , (2024).
- Munidasa, S. . Treatment monitoring of pediatric cystic fibrosis lung disease using free breathing lung MRI. , (2024).
- Zhu, X., Chan, M., Lustig, M., Johnson, K. M., Larson, P. E. Z. Iterative motion-compensation reconstruction ultra-short TE (IMOCO UTE) for high-resolution free-breathing pulmonary MRI. Magn Reson Med. 83 (4), 1208-1221 (2020).
- Tan, F., et al. Motion-compensated low-rank reconstruction for simultaneous structural and functional UTE lung MRI. Magn Reson Med. 90 (3), 1101-1113 (2023).
- Bhattacharya, I., et al. Oxygen-enhanced functional lung imaging using a contemporary 0.55 T MRI system. NMR Biomed. 34 (8), e4562 (2021).
- Kim, M., et al. Feasibility of dynamic T2*-based oxygen-enhanced lung MRI at 3T. Magn Reson Med. 91 (3), 972-986 (2024).
- Klimeš, F., et al. 3D phase-resolved functional lung ventilation MR imaging in healthy volunteers and patients with chronic pulmonary disease. Magn Reson Med. 85 (2), 912-925 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved