JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Free-Breathing, Self-Gated Ultra-short Echo Time Imaging을 사용한 폐 구조 MRI
요약
초단반향시간(UTE) 자기공명영상(MRI)을 사용하여 폐의 고해상도 구조 이미지를 생성하기 위한 프로토콜이 설명되어 있습니다. 이 프로토콜을 사용하면 자유 호흡 중에 간단한 MRI 펄스 시퀀스를 사용하여 이미지를 획득할 수 있습니다.
초록
폐의 고품질 MRI는 낮은 조직 밀도, 빠른 MRI 신호 이완, 호흡 및 심장 운동으로 인해 어려움을 겪습니다. 이러한 이유로 폐의 구조 영상은 거의 전적으로 컴퓨터 단층 촬영(CT)을 사용하여 수행됩니다. 그러나 CT 영상은 전리 방사선을 전달하므로 특정 취약 계층(예: 소아과) 또는 연구 응용 분야에는 적합하지 않습니다. 대안으로 초단반향시간(UTE)을 이용한 MRI가 주목받고 있다. 이 기술은 ~5-10분 스캔 과정에서 자유 호흡 중에 수행할 수 있습니다. 호흡 운동 정보는 이미지와 함께 인코딩됩니다. 이 정보는 이미지를 "자체 게이트"하는 데 사용할 수 있습니다. 따라서 셀프 게이팅은 고급 MRI 펄스 시퀀스 프로그래밍 또는 호흡 벨로우즈의 사용이 필요하지 않아 이미지 획득이 간소화됩니다. 이 프로토콜에서는 폐의 고품질 UTE MRI를 획득하기 위한 간단하고 강력하며 계산 효율적인 획득 및 재구성 방법을 제시합니다. 이 프로토콜은 3T MRI 스캐너에서 사용하기 위해 개발되었지만 더 낮은 자기장 강도에서도 동일한 원리를 구현할 수 있습니다. 이 프로토콜에는 3D 방사형 UTE 이미지 획득을 위한 권장 파라미터 설정과 뚜렷한 호흡 단계에서 이미지를 생성하기 위한 자체 게이트 이미지 재구성 지침이 포함되어 있습니다. 이 프로토콜의 구현을 통해 사용자는 움직임 아티팩트를 최소화하거나 최소화하거나 전혀 사용하지 않는 폐의 고해상도 UTE 이미지를 생성할 수 있습니다. 이러한 이미지는 폐 구조를 평가하는 데 사용할 수 있으며, 이는 다양한 폐 질환에서 연구용으로 구현될 수 있습니다.
서문
폐 구조의 고해상도 이미징은 많은 폐 질환에 대한 진단 정밀 검사의 필수적인 부분입니다. 일반적으로 이는 컴퓨터 단층 촬영(CT) 영상을 사용하여 수행되며, 이는 폐의 고해상도 이미지를 생성하는 데 이상적으로 적합합니다1. 그러나 CT 영상은 적지 않은 양의 전리 방사선을 전달하기 때문에 정기적인 반복 촬영, 여러 호흡기에서의 영상 촬영 또는 특정 인구 집단(예: 소아과)의 영상에는 적합하지 않습니다. 자기공명영상(MRI)은 전리 방사선과 동일한 위험을 수반하지 않으므로 이러한 이미징 작업에 적합합니다. 그러나 MRI를 사용하여 폐를 영상화하는 것은 낮은 조직 밀도, 호흡 및 심장 운동, 매우 빠른 신호 이완으로 인해 어렵습니다 2,3,4.
이러한 문제를 완화할 수 있는 MRI 기술 중 하나는 초단반향시간(UTE) MRI 4,5,6입니다. UTE MRI에서 MRI 신호는 신호 여기 직후 샘플링되어 빠른 신호 완화의 영향을 줄입니다. 더욱이, 이 기법은 k-공간을 중심에서 바깥쪽으로 샘플링하기 때문에 k-공간의 중심에서 상당한 오버샘플링이 발생합니다. k-space의 중심에서 이러한 오버샘플링은 이 이미징 기술을 움직임에 강하게 만듭니다. 움직임에 대한 이러한 고유한 견고성 외에도 k-공간 중심의 반복적인 샘플링은 호흡 움직임에 대한 정보를 인코딩하여 이미지 7,8,9의 자체 게이팅을 가능하게 합니다. 이 셀프 게이팅은 다양한 호흡 단계에서 이미지를 생성하는 데 사용할 수 있습니다. 인간은 호흡기의 대부분을 호기 때 보내기 때문에 이 단계에서 가장 많은 이미징 데이터를 획득하기 때문에 호기종료에 대한 이미지를 생성하는 것이 일반적입니다.
폐 MRI에서 호흡기 자가 게이팅을 위한 다양한 전략이 있습니다. 첫 번째 차이점은 이미지 기반 vs. k-공간 기반 게이팅10(그림 1). 이미지 기반 게이팅(image-based gating)에서는 이미징 데이터의 작은 시간적 부분 집합을 재구성하여 높은 시간 해상도를 가진 이미지 세트를 생성합니다. 이어서, 이들 이미지들에서 다이어프램의 위치는 주어진 이미지 투영기(10,11) 세트에 대한 호흡기를 식별하는데 사용된다. k-공간 기반 게이팅에서는 k-공간 중심("k0")의 데이터를 검사합니다(8,9,12). 이미지의 신호 강도는k0 로 인코딩되며, 따라서 k0 점의 강도는 호흡에 따라 달라집니다. 따라서 투영은 k0의 강도에 따라 다른 호흡 단계로 범주화할 수 있습니다. 이미지 기반 게이팅(gating)과 k-공간 기반 게이팅(k-space-based gating) 모두에서, 유사 호흡 단계를 가진 투영은 이미지 재구성을 위해 그룹화됩니다. 이미지 기반 게이팅(image-based gating)은 호흡기를 추정할 때 향상된 충실도를 제공하여, 블러링(blurring)이 감소된 이미지를 제공한다는 것이 제안되었다10,13.
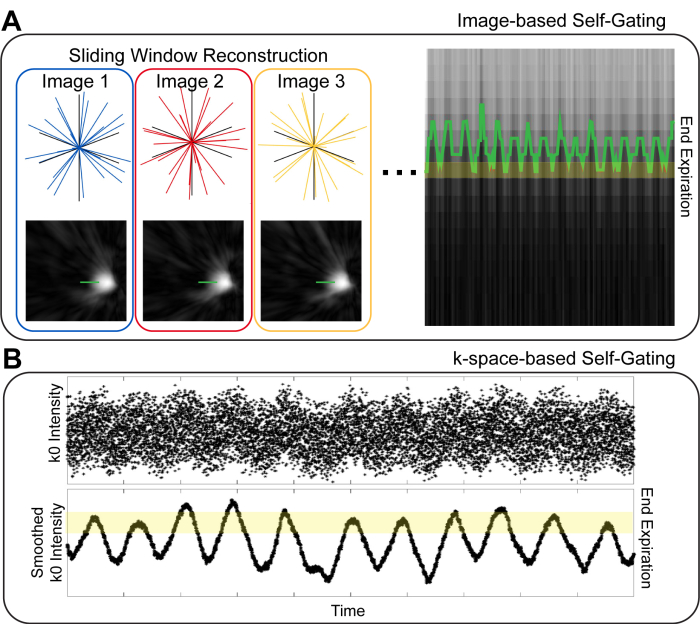
그림 1: 이미지 기반 및 k-공간 기반 셀프 게이팅 기술. (A) 이미지 기반 게이팅(gating)에서 낮은 공간 해상도(low spatial resolution), 다이어프램을 보여주는 높은 시간 해상도(high temporal resolution) 이미지는 전체 데이터의 시간적 하위 집합에서 생성됩니다. 다이어프램 위의 선을 사용하여 호흡 동작을 시각화하고 이미지 재구성을 위해 비닝할 수 있습니다. (B) k-공간 기반 게이팅에서 중심-아웃 k-공간 투영의 첫 번째 점("k0")은 호흡 운동을 시각화하는 데 사용됩니다. k0를 평활화한 후에는 호흡 주기에 따른 신호 강도 차이를 명확하게 볼 수 있으며 다른 호흡 단계를 식별하는 데 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이미지 및 k-공간 기반 게이팅은 하드 게이팅 또는 소프트 게이팅(soft gating) 11,14을 사용하여 수행할 수 있습니다. 하드 게이팅에서는 원하는 호흡기에 해당하는 돌출부만 재구성됩니다. 그러나 이러한 원치 않는 프로젝션을 버리면 이미지 신호 대 노이즈 비율(SNR)이 감소하고 언더샘플링 아티팩트가 증가할 수 있습니다. 이러한 원치 않는 영향은 소프트 게이팅을 사용하여 완화할 수 있습니다. 소프트 게이팅에서는 모든 프로젝션이 이미지 재구성에 사용되지만 원치 않는 호흡 단계의 프로젝션은 최종 이미지에 미치는 영향이 적도록 가중치가 부여됩니다. 이를 통해 최소한의 아티팩트와 높은 SNR로 이미지를 재구성하는 동시에 호흡 동작의 영향을 억제할 수 있습니다.
UTE MRI 획득과 획득 후 자체 게이팅의 조합을 통해 CT와 동일하지는 않지만 CT 이미징 6,15,16,17,18,19에 근접하는 대비 및 해상도를 갖는 고품질 이미지를 생성할 수 있습니다. 여기에서, 폐 구조의 고품질 이미지를 생성하기 위해 UTE MRI 이미지를 수집 및 재구성하기 위한 간단한 프로토콜이 제공된다.
이 프로토콜은 주로 3T MRI 스캐너용으로 작성되었습니다. 3T는 연구용 MRI에 사용되는 가장 일반적인 자기장 강도입니다. 1.5T 또는 최근에 사용 가능한 0.55 T20 과 같은 낮은 자기장 강도는 폐 내의 신호 완화가 이러한 자기장 강도에서 더 느리기 때문에 폐 내에서 향상된 이미지 품질과 신호 강도를 제공할 수 있습니다.
이 프로토콜과 제공된 이미지 재구성 코드에서 명확성과 단순성을 제공하기 위해 모든 시도가 이루어졌지만, 이 프로토콜은 MRI 스캐너에서 적절한 UTE MRI 시퀀스를 설정하기 위해 전담 MRI 물리학자(또는 유사한 MRI 전문가)를 필요로 할 수 있습니다. MRI 시퀀스는 Center-out k-space 궤적을 사용하여 3D 비데카르트 인코딩 전략을 구현해야 합니다. 예를 들어, 3D 방사형 또는 3D 나선형(예: "FLORET")21,22 이미징 시퀀스가 있습니다. 중요한 것은, 투영의 순서는 양호한 시간적 안정성을 가져야 한다는 것이다: 주어진 시간 부분 집합에 걸쳐, 투영은 k-공간(23)의 전체 범위를 커버해야 한다. 시간적 안정성이 좋은 투영 순서 전략의 예로는 황금 평균 또는 Halton-randomized Archimedean spiral이 있습니다. 시간적 안정성이 좋지 않은 투영 순서를 사용하는 경우 획득 후 자체 게이팅은 k-space의 큰 영역을 생략하여 이미지 아티팩트를 유발합니다. 마지막으로, 시퀀스는 <100μs의 에코 시간(TE)을 달성할 수 있어야 합니다. 3T에서 폐의 T2* 이완 시간은 <1ms24이므로 고품질 이미지를 생성하려면 매우 짧은 TE를 사용하는 것이 필수적입니다.
프로토콜
모든 human subject image는 KUMC IRB의 승인을 받아 수행하였다. 모든 참가자로부터 서면 동의서를 받았습니다. 이 연구의 이미지는 일반적인 기술 개발 프로토콜에 따라 얻어졌으며 포함/제외 기준은 의도적으로 광범위했습니다. 포함 기준: 나이 ≥ 18세. 제외 기준: MRI 선별 설문지에 대한 응답을 기반으로 금기된 MRI 및 임신. 이 연구에 사용된 액세서리 및 장비는 재료 표에 나열되어 있습니다.
1. UTE 이미지 획득
- 이미징 시퀀스를 준비합니다. 이미징 시퀀스를 한 번 준비하고 모든 참가자에 대해 동일한 시퀀스를 사용합니다.
- 표 1에 따라 매개변수를 설정합니다.
- MRI 팬텀을 MRI 중앙에 놓고 이미징 시퀀스를 실행합니다.
참고: 이 시퀀스에는 빠른 그래디언트 성능과 많은 RF 펄스가 필요하기 때문에 사람을 대상으로 테스트하기 전에 프로토콜 설정을 실행할 수 있는지 확인하는 것이 중요합니다.
- MRI를 위해 참가자를 준비합니다. 참가자가 MRI에 안전하게 들어갈 수 있도록 기관 표준 MRI 안전 검사를 사용하십시오.
- 참가자를 MRI 침대에 놓고 참가자의 몸통에 흉부 코일을 놓습니다. 폐 정점을 완전히 덮을 수 있도록 코일을 참가자의 턱 가까이에 배치합니다.
- 참가자를 MRI 스캐너로 이동합니다. 참가자의 흉골 바로 아래에 포지셔닝 랜드마크를 배치합니다.
- 로컬라이저 스캔을 수집하여 참가자의 폐가 UTE 스캔의 시야 내에 있는지 확인합니다. UTE 스캔의 형상을 이동하지 마십시오. 참가자의 폐가 시야 내에 있지 않은 경우 참가자를 이동하고 폐가 시야 내에 완전히 들어올 때까지 추가 로컬라이저 스캔을 수집합니다.
- UTE 시퀀스를 실행합니다. 이 시퀀스 동안 참가자는 정상적으로 숨을 쉴 수 있습니다.
- 스캐너에서 원시 데이터를 내보냅니다. 사용된 이미징 시퀀스에 따라 스캐너는 스캐너에서 이미지를 재구성하거나 재구성하지 않을 수 있습니다. 제안된 후향적 게이팅 재구성의 경우, 이미지가 스캐너에서 생성되는지 여부를 결정하기 위해 원시 이미징 데이터가 필요합니다. 원시 데이터는 큽니다(>10GB).
- k-space 궤적(즉, 모든 원시 데이터 포인트의 k-space 내 위치)을 내보내거나 계산합니다.
참고: 일부 이미징 시퀀스의 경우 k-space 궤적이 MRI 스캐너에 원시 데이터와 함께 저장될 수 있으며 직접 내보낼 수 있습니다. 다른 이미징 시퀀스의 경우, 이미징 매개변수를 기반으로 k-공간 궤적을 계산해야 합니다.
| 매개 변수 | 일반 권장 설정 | 여기에 구현된 설정 |
| 이미징 시퀀스 | Center-out k-space 궤적을 가진 3D Non-Cartesian | 황금이 있는 3D 방사형은 투영 순서를 의미합니다. |
| 시야각(field-of-view) | 400 x 400 x 400 mm3 | 400 x 400 x 400 mm3 |
| 매트릭스 크기 | 목표 해상도에 대해 원하는 대로 | 320 x 320 x 320 (1.25mm 등방성 해상도) |
| 대역폭 | 판독 시간 < 1.0ms에 필요한 경우 | 888Hz/픽셀 |
| 테 | < 0.1ms | 0.07밀리초 |
| TR | 최소(대상 3 – 4ms) | 3.5밀리초 |
| 플립 각도 | 약 5° | 4.8° |
| 프로젝션 수 | 최소 100,000 | 1,35,386 |
| 이미지 지속 시간 | 최소 5분 | 7분 54초 |
표 1: UTE 이미징을 위한 권장 설정. 프로토콜 설정을 안내하는 데 사용할 수 있는 일반 권장 설정이 제공됩니다. 데이터에 사용된 특정 권장 설정도 대표 결과로 표시되는 것처럼 제공됩니다. 매개 변수 사양은 대역폭을 제외하고 공급업체 간에 일반적입니다. 일부 주요 MRI 공급업체는 대역폭을 Hz/Pixel로 지정합니다. 다른 주요 MRI 공급업체는 절대 대역폭을 지정합니다. 권장 대역폭(888Hz/픽셀)은 절대 대역폭 284,160Hz에 해당합니다.
2. 영상 기반 호흡기 소프트 게이팅을 이용한 UTE 영상 재구성
참고: 다음 단계를 완료하기 위한 MATLAB 코드는 https://github.com/pniedbalski3/UTE_Reconstruction 에서 제공됩니다.
- 데이터와 k-공간 궤적을 MATLAB으로 가져올 수 있습니다. 원시 MRI 데이터를 가져오기 위한 코드는 모든 주요 MRI 공급업체에서 사용할 수 있습니다.
- 처음 1,000개의 투영을 버리고 데이터가 정상 상태 자화(steady-state magnetization)에 있는지 확인합니다.
참고: 사용된 이미징 시퀀스에 데이터 수집 전의 더미 스캔이 포함된 경우 이 단계를 건너뛸 수 있습니다. - 매우 작은 데이터 서브셋을 사용하여 저해상도 영상을 복원합니다.
- 균일하지 않은 고속 푸리에 변환을 사용하여 영상을 96 x 96 x 96의 행렬 크기로 복원합니다.
- 0.6초에서 0.8초의 데이터에 해당하는 약 200개의 프로젝션을 사용합니다.
- 모든 코일 요소의 이미지와 최종 코일 결합 이미지를 재구성하고 저장할 수 있습니다.
- 결과로 생성되는 코일 결합 영상에서, 다이어프램을 명확하게 보여주는 코로나 슬라이스 를 선택합니다.
참고: 제공된 코드는 사용자에게 다이어프램이 포함된 슬라이스를 선택하라는 메시지를 표시합니다. - 이 슬라이스를 선택한 후에는 이 슬라이스에 대한 개별 코일 이미지를 보고 다이어프램을 가장 잘 보여주는 하나 또는 두 개의 코일 요소를 선택합니다(그림 2).
알림: 제공된 코드는 사용자에게 코일 요소를 선택하라는 메시지를 표시합니다. - 슬라이딩 윈도우를 사용하여 이미지를 재구성하여 ~0.5초의 시간 해상도로 이미지를 생성합니다(그림 2).
- 2.4단계에서 선택한 코일 요소의 데이터만 재구성합니다.
알림: 모든 코일 요소를 재구성할 수 있지만 호흡 자체 게이팅을 위해 다이어프램을 시각화하려면 다이어프램에 가장 가까운 요소만 필요합니다. 다이어그램에 가장 가까운 코일 요소만 재구성함으로써 재구성 시간과 계산 부담이 크게 줄어듭니다. - 처음 200개의 투영을 사용하여 불균일 고속 푸리에 변환을 사용하여 이미지를 재구성합니다(그림 2). 다이어프램이 표시된 슬라이스만 저장합니다(2.4단계에서 찾을 수 있음).
참고: 궁극적으로 최대 1500개의 이미지가 생성됩니다. 다이어프램 위치를 시각화하는 데 2D 슬라이스만 필요하며 각 슬라이딩 윈도우 단계에 대해 3D 이미지를 저장하는 것은 금지됩니다. - 100 프로젝션으로 이동(즉, 첫 번째 이미지는 프로젝션 1-200을 사용하여 재구성됨). 두 번째는 투영부(101 - 300)를 사용하여 재구성하고, 단계 2.4에서 선택된 슬라이스를 저장하여 추가 이미지를 재구성한다.
- 모든 프로젝션이 이미지를 생성하는 데 사용될 때까지 계속합니다.
- 2.4단계에서 선택한 코일 요소의 데이터만 재구성합니다.
- 슬라이딩 윈도우 이미지의 첫 번째 이미지에서 다이어프램 위의 선을 선택합니다. 선이 5-10 복셀만큼 폐로 확장되고 5-10 복셀만큼 횡격막으로 확장될 수 있을 만큼 충분히 긴지 확인하십시오.
- 모든 투영에 대해 이 호흡 내비게이터를 보고 호흡 움직임을 시각화하십시오.
- 모든 호흡기 내비게이터에 대한 다이어프램의 위치를 결정하십시오. 이를 수행하는 방법에는 여러 가지가 있지만 간단한 방법은 Otsu의 방법25 를 사용하여 어두운 쪽(폐)과 밝은 쪽(횡격막)을 나누는 것입니다.
- 다이어프램 위치를 사용하여 투영을 지정된 호흡 빈에 속하는 것으로 레이블을 지정합니다. 주어진 호흡기 탐색기가 "위치 1"에서 다이어프램을 표시하는 경우 해당 탐색기에 대한 이미지를 생성하는 데 사용되는 200개의 투영은 "bin 1"에 속합니다.
참고: 이미지는 100 프로젝션 오버랩이 있는 슬라이딩 창을 사용하여 생성되었기 때문에 일부 프로젝션은 여러 빈에 속하는 것으로 레이블이 지정될 수 있습니다. 슬라이딩 윈도우 이미지의 거친 공간 해상도는 총 4~6개의 bins로 이어지며, 이는 만료까지의 전체 영감 범위를 포괄합니다. - 어떤 bin에 가장 많은 수의 프로젝션이 있는지 확인하여 재구성할 bin 을 선택하며, 이는 종료 만료에 해당해야 합니다.
- 또는 호흡기 탐색기의 육안 검사를 기반으로 원하는 호흡 단계에 대한 이미지를 재구성합니다.
- 소프트 게이팅을 위한 가중치 생성14.
- 지수 필터를 사용하여 기본 용기 내의 돌출부에 가중치 1을 제공하고 다른 호흡 용기 내의 돌출부에 가중치를 급격히 줄입니다.
- Berkely Advanced Reconstruction Toolbox(BART; https://mrirecon.github.io/bart/)26,27을 사용하여 원하는 호흡기에서 고해상도 이미지를 재구성합니다.
참고: BART는 MRI 이미지 재구성을 위해 무료로 사용할 수 있는 도구 상자입니다.- 반복 밀도 조합을 사용하여 밀도 보상 가중치를 계산합니다.
- 밀도 보상 가중치를 소프트 게이팅 가중치로 스케일링합니다.
- 밀도 보상(density compensation)과 소프트 게이팅(soft-gating) 가중치를 기반으로 데이터 스케일링
- 코일 결합을 용이하게 하기 위해 기본 NUFFT(Non-Uniform Fast Fourier Transform)를 수행합니다.
- NUFFT 이미지를 코일 조합에 사용할 그리드 k-space로 변환합니다.
- 코일 결합 행렬을 생성하고 이를 사용하여 원시 데이터와 그리딩된 k-공간 모두에 대한 코일을 결합합니다.
- 코일 민감도를 추정합니다.
- 가중 밀도 보상(weighted density compensation), 코일 결합 데이터(coil combined data), 코일 민감도 맵(coil sensitivity map)을 사용하여 압축 감지 재구성을 병렬 이미징합니다.
- 최종 이미지를 저장합니다. NIFTI 형식은 쉽게 구현할 수 있습니다. 이미지를 PAC 시스템에 업로드하는 경우 DICOM 형식이 필요할 수 있습니다.
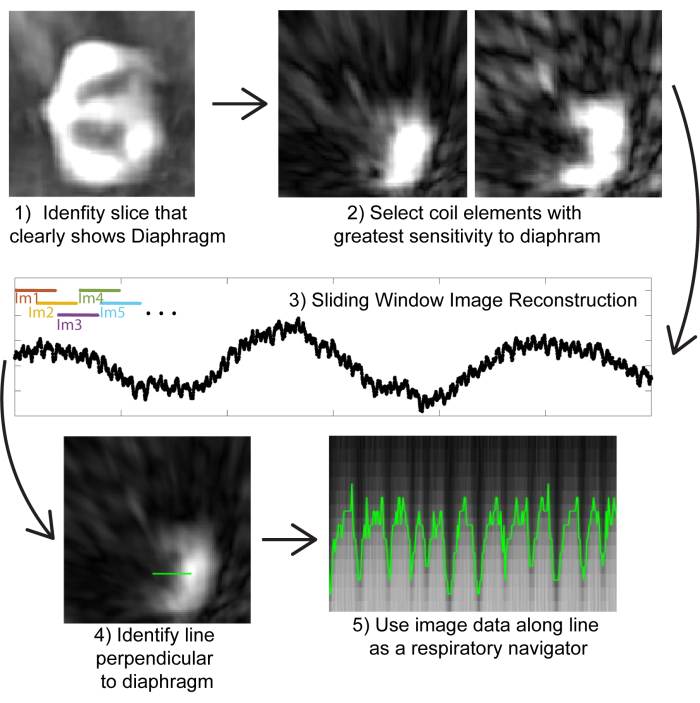
그림 2: 이미지 기반 자체 게이팅. (1) 적은 수의 투영으로 재구성한 저해상도 이미지를 사용하여(계산 효율성을 위해) 다이어프램을 명확하게 보여주는 coronal slice를 식별합니다. (2) 개별 코일 요소의 이미지를 검사하여 다이어프램에 가장 가까운 코일 요소를 선택합니다. (3) 다이어프램에 가장 가까운 코일 요소만 슬라이딩 창 재구성을 수행합니다(계산 효율성을 위해). 이미지는 200 개의 투영 (~ 0.8 초에 해당)의 하위 집합에서 생성 될 수 있습니다. 투영을 겹치면 이미지에서 ~0.5초의 의사 시간 해상도를 얻을 수 있습니다. (4) 호흡 내비게이터로 사용할 횡격막에 수직인 선을 식별합니다. (5) 이 라인에서 이미지 데이터를 시각화하면 호흡 움직임이 표시되며, 이는 이미지를 비닝하는 데 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. k-space-based respiratory soft-gating을 이용한 UTE 이미지 재구성
- 다이어프램에 가장 가까운 코일 요소를 식별할 수 있도록 2.1-2.4단계를 완료하십시오.
- 선택한 코일 요소에 대한 모든 투영에 대해 투영에서 첫 번째 점의 절대값을 사용하여 k0 시계열 추적을 생성합니다. 이렇게 하면 호흡 파형이 시각화됩니다.
- 5000 개의 투영 단계에서 k0 을 동일한 k0 점28의 평균 신호 강도로 정규화합니다. 이는 시간 경과에 따른 신호 강도 드리프트를 완화하고 투영을 정량적으로 비닝하는 향상된 기능을 제공합니다.
- 각 k0 점을 영감 또는 만료 중에 발생하는 것으로 레이블을 지정합니다.
- k0 시계열을 평활화하고 도함수를 사용하여 게이팅 추적의 모든 점에 대한 기울기를 평가합니다.
- 경사면의 표지판을 기준으로 영감 지점에 레이블을 지정합니다. 양의 기울기는 만료에 해당하고 음의 기울기는 영감에 해당합니다.
- 신호 강도를 기반으로 한 Bin 투영법. 호흡의 깊이는 가변적일 수 있기 때문에 빈 투영은 호흡 단계의 위치가 아닌 신호 진폭을 기반으로 합니다.
참고: 이를 수행하는 간단하고 빠른 방법은 k-means 클러스터링을 구현하여 다양한 신호 강도 수준을 식별하는 것입니다. - 최종 영감과 종료 만료 사이의 중간에 있는 bin의 경우 3.4단계에 따라 영감 및 만료 중에 발생하는 것으로 프로젝션을 식별합니다.
- 2.10단계부터 2.13단계까지 제공된 단계에 따라 이미지 재구성을 완료합니다.
- 원하는 경우, 호기종료 시에만 이미지를 재구성하는 것이 아니라 모든 호흡기에 대한 이미지를 재구성합니다.
결과
대표 결과(그림 3)는 표 1에 표시된 설정을 사용하여 생성되었습니다. 사용된 이미징 지속 시간은 대부분의 참가자가 수용할 수 있는 고품질 이미지를 제공합니다.
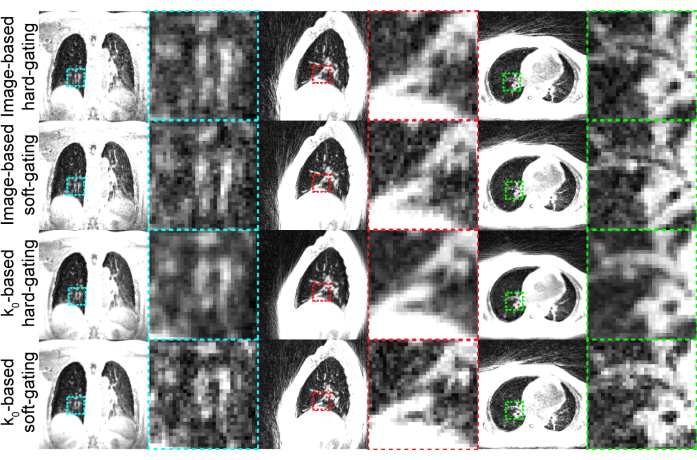
그림 3: 생성된 대표 UTE 이?...
토론
폐의 UTE 이미징을 수행할 때 획득 및 재구성의 다양한 변형을 사용하여 폐 이미지를 생성할 수 있습니다. 이 프로토콜은 구현의 용이성과 계산 효율성에 중점을 둡니다. 3D 방사형 UTE를 사용한 이미징은 주요 MRI 공급업체에서 일반적으로 구할 수 있는 이미징 시퀀스를 통해 비교적 간단합니다. 데이터 처리 및 셀프 게이팅을 위한 MATLAB 기반 툴이 제공됩니다. 대부분의 교?...
공개
Peter Niedbalski는 국립 경피증 재단(National Scleroderma Foundation), 미국 심장 협회(American Heart Association) 및 NIH로부터 연구 자금을 지원받습니다. 그는 과분극 129Xe MRI 기술을 개발하는 회사인 Polarean Imaging Plc.의 컨설턴트입니다.
감사의 말
이 프로토콜의 개발과 대표적인 결과로 표시된 이미지는 국립 경피증 재단(National Scleroderma Foundation)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Chest MRI Coil | Siemens, GE, Philips,, Other Clinical MRI Imaging Coil Vendor | N/A | A 26 - 32 channel Chest coil should be used |
| High Performance Workstation | HP, Apple, or other Computer Hardware company | N/A | A computer with a minimum of 64 GB of Memory is needed for image reconstruction |
| Matlab | Mathworks | R2016A or newer | A Matlab license is needed to run the provided computer code |
| MRI Phantom | Siemens, GE, Philips, or Other MRI Phantom Vendor | N/A | Any Phantom can be used to test the MRI sequence prior to its use in human subjects. |
| MRI Scanner | Siemens, GE, Philips, or Other Clinical MRI Scanner Vendor | N/A | The protocol was developed on a 3T scanner, but 1.5T or 0.55T would also work with minimal adaptation |
참고문헌
- Raju, S., Ghosh, S., Mehta, A. C. Chest ct signs in pulmonary disease: A pictorial review. Chest. 151 (6), 1356-1374 (2017).
- Biederer, J., et al. MRI of the lung (2/3). Why, when, how. Insights Imaging. 3 (4), 355-371 (2012).
- Biederer, J., et al. MRI of the lung (3/3)-current applications and future perspectives. Insights Imaging. 3 (4), 373-386 (2012).
- Johnson, K. M., Fain, S. B., Schiebler, M. L., Nagle, S. Optimized 3D ultrashort echo time pulmonary MRI. Magn Reson Med. 70 (5), 1241-1250 (2013).
- Ma, W., et al. Ultra-short echo-time pulmonary MRI: Evaluation and reproducibility in COPD subjects with and without bronchiectasis. J Magn Reson Imaging. 41 (5), 1465-1474 (2015).
- Roach, D. J., et al. Ultrashort echo-time magnetic resonance imaging is a sensitive method for the evaluation of early cystic fibrosis lung disease. Ann Am Thorac Soc. 13 (11), 1923-1931 (2016).
- Tibiletti, M., et al. Multistage three-dimensional UTE lung imaging by image-based self-gating. Magn Reson Med. 75 (3), 1324-1332 (2016).
- Weick, S., et al. Dc-gated high-resolution three-dimensional lung imaging during free-breathing. J Magn Reson Imaging. 37 (3), 727-732 (2013).
- Fischer, A., et al. Self-gated non-contrast-enhanced functional lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Tibiletti, M., et al. Respiratory self-gated 3D UTE for lung imaging in small animal MRI. Magn Reson Med. 78 (2), 739-745 (2017).
- Jiang, W., et al. Motion robust high resolution 3D free-breathing pulmonary MRI using dynamic 3D image self-navigator. Magn Reson Med. 79 (6), 2954-2967 (2018).
- Higano, N. S., et al. Retrospective respiratory self-gating and removal of bulk motion in pulmonary UTE MRI of neonates and adults. Magn Reson Med. 77 (3), 1284-1295 (2016).
- Metze, P., et al. Non-uniform self-gating in 2D lung imaging. Front Phys. 10, (2022).
- Gandhi, D. B., et al. Comparison of weighting algorithms to mitigate respiratory motion in free-breathing neonatal pulmonary radial UTE-MRI. Biomed Phys Eng Express. 10 (3), 035030 (2024).
- Fauveau, V., et al. Performance of spiral UTE-MRI of the lung in post-covid patients. Magn Reson Imaging. 96, 135-143 (2023).
- Metz, C., et al. Comparison of diagnostic quality of 3D ultrashort-echo-time techniques for pulmonary magnetic resonance imaging in free-breathing. Acta Radiologica. 64 (5), 1851-1858 (2023).
- Periaswamy, G., et al. Comparison of ultrashort TE lung MRI and HRCT lungs for detection of pulmonary nodules in oncology patients. Indian J Radiol Imaging. 32 (04), 497-504 (2022).
- Darçot, E., et al. Comparison between magnetic resonance imaging and computed tomography in the detection and volumetric assessment of lung nodules: A prospective study. Frontiers in Medicine. 9, 858731 (2022).
- Dournes, G., et al. 3D ultrashort echo time MRI of the lung using stack-of-spirals and spherical k-space coverages: Evaluation in healthy volunteers and parenchymal diseases. J Magn Reson Imaging. 48 (6), 1489-1497 (2018).
- Campbell-Washburn, A. E. 2019 American Thoracic Society Bear Cage winning proposal: Lung imaging using high-performance low-field magnetic resonance imaging. Am J Respir Crit Care Med. 201 (11), 1333-1336 (2020).
- Robison, R. K., Anderson, A. G., Pipe, J. G. Three-dimensional ultrashort echo-time imaging using a FLORET trajectory. Magn Reson Med. 78 (3), 1038-1049 (2017).
- Willmering, M. M., Robison, R. K., Wang, H., Pipe, J. G., Woods, J. C. Implementation of the FLORET sequence for lung imaging. Magn Reson Med. 82 (3), 1091-1100 (2019).
- Chan, R. W., Ramsay, E. A., Cunningham, C. H., Plewes, D. B. Temporal stability of adaptive 3D radial MRI using multidimensional golden means. Magn Reson Med. 61 (2), 354-363 (2009).
- Yu, J., Xue, Y., Song, H. K. Comparison of lung T2* during free-breathing at 1.5 T and 3.0 T with ultrashort echo time imaging. Magn Reson Med. 66 (1), 248-254 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Martin Uecker, F. O., et al. Berkely advanced reconstruction toolbox. Proc Intl Soc Magn Reson Med. 23, 2486 (2015).
- . . Bart Toolbox for Computational Magnetic Resonance Imaging. , (2024).
- Munidasa, S. . Treatment monitoring of pediatric cystic fibrosis lung disease using free breathing lung MRI. , (2024).
- Zhu, X., Chan, M., Lustig, M., Johnson, K. M., Larson, P. E. Z. Iterative motion-compensation reconstruction ultra-short TE (IMOCO UTE) for high-resolution free-breathing pulmonary MRI. Magn Reson Med. 83 (4), 1208-1221 (2020).
- Tan, F., et al. Motion-compensated low-rank reconstruction for simultaneous structural and functional UTE lung MRI. Magn Reson Med. 90 (3), 1101-1113 (2023).
- Bhattacharya, I., et al. Oxygen-enhanced functional lung imaging using a contemporary 0.55 T MRI system. NMR Biomed. 34 (8), e4562 (2021).
- Kim, M., et al. Feasibility of dynamic T2*-based oxygen-enhanced lung MRI at 3T. Magn Reson Med. 91 (3), 972-986 (2024).
- Klimeš, F., et al. 3D phase-resolved functional lung ventilation MR imaging in healthy volunteers and patients with chronic pulmonary disease. Magn Reson Med. 85 (2), 912-925 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유