Method Article
라만 분광학을 사용하여 세포와 세포외 기질의 비 접촉, 레이블이없는 모니터링
요약
라만 분광법은 비 접촉에 적합한 기술, 살아있는 세포, 조직 - 엔지니어링 구조와 기본 조직의 라벨이없는 분석입니다. 소스 고유의 스펙트럼 지문가 생성 및 복수 변수 분석을 사용하여 분석할 수 있습니다.
초록
세포와 조직 문화를 모니터링하는 비 파괴적인, 비 접촉 및 레이블이없는 기술은 생명 의학 연구 분야에서 필요합니다. 1-5 단, 현재 사용 가능한 일상적인 방법은 처리 단계를 필요로하고 샘플 무결성을 변경하지 않습니다. 라만 분광법은 추가 처리 단계없이도 생물 학적 시료의 측정을 가능하게 빠른 방법입니다. .이 레이저 기반의 기술은 단색 빛의 비탄성 산란을 감지 6 모든 화학 진동은 특정 라만 밴드 (cm -1에서 wavenumber)에 할당된으로, 각각의 생물 학적 샘플들은 본질적으로 생화 학적 조성에 의한 전형적인 스펙트럼 패턴을 갖추고 7. - 라만 스펙트럼 내에서 9, 피크 농도는 현재 분자 채권의 금액과 상관 관계 1. 유사점과 스펙트럼 데이터 세트의 차이는 다변수 분석 (예, 주요한 구성 요소 분석 (PCA)을) 채용에 의해 감지가 가능하다 10. 여기서는 살아있는 세포 및 기본 조직의 라만 분광을 수행합니다. 세포 중 유리 바닥 접시에 놓는 또는 정상 세포 배양 조건에서 현탁액에 보관 (37 ° C에서 5 % CO 2) 측정하기 전에합니다. 기본 조직은 4 ° C에서 사전 측정에 (PBS) 식염수를 버퍼 해부 및 인산염에 저장됩니다. 우리의 실험적인 함정에 따라, 우리는 다음 중 세포 핵이나 엘라스틴과 콜라겐 등 세포외 매트릭스 (ECM) 단백질에 집중했다. 모든 연구 내용은, 30 셀 또는 ECM 내에서 이익의 30 임의의 지점의 최소 측정합니다. 데이터 처리 단계는 배경 제거 및 정상화가 포함되어있었습니다.
프로토콜
1. 생물 학적 샘플의 준비
- 살아있는 세포의 준비
- 자기편 세포의 준비
- 유리 바닥 접시 (Greiner BioOne / 독일)와 37에서 그들을 품어에 대한 체외 - 교양이나 신선하게 분리된 세포의 씨앗 ° C에서 5 % CO 2 세포 부착이 완료될 때까지.
- 배지를 제거하고 PBS 사전 측정과 함께 부드럽게 세 번 씻는다. 전체 측정 과정에 걸쳐 PBS 또는 세포 배양 매체 중으로 덮여 세포 보관.
- 정지에있는 세포의 준비
- 일반적인 프로토콜 (예 : 트립신-EDTA (에틸렌 다이아 민 테트라 초산), 휴대된다고)에 따라 체외 - 교양 세포에서 분리, 세포를 원심 분리기 및 취득 PBS의 세포 펠렛이나 세포 배양 매체를 다시 일시 중지합니다.
- 유리 바닥 접시에 : 세포 현탁액을 100 μl (최대 100,000 세포 / ML. 농도)를 전송합니다.
- 자기편 세포의 준비
- NAT의 작성필자 조직
- 조직 수확 후 4 ° C에서 혹은 얼음 사전 측정을 12 시간 이상 살균, 얼음처럼 차가운 PBS로 전송 그들을 더이상 유지 없습니다. 이전 실험은 장기 저장 시간 (4 ° C에서 추위 국소 빈혈 시간> 12 시간) 자연 열화 공정에 의한 스펙트럼 변경이 발생한 것으로 나타났습니다.
- 측정은 조직 건조에 의한 ECM 단백질과 세포의 손상을 피하기 위해 PBS이나 매체에서 다루지 조직으로 수행되어야합니다.
2. 라만 분광기
저희의 맞춤 라만 분광계는 라만 스펙트럼과 밝은-필드와 형광 이미지의 직접적인 비교를 허용 라만 분광기와 표준 형광 현미경 (올림푸스 IX 71)이 결합되어 있습니다. 기본 세트는 최대 784 nm의 다이오드 레이저 (Toptica photonics AG / 독일), 여기 광의 라만 - 흩어진 빛의 분리를위한 노치 필터, 현미경으로 구성되어 있습니다차 스펙트럼 정보 (소프트 이미징 시스템 / 독일에서 F-보기)의 검출에 최적화된 요금 결합 소자 (CCD 카메라)와 분광기 (카이저 광학 시스템 주식 회사, 앤아버에 / 미국).
3. 레이저 기능의 제어
- 소프트웨어 Andor Solis (Andor / 영국)를 시작하고 -60으로 CCD 카메라의 온도를 설정할 ° C 카메라에 열 유도된 전류로 인한 노이즈를 최소화합니다.
- 교정 절차에 대한 현미경 스테이지에 실리콘 웨이퍼를 놓습니다.
- 에 레이저를 켜고 전원 85 MW로 설정합니다.
- XY가 나타날 때까지 웨이퍼에 레이저를 초점 소프트웨어 셀 B (올림푸스 / 독일)를 사용합니다.
- 60x 공기 객관적를 사용하여 1 초의 단일 적분 시간과 함께 실리콘 웨이퍼를 측정합니다.
- 픽셀 번호에서 Andor Solis 소프트웨어의 라만 시프트 (cm -1)에 X-축 단위를 변경합니다.
- 에서 520cm -1에서 실리콘 최고의 레이저 초점을 다릅니다이 라만 밴드에 대한 가능한 최대 강도를 찾기 위해 스펙트럼 수집했습니다. 카운트의 최소 금액은 성공적인 교정을 가지고 11,000보다 높아야합니다.
4. 라만 Spectroscopic 측정
모든 측정은 상온에서 수행됩니다.
- 기본 설정
- 샘플의 스펙트럼을 수집하기 위해 1.2의 수치 조리개와 60x 물 침지 목표 (올림푸스 / 독일)를 사용합니다.
- 측정 100 초 총 10 통합 / 10 초 인수 설정을 변경합니다.
- 자기편 세포의 측정
- 전지와 유리 바닥 접시를 타고 현미경 스테이지에 배치하십시오.
- 더 나은 신호를 구하여 재현성을 확보, 세포 핵에 레이저를 집중하기 위해서는 현미경 조명을 끄고 스펙트럼 수집을 시작합니다.
- 배경 전자의 참조 스펙트럼을 측정셀 옆에 레이저 포커스를 이동하여 매우 10 스펙트럼. 그것은 포커스를 변경할 때 새로운 배경이 각각의 초점 심도를 위해 수집되어야함을 고려하는 것이 중요합니다.
- 정지에있는 세포의 측정
- 유리 바닥 접시에 세포 현탁액을 100 μl를 전송하고 현미경 단계에 그것을 배치하십시오.
- 세포의 중앙에 레이저를 집중하고, 현미경 조명을 끄고 스펙트럼 수집을 시작합니다.
- 셀 옆에 레이저 포커스를 이동하여 배경의 참조 스펙트럼 매 10 스펙트럼을 측정합니다. 포커스를 변경하면, 새로운 배경은 새로운 초점 심도를 위해 수집해야합니다.
- 기본 조직의 측정
- 샘플을 가지고 유리 바닥 접시에 넣습니다. 관심 (ROI)의 지역은 접시의 바닥을 향하게 지향적이어야합니다.
- 샘플을 충당하기 위해 충분한 PBS로 접시를 채우십시오.
- 어떤 MOV를 피하기 위해 샘플을 커버 글라스를 배치측정하는 동안 시료의 장담.
- 관심있는 구조로 레이저 포커스를 설정합니다 (깊이 해상도는 레이저와 조직에 따라 달라지게된다) 및 스펙트럼 수집을 시작합니다.
- 전체 조직 영역의 레이저 초점이 이동하여 배경의 참조 스펙트럼 매 10 스펙트럼을 수집합니다. 포커스를 변경하면, 새로운 배경은 새로운 초점 심도를 위해 수집해야합니다.
- immunofluorescence 측정 (IF) - 라벨 cryosections
- 표준 cryotom 및 실리카 코팅 커버 유리에 그들을 마운트를 사용하여 섹션 신선 스냅인 냉동 조직 샘플.
- 짧은 고정 단계 (4 % paraformaldehyde로 최대 10 분) 고용과 관심의 단백질의 검출을위한 적절한 항체를 사용하는 경우에 대한 일상적인 프로토콜에 따라 cryosections을 청바지.
- 형광이 발생 지역에 초점 라만 측정을 수행합니다.
- 엘라스틴의 열화 실험
- 괞찮아CE 유리 바닥 접시의 바닥으로 향하게 해부하는 돼지의의 대동맥 밸브 전단지 (엘라스틴이 풍부한, 심장 밸브 전단지의 혈액 유입 측 층)의 ventricularis.
- 원섬유의 구조에 초점을 전체 조직의 표면에 걸쳐 30 임의 지점에서 '비 incubated 제어'로 기본 조직을 측정합니다.
- 3 섹션으로 샘플을 나누어하고 엘라스타제 솔루션 (5 U / ML, 워싱턴 / 독일) 2 ML 가득 별도의 2.5 ML Eppendorf 튜브에 넣어.
- 37에 15이나 30 분 동안 어느 조직을 품어 ° C.
- 15이나 30 분 중을위한 인큐베이션 후, Eppendorf 튜브에서 조직을 제거하고 완전히 효소 반응을 중지하기 위해 PBS와 함께 신중하게 씻는다.
- 원섬유의 구조에 초점을 맞추고, 30 임의의 지점에서 각 샘플을 측정합니다.
5. 데이터 처리 및 분석
- 라만 스펙트럼 처리
의 사전 처리생성된 스펙트럼은 오푸스 소프트웨어 (Bruker Optik 게엠베하 / 독일)를 사용하여 수행되었다.- 측정하는 동안 초점의 변화에 의한 변형을 방지하기 위해 유리와 매체뿐만 아니라로부터 간섭 신호를 줄이기 위해, 수집된 스펙트럼에서 해당 배경 스펙트럼을 뺍니다.
- 정보의 최고 금액을 제공 4백~1천8백cm -1 사이 wavenumber 영역 스펙트럼을 줄입니다.
- 필요한 경우, 최대 피크로 스펙트럼을 정상화. 샘플 스펙트럼의 구조적인 변화의 감지를 간소화 강도 변화와 체계적인 결함, 아웃 정상화 요인.
- 다른 실험 사이 comparability을 높이기 위해 기본적인 보정을 수행합니다.
- 라만 스펙트럼 분석
라만 스펙트럼은 Unscrambler (카모 / 노르웨이) 소프트웨어와 PCA를 사용하여 분석되었다. 이것은 다변수 분석 스펙트럼 데이터 사이의 차이와 유사성을 감지세트. 모든 스펙트럼은 모든 라만 시프트에 대한 회수 카운트를 기반으로 다차원 공간에서 하나의 지점으로 꾸몄다있다. 각 주요 구성 요소 (PC)에서 원본 데이터에 포함되어있는 전체 정보의 특정 수량에 대해 설명합니다. 최초의 PC는 변화의 가장 높은 소스를 포함 하나이다. 각 다음과 같은 PC는, 순서대로, 이전보다 적은 정보가 들어 있습니다. 모든 변수는 각 PC의 점수와 로딩이 있습니다. PC를 (= 점수)하려함으로써, 중요한 표본 상관 관계가 노출될 수 있습니다. loadings은 PCA에 대한 각 분석 변수의 기여를 설명합니다.- 모든 샘플 그룹에 대한 행 범위를 만들어 측정의 각 그룹 레이블.
- PCA에 대해 다음 기본 설정을 사용하여 교차 검증 NIPALS 알고리즘없고 회전을하고 분석을 시작합니다. 이러한 설정은 스펙트럼 따라 달라집니다.
- PCA를 수행합니다.
6. 대표 결과
라만 SP자기편 세포에서 생성된 ectra은 종종 낮은 신호 대 잡음 비율과 낮은 전반적인 신호 강도 (그림 1) 레이저 초점 유리 바닥, 간섭의 영향 근처로 설정되어야한다는 사실로 인해. 11 공개 유리 신호는 실제 샘플 신호의 마스킹을 초래, 오히려 높습니다. 후속 배경 제거하는 동안 따라서, 샘플 신호가 최소화 수도, 심지어 탈락. 그들은 상세한 스펙트럼 정보의 검출을 허용으로 따라서, 우리는 우리의 라만 spectroscopic 분석을 위해 중지 세포를 사용하는 것을 선호합니다. 그러나 자기편 및 정지 전지의 스펙트럼은 그들의 농도에 다양한 동일한 주요 봉우리를 나타냅니다.
현탁액 내에서 다른 세포 유형의 특성을 보려면 아무 사전 치료도 필요하지 않습니다. 정학로 측정 평균 라만 스펙트럼과 인간의 섬유아 세포, mesenchymal 줄기 세포 (MSCS), chondrocytes 및 keratinocytes의 표준 편차입니다그림 2에 묘사되어. 모든 라만 스펙트럼이 비슷한 봉우리는 (표 1 참조)와 같은 단백질, 핵산 및 lipids과 같은 전형적인 biomolecules에서 발생으로 구성되어있다. 이러한 세포 유형에 대한 12, 600 및 1천8백cm -1 가장 관련성이 높은 스펙트럼 정보를 포함 간의 스펙트럼 영역별로이 어떤 명확한 차이는 서로 다른 세포 유형 (그림 2A) 사이에 감지됩니다. 모범, 우리는 콜라겐과 lipids의 분자 진동에 양도할 수있다 명확한 구조적 차이를 표시 한 스펙트럼 지역 (1천2백80~1천3백50센티미터 -1)을 강조했다. 반대로, 형태학의 분석은 대부분 세포의 식별 및 구분 (그림 2B-I)에 적합하지 않습니다. chondrocytes과 피부 세포 사이의 차이 (그림 2D, H 대 B, F와 E, I) 관찰할 수있는 동안, 섬유아 세포 및 MSCS는 전적으로 밝은-필드 micrsoc를 사용하여 구분하기가 어렵습니다제발요 (그림 2B, F 대 C, G) 13.
특히 ECM 단백질의 기본 조직, 중 라만 spectroscopic 분석은 투자 수익 (ROI)가 각각의 구조에 집중할 수있게하기 위해서는 밝은 - 필드 이미징에 의해 시각이 될 수 있어야합니다. 특정 지문 스펙트럼에 대한 단백질의 할당을 위해서는 상용 순수 단백질과 immunohistologically 스테인드 cryosections의 라만 스펙트럼을 올렸습니다. 여기서는 동결 건조된 엘라스틴과 엘라스틴에 대한 항체를 고용 immunofluorescence 묻은 cryosections를 비교 네이티브 조직 내에서 탄성 섬유의 지문 스펙트럼을 확인. 엘라스틴은 라만 스펙트럼에 반영되어 높은 autofluorescence을 갖추고 있기 때문에 그러나, 데이터 분석 (그림 3A) 도전입니다. 때문에 같은 autofluorescence, 데이터 세트의 적절한 처리와 같은 샘플에 특정한 속성에 체계적인 실패를 줄이기 위해 매우 중요합니다. 우리의 데이터alyses, 우리는 순수한 엘라스틴 단백질의 상당히 높은 신호 강도를 제거하기 위해 정규화를 사용하고, 따라서, 우리는 (그림 3B) 비교 라만 스펙트럼을 생성할 수 있었다. 엘라스틴은 신체에서 가장 안정적인 ECM 단백질 중 하나이며 저하하는 것이 매우 어렵습니다. 우리의 실험 세트 최대 14 우리는 효소 소화를 수행하여 건강한 돼지의의 대동맥 밸브 전단지에 엘라스틴 저하를 유도. 다변수 분석 PCA를 적용, 우리는 효소 - 대우 샘플 및 네이티브 컨트롤 (그림 3C)의 라만 스펙트럼 사이의 중요한 차이점을 발견. 이러한 스펙트럼의 차이는 861, 1,003 및 1,664cm -1에서 로딩 스펙트럼에서 관찰되었다. 엘라스타제로 확장 노출 시간으로 인해 엘라스틴 함유 섬유의 예상 구조적인 변화도 더 분명하게 분리 점수 클러스터에 반영되었다 하트의 염색법 (그림 4), (그림 3C)에 의해 표시되었다.

그림 1. 분리 자기편 섬유아 세포의 라만 스펙트럼을 뜻합니다.
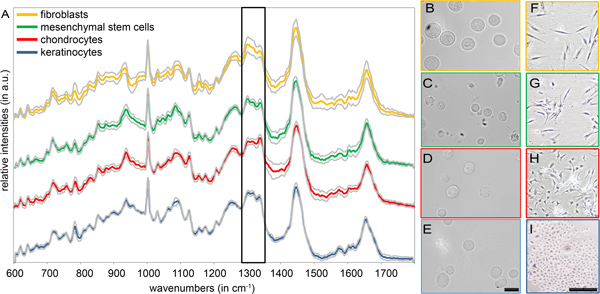
그림 2. () 라만 스펙트럼과 네 가지 기본 절연 세포 유형 (섬유아 세포, MSCS, chondrocytes 및 keratinocytes)의 표준 편차를 평균입니다. 구조적 차이와 -1 1천3백50센티미터 - 프레임은 1,280의 스펙트럼 영역을 강조 표시합니다. 단독 (B) 섬유아 세포의 ()가 밝고-필드에 이미지, (C) MSCS, (D) chondrocytes와 (E) keratinocytes. 스케일 바는 20 μm의 같습니다. 자기편 (F) 섬유아 세포의 (FI) 브라이트 - 필드에 이미지, (사) MSCS, (H) chondrocytes 및 (나) keratinocytes. 스케일 바는 200 μm의 같습니다.

그림 3. lyophili의 정상화없이 () 라만 스펙트럼데이빗 엘라스틴 (파란색 라인), immunofluorescence (IF) - 라벨 cryosections (오렌지 라인) 및 네이티브 대동맥 밸브 전단지 내에서 측정한 탄성 섬유 (빨간색 선). 동결 건조된 엘라스틴의 높은 신호 강도는 autofluorescence로 인해 발생합니다. 정규화 후 (B) 라만 스펙트럼 체계적 오류를 제거하는 순서를 유지해야합니다. (C) 점수와 비 처리 제어 (적색)과 효소 - 타락한 (파란색과 녹색) 기본 조직 내의 탄력 섬유 간의 비교 loadings.

그림 4. HART's 묻은 돼지의의 대동맥 밸브 전단지. 탄성 섬유는 검은색의 시각입니다. (A)와 (B) 비 처리 제어 및 (C)와 (D) 30 분간 엘라스틴 - 굴욕적인 효소 엘라스타제에 노출된 조직 샘플을 묘사 표시됩니다.
| cm -1에서 Wavenumber | 할당 12 | |
| 717-719 | CN | Phospholipids |
| 785-788 | DNA / RNA 기지, OPO 백본 | DNA / RNA |
| 1003년에서 1005년까지 | 페닐알라닌 | 단백질 |
| 1220년에서 1280년까지 | 아미드 III | 단백질 |
| 1445년에서 1447년까지 | CH 2 | 단백질 / 지질 |
| 1655-1680 | 아미드 IC = C | 단백질 지질 |
표 1. 모든 세포 유형 (섬유아 세포, MSCS, chondrocytes 및 keratinocytes)의 스펙트럼 내에서 검출 라만 밴드.
토론
라만 분광법은 네이티브 조직 내에서 체외 - 교양 세포와 ECM 단백질뿐만 아니라 세포와 같은 생물 학적 샘플을 분석하는 적합한 도구입니다. 여기 11,15,16, 우리는이 비 접촉, 레이블이없는 기술을 허용하는 입증 다른 세포 유형의 차별과 전적으로 이러한 생물 학적 샘플의 본질 biomolecular 구성을 기반으로 ECM 단백질 저하의 감지.
라만 분광법의 주요한 이점은 비 invasively 그 결과로 라만 스펙트럼에 의한 시료의 생화 학적 지문을 계량하는 기능입니다. 유사한 정보를 얻을 적외선 분광법, 달리, 라만의 스펙트럼은 약한 물에서 라만 산란으로 수성 샘플에서 수집한 수 있습니다. 또한, 라만 분광법은 전적으로 단색 광을 backscattering의 검출을 기반으로하므로, 어떤 시료 처리 전에 측정을 필요하지 않습니다. 이러한 특성은 라스하다생체내 이미징 애플 리케이션에서 가능성을위한 사람 분광법은 유망한 대안. 보다 빠르고 실험에서 널리 같은 vibrational 신호를 기반으로 데이터를 더욱 민감한 취득 가능하게 때문에이 안부에서 일관된 반 스톡스 라만 분광법은 (대) 매우 흥미로운 기술입니다. multiphoton 유발 autofluorescence 포함한 15,16 다른 대안 방법 와 두 번째 고조파 생성 이미지는 이전에 다음 ID 17는 그러나 이러한 이미징 modalities가 매우 높은 비용과 연결되어 있습니다. 비 또는 최소한의 invasively 생물 학적 샘플을 모니터하는 데 적합한 것으로 입증되었으며 autofluorescence 창출 분자로 제한됩니다. 또한, 라만 분광계는 종래의 광학 현미경과 결합하기 쉽다. 이러한 특성은 라만 분광법 생리적 환경에서 생물 학적 샘플을 공부하는 유용한 도구합니다.
우리 라만 분광법의 현재 한계 중 하나는 설정높은 수치 조리개 목표 (NA가 = 1.2)에 의해 만들어진 비교적 적은 레이저 초점 (250 nm의 전체 폭 절반 최대 (FWHM) 수평 700 nm의 FWHM 축). 높은 수치 조리개가 높은 신호 대 노이즈 비율에 항복 방출 라만 빛의 적당량을 충당하기 위해 수 있지만, 높은 NA는 일반적으로 세포보다 훨씬 작은 샘플에서만 작은 컬렉션 초점을 생산하고 있습니다. 다른 세포의 라만 스펙트럼을 비교하기 위해서, 대표적인 스펙트럼의 컬렉션 작은 초점 영역으로 얻기 어려운하는 것이 필수적입니다. 이 문제를 해결하기 위해 평균 및 대표 스펙트럼에 항복 스펙트럼의 결과로 세포 내에서 다양한 포인트 (= 라만 spectroscopic 매핑)에서 신호 수집을 자동화하는 절차에 노력하고 있습니다. 또한이 기술은 세포 내에서 단백질 배포판의 예를 들어, 특정 라만 밴드의 배포에 대한 개요를 제공합니다.
Biological 샘플이 매우 복잡하며 수집된 라만 스펙트럼에 기여 biomolecules의 이기종 혼합 구성되어 있습니다. 따라서 스펙트럼 패턴은 매우 복잡하고 라만 스펙트럼 내에서 분자의 단일 유형의 모니터링은 다른 분자 신호의 중복으로 달성하기 어렵습니다. 또한 샘플의 본질적인 형광이 약한 라만 신호의 귀중한 정보를 숨길 수 있습니다. 흥미롭게도, 우리의 이전 연구의 일부로, 우리는 적절한 분석 도구를 사용하여 셀 타입 (MSCS와 섬유아 세포) 사이의 주요 차별화 요소로 라만 스펙트럼에 autofluorescence 밝혀졌습니다. 13 저희는 또한 전체 라만 신호 강도의 변화가 될 수있는 식별 콜라겐과 대동맥 밸브 전단지의 ECM 내의 콜라겐 섬유의 상태에 대한 표시가 9. 그러나 이러한 조직에서 엘라스틴의 상태를 분석했을 때, 우리는 비슷한 결과를 검색할 수 없습니다. 마찬가지로 결과에 언급의 섹션, 우리는 네이티브 컨트롤에 비해 엘라스타제-대우 샘플에서 특정 라만 밴드의 변경을 감지할 수 있었다. 우리는 예상대로 효소 처리 - 처리 샘플에 전체 라만 신호의 감소를 보지 못했어요. 이러한 관찰은 이전 연구에서 본대로 명확한 클러스터 형성을 밝히지 않았 점수 음모에 결과. 반면 9, 효소 치료의 영향 PCA 결과 내에서 감지되었다. 우리는 두 ECM 단백질, 엘라스틴과 콜라겐 사이에 이러한 차이는 형태학의 차이와 다양한 효소 저하 프로세스를 기반으로하는 것으로 가정합니다 : 대동맥 밸브 전단지 내에 콜라겐이 풍부한 영역 (fibrosa)은 인해에 느슨하게된다 지속적인 레이어이다 효소 치료, 약자 영역 (ventricularis)이있는 엘라스틴이 엘라스타제에 노출 (그림 4) 후 조각 나타나는 네트워크 구성을 가지고 있습니다. 단일 스폿 측정 따라서 appropri 아니었엘라스틴 네트워크 내에서 이러한 작은 파열을 감지 먹었다. 여기서 조직의 라만 매핑은 네트워크 고장을 식별하는 데 도움이 될 것이다.
생물 학적 샘플의 라만 분광에 대한 도전은 측정 시간을 줄이는 것입니다. 하나의 솔루션은 생물 학적 샘플 사진 손상에 의해 영향을받지 않는 동안에는 적합한 레이저의 파워를 늘리는 것입니다. 현재 실험의 모든 기초 연구에 초점을 증명 원리 연구가 있지만, 우리의 전반적인 목표는 재생 의료 (조직 - 공학 제품의 예 : 품질 관리), 사전 이식 이식 모니터링 등 임상 응용을위한 라만 분광법을 구현하는 것입니다 암 진단.
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
우리는 원고에 대한 자신의 유용한 제안을 위해 자신의 기술 지원과 섀넌 리 Layland (Fraunhofer IGB 모두 슈투트가르트)에 대한 Steffen 코흐 감사드립니다. 이 작품은 재정적 Fraunhofer-Gesellschaft와 BMBF (KS-L까지 모두.)의 유치 프로그램에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 엘라스타제 | 워딩턴 | LS006363 | |
| 안티 엘라스틴 항체 | 시그마 | HPA018111 | 1:75, 구연산 완충액 |
| PBS | Lonza | 17-512F | |
| 유리 바닥 요리 | Greiner BioOne | 627,860 | |
| Unscrambler | 카모 | ||
| 작 | Bruker |
참고문헌
- Chan, J. W., Lieu, D. K. Label-free biochemical characterization of stem cells using vibrational spectroscopy. J. Biophotonics. 2, 656-668 (2009).
- Downes, A., Mouras, R., Elfick, A. Optical spectroscopy for noninvasive monitoring of stem cell differentiation. J. Biomed. Biotechnol. 2010, 101864-101864 (2010).
- Gentleman, E. Comparative materials differences revealed in engineered bone as a function of cell-specific differentiation. Nat. Mater. 8, 763-770 (2009).
- Notingher, I., Hench, L. L. Raman microspectroscopy: a noninvasive tool for studies of individual living cells in vitro. Expert. Rev. Med. Devices. 3, 215-234 (2006).
- Schenke-Layland, K. Optimized preservation of extracellular matrix in cardiac tissues: implications for long-term graft durability. Ann. Thorac. Surg. 83, 1641-1650 (2007).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 122, 12(1928).
- Frushour, B. G., Koenig, J. L. Raman scattering of collagen, gelatin, and elastin. Biopolymers. 14, 379-391 (1975).
- Pudlas, M., Koch, S., Bolwien, C., Walles, H. Raman spectroscopy as a tool for quality and sterility analysis for tissue engineering applications like cartilage transplants. Int. J. Artif. Organs. 33, 228-237 (2010).
- Votteler, M. Raman spectroscopy for the non-contact and non-destructive monitoring of collagen damage within tissues. J. Biophotonics. , (2011).
- Wold, S., Esbensen, K., Geladi, P. Principal component analysis. Chemometrics and Intelligent Laboratory Systems. 2, 37-52 (1987).
- Pudlas, M. Raman Spectroscopy: A Noninvasive Analysis Tool For The Discrimination of Human Skin Cells. Tissue Eng. Part C Methods. 10, (2011).
- Movasaghi, Z., Rehman, S., Rehman, I. U. Raman Spectroscopy of Biological Tissues. Applied Spectroscopy Reviews. 42, 493-541 (1080).
- Pudlas, M. Non-contact discrimination of human bone marrow-derived mesenchymal stem cells and fibroblasts using Raman spectroscopy. Medical Laser Application. 26, 119-125 (2011).
- Mecham, R. P. Methods in elastic tissue biology: elastin isolation and purification. Methods. 45, 32-41 (2008).
- Downes, A., Mouras, R., Bagnaninchi, P., Elfick, A. Raman spectroscopy and CARS microscopy of stem cells and their derivatives. Journal of Raman Spectroscopy. 42, 1864-1870 (2011).
- Krafft, C., Dietzek, B., Popp, J. Raman and CARS microspectroscopy of cells and tissues. Analyst. 134, 1046-1057 (2009).
- Schenke-Layland, K. Non-invasive multiphoton imaging of extracellular matrix structures. J. Biophotonics. 1, 451-462 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유