Method Article
뇌 이식 Microdevices과 주변 조직의 손상 조직 학적 특성
요약
여기 광학 삭제하고, 쥐 뇌 조직에 만성 이식 microdevices 주변의 이미지 그대로 뇌 조직 인터페이스를 라벨, 캡처하기위한 조직 학적 방법을 제시한다. 이 방법을 포함하는 기술의 결과는 주변 조직의 다양한 관통 뇌 이식의 영향을 이해하는 데 유용합니다.
초록
디자인 및 microelectrode 배열과 같은 뇌 이식 microdevices의 활용 연구는 뇌 조직을 둘러싼으로 만성 인터페이스 임상 관련 장치를 생산하는 것을 목표로하고 있습니다. 이러한 이식을 둘러싼 조직은 장치 주변의 절연 "glial 흉터"의 형성을 포함 시간이 지남에 따라 장치의 존재에 반응하는 것으로 생각된다. 그러나, 이러한 조직 변화의 조직 학적 분석은 일반적으로 관심의 조직의 형태를 방해 할 수있는 과정에서 장치를 explanting 후 수행됩니다.
여기 대뇌 피질 - 주입 장치가 쥐 뇌 세포를 둘러싼에 손상 수집되는 프로토콜을 보여줍니다. 우리는 한 번 정착액과 perfused 방법을 설명, 머리 제거 및 explanting 장치를 피하기 위해 같은 방법으로 썰어 있습니다. 우리는 형광 항체 라벨링 및 정보, 아직 두꺼운 조직을 생산하는 데 유용 광학 개간 방법을 설명절을 참조하십시오. 마지막으로, 우리는 뇌 이식 장치 주변의 생물 인터페이스를 조사하기 위해 이들 조직 섹션의 장착 및 이미징을 보여줍니다.
서문
neuroprosthetic 연구 분야는 장치 1,2를 인터페이스 CNS를 통해 몸에 병에 걸린 또는 손상된 구조를 우회하여 다양한 장애 질환을 앓고있는 사람들을 지원하는 것을 목표로하고 있습니다. 이러한 microelectrode 배열 (MEAs)과 같은 뇌 이식 microdevices은, 기록 또는 자극 뇌 구조를, 그래서 전자와 CNS 조직 3-5 사이의 장기 인터페이스의 설립을 허용하는 데 사용할 수 있습니다. 관통 MEAs, 뇌 조직에 구동 장치는,이 근처 뉴런 6 상대적으로 작은 집합에 전극을 제시하는 이내에 가까이로 인해 양방향 인터페이스와 같은 특정 약속을 누르고 있습니다.
하지만, 관통 MEAs의 장기 이식에서 복잡한 조직 응답 결과는 종종 개월 일 동안의 변수를 점차적으로 저하 electrophysiological 신호 대 잡음 비율의 결과로, 전기 imped의 증가전극 사이트 및 지상 7,8 사이의 ance. 이러한 변화의 putative 기원은 microglia의 활성화, microdevices 따라 반응 astrocytosis 및 주입 장치 9-11에 주변 조직에서 뉴런의 손실이나 마이그레이션이 포함되어 있습니다. 만성, 침투 MEAs에있는 이런 조직 변화를 이해하는 데 큰 문제는 만성 이식 장치 12를 둘러싼 그대로 조직 인터페이스의 조직 학적 데이터를 캡처에 어려움이 있습니다. 여전히 현재 장치 / 조직 인터페이스를 조직의 조직 학적 분석은 현재의 장치 제거 조직 학적 프로토콜을 개선합니다. 조직에 남아 그대로 장치와 함께, 이러한 biocompatible 코팅 13,14 또는 전극 표면 15,16의 전기 개간의 활용 등 상대적으로 미묘한 상호 작용,의 생물학적 영향은 이미징 될 수 있고 임플란트에 대해 분석했다.
H오히려 우리는 수집하는 방법, 프로세스 및 이미지 주변 뇌 조직의 자세한 현미경 기반의 분석을 위해 그대로 microdevice 인터페이스를 보여줍니다. 이 방법에서, 장치 및 주변 뇌 조직은 vibratome를 사용하여 두께 (> 250 μm) 조직 섹션에 저장됩니다. 이 두꺼운 조각으로 조직 학적 라벨 침투을 개선하기 위해 형광등 histochemical 및 immunohistochemical 라벨은 여러 일 동안 차단 혈청 및 세제를 포함하는 솔루션에 높은 농도에 적용됩니다. 광학 개간 솔루션은 현미경 이미징 깊이를 개선하기 위해 고용하고 있으며, 조직은 공 촛점 현미경 17 스캔 이후 레이저를위한 양면 챔버에 장착되어 있습니다. 전체 조직 학적 인터페이스를 캡처하려면, 컴퓨터 제어 병진 무대 임플란트의 길이를 따라 Z-스택 파노라마를 수집하는 영상 중에 사용됩니다. 영상뿐만 아니라 임플란트에서 돌아온 레이저 반사율를 수집, 조직 라벨을 적용및 조직 도움말 모두를 통해 전송 빛이 조직을 주변에 관련 장치 인터페이스를 현지화. 조직이 '디바이스 캡처 조직학 "을 사용 준비 (DCHist) 프로토콜은 morphologically 보존 조직 / 장치의 상호 작용에 대한 이미징 액세스를 제공하므로 이전 장치 제거 조직 학적 프로토콜 18시 향상시킵니다.
프로토콜
솔루션
산도 7.4에서 9g NaCl, 0.144 g KH 2 PO 4, 0.795 g 오세영 2 HPO 4, g / L의 - 인산염은 식염 (PBS)를 버퍼
4 %의 포름 알데히드 -에 ML / L, 202 ML 나트륨 인산염 이염 기성 솔루션 (0.4 M 오세영 2 HPO 4), 48 ML 나트륨 인산염 일 염기의 솔루션 (0.4 M 아뇨 2 PO 4), 500 ML 8 % 포름 알데히드 용액, 250 ML 밀리 산도 7.4의 Q DDI 물,
7.5 g NaCl, 0.3 g KCl, 0.06 g KH 2 PO 4, 0.13 g 오세영 2 HPO 4, 2g 포도당, 2.4 g의 HEPES, 0.05 g MgCl 2, g / L의 - HEPES은 나트륨 Azide (HBHS)와 행크의 식염 버퍼 6 부품 H 2 O, 0.05 g MgSO 4 7 부품 H 2 O, 0.165 g CaCl 2, pH를 7.4에서 0.09 g 앤 3
워시 솔루션 (WS) - 1퍼센트 권 / 권이나'말의 염소 혈청, 0.3 % 트리톤 나트륨 azide (할머니 3) HBHS의 X-100,. 4 번 ° C 이후 단계에서 사용하기 전에 WS 냉장.
U2 무서 리터 전자 솔루션 - 4 M의 우레아, 30 % 글리세롤과 0.1 % 트리톤 X-100 17
절차
모든 실험은 퍼듀 동물 관리 및 사용위원회와 Purdue 대학의 실험실 동물 프로그램의 감독하에 수행되었다.
1. 외과
- 다양한 무균 수술 방법은 제시 조직 학적 방법과 호환됩니다. stereotaxic 프레임 및 자동 inserters의 사용은 stereotaxic 비행기와 관련하여 재현성과 microelectrode 배열 (MEA)의 제어 주입 각도를 개선하는 것이 좋습니다.
참고 : 다음과 같이이 예제에서 우리 수술 방법은 다음과 같습니다 : stereotaxic earbars whil에서 쥐 주제를 개최isoflurane 마취하에 e는 (1-3 % 사이) 의료 학년 산소에 의해 운반. 발가락 - 핀치의 부족에 대한 테스트는 동물이 완전히 anesthetized 있는지 확인하기 위해 마우스의 꼬리 핀치 반사의 쥐 또는 부족에 반영하고 있습니다. 눈 연고를 적용하고 Betadine과 에탄올 세 번갈아 세차와 외과 사이트를 청소하십시오. 워시 손 새벽 수술 장갑, 헤어 넷, 안면 보호구 및 가운. , 외과 영역을 마비 가위 나 뼈 스크레이퍼와면 applicators과 메스, 맑은 골막을 사용하여 절개를 만들고, 치과 드릴 핸드 피스와 드릴 비트를 사용하여 craniotomy을 만들 Lidocaine의 bolus를 삽입. micromanipulator를 사용하여 피질에 단일 생크 MEA를 운전. 무균 수술 조건을 유지에 수술 보조 원조가 있으며 수술의 진행 상황을 문서화.
- 뇌에 MEA의 주입 후, B 주변에서 두개골의 최종 제거를 알려 수술 현미경을 통해 이미지를 수집비. 장치의 주입 부분은 현장에 보존됩니다.
참고 : 현장 장치와 조직의 최종 컬렉션 밀접하게 조직 sectioning의 비행기에 장치 삽입 비행기를 일치에 의존하고 있습니다. 뇌를 기준으로 장치 삽입 비행기에 대한 자세한 사항 때문에 매우 중요합니다.
- 장치 주입 후에는, 노출 MEA 정강이 또는 케이블 주위에 실리콘 엘라스토머 편의점 - 실 (WPI)를 적용하고, 치료 할 수 있습니다. 이러한 컷 피펫 팁 등의 살균 플라스틱 조각은, 치료하는 동안 작은에 잘 craniotomy 주변의 실리콘 탄성 중합체를 포함하는 데 도움이 될 수 있습니다.
- 두 부분의 층 편의점 - 실 이상 치과 아크릴 ( "제트 액체"와 랑 치과에서 "제트 분말")와 노출 된 두개골을 적용합니다.
참고 : 나중에 단계에서 headcap는 분리 될 수있는 임플란트을 할 수 있도록을 통해 녹아 될 것입니다두개골에서. 이 매우 어려운 아크릴 나중에 제거하기가 어렵습니다으로 UV-경화 아크릴은 편의점 - 실 및 craniotomy으로 피해야한다. 임플란트 주변의 시각 불투명 한 물질은 피해야한다, 명확 편의점 - 실이 프로토콜의 후속 단계에서 임플란트의 전망을 제공합니다.
- 동물 복지 규정의 로컬 프로토콜에 따라 수술 치료 절차를 수행하고 단일 자리 잡고 케이지 - 상자에 외래 과목을 반환합니다.
2. 재관류 및 조직 컬렉션
참고 : 게이지 외를 참조하십시오. 쥐 동물 모델 19에 대한 자세한 재관류 절차 연습하십시오.
- 기관의 동물 관리 및 사용위원회의 승인을 마취 및 재관류 프로토콜을 사용합니다. 깊이 쥐를 (쥐 또는 마우스의 꼬리 - 핀치 반사의 발가락 - 핀치 반사의 부족에 의해 확인) anesthetizing과 마음을 노출 한 후에 얕은 가위 컷을왼쪽 심실과 오른쪽 아트리움합니다. 왼쪽 심실에 무딘 바늘을 넣고 실 온도 PBS를 제공합니다. 시 ~ 10 ML PBS의 총을 제공합니다 ~ 5 ML / 마우스의 분, ~ 200 ML PBS ~ 100 ML / 쥐의 분. 시 간으로 혈액 통관을 찾아보세요.
- 원할 경우 거품을 소개 방지하기 위해 담당과 주사기 전달에 의해, transcardially histologically 관련 화학 레이블을 삽입.
참고 : 혈관 라벨 (예 : DiI) 및 핵산 counterstain 염료은 (Hoechst 33342 등) 재관류 동안 배달 화학 라벨의 예입니다. 제대로 관리하면 이러한 조직 학적 마커 전체 동물 20 레이블을해야합니다.
- 버퍼, 룸 온도, 동물을 해결하는 transcardially 4 % 포름 알데히드를 제공합니다. 재관류 동안 폐, 코 배수에 의해 입증 할 수있는 심장,에서 중격의 천공을 피하십시오. 큰 근육에 고정 흔들림을 찾습니다완전한 재관류를 표시합니다. 시 ~ 10 ML의 정착액의 총을 제공합니다 ~ 5 ML / 마우스의 분, ~에서 ~ 200 ML의 정착액 100 ML / 쥐의 분.
- 재관류 후, 동물 목을 벨 4 ° C.에서 뇌 줄기 나 밤새 4 %의 포름 알데히드 용액에 rongeurs이나 가위, 및 장소 헤드를 사용하여 소뇌의 일부를 노출
- 세차 사이 1-4시간 간격으로 PBS의 세 변화에 머리를 씻으십시오.
- 개월 일 동안 4 ° C에서 나트륨 azide를 포함하는 HBHS에 고정 헤드를 저장합니다.
3. 현장 장치의과 뇌 제거
참고 : 적절한 개인 보호 장비를 입고있을 때 연기 후드에서이 섹션을 수행합니다. 정기적으로 솔루션을 HBHS하기 위해 고정 머리를 반환하여 조직 건조하지 마십시오.
- 포셉 작은 가위를 사용하여 아크릴 두개골 캡 주위의 피부와 다른 조직을주의 깊게을 멀리 해부.
- 열 전을 입고 있지만nsensitive 장갑, 치과 아크릴을 제거하고 편의점 - 실 (그림 2A) 명확한 하부의 영역을 노출 납땜 인두를 사용합니다.
참고 :이 단계의 목적은 뇌 이식 구성 요소가 두개골에 고정 구성 요소가 분리 될 수 있도록, 마이크로 가위에게 주입 장치가 뇌를 입력 위치에 대한 액세스 권한의 적절한 각도를 허용하는 것입니다.
- 수술 현미경 아래에서 장치가 뇌를 입력하는 위치에 핀셋과 편의점 - 실의 작은 조각을 제거 곡선 마이크로 가위로 실리콘 엘라스토머로 자른다.
- 뇌에 이식 구성 요소에서 폴리 실리콘과 두개골에 부착 된 별도의 장치 구성 요소에 곡선 마이크로 가위로 craniotomy의 표면을 따라 절단 계속합니다. 노출 된 장치 구성 요소를 절단되면 다시 노출을 밀어 또는 드래그 방지하기 위해 관리하고, 현미경 배율과 훌륭한 관리를 사용하여고정 조직에서 lants.
- rongeurs를 사용하여주의 headcap 주위 뼈를 제거합니다. 두개골에서 주입 장치와 뇌를 분리 주걱을 사용합니다. 가를 할 준비가 될 때까지 HBHS 솔루션에 뇌를 저장합니다.
- HBHS로 가득 찬 유리 페트리 접시에 뇌를 놓고, 그리고 그들이 장치 주입의 위치와 관련이 있는지 여부에 따라 이러한 척추, 소뇌, 또는 후각 망울로,없는 조직을 제거하기 위해 면도날을 사용합니다. 섹션 뇌를에 뇌 블록 (테드 펠라)와 면도날을 사용하여 밀접하게 주입 장치의 각도와 일치하는 평면 평면을 생성,이는 등 어떤 그 뇌를 오리엔테이션, 적절한 크기의 뇌 블록의 뇌를 배치하여 수행됩니다 임플란트의 눈에 보이는 부분은 면도날 가이드와 병렬이며, 블레이드 가이드 임플란트에서 최소한 2mm의 면도날을 배치. 조직을 통해 면도날을 누릅니다. vibratome 플랫폼이 표면을 탑재합니다. Alternatively, 면도날이 밀접하게 보형물의 방향을 일치 비행기를 만들 수있는 뇌 블록으로 비슷하게 제어 방식으로 사용할 수있는 micromanipulator에 장착.
- 장소 vibratome 플랫폼에 따라 얼음, 그리고 조직 표면이 잠시 종이 타월에 건조 할 수 있도록 한 후, 슈퍼 접착제를 사용하여 vibratome 뇌를 준수합니다. 접착제는 이전 단계에서 만든 평면 조직 비행기는 무대하는 것입니다. 비대칭 조직 크기로, 방향 폭 넓은 차원의 가능성이 위에 조직을 노크 블레이드를 방지하는 데 도움이 vibratome 블레이드의 운동 방향과 평행하게 아래로 접착되는 등의 샘플. 접착제 세트 후 (~ 1-2 분) 추가, 차가운 (~ 4 ° C) 조직 주변의 vibratome 요리에 PBS.주세요
- 호에서 10 °의 블레이드 각도로, 최대 진동 속도 (~ 100 Hz에서)과 느린 블레이드 진행 속도 (초당 <0.2 mm)을 사용하여, 컨트롤 조직을 포함 200-400 μm 사이에 두꺼운 조직 조각 수집rizontal. 4에서 24 잘 플레이트에 HBHS에서 브러쉬 나 주걱 주걱 및 점포주의 깊게 조각을 수집 ° C.
- 현장 장치의이 남의 도움이 눈이나 수술 현미경 볼 수있게되면, 100 μm 이하의 슬라이스 단위로 장치를 접근 얇은 부분을 수집합니다.
참고 : 일반적으로 실리콘 마이크로 임플란트는 장치 표면에서 300와 500 μm 사이의 포름 알데히드 - 고정 쥐 대뇌 피질 조직에서 남의 도움이 눈 볼 수 있습니다.
- 현장 장치는 이제 조직의 표면 가까이로 내 장치를 포함하는> 250 μm 조직 슬라이스를 수집합니다. 필요한 두께의 평가는 이전에 수집 한 조각을 참조하여 도왔 할 수 있습니다.
참고 : 큰 장치, multishank 장치 및 직각 장치는 두꺼운 조직 슬라이스 (> 500 μm가) 한 조직 부분에있는 장치를 캡처해야 할 수도 있습니다, 재적용 라벨의 침투 및 현미경 이미징 깊이 모두이 매우 두꺼운 조각에서 최종 데이터 수집 제한됩니다 회원이다. 가능하면이 조직과 형태학의 변형을 통해 장치의 드래그가 발생할 수로, vibratome 블레이드 장치를 때리는하지 마십시오.
4. 조직 가공 클리어링
- HBHS에 세탁 당 5 분에서 3 배 조각을 씻으십시오
- 30 분 총 (15 분 슬라이스의 각 측면)에 대해 (5 MG NaBH 4 / HBHS 1 ML) 나트륨 borohydride에 품다. 스테인리스 스틸이나 테플론 코팅 마이크로 스푼과 작은 붓 (테드 펠라)를 사용하여 조각을 뒤집. 느리고 사려 깊은 움직임은 각 슬라이스 플립의 성공을 향상시킬 수 있습니다. 붓으로 주입 장치 주변에있는 지역을 터치하지 마십시오. 가능하면, 필요한 (> 2 ML)보다 훨씬 더 많은 솔루션을 추가하는 것은 사람이 더 쉽게 조직 조각을 조작하고 대칭 할 수 있습니다.
참고 :이 단계는 autofluorescence 내생 감소, 형광 라벨이 재관류 동안 적용 또는 XFP 유전자 변형 마커가 존재 한 경우에는이 단계를 건너 뛰십시오.
- 상온에서 워시 솔루션의 세척 당 5 분에서 3 배 조각을 씻는다.
참고 : 세척과 부화 단계 동안 교반는 선택 사항입니다. 저자는 주변 뇌 조직에 대해 치열한 임플란트의 부조화 미묘한는 동요가 발생할 수 있다는 추측. 솔루션의 움직임을 증가시키는 동시에 그러나, 완만 한 속도 (<60 RPM)에서 이동 궤도 믹서는이를 방지 할 수 있습니다.
- 객실 온도 (플립 조각 일시간 이후)에 워시 솔루션에서 2 시간에 차단할 수 있습니다.
- 4 ° C.에 약 48 시간 (슬라이스의 각면에 24 시간)에 대한 기본 항체 (워시 솔루션에 희석)에 품다
- 워시 솔루션 6 빠른 3 분 세차를 수행합니다.
- 6, 1 시간 세차 (3 세차를 수행워시 솔루션의 조직 슬라이스의 각면에 에스) (4에서 저장 ° C 세탁기 밤새 경우).
- 4 ° C.에 약 48 시간 (각면에 24 시간)에 차 항체 (워시 솔루션을 희석)에 품다
- 워시 솔루션 6 빠른 3 분 세차를 수행합니다.
- 밤새 세탁기 경우 4에 저장 ° C, 워시 솔루션에서 6, 1 시간 세차를 (각면에 3 세차) 수행합니다.
- 개간 솔루션 - 솔루션을 씻고 글리세롤 기반 "무서 리터 전자 U2 '을 추가 제거합니다. 4 ° C.에 아주 두꺼운 조직 섹션 (> 500 μm)를 두꺼운 조각 (250-500 μm) 또는 2-3주에 약 1 주일 삭제 할 수 있도록 허용
- 4 ° C.에 호일 및 매장과 커버 플레이트
- 설치 미디어로 개간 솔루션을 사용하고 투명 매니큐어를 씰링 두꺼운 조직 섹션 (그림 2B, 2C)를 수용 슬라이드에 탑재합니다. ° C까지는 빛의 4에 저장합니다.
5. 전체 티의 파노라마 영상ssue 및 장치 인터페이스
- 오래 작동 거리 현미경 목표를 (> 2mm)을 사용하여 공 촛점 현미경 또는 2 광자 현미경 레이저 이미징을 시작합니다. 우리는 Zeiss LSM 710, 칼 Zeiss '선 (禅)'소프트웨어 (2010), 이미지 임플란트 주위에 3D 파노라마를에 컴퓨터 제어 XY 번역 단계를 보여줍니다.
참고 : 목적에 시정 칼라 통해 소프트웨어의 삭제 솔루션의 굴절률에 대한 올바른, 또는 수집 한 후 처리 데이터를 인치 이 예제에서 우리는 Leica 선 현미경 소프트웨어에 1.4의 "U2"개간 솔루션에 대한 굴절률 값을 입력,이 설정은 미묘하게 굴절률이 일치를위한 계정에 Z-단계 간격을 조정합니다.
- 장치 근처 조직에서 약 낮은 레이저 파워 (~ 0을 사용하여 각 형광 채널 Z 차원에서 해당 Z 축 창 및 데이터 수집 설정을 평가0.5-5 %)과 대형 Z 단계 크기 (> 25 μm).
참고 : 파노라마 데이터 수집에 설정할 때 조직은 슬라이드 유리 (~ 20 μm 각 방향)에 완전히 평면 거짓말을하지 수 있으므로, Z 축을 설정할 때 위 아래 추가 공간을 포함합니다.
- 귀하의 최종 파노라마의 XY 중앙에 목표를 설정하고, 선 (禅) 파노라마 소프트웨어를 사용하여 관심 지역을 커버하기 위해 각 축 (x와 y)에 필요한 수집 위치의 수를 결정합니다.
- 재평가 및 Z 축 수집 창을 완료.
- 수동으로 증가 깊이와 적절한 방면 진입로 검출기 감도 및 레이저 전원을 설정하고, 목표는 조직 슬라이스에 관계없이 이미지 깊이의 약 같은 이미지 강도를 유지하기 위해하지만, 높은 배경 잡음도를 피하기 위해 일반적이다.
- 각 형광 이미지 데이터 시리즈를 수집합니다. 신호를 중복 방지하기 위해 필요한 경우, 레이저 라인을 실행순차적 s입니다.
참고 : 가능한 경우, 자동으로 수집하는 동안 하드 드라이브에 데이터를 저장 할 수있는 소프트웨어를 설정합니다.
- "반사율"와 "투과율"데이터를 수집하는 소프트웨어 설정을 변경하고이 채널을 캡처 할 이상 더 침투하는 파장 레이저 (예를 들어 633 nm 정도)을 사용합니다. "반사율"와 "투과율 '컬렉션에 해당하는 레이저 전력 및 검출기 감도를 확인하고 주입 장치 주변의 같은 컬렉션 시리즈를 반복합니다.
- 나중에 처리, 정량화 및 분석을위한 데이터를 내 보냅니다.
결과
뇌 이식 MEAs 먼저 뇌 내장 된 구성 요소에서 모든 두개골 마운트 구성 요소를 분리하여 조직 슬라이스에서 수령하실 수 있습니다. 그림 2A 한 치과 시멘트 headcap의 측면과 MEA 케이블을 주변 편의점 - 실의 일부를 제거하는 결과를 보여줍니다 쥐 두개골 있습니다. 납땜 인두는 연기 후드에 치과 시멘트와 편의점 - 실을 제거하는 데 사용되었다. 케이블 및 비 이식 MEA 구조는 다음 천천히 고정 뇌의 표면에 편의점 - 실을 통해 다운 발굴하여 마이크로 가위로 잘라되었습니다.
썰기 한 후, 라벨, 그리고 조직을 삭제, 간단한 주문 제작 슬라이드 두꺼운 조직 슬라이스 (그림 2B)를 장착하는 데 유용합니다. 이식 microdevice을 포함 장착 뇌 슬라이스은 그림 2C에 표시됩니다. 그림 3에서 보여준대로 슬라이드의 양쪽을 통해 이미징, 당신은 장치 주위 인터페이스를 평가하도록 허용 할 수 있습니다 (그림 3A)와 microglia는 다른 쪽 (그림 3B)에서 볼 수 있습니다.
일단 장착, 조직은 XY 번역 단계를 사용하여 이미지로 할 수 있습니다. 전체 조직 슬라이스에 걸쳐 형광 라벨의 개요는 원하는 해상도 (그림 4)에서 생성 할 수 있습니다. 주입 microdevices 주변의 morphologically 보존 조직 인터페이스의 상세한 시험은 지역 조직 반응 (그림 5)의 분석을 위해 높은 배율에서 수령하실 수 있습니다.
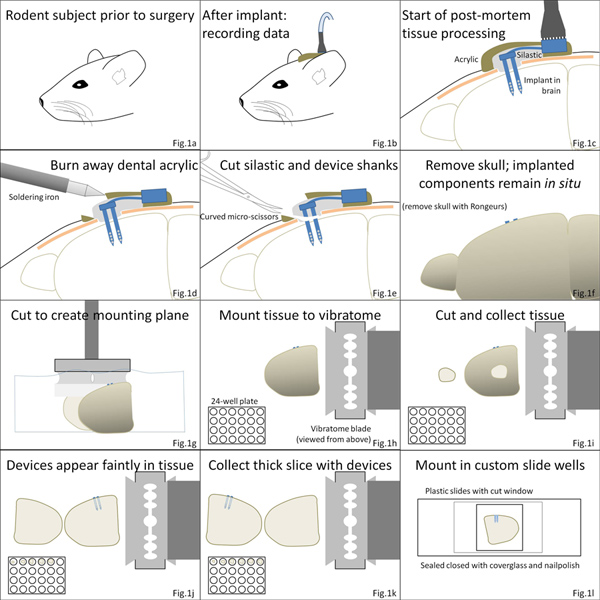
1 그림. 절차의 개요. (AC) 뇌 마이크로 임플란트 수술은 에서야 아르즉시 장치를 주변 편의점 - 실 폴리머의 레이어로 lized, 아크릴 시멘트 덮개에 이어. (D, E) 다음과 같은 안락사는, 아크릴 층이 타 버렸 있으며, 장치의 두개골 마운트 구성 요소 실리콘 탄성체를 통해 절단에 의해 주입 된 구성 요소에서 분리됩니다. (F, G) 뇌는 다음 두개골에서 제거하고 잘라 vibratome 단계에 장착된다. (HK) 조직 슬라이스가 장치를 포함하는 조직 슬라이스를 포함하여 수집하고 있습니다. (L) 조직은 다음 처리 및 세부 현미경에 대한 사용자 정의 방에 마운트 할 수 있습니다. 더 큰 그림을 보려면 여기를 클릭하십시오 .
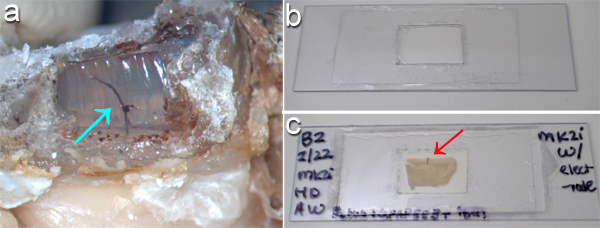
그림 2. (A) 편의점 - 실 실리콘 엘라스토머 님을 지우기전극 배열 케이블 (화살표)를 rrounding 것은 납땜 인두를 사용하여 perfused 쥐 머리에 치과 시멘트 모자에 창을 거리에 굽기에 의해 노출되어 있습니다. (b)는 두꺼운 조직 슬라이스의 양쪽에 영상을 수용하기 위해, 간단하게 "슬라이드 방"플라스틱 슬라이드를 절단하고 조직 주위 양쪽에 coverglass을 준수하고 솔루션을 장착하여 만들 수 있습니다. (주) 그대로 이식 (빨간색 화살표)와 쥐의 뇌 조직 슬라이스는 설치 후 표시됩니다. 조직의 양쪽이 설정에 현미경 영상에 신속하게 액세스 할 수 있습니다. 패널 (B, C)가 맨 아래에있는 전체 80mm 반면 규모를 들어, 패널 (a)는, 하단에서 25mm입니다.
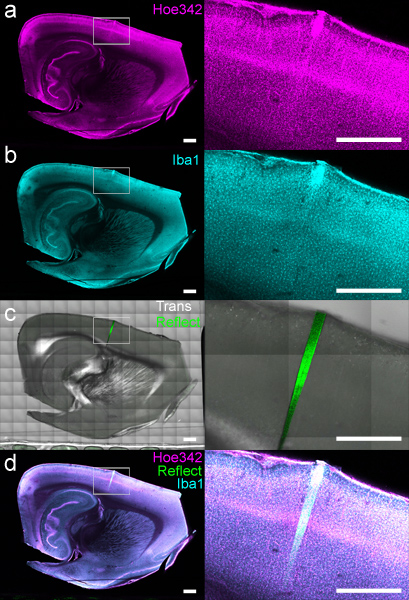
그림 3. 최대 정수ensity는 40 μm 두께 이미지 스택의 Z-투영, 뒷쪽 (a)와 이식 microelectrode 배열의 앞 (B) 주변에 모았습니다. Microglia (반 Iba1하고, 알렉사 형석 633, 흰색으로 표시)와 장치의 표면에서 수집 된 레이저 빛의 반사율 (적색)는, 순차적으로 400 μm 두께의 조직 슬라이스의 양쪽에서 이미징되었습니다. 뇌 이식은 종종 불투명에 따라, 양쪽에 광학 접속을 장착하면 현미경 대물에 대해 임플란트 "뒤에"이라는 조직 구조의 명확한 전망을 제공합니다. 스케일 바 50 μm.
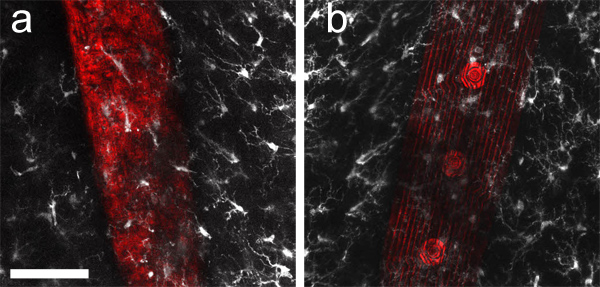
그림 4. 공 촛점 현미경 레이저에 컴퓨터 제어 단계를 사용하여 이미지로 표시 DCHist 슬라이스. (가) 세포 핵 (Hoechst 33342 물들) 및 (b) 단핵 세포 / microglia(안티 Iba1으로 표시)은 동시에 별도의 채널에 이미징했다. (C) 전송 빛과 반사율은 Hoechst와 Iba1 데이터와 관련하여 4 주 보형물의 위치를 보여주는 수집되었습니다. (D) 모든 채널 만 전송 오버레이도 표시됩니다. 흰색 사각형 영역이 바로 위에 표시 이미지에 확장됩니다. 스케일 바 1mm.
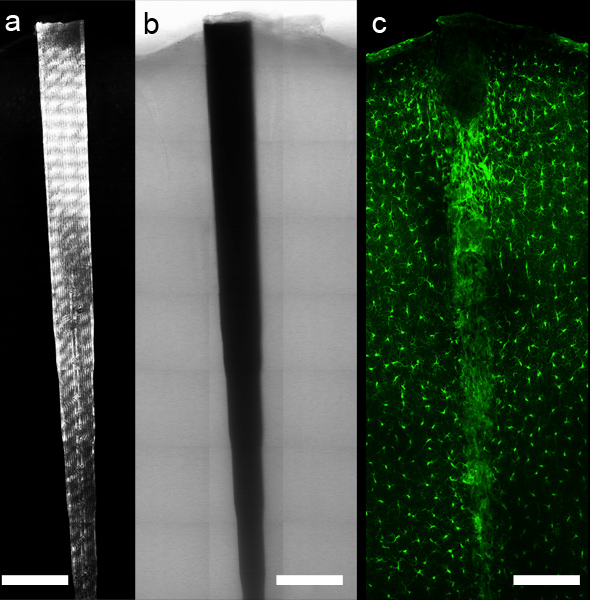
그림 5. 컴퓨터 제어 현미경 무대와 적절한 소프트웨어를 사용은, 탁 트인 영상 데이터는 임플란트 주위에 수령하실 수 있습니다. 반사율 (a)와 투과율은 (B), 장치의 국산화를 허용하면서 형광 항체 또는 화학 라벨 (C, microglia 및 Mac의 방지 Iba1 라벨) rophages은 그대로 조직 인터페이스를 따라 조직 구성 요소에 대한 자세한 이미징 할 수 있습니다. 스케일 바 200 μm.
토론
여기 보여 "디바이스 캡처 조직학"(DCHist) 메서드는 뇌 조직과 조직 이식 사이의 morphologically 보존의 상호 작용 가까운 조직 학적 평가를 할 수 있습니다. DCHist 조직 컬렉션은 뇌에 이식 구성 요소에서 두개골에 장착 된 장치 구성 요소의주의 분리가 필요합니다. DCHist 또한 두꺼운 조직 학적 조직 슬라이스 (> 250 μm)의 수집이 필요합니다. 이러한 조직 섹션은 한 번, 라벨 삭제, 장착 및 이미징, 주입 부상이나 내재하는 장치에 후속 만성 반응으로 소설 통찰력을 제공 할 수 있습니다. 그림 3-5와 같이 고급 현미경 도구를 사용하여 조직 및 장치 사이의 인터페이스는 이미징 될 수 있으며, 높은 자세히 분석했다.
현재의 형태로 제시 기술은 천천히 내려 장치 주입의 포인트를 두 부분으로 치과 시멘트와 편의점 - 실에서 만든 headcap을 멀리 발굴 할 수있는 능력에 의존하고 있습니다.타 버렸하거나 제거 할 수 치과 시멘트와 작은 가위가 시각적으로 크게 성공적으로 두개골에 장착 된 구성 요소에서 주입 장치를 분리에 도움이 안내 할 수있는을 통해 명확한 실리콘 엘라스토머를 활용. 현장에서 수집하기 위해 두개골 밑과 뇌 위의 장치를 자르고 것은 두개골 마운트 임플란트가 뇌에 많은 양의를 꺼내는 될 것 같은 권장하지 않습니다.
이러한 NeuroNexus 기술에서 단일 생크 MEAs와 같은 얇고 작은 이식은, DCHist 가장 의무가 있지만 원칙은 단일 장치 정강이 또는 microelectrode 배열로 제한되지 않습니다. 수집 및 이미징 전략이 요구들이 어떤 두개골 마운트에서 분리 두꺼운 조직 섹션에서 수집해야하는이되면, 멀티 생크 장치 및 cannulas과 같은 큰 임플란트에 광범위하게 적용 할 수 있습니다. 저자는 조직의 분석에 초점을 맞추고 있지만주변 피질 이식은 뇌에 깊이 구동 장치는 수집 이미징 될 수 있습니다. 임플란트 삽입의 깊이는 장치가 삽입 알려진 각도에서 격렬하게 이탈하지 않는 제공하는 슬라이스에 보형물의 캡처에 영향을 미치지 않습니다.
제한 DCHist 방법의 유용한 응용 프로그램에 존재합니다. 광학 개간 솔루션은 크게 다양한 조직 21 이미징 깊이를 향상시킬 수 있지만 뇌 조직 섹션, 특히 흰색 물질의 영역에서 마이크로 미터의 수백을 통해 이미지를 도전하고 있습니다. 더 이미징 깊이를 개선하기 위해, 두 광자 여기 현미경은 설명 광학 개간과 함께 사용될 수있다.
설명 방법의 또 다른 잠재적 인 제한은 연구자에 의해 고용 특정 형광 immunohistochemistry 방법 및 항체 할 수 있습니다. 수동 확산은 일반적으로 고정 된 조직을 통해 이러한 마커의 설립을 유도와 항원 바인딩 사이트로. 최종 항체 작업 농도는 배경 라벨의 높은 수준을 피하는 동안 라벨 침투를 극대화하기 위해 사례별로 연구자에 의해 결정되어야합니다. 항체 라벨이 동일하게 처리됩니다 조각 사이에 변수이 아니어야하지만, 다른 항체 일부 항체를 쉽게 항원에게 마이크로 미터 만 수십 깊은 항원의 라벨을 여러 깊이 수백 마이크로 미터와 다른 라벨과 함께 자신의 항원에 침투 태그 능력에 상당히 다를 수 있습니다. 우리는 응용 프로그램의 여러 일 동안 전형적인 농도보다 높은에서 항체 라벨을 적용하여이 확산을 개선하고, 희석 세제를 포함하고 혈청을 차단 솔루션 인치 설명 정기적으로 조각을 내리고하면 더 라벨을 촉진합니다. 항원 검색 단계 및 대체 고정 프로세스 (예 : 글 루타 알데히드, 전자 레인지 등) 특정 항원에 적합 할 수 있습니다. 항체 - fluoroch 차이것은 Invitrogen에서 알렉사 형석 레이블을 사용하여 저자가 관찰되지 않았습니다 불구하고 로마 conjugates 또한, 두꺼운 부분을 라벨의 성능이 다를 수 있습니다. 또는 관심의 세포 유형에 형광 단백질을 표현 형질 전환 동물 과목은 항체 라벨 침투 문제를 방지하기 위해 활용 될 수있다 eGFP 많은 형광 단백질로, 포름 알데히드 처리 한 후 자신의 형광을 유지하고, 조직 섹션에서 즉시 시각화 할 수 있습니다.
DCHist은 뇌 조직에 주입 microdevices의 영향을 캡처하고 분석하는 기술의 강력한 집합입니다. 전기 생리학 품질과 전극 임피던스 데이터를 22 생체 평가에 사용하여이 조직 학적 프로토콜을 결합하는 것은 크게 생리학의 다양성과 저하의 생물 자원에 대한 우리의 이해를 향상시킬 수. 특히 이식 신경 보철 장치의 필드는 자세한 DCHist IMA 혜택을 누릴 수 있습니다생물학적으로 중립적 인 MEA 장치의 발전을 알려 손상 장치 / 조직 인터페이스 ging.
공개
저자는, 금융 또는 기타 선언 할 관련 공개가 없습니다.
감사의 말
모든 실험은 퍼듀 동물 관리 및 사용위원회와 Purdue 대학의 실험실 동물 프로그램의 감독하에 수행되었다.
이 작업은 통해 신뢰할 수있는 신경 기술 프로그램의 일환으로 박사 잭 W. 주디 (jack.judy @ darpa.mil)의 후원하에 국방 고급 연구 프로젝트 기관 (DARPA) 마이크로 기술 사무소 (MTO)에 의해 후원되었다 공간과 해군 전쟁 시스템 사령부 (SPAWAR) 시스템 센터 (SSC) 태평양 부여 번호 N66001-11-1-4013.
저자는 자신의 현미경 전문 지식을 공유 미하일 Slipchenko, 돈 준비, 그렉 리히터, 아론 테일러, 그리고 케빈 Eliceiri 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | |||
| Hoechst 33342 | Invitrogen | 14,533 | DNA 마커 |
| 토끼 반 Iba1 | 와코 (일본) | 019-19741 | 단핵 세포 항체 |
| 치과 아크릴 | 랭이 치과 (각종 유통 업체) | 제트 틀니 수리 분말 및 액체 | Headcap 건설 |
| 편의점 - 실 | 세계 정밀 계측기 | 편의점-SIL | 노출 두개골 이식을 포함 |
| 일반 염소 혈청 | 잭슨 ImmunoResearch | 005-000-121 | 조직 처리 |
| 트리톤 X-100 | 시그마 - 알드리치 | X100-500ml | 조직 처리 |
| 요소 | 시그마 - 알드리치 | U4883 | 솔루션을 지우기 |
| 글리세린 | 시그마 - 알드리치 | G20225 | 솔루션을 지우기 |
| 장비 | |||
| 구부러진 마이크로 가위 | 세계 정밀 계측기 | 14,208 | 뇌를 제거하기 전에 임플란트를 절단 |
| 면도날 | 테드 펠라 | (다양한 크기) | 뇌 블록과 함께 사용 |
| 아크릴 뇌 Matrice | 테드 펠라 | 15,054 | 조직의 초기 비행기를 만드는 뇌 블록 |
| 플라스틱 슬라이드 | 테드 펠라 | 260225 | 장착 조직 |
| 유리 커버 | 테드 펠라 | (다양한 크기) | 장착 조직 |
| 전극 배열 | NeuroNexus 기술 | (각종 디자인) | 예 MEAs |
| Vibratome | Leica | VT1000 S | 제출 방법에 사용되는 특정 시스템 |
| Vibratome 블레이드 | (각종 공급 업체) | 조각 수집 | |
| 24 잘 접시 | (각종 공급 업체) | 조직 슬라이스를 저장하고 처리 | |
| 전동 XY-스캐닝 단계로 공 촛점 현미경 | 칼 Zeiss 현미경 | Zeiss LSM 710과 '선 (禅) 2010'소프트웨어를 | 제출 방법에 사용되는 특정 시스템 |
| 납땜 인두 | (각종 공급 업체) | headcap 발굴 |
참고문헌
- Schwartz, A. B. Cortical Neural Prosthetics. Annual Review of Neuroscience. 27, 487-507 (2004).
- Normann, R. A. Technology Insight: future neuroprosthetic therapies for disorders of the nervous system. Nature Clinical Practice Neurology. 3, 444-452 (2007).
- Rousche, P., Normann, R. A. Chronic recording capability of the Utah Intracortical Electrode Array in cat sensory cortex. Journal of Neuroscience Methods. 82, 1-15 (1998).
- Koivuniemi, A., Wilks, S. J., Woolley, A. J., Otto, K. J. Multimodal, longitudinal assessment of intracortical microstimulation. Prog. Brain Res. 194, 131-144 (2011).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing Research. 210, 112-117 (2005).
- Drake, K., Wise, K., Farraye, J., Anderson, D., BeMent, S. Performance of planar multisite microprobes in recordingextracellular single-unit intracortical activity. IEEE Transactions on Biomedical Engineering. 35, 719-732 (1988).
- Liu, X., et al. Stability of the interface between neural tissue and chronically implanted intracortical microelectrodes. IEEE Trans. Rehab. Eng. 7, 315-326 (1999).
- Williams, J. C., Hippensteel, J. A., Dilgen, J., Shain, W., Kipke, D. R. Complex impedance spectroscopy for monitoring tissue responses to inserted neural implants. J. Neural Eng. 4, 410-423 (2007).
- Polikov, V., Tresco, P., Reichert, W. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).
- Szarowski, D. H., et al. Brain responses to micro-machined silicon devices. Brain Research. 983, 23-35 (2003).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. J. Neural Eng. 6, 056003 (2009).
- Holecko, M. M., Williams, J. C., Massia, S. P. Visualization of the intact interface between neural tissue and implanted microelectrode arrays. J. Neural Eng. 2, 97-102 (2005).
- Pierce, A. L., Sommakia, S., Rickus, J. L., Otto, K. J. Thin-film silica sol-gel coatings for neural microelectrodes. J. Neurosci. Methods. 180, 106-110 (2009).
- Wilks, S. Poly(3,4-ethylene dioxythiophene) (PEDOT) as a micro-neural interface material for electrostimulation. Frontiers in Neuroengineering. 2, (2009).
- Johnson, M. D., Otto, K. J., Kipke, D. R. Repeated voltage biasing improves unit recordings by reducing resistive tissue impedances. IEEE Trans Neural Syst. Rehabil. Eng. 13, 160-165 (2005).
- Otto, K. J., Johnson, M. D., Kipke, D. R. Voltage pulses change neural interface properties and improve unit recordings with chronically implanted microelectrodes. IEEE Trans. Biomed. Eng. 53, 333-340 (2006).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14, 1481-1488 (2011).
- Woolley, A. J., Desai, H. A., Steckbeck, M. A., Patel, N. K., Otto, K. J. In situ characterization of the brain-microdevice interface using Device Capture Histology. Journal of Neuroscience Methods. 201, 67-77 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep Tissue Fluorescent Imaging in Scattering Specimens Using Confocal Microscopy. Microscopy and Microanalysis. 17, 614-617 (2011).
- Wilks, S. J., Richner, T. J., Brodnick, S. K., Kipke, D. R., Williams, J. C., Otto, K. J. Voltage Biasing, Cyclic Voltammetry, & Electrical Impedance Spectroscopy for Neural Interfaces. J. Vis. Exp. (60), e3566 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유