JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
neurodegenerative 질병의 분석에서 확산 텐서 자기 공명 영상
요약
MRI 기반 도구를 식별하기로 확산 텐서 영상 (DTI)는 기본적으로 제공 생체 내 대뇌 백질 내의 신경 장애로 인해 뇌와 병적 인 프로세스의 미세 구조. DTI 기반 분석은 그룹 수준과 하나의 주제 데이터를 모두 뇌 질환에 응용 프로그램을 허용합니다.
초록
확산 텐서 영상 (DTI) 기술은 생체 내에서 대뇌 백질 (WM)의 미세 프로세스에 대한 정보를 제공합니다. 현재 응용 프로그램은 대조군에 비해 다른 DTI 분석을 사용하여 서로 다른 뇌 질환, 특히 퇴행성 신경 질환에 WM 참여 패턴의 차이를 조사하기 위해 설계되었습니다.
DTI 데이터 분석은 변량 방식으로 수행됩니다, 함께 섬유 추적과 같은 부분 이방성 등의 지역 확산 방향 기반의 메트릭 (FA), (FT) 즉 voxelwise 비교 순서로 그룹 수준에서 tractwise 분수 이방성 통계 (TFAS)와 함께 그룹 수준에서 WM의 변경 지역의 패턴의 정의를 목표로, WM 구조에 따라 FA의 차이를 식별합니다. 정위 표준 공간으로 변환 그룹 연구를위한 전제 조건이며, D를 유지하기 위해 처리 철저한 데이터를 필요로irectional 상호 의존성. 현재 응용 프로그램은 그룹 수준에서의 데이터 분석에서 공간 정상화 동안 양적, 방향 정보의 보존을위한 최적화 된 기술 방법을 보여줍니다. 이 기초에, FT 기술은 FT에 의해 정의 된 메트릭 정보를 정량화하기 위해 그룹의 평균 데이터에 적용 할 수 있습니다. 또한, DTI 방법의 응용 프로그램, 개별 과목 단위에서 종 분석 정위 정렬 후 FA-지도 즉 차이, 신경 장애의 진행에 대한 정보를 알 수있다. DTI 기반의 결과를 더욱 품질 개선은 높은 소음 수준 그라데이션 방향 제어 제거의 응용 프로그램에 의해 전처리하는 동안 얻을 수 있습니다.
요약하면, DTI는 뇌 전체 기반 및 기관 기반 DTI 분석의 조합에 의해 다양한 뇌 질환의 독특한 WM의 pathoanatomy을 정의하는 데 사용됩니다.
서문
인간의 뇌 확산 텐서 영상
중추 신경계 백질 (WM) 책자는 neuroglia 세포의 다른 작은 집단의 여러 유형의 이외에 밀집 축삭으로 구성되어 있습니다. 축삭 내의 축삭 막뿐만 아니라, 잘 정렬 된 단백질 섬유는 뇌 WM 1 이방성 물 확산을 선도 섬유 방향으로 물 확산 수직을 제한합니다. 축삭의 주위에 수초도 내 및 세포 외 수분이 모두 이방성에 기여할 수 있습니다.
이 이방성의 정량적 인 설명은 확산 텐서 영상 (DTI)에 의해 감지 될 수있다. DTI 물 확산의 로컬 미세 특성 가중치 조직의 이미지를 생성합니다. 각 위치에서의 이미지 강도는 (로 표현 소위 자기 확산 그라디언트의 강도와 방향에 따라 감쇠B 값),뿐만 아니라 물 분자가 3 확산하는 지역의 미세 구조, 확산 계수 D, 스칼라 값에 :

그러나 WM에서 이방성의 존재 확산은 더 이상 단일 스칼라 계수를 특징으로,하지만 텐서를 필요로 할 수있다  첫 번째 접근에서 이러한 방향으로 4 사이의 각 방향과 상관 관계에 따라 분자의 이동성을 설명하는. 확산 이방성은 주로 WM의 섬유 책자의 방향에 의해 발생되고 그 마이크로 및 macrostructural 기능에 의해 영향을 받는다. 미세 기능, intraaxonal 조직 섬유의 밀도 외에 확산 이방성에 큰 영향이 될 것으로 보인다ND 세포 포장, 수초 정도, 개별 섬유 직경. 거시적 규모에서 영상 복셀의 모든 WM 책자의 방향 변화는 이방성 5의 정도에 영향을 미칩니다.
첫 번째 접근에서 이러한 방향으로 4 사이의 각 방향과 상관 관계에 따라 분자의 이동성을 설명하는. 확산 이방성은 주로 WM의 섬유 책자의 방향에 의해 발생되고 그 마이크로 및 macrostructural 기능에 의해 영향을 받는다. 미세 기능, intraaxonal 조직 섬유의 밀도 외에 확산 이방성에 큰 영향이 될 것으로 보인다ND 세포 포장, 수초 정도, 개별 섬유 직경. 거시적 규모에서 영상 복셀의 모든 WM 책자의 방향 변화는 이방성 5의 정도에 영향을 미칩니다.
일반적인 DTI 측정에서 복셀 치수는 밀리미터의 순서에 있습니다. 따라서, 복셀은 항상 일반적으로 여러 축삭뿐만 아니라 주변의 물 분자를 포함 검출 볼륨 내부의 물 분자의 평균 정보가 포함되어 있습니다. 이 다각적 인 환경에도 불구하고, DTI가 주된 축삭 방향으로 정렬 큰 주축의 방향에 민감, 즉 축삭 기여도는 측정 된 신호 2를 지배하고있다.
첫째, 확산 이방성 5 번째와 두 번째의 방향에 의존 정도, imag에 물 확산의 주된 방향 : DTI 물 확산의 속성에 대한 두 가지 종류의 정보를 제공전자 복셀이 확산 방향 6 즉.
다음에 설명 된대로 현재의 프로토콜은 그룹 수준에서 대상 그룹의 정량적 비교를 위해 DTI 분석 기술의 프레임 워크를 제공하기로되어있다.
확산 특성의 정량 분석 - 매개 변수
B (식 1) 텐서되고있다 있도록 대칭 텐서의 요소는 신호 감쇠의 결과로, 적어도 6 비 직선이 아닌 평면 방향을 따라 확산 기울기에 의해 측정 될 수있다
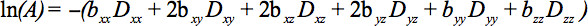
이 방정식은 직교 방향 (크로스 용어)에 적용에도 적용되는 이미징 그라디언트 사이 영상과 확산 기울기 사이의 상호 작용에 대한 회계 처리를 필요로직교 방향 4인치
두 번째 순위 확산 텐서  항상 텐서의 주 대각선을 따라 세 개만 아닌 요소를 떠나 diagonalized 수 있습니다 (고유 값, 즉
항상 텐서의 주 대각선을 따라 세 개만 아닌 요소를 떠나 diagonalized 수 있습니다 (고유 값, 즉 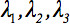 ). 고유 값 타원체의 모양이나 구성을 반영합니다. 타원체와 실험실 프레임의 주요 좌표 사이의 수학적 관계는 고유 벡터에 의해 설명되어 있습니다
). 고유 값 타원체의 모양이나 구성을 반영합니다. 타원체와 실험실 프레임의 주요 좌표 사이의 수학적 관계는 고유 벡터에 의해 설명되어 있습니다 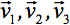
텐서 데이터를 표시하는 몇 가지 과제가 있기 때문에, 확산 타원체의 개념은 3을 제안하고있다. 이러한 전자의 Eigendiffusivities타원체의 이심률이에 대한 정보를 제공하는 반면 타원체의 주축이, 섬유의 방향과 일치 복셀의 주요 확산 방향을 나타냅니다 즉 llipsoids는 매체의 확산 계수의 기본 방향으로 일차원 확산 계수를 나타내는 이방성과 대칭의 정도. 따라서, 소수 이방성 (FA)로 확산 이방성 측정은 7 정의 할 수 있습니다.

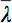 모든 고유 값의 산술 평균입니다.
모든 고유 값의 산술 평균입니다.
추가 방법은 tractography approa에 해당하는 뇌의 WM 연결을 해결하기 위해 확산 텐서의 주요 방향을 사용하는 것입니다어떤 채널은 서로 연결되어있는 뇌의 부분 조사 할 의도를 가지고 있습니다. 확산 텐서의 주요 구성 요소의 방향이 지배적 인 축삭 책자의 방향을 나타내는 가정 각 벡터 섬유 방향을 나타내는에 3 차원 벡터 필드가 제공됩니다. 첫 번째 범주는 섬유 기관 전파 2,8,9의 각 단계의 로컬 텐서 정보를 사용하여 선 전파 알고리즘을 기반으로합니다 : 현재, 두 가지 유형으로 나눌 수있다 WM 책자를 재구성하는 여러 가지 방법이 있습니다. 두 번째 범주는 요로 기반 공간 통계의 접근 방식의 결과로 두 개의 WM 영역 사이의 에너지 적으로 가장 유리한 경로를 찾기 위해 세계 에너지 최소화를 기반으로 (TBSS)은 tractwise 부분 이방성 통계 (TFAS 다른 알고리즘에 사용 된 10 - 프로토콜 텍스트 섹션 2.4 참조)..
정위 스탠드로 변환ARD 공간
다른 고급 MRI 방법에서와 마찬가지로, 임상 상황에서 DTI와 FT-기반의 연구는 11 미터 일부 차별에 기초하여 진단 과정을 촉진하기 위해 개별 환자의 뇌 형태를 분류하는 궁극적 인 목표를 추구한다. 일반적인 임상 표현형은 하나 이상의 특정 뇌 영역 또는 특정 해부학 적 네트워크에 손상으로 인해 있어야하는 경우 그룹 수준에서 연구가 가장 관련이 있습니다. 여기에, 다른 과목에 대한 결과의 평균은 미세 변화의 일반적인 패턴을 평가하기 위해 유용합니다. 각각의 뇌는 그래서, 두 번째 단계에서, 평균 산술 복셀 별 복셀 수준의 결과 수 있습니다 정위 공간으로 전송할 수있다. 공간 정규화 신호 대 잡음비 (SNR)를 향상시키고 환자의 샘플 및 연속의 비교를 수행하기 위해 다른 과목에서 얻은 결과의 산술 평균을 허용rols는 특정 장애의 계산 pathoanatomy을 분석하기 위해, 특정 두뇌 시스템의 허식과 관련된 신경 퇴행성 질환 예를 들면.
12에 의해 표준화 된 정위 공간 정상화의 초기 접근 방식은 다양한 뇌 랜드 마크와 뇌 사분면의 단편적인 확장의 식별을 포함하는 표준 아틀라스로 변환 알고리즘을 제안 하였다. 요즘 고급 MRI 데이터 분석 패키지의 대부분은 몬트리올 신경학 연구소 (MNI) 정위의 공간 (13)에 정상화를 사용합니다. 이 변환에 대한, 연구 특정 템플릿을 사용하여 반자동 및 자동 뇌 등록 알고리즘은 14,15을 개발 하였다. DTI에 특별한주의가 정상화 과정 16, 17시 방향 정보를 보존 그릴 수있다. DT-MR 이미지에 공간 변환의 응용 프로그램이있는 공간 정상화에 필요한의 데이터 세트의 컬렉션 DTS 다시 변형에 의해 영향을 배향성 정보가 포함되어 있다는 사실에 의해 복잡하게 휘게하는 스칼라 이미지는 대조적이다. 이 효과는 변환 된 이미지의 해부학 적 정확성을 보장하기 위해 고려되어야합니다. 여기에 DTI 데이터 세트에 아핀 변환을 적용하기위한 방법을 제시한다.
뇌 질환에 대한 DTI 적용
세로 DTI 데이터의 비교는 서로간에 하나의 주제 데이터의 정렬 / 등록을해야합니다. 그런 맥락에서, 방향 정보의 보존 (아핀 변환 중에 확산 텐서 즉 회전)가 필요합니다. 퇴행성 신경 질환에 대한 가능한 응용 프로그램 (예 : 18,19) 이전에보고되었다.
DTI는 생체 neuropathol에서 조사하는 강력한 비 침습 기술 도구로 설립되었습니다WM 신경 책자의 OGY (예 : 11,20,21,22). 확산 공정의 DTI 기반의 정량적 측정이 FA 예를 들어, 이미 뇌졸중 20, 다발성 경화증 23 일 루게릭 병 24, 25, 알츠하이머 병 26 등 WM 병리의 넓은 범위를 공부 민감한 마커로 표시되었습니다 , 그리고 여러 가지 다른 WM 장애 27,28.
또한, FT와 DTI는 WM 책자 23 번을 식별하는 데 사용할 수 있습니다. 이 기술은 여전히 일상적인 임상 사용, 신경 질환에서 경로 별 이상의 평가를위한 강력한 도구로 떠오르고있다하지 동안. 확인 된 책자에서 다양한 정량적 MRI 지수는 DTI 데이터에 대한 해부학 적 coregistered입니다 측정 할 수있는 DTI와 추가 인수 (예 : T2 강조 영상 및 / 또는 자화 전송 (MT) 이미징)에서 유래. 이로써, 각 인덱스는 calcul을 수기관 프로필로 자신의 공간 변화를 묘사하는 그래프를 참조하여 기관 내에서의 위치의 함수로 ated.
1.5에서 수행 된 다음, 인간의 DTI 검사에서 테슬라 MRI-스캐너 (지멘스 의료, 에를 랑겐, 독일)의 환자 군에서뿐만 아니라 개인의 흰색 물질 이상을 검출하기위한 다양한 분석 기법의 가능성을 조사 하였다. 유물의 다른 종류의 모션 손상된 볼륨과 볼륨의 제거를위한 자동 품질 검사 후, 표준화 된 후 처리 절차는 연속 분석을위한 DTI 데이터를 준비합니다. 다른 분석 방법은 다음에 설명, 즉 공간 통계를 기반으로 첫 번째, 전체 뇌 (WBSS), 초, FT, 그리고 세 번째, Tractwise 분수 이방성 통계 (TFAS). 수 WBSS는 일반적으로 DTI 데이터 (VBM / DTI)에 복셀 기반 형태 계측 / 통계로 알려져 있습니다 복셀 기반 형태 계측 (VBM)에 비유에서 실행하는 방법입니다 . VBM은 원래 WBSS은 실제 매개 변수의 voxelwise 비교를 사용하는 방법입니다 동안 별도의 검사에 대비 차이가 해결해야 할 콘트라스트 이미지를 실행하는 방법입니다. 알고리즘과 유사하지만 따라서, WBSS 및 VBM을 차별화하는 용어는 다음에 사용됩니다.
프로토콜
분석 방법 : 사전 및 사후 처리
voxelwise 검출로 인해 - - 등방성 또는 이방성 하나, 각각의 복셀에 대한 늘어난 또는 편원 확산 텐서의 결과로 다음과 같은 프로토콜의 작업이 될 수 있습니다 흰색 물질 책자에서 voxelwise 확산 특성을 분석하는 것입니다. 복셀 텐서의 파라미터는 FA-맵의 계산이나 fibertracts의 식별 (그림 1) 중 하나에 사용됩니다.
다음과 같이 분석 결과를 얻기 위해서는 소프트웨어 패키지 텐서 영상 및 섬유 추적 (TIFT) 17를 사용합니다. TIFT은 다음과 같은 요구 사항에 대한 분석 도구를 제공합니다 :
- DTI 측정, 예를 들어, FA-지도,의 관점에서 분석
- 정위 정상화
- FA의 조건이나 다른 DTI 통계 그룹 비교
- FT의 다양한 분석 방법
- 그룹의 FT는 D의 평균TI 데이터와 해당 통계 분석.
이러한 기능은 하나의 소프트웨어 환경 17,29,30,31에서 다양한 분석 할 수 있습니다. TIFT 소프트웨어는 DTI 데이터 분석의 새로운 옵션을 끊임없이 개발이다.
그림 2에서는 그룹 수준에서 DTI 데이터를 분석하는 두 개의 보완적인 방법으로 공간 정규화 한 후, 마지막으로 그룹 수준에서 적용 샘플 사이의 차이, 건강한 통제 대 등 질병의 두뇌를 얻기 위해 WBSS 의해 TFAS에 의해 모두, 즉 도식 개요를 제공합니다. TFAS는 사전 정의 된 fibertracts를 기반으로하는 반면, 여기 WBSS은 그룹 수준에서의 차이와 지역의 voxelwise 공정한 검출을 목표로, 지역을 시작 TFAS은 어느 자유롭게 선택 될 수있다 또는 WBSS 결과 (`핫스팟`의에서 파생 될 수 크게) FA 변경.
FA-맵의 개별 종 비교 검출하여 수행됩니다아핀 정위 정렬 후 다른 timepoints의 측정 FA-맵에서 팅의 차이 (그림 2).
- 손상된 그라데이션 방향에 대한 보정 등의 품질 검사 (QC)
손상된 볼륨의 경우 인수 즉, 동안 운동 장애의 경우, SNR 증가는 텐서 계산 한 기울기 방향 (GD)를 생략하여 얻을 수 있습니다. 이를 위해 품질 검사 (QC) 알고리즘 (32)는 개발되었다. 간단히 말해서 볼륨을 손상 들어 검사에, SNR의 증가는 하나의 그라데이션 방향 텐서 추정하기 전에 한 번에 하나를 생략하여 달성된다 : 각 GD에 대해 가중 분산은의 각도 가중치에 의해 순서대로 나머지 모든 방향에서 계산됩니다 그들이는 인덱스 GD 달랐다.- 감소 강도를 표시하는 적어도 하나의 슬라이스 GD를 감지하여 이슈 보정을 수행, 즉 모션 아티팩트 자연 스와로 인한 bject 운동 (그림 3, 상단 패널). 모든 확산 가중 볼륨의 각 조각의 평균 강도를 계산하고 가중 평균 방식을 사용하여 모든 다른 볼륨에 동일한 슬라이스의 강도를 비교 - 가중치는 두 개의 GD의 벡터의 내적이다
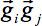 :
: 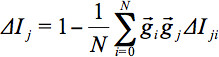
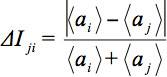
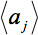 관찰에서 슬라이스의 산술 평균 강도를 표시하는 것이며427eq12.jpg "/ 비교> 조각. 상대 평균 강도 편차
관찰에서 슬라이스의 산술 평균 강도를 표시하는 것이며427eq12.jpg "/ 비교> 조각. 상대 평균 강도 편차 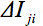 GD의 내적에 의해 가중된다. 따라서, 글로벌 매개 변수를 정의하기 위하여 :
GD의 내적에 의해 가중된다. 따라서, 글로벌 매개 변수를 정의하기 위하여 : 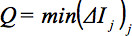
모든 슬라이스의 slicewise 비교 최소값을 반영합니다. - Q가 특정 임계 값 (예제 0.8의 임계 값이이 목적을 위해 사용됩니다) 미만인 경우 그 전체 볼륨을 제거하거나 GD. 0.8 임계 값은 그림 3은 시상 복원 모션 아티팩트를 볼 수 보여줍니다. 안정적인 솔루션을 32으로 간주하고 QC 알고리즘에 의해 감지됩니다. 이 예에서는 GD의 총 개수 (그림 3C에 파란색 점)의 아웃 17 Q에 해당하는 빨간색 선 밑에 있었다 = 0.8 수오LD는 제거 할 수. 전체 연구를위한 볼륨 제거 통계의 예는 그림 3 차원으로 표시됩니다. 본 실시 연구에서는 29 presymptomatic HD 과목의 DTI 데이터는 30 컨트롤 DTI 데이터를 비교 하였다. 이 알고리즘의 더 자세한 사항은 32, 33에 제시되어있다.
- 감소 강도를 표시하는 적어도 하나의 슬라이스 GD를 감지하여 이슈 보정을 수행, 즉 모션 아티팩트 자연 스와로 인한 bject 운동 (그림 3, 상단 패널). 모든 확산 가중 볼륨의 각 조각의 평균 강도를 계산하고 가중 평균 방식을 사용하여 모든 다른 볼륨에 동일한 슬라이스의 강도를 비교 - 가중치는 두 개의 GD의 벡터의 내적이다
- 전처리 및 공간 정규화
- 에코 평면 영상 데이터의 와류에 의한 기하학적 왜곡 보정 (34)에 의해 제안 된 방법으로 설정을 수행합니다.
- 정위 정상화를 위해, 연구 관련 (B = 0)를 생성 - 템플릿 및 이전 17,28,31 설명 된대로 FA-템플릿을. 기본적으로, 완전한 비선형 정위 정상화는 세 가지 변형 구성 요소로 구성됩니다. 따라서, 결과 확산 텐서
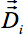 각 복셀의 난 rotat 수있다(그림 4) 위에 나열된 모든 회전에 따라 ED :
각 복셀의 난 rotat 수있다(그림 4) 위에 나열된 모든 회전에 따라 ED : - 그림 4A는 기본 좌표 프레임을 정렬하는 딱딱한 뇌 변화를 보여줍니다. 회전
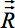 기본 좌표계에 정렬의 결과는 적용 할 수있다
기본 좌표계에 정렬의 결과는 적용 할 수있다 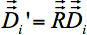
- 그림 4b의 랜드 마크에 따라 선형 변형을 보여줍니다. 고유 벡터의 구성 요소
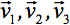 선형 변형의 S (뇌 영역들,, = 1 ... 6에 따라 다름)의 여섯 정규화 매개 변수에 따라 적응해야합니다.
선형 변형의 S (뇌 영역들,, = 1 ... 6에 따라 다름)의 여섯 정규화 매개 변수에 따라 적응해야합니다.
V W, J '' '=의 V W, J '''
W = 1,2,3와 j = X, Y, Z. - 그림 4C는 비선형 뇌 모양의 차이를 균등 비선형 정규화를 보여줍니다. 3-D 벡터 변화는 3 차원 복셀 배열의 각 복셀에 대해 별도의 변환에 이르는 각 복셀에 따라 다릅니다
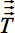 ). 표준 삼각법 3-D 벡터 이동이 neighbored 복셀의 고유 벡터 사이의 방향 관계를 유지하기 위해 16의 개념을 다음의 결과, 각 복셀에 대해 독립적으로 회전 매트릭스를 제공합니다. 따라서, 두 neighbored 복셀의 다른 변화는 해당 고유 벡터의 회전에 결과. 텐서의 정렬을위한 팽창 행렬을 사용하여
). 표준 삼각법 3-D 벡터 이동이 neighbored 복셀의 고유 벡터 사이의 방향 관계를 유지하기 위해 16의 개념을 다음의 결과, 각 복셀에 대해 독립적으로 회전 매트릭스를 제공합니다. 따라서, 두 neighbored 복셀의 다른 변화는 해당 고유 벡터의 회전에 결과. 텐서의 정렬을위한 팽창 행렬을 사용하여 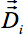 각 복셀의주변의 복셀.
각 복셀의주변의 복셀. 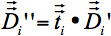
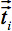 의 구성 요소
의 구성 요소 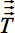
- 그림 4A는 기본 좌표 프레임을 정렬하는 딱딱한 뇌 변화를 보여줍니다. 회전
- 이 각각의 정규화 과정을 거친 후 (STEP (I) - 템플릿 T 1) - DTI 데이터 I 0) 모든 개별 DTI 데이터를 연구 특정 만들기위한 설정 (- 템플릿과 FA-템플릿 (단계 (II B = 0))를 사용합니다. FA-템플릿 비 아핀 등록으로 장점은 비교에서 더 많은 대비를 제공하는가 (B = 0) 이미지 10, 모든 개별적으로 환자의 FA-지도와 컨트롤을 파생를 평균하여 FA-템플릿을 정의합니다.
- 두 번째 단계에서 Ashburner 및 Friston 35의 기본 개념에 따라 비선형 MNI 정상화를 DTI 데이터 (단계 (III)) FA-지도 지역 강도 사이의 불일치가 설치 될 최소화 및 설정을 수행 제곱 (X 2)에 따라 FA-템플릿 - 그런 식으로, 당신은 DTI 데이터 I 1을 구하십시오.
- 이러한 데이터를 기반으로 새로운 템플릿 T 2 단계 ((IV)) 파생됩니다. 이 개별 FA-지도와 t 사이의 상관 관계 때까지 과정을 반복 반복그는 FA-템플릿> 0.7. 일반적으로이 두 가지 반복에 도달 한 후에.
- 전체 뇌 기반 공간 통계
다음 단계까지 1.3.5을 1.3.1 그림 5b에 개략적 시각입니다.- 1.2 정규화 절차에 대하여 정규화 된 DTI 데이터에서 FA-맵을 계산합니다. 방향 정보 (단계 (I)) 유지하기 위해합니다.
- voxelwise 통계 비교하기 전에 전처리 단계로, 각각의 정규화 된 FA-지도에 스무딩 필터 (단계 (II)) 적용됩니다. 다듬기를 들어, 필터 크기는 DTI 데이터 분석 (36)의 결과에 영향을 미친다는 사실 설명 된대로, 데이터를 처리하는 데 사용되는 필터의 폭이 예상되는 차이의 크기에 맞게 조정되어야한다는 것을 명시 정합 필터 정리의 응용 프로그램이 필요합니다 퇴행성 신경 장애 환자 (예 : 28)으로 DTI 데이터 이전에 응용 프로그램을합니다.
- 통계 샘플을 수행학생의 T - 테스트로 환자 그룹과 해당 컨트롤 그룹 voxelwise 사이 Arison는, (단계 (ⅲ 각 복셀 별도로, FA-맵 '컨트롤의 FA 값으로 FA-맵'환자의 FA 값을 비교 즉, )). 대뇌 피질의 회색 물질 0.2 37 FA 값을 보여주기 때문에 0.2 이하 FA 값은 계산에 고려되지 않습니다.
- 통계 결과는 거짓 발견 속도 (FDR) P에서 알고리즘 <0.05 38 (단계 (IV))를 사용하여 다중 비교를위한 보정해야합니다. 512의 임계 값 클러스터 크기에 이르는, 고립 된 복셀 또는 부드럽게 커널의 크기 범위에있는 복셀의 작은 고립 된 그룹을 제거 - 알파 오류의 추가 감소는 공간적 상관 관계 알고리즘 (단계 (V) 클러스터링)에 의해 수행되어야합니다 복셀.
- 형태 학적 배경 (단계 (V))에 결과를 표시하려면 산술적으로 MNI 공간 및 평균 설정 3-D T1 강조 데이터를 정상화. 이 정규화 P를 수행DTI 데이터에 적용 정상화에 비유 연구 특정 템플릿을 사용하여 rocedure 17을 설정합니다.
그림 6은 ALS 환자 대 컨트롤의 뇌를 기반 공간 통계 (WBSS)의 결과를 보여줍니다. 그림 6A는 시상의 감소 FA 값의 로컬 최대를 보여줍니다 coronar 및 축보기 (p <0.01에서 역치 복수를 위해 수정 비교). 그림 6B는 TFAS을위한 기초로 사용 피질 기관의 시작점과 projectional FT를 보여줍니다. 그림 66은 ALS 환자의 샘플과 일치하는 컨트롤 사이의 공간 통계 (WBSS) 기준으로 전체 뇌에서 감지 FA-맵에서 그룹 차이점을 보여줍니다 slicewise 시각화.
- Tractography 및 tractwise 분수 이방성 통계 (TFAS)
그림 7은 1과 TFAS 등의 그룹 기반 FT의 프로세스를 보여줍니다.4.1 1.4.4까지.- 그룹 기반 FT 알고리즘을 적용하기 위해 생성 DTI 데이터를 함께 이전 17 설명 된 방법에 따라 환자의 데이터와 컨트롤의 '의 데이터 세트의 평균. 이 평균화 (16)에 의해 기술 된 방법에 따라 정상화 과정에서 보존 배향성 정보를주의 치료가 필요 - 자세한 내용은 30를 참조하십시오.
- 유선형 추적 기술 31 응용 프로그램에서 대상 그룹의 평균 DTI 데이터 세트에서 tractography을 수행합니다. 연속 FT 분석을위한 기초가 전체 뇌 기반 FA 분석으로 로컬 최대 값에 인접하여 수동으로 정의 씨앗 포인트를 확인합니다. 씨앗의 식별 한 후, tractography를 수행하고 다음과 같은 TFAS 30 그룹 특정 마스크로 묘사 섬유의 복셀을 정의합니다.
- tractography 결과를 정량화하기 위해, 일을 사용하여 TFAS의 기술을 적용평균 DTI 데이터에서 생성 된 전자 섬유 책자는 환자와 컨트롤의 FA-맵의 비교에 기여하는 복셀의 선택에 대한 각 그룹 (환자 데이터 및 제어 데이터를 함께)의 과목으로 설정합니다.
- 학생의 t-검정으로 통계 분석 0.2 이상 FA 값을 가진 모든 결과 복셀을 고려하십시오.
- 원하는 경우, TFAS 기술은 같은 의미 확산 등의 파생 DTI 메트릭 (MD), 광선 이방성 축 이방성 등 (예를 들어, 28 참조)에 적용 할 수 있습니다.
- 결과는 MNI 정규화 된 3-D T1-가중 데이터 세트로 구성된 형태 배경에 표시됩니다
결과
1. hyperkinetic 장애 QC 및 환자의 데이터를 응용 프로그램의 손상 그라데이션 방향에 대한 수정
QC의 응용 프로그램과 후속 볼륨 배제 (손상 GD에 대한 수정의 결과로)의 효과에 대한 예를 들어, 그림 8은 29 premanifest 헌팅턴의 질병의 그룹 비교 볼륨 배제와와하지 않고 전체 뇌 기반 공간 통계의 차이점을 보여줍니다 30 나이와 성 대 과목 컨트롤을 일치. 스캔 프로토콜은...
토론
DTI 데이터 간 주제 평균값은 각각 확산 진폭 (FA 정보를 이용하여)과 확산 방향 (FT에 따라)에 대하여 달성 할 수있다. FA 맵의 평균은 WBSS 및 TFAS하여 대상 집단의 통계적 비교를 할 수 있습니다. 이 방법론 프레임 워크는 간 대상 평균화 및 그룹 비교와 DTI 기법에 대한 소개를 제공합니다. 정위 정규화 및 그룹 수준에서 FA지도의 비교 대상 그룹 간의 차이를 정량화하기 위해 여러 가능성을 수 있습니?...
공개
저자는 공개 아무것도 없어.
감사의 말
이 작품의 일부는, QC 및 hyperkinetic 장애 환자의 데이터를 응용 프로그램의 손상 그라데이션 방향에 대한 보정에 대한 연구, 즉 유럽의 HD 네트워크 (EHDN 프로젝트 070)에 의해 지원되었다. 이 특정 연구에서 MRI 검사는 런던 사이트 TRACK-HD 일대의 일환으로 획득 하였다.
자료
| Name | Company | Catalog Number | Comments |
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT - Tensor Imaging and Fiber Tracking |
참고문헌
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies - a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer's disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer's disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington's disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington's disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI - Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology - special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유