JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
대사율의 측정에
요약
대사 질환은 인간에서 가장 흔한 질병 중 하나들이다. 유 전적으로 다루기 쉬운 모델 생물 D. melanogaster의 대사를 조절하는 신규 한 유전자를 확인하는데 사용될 수있다. 이 논문은 자신의 CO 2 생산을 측정하여 파리의 신진 대사 속도를 연구 할 수있는 비교적 간단한 방법을 설명합니다.
초록
대사 장애는 인간의 건강에 영향을 미치는 문제가 자주 발생합니다. 따라서 신진 대사를 조절하는 메커니즘을 이해하는 것은 매우 중요한 과학적 작업입니다. 인간의 많은 질병의 원인이 유전자는 초파리의 다른 질환의 개발에 관련된 신호 전달 경로를 연구 할 수있는 좋은 모델을 만들고, 비행 동성이있다. 또한, 초파리의 온순함은 신진 대사를 조절 할 수 있습니다 새로운 치료 표적을 식별에 도움이 유전 화면을 단순화합니다. 이러한 화면을 수행하기 위해 파리의 대사 상태의 변화를 확인하는 간단하고 빠른 방법이 필요하다. 일반적으로, 이산화탄소 생산 산화 기질 및 에너지 비용이 대사 상태에 대한 정보를 제공하는 좋은 지표이다. 이 프로토콜에서 우리는 파리에서 CO 2의 출력을 측정 할 수있는 간단한 방법을 소개합니다. 이 기술은 잠재적으로 신진 대사 속도에 영향을 미치는 유전 적 교란의 식별에 도움이 될 수 있습니다.
서문
생화학 Kreb의주기는 탄수화물, 지방, 그리고 CO 2 생성 단백질에서 파생 된 아세트산의 산화를 통해 ATP를 생성합니다. 초파리에서, O 2 입력은 직접 CO 2 출력과의 상관 관계 및 대사 1의 수준을 반영한다. 따라서, CO 2 출력의 측정은 성공적 노화와 신진 대사 2-5 관련 연구에 이용되고있다. 여기에 우리의 실험실은 전문 장비가 필요없이 최대 18 개의 시료에서 CO 2 생산을 측정 할 수 있도록, 이전에 설계 실험 설정을 수정했다. 기타 우리는 이전에 근육 영양 장애 관련 단백질, Dystroglycan (DG) 6-8 불충분 파리의 신진 대사 속도의 차이를 보여주기 위해이 방법을 사용했습니다.
O 산화 대사에 사용되는 2 호흡 폐기물로 배출되는 CO 2로 변환됩니다. construc손으로 만든 respirometers의 기는 O 2 소모의 속도의 측정을 위해 허용하는 기술되어있다. 파리 효율적으로 기체 상태에서 제거, CO 2 배출을 흡수하는 물질로 밀폐 용기에 배치됩니다. 가스 부피 (감소 압력)의 변화는 폐쇄 호흡계에 부착 유리 모세관 유체의 변위에 의해 측정된다.
다른 것보다이 기술의 주요 장점은 비용이다. 이전 연구는 가스 분석기 및 기술적으로 진보 된 respirometry 시스템 1.9을 사용하여 초파리에 의한 CO 2 생산을 측정했다. 더 복잡한 장비에도 불구하고, 여기에 기재된 방법의 감도는보고 된 값 (표 1)과 유사하다. 또한, 여러 가지 다른 그룹은 초파리 4-6에서 상대 신진 대사 속도를 결정하기 위해이 기술의 변화를 사용했습니다. 따라서, 이러한 분석은 reliab에를 생성하는데 사용될 수있다르, 모든 실험실에 설치 될 수 있으며, 교육 목적으로 사용할 수있는 특수 장비를 구입하지 않고 초파리의 신진 대사에 관련된 데이터를 재현.
일반적으로, 생체의 신진 대사를 결정하는 허용 기법 CO 2 생산을 측정하는 소비 O 2 또는 둘 3,4,9. 하지만, 그것은 O 2의 1 당량은 CO 2의 1 당량을 생성하는 가정 할 수있다, CO 2의 정확한 비율은 발생 10을 활용 한 대사 기판에 따라 달라집니다. 따라서 정확하게 에너지 단위 대사량을 결정하기 위하여 그것 O이 소비 및 CO 2 생산 양을 측정 할 필요가있다. 이 때문에, 여기에 기재된 방법은 동물이 아닌 절대 값 사이의 CO 2 생산의 차이를 비교하는 특별히 중요한 것이다. 우리의 기술은 포의 기간에 걸쳐 여러 동물 CO 2 생산을 통합따라서 전자 (1 ~ 2 시간) 및 동물의 활동의 평균을 반환합니다. 실험 동물은 측정이 다른 활동의 수준과 반드시 신진 대사를 반영 할 수있는 제어 동물보다 활성화되어 있다고 믿을만한 이유가있는 경우.
프로토콜
Respirometers 1. 준비
- 50 μL 모세관 마이크로 피펫의 삽입을 허용하는 면도날 1,000 μL 피펫 팁을 잘라 가능한 똑바로 피펫 팁을 얻을하려고합니다.
- 피펫으로 거품의 조각을 놓고 피펫 팁에 아래로 누르십시오.
- CO 2 흡수의 작은 금액을 추가하고 폼의 두 번째 부분으로 포함되어 있습니다.
- 마이크로 피펫은 피펫 팁에 삽입되는 장소에 접착제를 적용합니다.
- 접착제가 건조 할 수 있도록 밤새 호흡계를 남겨주세요.
호흡계의 회로도는 그림 1A에 표시됩니다.
측정 상공 회의소 2. 준비
- 눈에 보이는 발색이 발생합니다 비율로 에오신와 물을 혼합하여 챔버의 솔루션을 준비합니다.
- 챔버에 에오신 / 물 솔루션을 붓는다.
- 센티미터 스케일과 챔버의 측면 중 하나를 레이블.
3. Respirometers에 파리를 배치
- 마커로 개별 respirometers 레이블을 지정합니다.
- 2 CO 각 호흡계 안에 원하는 유전자형의 3-5 파리를 배치하는 다른 방법을 사용하여 파리를 마취.
- 플라 퍼티를 사용하여 단단히 상단에 respirometers를 밀봉.
- 파리가 약 15 분 동안 마취에서 회복 할 수 있습니다.
- 대기 제어로 사용되는, 파리 않고 한 호흡계를 준비합니다.
4. 실험을 수행
- 챔버의 상부에서 상단과 하단에 열려 1.5 ㎖의 에펜 도르프 튜브 홀더를 부착하여 챔버 respirometers 매달아.
- 아래로 끝이 색 용액에 잠수함 수 있도록 챔버에 마이크로 피펫 팁과 respirometers를 삽입합니다.
- 온도 및 압력 fluct에서 강한 분리를 제공하기 위해 뚜껑 덮개와 챔버 사이 바셀린 추가상황들.
- 뚜껑을 닫고 시스템이 15 분 동안 평형 수 있습니다.
- 각 마이크로 피펫 내의 액체의 레벨이 표시되어 있는지 확인하고 챔버의 사진을 가지고 이렇게 스케일 (그림 1b에 도시 예 참조).
- 1 ~ 2 시간 후, 사진을 촬영.
- 실험이 완료되면, respirometers에서 파리를 제거하고 원하는 경우 무게 나 더 필요한 경우 유리 병에 다시 전송합니다.
결과 5. 분석
- 오픈 ImageJ에 소프트웨어 (11)를 사용하여 이미지를 획득.
- 각 그림의 배율을 사용하여 소프트웨어의 픽셀 스케일링을 설정합니다.
- 액체가 시작 (D1)에서 촬영 한 이미지의 판단 기준 지점에서 여행 그 거리 (Δd 및) 실험의 끝 (D2)를 측정한다. 개략적 인 예는 그림 1C에 표시됩니다.
- 식으로 제작 CO 2 (μL / 시간 / 플라이)의 양을 계산한다
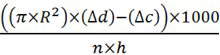
센티미터 마이크로 피펫 관의 R은 = 반지름
ΔD = 거리는 액체가 센티미터로 측정 시료의 마이크로 피펫에 이동했다
ΔC = 거리는 액체 (초파리없이) 음성 대조군 샘플의 마이크로 피펫에 이동했다
사용 파리의 N = 번호
h = 시간
결과
이 방법은 우리가 야생형 (오레곤 R)에서 CO 2 생산 남성은 18, 25 일에 파리, 29 ° C 및 DG에 돌연변이 파리를 측정 민감하다는 것을 보여주기 위해. 파리는 25 ° C에서 제기 한 후 측정에 앞서 5 일 동안 실험 온도로 이동했다. 이 ectothermic 종 예상 한 바와 같이, CO 2의 양은 온도 (그림 2)로 증가 생산. 우리는 과거에 설탕 무료 다이어트는 모두 야생 유형의 신진 ...
토론
이 프로토콜에서는, 우리는 파리에있는 CO 2 생산을 측정하기위한 저렴하고 신뢰할 수있는 방법에 대해 설명합니다. 우리는이 실험을 수행하는 빠르고, 쉽고, 다른 연구 1, 6, 9와 계약에 재생 가능한 데이터를 생성하는 것으로 나타났습니다. 여기에 설명 된 프로토콜은 쉽게 연구소의 예산 및 재료에 맞게 수정할 수 있습니다. 각 개별 호흡계의 구조는 한 챔버가 밀폐 남아 적응 될 ...
공개
우리는 공개 아무것도 없어.
감사의 말
우리는 우리의 연구 자금에 대한 최대 플랑크 사회에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
참고문헌
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유