Method Article
F9를 RARE-LacZ를 셀 기반 리포터 분석을 사용하여 E8.5 배아 및 Neurosphere 문화에서 상대 레티노 산 수준의 정량적 측정
요약
Methods to accurately measure retinoic acid (RA) levels in small amounts of tissue do not exist. This protocol describes the easy, quantitative measurement of relative RA levels in E8.5 embryos and neurospheres using an RA reporter cell line.
초록
Retinoic acid (RA) is an important developmental morphogen that coordinates anteroposterior and dorsoventral axis patterning, somitic differentiation, neurogenesis, patterning of the hindbrain and spinal cord, and the development of multiple organ systems. Due to its chemical nature as a small amphipathic lipid, direct detection and visualization of RA histologically remains technically impossible. Currently, methods used to infer the presence and localization of RA make use of reporter systems that detect the biological activity of RA. Most established reporter systems, both transgenic mice and cell lines, make use of the highly potent RA response element (RARE) upstream of the RAR-beta gene to drive RA-inducible expression of reporter genes, such as beta-galactosidase or luciferase. The transgenic RARE-LacZ mouse is useful in visualizing spatiotemporal changes in RA signaling especially during embryonic development. However, it does not directly measure overall RA levels. As a reporter system, the F9 RARE-LacZ cell line can be used in a variety of ways, from simple detection of RA to quantitative measurements of RA levels in tissue explants. Here we describe the quantitative determination of relative RA levels generated in embryos and neurosphere cultures using the F9 RARE-LacZ reporter cell line.
서문
레티노 산 (RA)는 레티놀 또는 비타민 A의 대사 유도체 여러 셀룰러게나 제 (1)의 순차적 인 활동을 통해 제조된다. 때문에 양친 성 화학적 특성, 그것은 쉽게 지질 세포막을 교차 및 가용성 형태 형성 인자 (1) 역할을 할 수 있습니다. 이것은 핵 레티노이드 수용체에 대한 리간드로 작용하는 유전자 발현 2-10을 활성화함으로써 다수의 발달 및 성체 세포 과정을 조절하는 근본적인 분자이다. RA없이,이 RA 수용체 (RAR들) 리프레로 DNA 행동에 바인드 라 레스; RA는이 수용체에 결합하는 표적 유전자의 발현 1,5,6의 결과로 전사 활성제로 변합니다.
적경의 신호 전달 경로가 잘 특징입니다 만, RA의 작은 크기 (~ 300 다)와 양친 매성 자연을 직접 조직 학적 시각화 및 현재 RA의 측정 (11) 기술적으로 실행할 수 없게한다. DIR에 대한 유일한 방법RA 레벨 요법 측정은 고성능 액체 크로마토 그래피 (HPLC) (11)를 사용하여 조직 샘플로부터 RA 단리 통해서이다. 이 방법은 일반적으로 서로 다른 샘플 (12)에 의해 용이 풀링 조직 대용량을 필요로한다. 따라서,이 기술은 각각의 배아 또는 샘플 / 조직 소량 RA 레벨 측정 저조한 적합하다.
RA의 세포 기능을 조사하기 위하여, 여러 방법들이 간접적 RA 존재를 추론하기 위해 개발되었다. 이러한 방법은 베타 - 갈 락토시다 제 또는 루시 페라 제 11,13,14의 발현을 구동 RARE 고 응답 RAR 베타를 포함하는 기자 시스템을 사용한다. Rossant 등. (13)에 의해 생성 된 형질 전환 RARE-LacZ를 기자 마우스 현장 11,13,15,16에서 RA 신호의 시공간 영역을 시각화를위한 이상적인 시스템이지만 정량적 측정에 적합하다. t의 F9 RARE-LacZ를 세포주 14그는 다른 한편으로, 조직 외식 11,12,14,17,18에서 RA 및 RA 수준의 정량적 측정의 검출에 유용합니다.
F9의 기형 암종 세포는 베타, 내생 알파를 표현하고, 감마 - 레티노 산 (19) 수용체 및 RA 19-21에 노출 된 후 정수리 내배엽으로 분화를 시작합니다. F9 세포는 오래가 RA 기자 분석을위한 이상적인 세포주로 선정 된 이유는 RA에 의한 세포 분화의 모델로 설립되었습니다. 바그너 등 의해 생성 F9 유래 장영실 15 RA 리포터 세포주.도 14는 E.를 포함 인간 베타 - 레티노 산 수용체 (RAR 베타) 유전자 (RARE) 64 BP 레티노 산 반응 요소의 사본 한 하류 coli'LacZ 유전자. 안정한 클론 선택을 유지하기 위해, 구조는 또한 G418의 존재 하에서 선택 마커로 아미노 글리코 시드 포스 (NEO R) 유전자를 포함한다. 이 구조의 공동LacZ를 염색을 통해 가시화 될 수 RA의 존재하에 B- 갈 락토시다 제의 발현을 유도 nfers이 반응은 연속적이어야 11,12,14,18 비색법을 이용하여 정량화 할 수있다.
이것은 매우 다양한 리포터 세포주 널리 17 인공 배아 상판 이식편 14 리포터 세포와 조직 샘플의 공동 배양을 통해 내인성 RA 생성의 검출에 사용되었다. 또한,이 리포터 라인 별도로 배아 척수의 풀링 섹션 배양 F9 RARE-LacZ를 셀 (18)이 배양 물로부터 조정 배지를 첨가함으로써, 현상 척수 RA 수준의 정량화에 사용되었다. 정량은 표준 ELISA 플레이트 판독기를 사용하여 비색 11,12,18 읽어서 LacZ를 염색 한 후 실시 하였다. 마지막으로,이 리포터 세포주 monitori 의해 RA 대사 효소의 존재의 검출에 사용 된NG는 RA 레벨 12, 18, 20, 22으로 변경합니다.
여기서 우리는 리포터 세포주의 민감도는 개별 공동 배양 E8.5 배아로부터 발생 RA 레벨의 측정을 허용한다는보고한다. 이는 다른 유전자형의 개별 배아 간의 비교를 할 수 있습니다. 특정 예로서, Gpr161은 RA의 신호 경로 (22)를 통해 부분적으로 neurulation을 조절 고아 GPCR, 우리는 전반적인 RA 레벨에 Gpr161 (Gpr161의 VL)의 열성 돌연변이의 효과를 조사하기 위해 리포터 세포주를 이용하여 신고 태아. 이 외에도, 기능성 및 편의성이 리포터 시스템의 측정에도 성인 척수 줄기 세포로부터 수득 neurosphere 배양 물에서, 상이한 조직 샘플에서 RA 레벨을 비교하는 자유를 허용한다. 여기에서 우리는 F9 RARE-LacZ를 RA 담당자와 직접 공동 문화를 통해 배아 및 neurosphere 문화에 상대적으로 RA 수준의 정량을 설명의 orter 세포주.
프로토콜
모든 동물의 작업은 승인 럿 거스 - RWJMS IACUC 방법에 따라 수행 하였다.
1. 솔루션 및 미디어 준비
- . 표 1에 따라 주식 및 버퍼 솔루션을 준비 표 2에 따라 작업 솔루션을 준비합니다.
2. 문화 F9 RARE-LacZ를 세포의 유지 보수
- 해동 냉동 세포
- 표 2에 자세히 F9 RARE-LacZ를 세포 배양 배지를 준비한다.
- 코트 10cm 배양 접시 0.2 % 젤라틴 10 mL로 (처리 된 세포 배양 물)을 RT에서 30 분 동안 (표 2 참조). 증류수 10 ml의 두 린스와 초과 젤라틴을 씻으십시오. 즉시 건조되는 젤라틴을 방지 플라스크 F9 RARE-LacZ를 세포 배양 배지 9 ml에 추가한다.
- 3 분 - 2 37 ° C의 물을 욕조에 F9 RARE-LacZ를 셀 (14)의 병을 해동. 코팅 접시 C 플레이트에 세포 (1 × 106 주위 세포 / ml)배지 9 ml에 ontaining. 37 ° C에서 문화, 5 % CO 2. 다음날 매체를 변경합니다.
- F9 RARE-LacZ를 세포의 유지 보수
- 1:10 비율 3 일 - 매 2 일반 통로를 유지한다.
참고 : 세포가이 분화가 발생합니다 같이 포화 상태로 성장하게하지 마십시오. - 80-90%의 포화 상태에서 문화를 분할합니다. 용지를 제거하고 1 배 인산 완충 식염수 10 ㎖ (PBS)와 세포를 씻는다. 5 분 동안 품어의 PBS를 제거하고 트립신의 1ml를 추가합니다. 배지, 피펫 9 ml의 상하 분할 세포 1시 10분 통과를 위해 추가.
- 1:10 비율 3 일 - 매 2 일반 통로를 유지한다.
- F9 RARE-LacZ를 세포를 냉동
- 단계 2.2.2에 설명 된대로 90 % 합류 - 80 F9 RARE-LacZ를 세포를 포함하는 10cm 접시를 Trypsinize. 5 분 동안 200 XG에 15 ML의 원심 분리기 튜브와 스핀에 해리 세포를 전송합니다.
- F9 RARE-LacZ를 F 10ml에 뜨는 및에 resuspend 세포 펠렛을 제거매체 reezing (표 2 참조). 나누어 냉동 컨테이너에 표시 크리오 바이알 (cryovial) 및 전송 바이알에 1 ml의. 다음날 액체 질소 탱크에 -80 ° C의 냉동고 O / N 및 전송 유리 병 용기를 동결 놓습니다.
E8.5 배아 3. 해부
- 짝짓기 케이지 설치 및 플러그 확인
- 설정 한 결합 쌍을 포함하는 결합 케이지. 다음 날의 아침, 질 플러그의 존재를 확인하고 플러그를 하루 0.5 (23)로 발견되는 일을 지정합니다. 일 E8.5, 수확 배아에서.
- 태아의 해부
- 경추 탈구를 통해 댐 희생과 70 % 에탄올로 복부 스프레이 (표 2 참조). 수술 가위를 사용하여 복부 위의 피부에 잘라 가로을 확인하고 복부를 노출 간격 (전방 및 후방) 두 개의 플랩을 잡아 당깁니다. 비슷한 상처를 확인복막의 복부를 노출합니다.
- 자궁를 찾아 난관에서 자궁을 해제하고 가위 (23)의 쌍을 사용 mesometrium. PBS는 여분의 지방과 혈액을 씻어 1X 10 ml를 가진 6cm 요리 (처리되지 않은 세포 배양)에서 자궁을 놓습니다. PBS 1X 신선한 10 ml에 포함 된 다른 6cm 접시에 전송합니다.
- 수술 가위를 사용하여 절단하여 하나의 배아를 포함하는 하나 자궁 별도. 자궁과 탈락을 제거하고 더 두 쌍을 사용하여 배아를 포함하는 난황을 놓습니다. 5 집게 23.
- 배아에서 난황을 분리하고, 유전자형에 사용되는 게놈 DNA 추출을 위해 1.5 ML의 microcentrifuge 관에 난황을 전송합니다. 트립신 10 μl를 포함하는 1.5 ml의 microcentrifuge 관에 전체 배아를 전송, 넓은 구멍 팁으로 P20 피펫을 사용합니다. 얼음에 튜브를 놓습니다.
- 모든 배아가 해부 될 때까지 3.2.4 - 반복 3.2.3 단계를 반복합니다.
- 배아 해리
- 5 분 효소 분해를 촉진하기 위해 37 ℃에서 트립신 배아를 함유하는 1.5 ㎖의 튜브 부화.
- 씹다 부드럽게 배아의 기계적 분리를위한 P20에 피펫을 이용하여 96- 웰 플레이트에서 F9 RARE-LacZ를 세포 중 하나 이상 잘 한 해리 된 배아를 포함하는 전체 10 ㎕의 부피 플레이트 (F9 RARE-LacZ를 세포 도금위한 단계 5.1 참조 96- 웰 플레이트). 문화 O / N 37 ° C에서 5 % CO 2.
- 5 분 효소 분해를 촉진하기 위해 37 ℃에서 트립신 배아를 함유하는 1.5 ㎖의 튜브 부화.
4. 후궁 절제술, 해부 성인의 요추 척수 및 Neurosphere 문화
- 후궁 절제술
- 자궁 경부 전위를 통해 성인 (P60) 마우스를 희생.
- 70 % 에탄올로 등의 측면 스프레이 및 수술 가위를 사용하여 가로 컷을합니다. 허리와 척추를 노출 떨어져 모두 플랩 (전방 및 후방)를 당깁니다.
- 수술 가위를 사용하여 척추를 덮고있는 근육을 잘라.리브 이하, 척추의 요추 영역을 찾아. 가위를 사용하여 절단 깊이가 척수를 노출 이때 척추를 절단 할 수 있습니다.
- 더와 척추의 요추 영역을 위로 당겨 없습니다. 5 집게는 척수의 노출 횡단면은 실험을 향하도록. 미세 위의 팁을 사용하여, 노출 된 단부의 3시 방향 9시 위치에서 척추 근육을 자르지. 집게로 잘라 척추의 등 플랩을 잡고. 요추 척수의 길이가 노출 될 때까지 꼬리 쪽이 상처를 계속합니다.
- 더 사용하여 척추에서 척수를 놓습니다. 5뿐만 아니라 무딘 종단 집게. DMEM / F12 배지 3 ㎖을 함유하는 15 ㎖의 튜브 척수 전송. 모든 요추 척수가 분리 될 때까지 얼음에 보관하십시오.
- 척수의 해부
- 6 접시 형상으로 척수와 배양액을 붓고 (비 세포 배양 처리).
- 실체 현미경 아래에서, 아니 두 쌍을 사용하여 신경과 혈관을 잡고 척수 세그먼트 주위의 지느러미 루트 신경과 혈관을 제거합니다. 5 집게는 부드럽게 척수에서 그들을 멀리 당겨. 아니오 매체와 6cm 접시 척수 세그먼트를 전송하고 미세 메스 블레이드를 사용하여 조직을 말하다.
- neurosphere 해리 배지 1 ㎖를 함유하는 15 ㎖의 튜브에 전송 다진 조직 (표 2 참조). 모든 척수가 처리 될 때까지 4.2.2 - 4.2.1 단계를 얼음과 반복에 튜브를 넣어.
- 10 분 동안 37 ℃에서 해리 배지에서 다진 조직을 포함하는 튜브를 혼합하는 부화 측의 튜브를 가볍게하고 또 다른 10 분 동안 37 ℃에서 배양한다. 기계적 분리에 대한 직경을 감소 화재 연마 피펫과 효소 소화, 씹다 후.
참고 : 실험을 수행하기 전에 직경을 감소 화재 광택 피펫을 준비합니다. 유리 파스퇴르을피펫과 깨끗한면에 넓은 끝을 연결합니다. 알코올 램프를 사용, 화재 폴란드어 화염에 피펫의 끝이 서로 다른 직경을 만들려면 : "일반", "좋은"및 "극세". "일반"연마 피펫의 경우, 직경 (~ 1mm)를 감소시키지 않고 가장자리 둘레에 화염 피펫의 끝을 돌리기. "좋은"(~> 1mm과> 5mm 직경)와 "극세"(~ 0.5 mm) 광택 피펫을 만들기 위해 약간 더 긴 기간 동안 불꽃 피펫의 끝을 돌립니다. 0.5 mm보다 작은 직경 피펫을 사용하지 마십시오.
- Neurosphere 문화
- 스핀 다운 함유 관을 10 분 동안 200 XG에서 척수 조직을 분해. neurosphere 배양 배지 1 ㎖에 재현 탁 상등액과 세포 펠렛을 제거 (표 2 참조). 분해를 촉진하기 P200 피펫에 이어 P1,000 피펫 씹다.
참고 : 도입 거품을 피하고,이는 세포 생존율을 감소시킨다. - 혈구로 전송 해리 세포의 10 μl를하고 세포 수를 얻을 수 있습니다. neurosphere 배양 배지 10 ㎖와 T25 플라스크에 1 × 10분의 5 ml의 밀도로 접시 셀. neurosphere를 24 나타날 때까지 7 일간 CO 2, 37 ℃에서 인큐베이션하고, 5 %.
- 스핀 다운 함유 관을 10 분 동안 200 XG에서 척수 조직을 분해. neurosphere 배양 배지 1 ㎖에 재현 탁 상등액과 세포 펠렛을 제거 (표 2 참조). 분해를 촉진하기 P200 피펫에 이어 P1,000 피펫 씹다.
- Neurosphere 해리
- neurosphere 문화를 수집하고 15 ML의 튜브로 전송할 수 있습니다. 10 분 동안 200 XG 스핀. 뒤에 1 ml에 떠나는 뜨는의 대부분을 제거합니다. 세포 펠렛을 재현 탁하고 단일 세포로 neurosphere를을 해리하기 위해 P1,000 피펫으로 씹다. 혈구로 전송 해리 세포의 10 μl를하고 세포 수를 얻을.
- 플레이트 1 × 5는 96 웰 플레이트 (96 웰 플레이트에서 F9 RARE-LacZ를 도금을위한 5.1 절 참조) F9 RARE-LacZ를 잘 하나 이상 neurosphere 세포를 분해. 플레이트 복제로 3 우물. 문화 O / N 37 ° C에서 5 % CO 2.
E8.5 배아 및 척수 neurosphere를 5. RA 분석
- 96 웰 플레이트에 도금 F9 RARE-LacZ를
- 하루 수확 E8.5 배아 또는 neurosphere를 해리하기에 앞서, 외투 RT에서 30 분 동안 웰 당 0.2 % 젤라틴 100 ㎕와 함께 96 웰 플레이트. 기음과 젤라틴에서 증류수 200 μL로 두 번 씻어.
- 단계 2.2.2에 설명 된대로를 Trypsinize F9 RARE-LacZ를 세포는 10cm 요리로 유지. 플레이트를 1 × 105 세포 / 웰의 F9 RARE-LacZ를 셀하지만 G418없이 배양 배지를 이용하여 이번에.
- , neurosphere를 (3 우물 / 유전자형)뿐만 아니라 대한 세중의 표준 곡선 (27 웰) - 배아의 공동 문화 (쓰레기 크기에 따라 20 ~ 12)에 대한 충분한 우물을 준비합니다.
- F9 RARE-LacZ를하고 E8.5 배아 또는 척수 neurosphere를 공동 문화
- F9 위에 섹션 3.2 판에 설명 된대로 수확 배아5.1 절에서 96 웰 플레이트에서 RARE-LacZ를. 유사한 방식으로, 단계 4.4에서와 같이 상세한 96- 웰 플레이트에서 F9 RARE-LacZ를 위에 neurosphere를 접시를 해리. 문화 O / N 37 ° C에서 5 % CO 2.
- 표준 곡선을 생성
- 100 nm의, 10 nM의 1 nM의의 AT- 용액을 희석 100 오후 10 오후 1 오후 100 FM : 표준 곡선을 작성하려면 다음 농도 솔루션 (AT-RA) 모든 트랜스 RA를 준비 F9 RARE-LacZ를 배지와 RA 스톡 (표 1 참조).
- 5.1 절에서 F9 RARE-LacZ를 세포에 농도-RA의에서 서로 다른 100 μl를 추가합니다. 치료 F9 RARE-LacZ를 세포에게 부정적인 컨트롤을 포함 우물을 할당합니다. 각 RA 농도와 음성 대조군 웰의 삼중를 준비합니다. 문화 O / N 37 ° C에서 5 % CO 2.
주 : F9 RARE-LacZ를 세포는 올 - 트랜스 RA의 다양한 농도로 용량 의존적 선형 방식으로 반응한다.
- RA의 분석
- 표준 곡선과 공동 배양 물을 함유하는 96 웰 플레이트의 O / N 배양 후, 상기 미디어를 제거하고 2.5 % 글루 타르 알데히드 100 ㎕를 첨가하여 배양을 해결 15 분, RT 경우 (표 2 참조). 정착액을 제거하고 PBS 1 배 200 μL, 세척 당 10 분으로 두 번 씻는다.
- PBS를 제거하고 LacZ를 세척 용액을 200㎕로 3 회 세척 세척 당 10 분 (표 2 참조). 세 번째 세척 동안 호일로 싸서 15 ㎖의 튜브의 X-GAL 염색 용액을 제조 하였다 (표 2 참조). 필요한 얼마나 많은 염색 액 계산하고 해당 금액 (200 μL / 웰)을 준비합니다.
참고 : X-여자 염색 솔루션은 민감한 빛입니다. 준비 후 15 분 이내에 염색 액을 사용합니다. - 96 웰 플레이트를 저장하기에 충분히 큰 플라스틱 용기에 증류수를 적신 종이 타월을 배치하여 가습 챔버를 준비합니다. 는 X 200 μl를 추가β-gal을 염색 96 웰 플레이트의 웰 당 솔루션은 가습 챔버에서 접시를 놓습니다.
- 청색 침전물을 개발하도록 37 ° C에서 96 웰 플레이트를 포함하는 습한 챔버 부화. (- 16 시간 12) E8.5 배아의 경우, 플레이트 O / N을 품어. 8 시간 - neurosphere 문화를 들어, 4 접시를 품어.
- OD (610) 및 이미지에서 흡광도를 읽기
- 발색 반응 후에는 LacZ 염색 용액을 제거하고 PBS 1X 200 μL로 대체. RA에 대한 리포터 반응을 정량화하는 표준 ELISA 플레이트 리더를 사용하여 610 nm에서 흡광도를 측정한다. 카메라가 장착 된 표준을 사용하여 입체 영상의 개별 웰.
F9 RARE-LacZ를 세포의 6. 서브 클로닝
- RA에 F9 RARE-LacZ를 rResponse 확인
- 모든 실험을 시작하기 전에, RA에 F9 RARE-LacZ를 세포의 응답을 테스트한다. 플레이트 F9 RARE-LacZ를 C를96 웰 플레이트에 ELL 학생은 (5.1 절 참조), 1 nM의 모든 트랜스 레티노 산 (단계 5.3 참조)에 추가합니다. 37 CO / N에서 가습 실에 품어.
- 현미경을 사용하여 푸른 색의 침전물의 개발을 시각화합니다. 발색 웰의 세포에 걸쳐 균일하지 않은 경우, 아래에 설명 된 서브 클로닝을 수행 (좌도 1b를 참조).
- F9 RARE-LacZ를 세포의 서브 클로닝
- 단계 2.2.2에 설명 된대로 10cm 접시에서 배양 F9 RARE-LacZ를 셀을 분할합니다. 대신 1:10 비의 각 콜로니는 단일 F9 RARE-LacZ를 셀에서 발생되도록 절연 콜로니의 성장을 허용하기 위해 10cm 접시에 1 × 105 세포 / 10 ㎖의 낮은 시딩 밀도 접시.
- 이일 후, 코트 30 분 동안 잘 당 0.2 % 젤라틴의 500 μL와 24 웰 플레이트. 젤라틴 용액을 제거하고 증류수 500 μL로 두 번 우물을 씻어. F9 RARE-LacZ를 세포 배양 배지 500 μl의 물을 교체합니다.
- 잘 하나에 멸균 P10 피펫 팁 및 전송을 사용하여 식민지를 선택; 24 개별 콜로니를 수득하기 위해 24 회 수행. 4 일 - 37 ° C, 3, 5 % CO 2에서 문화.
- 이 24 웰 플레이트에 개별 식민지를 분할합니다. 문화 2 일 후, 한 24 웰 플레이트와 문화 O / N의 각 웰에 RA의 1nM이를 추가합니다. 높은 조치를 테스트하는 섹션 5.4에 설명 된대로 LacZ를 염색을 수행합니다. 강하고 균일 조치를 결정하도록 잘 현미경 하에서 각각의 발색 반응을 가시화.
- 강한 서브 클론 응답자가 결정되면, 다른 24- 웰 플레이트로부터 해당 배양을 확장. 또한, 10cm 접시에 그 식민지를 확장 2.3 절에 설명 된대로 여러 가지 병을 동결하고, 다른 모든 식민지를 폐기합니다.
참고 : 원래 식민지의 1/4이 높은 대응을 초래할 만에 대해. 일반적으로 서브 클로닝의 첫 번째 라운드는 균일 한 LacZ를 염색 발생하지 않습니다 및 서브 클로닝의 후속 라운드에 수행해야균일 한 강력한 대응을 얻을 수 있습니다.
결과
F9 RARE-LacZ를 기자 젤라틴 코팅 표면에 성장 자기편 배아 암종 세포주이다. 기자의 구조는 세포가 베타 - 갈 락토시다. 11,12,14,18의 비례 유도와 RA에 정량적으로 응답 할 수 있습니다. 이 세포는 상피 형태 (그림 1A)를 표시합니다. 1:10 비율 3 일 - 때문에 높은 두 배 속도로, 이들 세포는 매 2 분할하는 것이 좋습니다. 이 리포터 세포주와의 작업 동안, 우리는 심지어 배양 배지에 G418의 추가, RA에 대한 이들 세포의 반응은 여러 통로 (좌도 1b) 및 이것의 리포터 능력에 영향을 미칠 수 후 약화 것을 관찰 이 세포주. 응답이 손실은 나중에 통로의 유전자의 부분적인 손실에 기인 할 수있다. 이러한주기적인 서브 클로닝는 RA에 강하고 균일 한 대응을 보장하기 위해 필요하므로 (그림1B, 오른쪽).
이 세포주를 각종 용도로 이전 12,14-18 발표되었지만, 여기에보고 된 다른 유전자형을 가진 개별 E8.5 배아로부터 RA 내생 수준을 측정하기 위해이 세포주의 사용이다. 의 Gpr161 VL / VL 돌연변이 결과 22 신호 배아 RA 감소했다. F9 RARE-LacZ를 세포 해리 배아의 공동 배양에 의해 도시 된 바와 같이, 이러한 Gpr161 VL / VL 배아 야생형 한배 새끼 (도 2a)와 비교하여 내인성 RA를 감소시켰다. 여기에보고 있기 때문에이 리포터 세포주의 다양성 성인 Gpr161 중량 / 중량 마우스 (도 2B)에서 얻은 neurosphere 배양에 의해 생산 RA 레벨을 감지하는 이러한 세포의 신규 한 용도이다. 이 리포터 세포주 내인성 RA 생성 성인 척수 줄기 세포로부터의 neurosphere 배양을 입증 할 수 있었다. 위대한은 diff염색 강도 퍼런는 E8.5의 배아에 비해 척수 neurosphere를에 큰 기자 세포 반응을 나타냅니다. 이는 인해 neurosphere 배양 E8.5 배아보다 균질하며, 따라서 더 RA 생산 세포를 포함한다는 사실에있을 수 E8.5 배아에 비해 시간 경과에 neurosphere를 생성 훨씬 더 RA 레벨로 할 수있다.
리포터 세포의 투여 량 - 의존성의 선형 응답하여 AT-RA 결과 상이한 농도의 첨가. 이 반응은 610 nm에서 흡광도를 판독하여 비색 측정 할 수있다. 생성 된 표준 곡선은 예컨대 야생형 neurosphere 배양 (도 3a) 또는 E8.5 배아 (도 3B)에서와 같은 샘플 RA 수준을 정량화하는데 사용될 수있다.
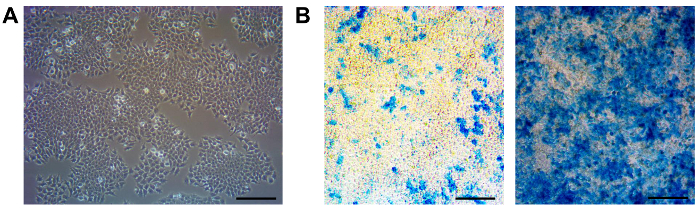
그림 1. MAINTenance 및 F9 RARE-LacZ를 세포의 서브 클로닝. (A) F9 RARE-LacZ를 셀의 위상차 이미지를 나타낸다. 이러한 세포 ~ 10 시간의 배가 시간이 매 3 일마다 전달되어야한다. - 1:10 비율 (약 70 ~ 80 %의 컨 플루 언스) (B) 및 후속 LacZ를-RA에서 1 nm 인 첨가하여 배양주기 테스트 염색 문화가 RA (오른쪽)에 강하고 균일 한 대응을 유지하기 위해 수행해야합니다. 불량한 및 불균일 응답자 (왼쪽)의 경우, 서브 클로닝을 수행해야한다. 규모는 100 μm의 바. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
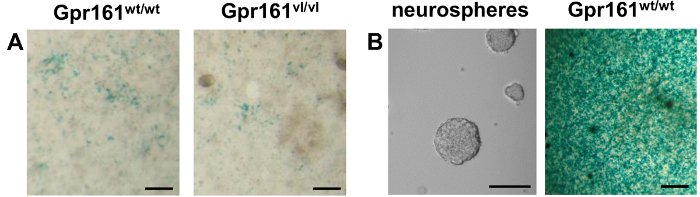
그림 2의 LacZ를 염색 공동 배양 샘플 (해리 E8.5 태아 / neurosphere를) 및 F9 RARE-LacZ를 세포. (A) E8.5 마우스 배아 다양한 유전자형들 해리 F9 RARE-LacZ를 셀의 상단에 도금 하였다. LacZ를 24 시간을 염색하면 나중에 공 배양 샘플에 의해 생성 된 내인성 RA에 F9 RARE-LacZ를 세포의 반응을 시각화 할 수 있습니다. 리포터 세포의 환원 반응에 의해 구상으로 감소 내인성 RA의 Gpr161 VL 돌연변이 결과. (B)를 떠났다. 성인 척수 신경 줄기 세포의 배양 neurosphere를 위상 콘트라스트 화상을 도시한다. 권리. 성인 Gpr161 중량 / 중량 척수로부터 유래 neurosphere를는 해리 F9 RARE-LacZ를 셀의 상단에 도금 하였다. LacZ를 염색 다음 파란색 침전물의 존재는 이러한 neurosphere를 내인성 RA의 존재를 나타냅니다. neurosphere 및 E8.5 배아 공동 문화 사이의 강도를 염색의 차이는 E8.5의 배아보다 neurosphere를에서 RA 존재의 높은 수준을 나타냅니다. 규모는 100 μm의 바.대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3 표준 곡선 및 RA 레벨 비색 정량. F9 RARE-LacZ를 리포터 세포주의 반응은 표준 ELISA 플레이트 판독기를 사용하여 610 nm에서 비색 측정 할 수있다. (A)의 상대 RA 수준을 정량화하기 위해 사용되는 대표적인 표준 곡선 야생형 neurosphere 문화의. 공동 배양 E8.5 배아에서 상대 RA 수준의 (B) 정량. N = 3; * P <0.05, 학생의 t-test를. 오차 막대 SEM. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 스토CK 버퍼 / 솔루션 | 구성 요소들 | 보관 조건 |
| 10 % 나트륨 데 옥시 콜레이트 수화물 (C 24 H 39 NAO 4 · H 2 O) | 100 ㎖ DH 2 O 10 ml의 | 4 ºC |
| 1 M 염화 마그네슘 (의 MgCl 2) | RT | |
| 100X의 페로 시안화 칼륨 (K 4의 Fe (CN) 6] · 3H 6 O) | 10 ML의 DH에서 2.12 g 2 O | 어둠 속에서 RT |
| 100X의 페리 시안화 칼륨 (K 3의 Fe (CN) 6]) | 10 ML의 DH에서 1.64 g 2 O | 어둠 속에서 RT |
| 20 ㎎ / ㎖ X-gal을 (5- 브로 모 -4- 클로로 -3- 인돌 릴 β-D-갈 락토) | 20 ㎎ / ㎖ 원액을 5 ml의 디메틸 포름 아미드를 추가 | -20 ºC |
| 10 mM의 (3 ㎎ / ㎖) 모든 TR레티노 산을 ans와 | 16.67 ml의 무수 에탄올 50 mg을 녹이고. 1 ml의 분취 량을 준비합니다. | 1.5 ml의 황색의 microcentrifuge 튜브 어둠 속에서 -80 ºC, |
| 파파인 | 7 ml의 HBSS 한 병을 녹여 | 4 ºC |
표 1. 버퍼 및 솔루션 조성물.
| 버퍼 / 솔루션 작업 | 구성 요소들 | 보관 조건 |
| F9 RARE-LacZ를 세포 배양 배지 | 50 ml의 소 태아 혈청 (FBS) (최종 농도 10 %) | 필터 - 소독. |
| 5 ㎖의 100 배 페니실린 스트렙토 마이신 (최종 진한 1X) | 4 ºC에 저장합니다. | |
| 4용액 50 ㎎ / ㎖의 G418 (최종 농 0.4 ㎎ / ㎖) | ||
| 500㎖의 DMEM에 / F-12 (L 글루타민과 HEPES와) | ||
| 0.2 % 젤라틴 | 25 ml의 2.0 % 젤라틴 | 4 ºC에 저장합니다. |
| 80 ml의 증류수 | ||
| 잘 섞다 | ||
| 70 % 에탄올 | 30 ml의 95 % 에탄올 | 스프레이 병에 넣습니다. |
| 70 ml의 증류수 | 실온에서 보관 | |
| Neurosphere 해리 매체 | 1 ml의 20U 파파인 | 신선한마다 준비 |
| 100 ㎕의 13 mg을 / ㎖ 트립신 | ||
| 100 μL 7 ㎎ / ㎖의 히알루 론산 | ||
| 28 ㎕의 10 ㎎ / ㎖ DNaseI | ||
| 50 μL의 4 ㎎ / ㎖ kynurenic 산 | ||
| Neurosphere 배양 배지 | DMEM / F-12 (L 글루타민과 HEPES와) | 신선한마다 준비 |
| 2 % B-27 보충 | ||
| 20 ng / ml의 섬유 아세포 성장 인자 (FGF) | ||
| 20ng 표피 성장 인자 (EGF) | ||
| 2.5 %의 글루 타르 알데하이드 | 250 ㎕의 50 % 글루 타르 | 신선한마다 준비 |
| 4750 μL 1X PBS | ||
| LacZ를 세척 솔루션 | 0.5 ml의 10 % 데 옥시 콜레이트 (0.1 % 최종 농) | 4 ºC에 저장합니다. |
| 1.0 ml를 100 % NP-40 (최종 농 0.2 %) | ||
| 50 ml의 10 배 PBS | ||
| 500 ml의 증류수 | ||
| X-여자 염색 솔루션 | 1X 칼륨 페로 | 신선한마다 준비 |
| 1X의 페리 시안화 칼륨 | ||
| 1 ㎎ / ㎖ X-여자 | ||
| 적절한 볼륨 LacZ를 세척 용액을 사용하여 | ||
| F9 RARE-LacZ를 동결 매체 | F9 RARE-LacZ를 배지 + 5 % DMSO | 신선한마다 준비 |
표 2. 작업 버퍼 및 솔루션 조성물.
토론
F9를 RARE-LacZ를 세포주 (14) 조직 이식편 12,14,17,18 제조 RA의 검출에 사용될 수있는 강력한 시스템이다. 그것은 RA 12,14,18와 치료 세포에서 감지 된 비특이적 반응과, 100 FM의 낮은 RA 농도에 민감합니다. 또한, 리포터 세포 따라서 LacZ를 반응 정량화 RA 12,14,18 레벨의 크기를 결정하는데 이용 될 수 있도록 농도를 특정 범위로 선형 방식으로 올 - 트랜스 RA로 응답한다. 여기에 제시된 빠르고 쉽게 RA 기자 분석은 배아 배양 성인 신경 줄기 세포의 시각화 (그림 2)와 상대 정량 측정 (그림 3)에 대한 F9 RARE-LacZ를 리포터 세포주를 사용합니다. 이 리포터 시스템은도 2에 도시 된 바와 같이 각각의 샘플 사이의 내인성 RA 수준의 비교를 허용한다. RA를 감지 할 수있을만큼 민감배양 neurosphere를 (그림 2B)에 의해 생성 된 개별 E8.5 배아 (그림 2A)뿐만 아니라 RA에 의해 생성. RA의 다양한 농도로이 세포주의 투여 량 - 의존적 반응이 샘플 (도 3b) 사이의 상대적인 RA 레벨의 샘플에 RA 레벨 (도 3a)의 정량과 비교 가능하다. F9 RARE 리포터 세포주 배양 시간별 조직 샘플에 의해 생성 된 RA의 전체 양을 측정하는 것이 중요하다. 이 RA 합성과 이화 작용의 순 잔액에 해당합니다.
F9를 RARE-LacZ를 리포터 세포 시스템은 매우 민감하고 다양한 있지만, 우리는이 시스템의 신뢰성을 보장하기 위해 도입 한 몇 가지 중요한 문제 해결 방법이있다. 도 1에 도시 된 바와 같이 우선, 그들이 g셔서없이 일정한 통로에 의해 이들 세포의 상태를 유지하는 것이 중요포화 상태에 행. 둘째, 우리가 관찰 한 후에 구절은 문화가 지속적으로 G418와 선택에 따라 유지되는 경우에도 일관성 RA 응답 발생하는 경향이있다. 이 문제를 해결하기 위해, 20 구절 후 문화를 버리고 새로운 병을 해동하는 것이 좋습니다. 또한, 정기적 인 검사가 리포터 세포는 여전히 미디어 RA의 존재에 대한 강한 대응되도록 수행되어야한다. 셋째, 초기 통로 강력한 대응 (그림 1B, 맞 t)를 얻을 때까지해야 할 수도 있습니다 RA (왼쪽 그림 1B), 하나 이상의 서브 클로닝 몇 차례에 불량 또는 비 균일 한 응답을 표시합니다. 마지막으로, 문화 공동 전에, 이러한 배아 및 neurosphere를 같은 조직 샘플이 하나의 세포로 분해하는 것이 좋습니다. 우리는 일관성 비색 측정에서 샘플 결과의 해리를 관찰했다. 해리 세포가 유니에있는 이것은, 문화 우물에서 RA의보다 균일 한 분포에 기인 할 수있다기자 세포와 형태 접촉.
몇 가지 수정은 원래 프로토콜 (14)에 만들어졌다. 먼저, F9 RARE-LacZ를 셀 RA 응답 직접 세포를 고정하고 610 nm에서 흡광도를 측정하는 대신에 세포를 수집하고 B- 갈 락토시다 제 활성을 14 해물을 분석하여 정량 하였다. 다른 변형은 RA 반응의 정량화 전에 F9 RARE-LacZ를 해리와 시료의 직접 동시 배양한다. 이전 방법은 별도로 샘플을 배양하고 RARE-LacZ를 16, 18에서 F9 이러한 문화에서 만 미디어를 추가보고했다.
해당되는 강력한 시스템에도 불구하고, F9 RARE-LacZ를 리포터 분석은 몇 가지 제한 사항이 있습니다. 이 리포터 세포주의 한 가지 제한은 올 - 트랜스 RA의 존재를 강력하게 반응하지만,도 9 시스 RA 및 13-CIS-RA 포함한 다른 레티노 산 이성질체 응답이다; 그러나 이러한 올 - 트랜스 RA 안돼요 더 민감 100 배이다다른 이성질체 18 빨간색. 이 시스템의 또 다른 제한은 선형 용량 의존적 반응은 10-7 10 -13 M 사이에 떨어지는 것입니다 M에서-RA (14, 18); 따라서, 이러한 한계를 벗어난 RA 레벨을 비교하는 경우, 측정이 선형 범위 내로 될 때까지 시료의 일련의 희석을 수행 할 필요가있을 수도있다. 이것은 주로 비색 분석법 때문에 마지막으로, 발색 엔드 샘플과 실험 사이에서 변할 것이다. 따라서, 항상 위해 매 실험 평행 도금 표준 곡선은 리포터 세포 반응의 정량을 위해 사용하는 것이 중요하다.
결론적으로 neurosphere를 이전에보고되지 않은, E8.5 배아 정량적 RA 수준을 측정하기 위해 F9 RARE-LacZ를 RA 리포터 세포주의 사용을보고 하였다. 이 리포터 시스템의 다양성은 거의 모든 세포 또는 조직 유형 RA 수준의 정량화를 허용하고, 수 mAY 향후 다양한 애플리케이션 개발 될.
공개
The authors have nothing to disclose.
감사의 말
We would like to acknowledge Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) for providing us with the F9 RARE-LacZ cells and technical support. This study is funded by the New Jersey Commission on Spinal Cord Research (NJCSCR) (Grantnumber:10-3092-SCR-E-0) and the New Jersey Commission on Brain Injury Research (NJCBIR) (Grant number: CBIR13FEL006).
자료
| Name | Company | Catalog Number | Comments |
| C3H/HeSn-Gpr161vl/J mouse strain | Jackson Laboratory | 000316 | |
| F9 RARE-LacZ reporter cell line | from Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) | ||
| DMEM/F-12 (with L-glutamine and HEPES) | ThermoFisher Scientific | 11330-057 | |
| Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific | 26140-079 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; warm in 37 °C for media preparation |
| Penicillin/Streptomycin | ThermoFisher Scientific | 15140-122 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; light-sensitive |
| G418 | ThermoFisher Scientific | 10131-027 | Store at 4 °C; light-sensitive |
| 2% Gelatin | Sigma Aldrich | G1393 | Store at 4 °C |
| B-27 supplement (2 % stock solution) | ThermoFisher Scientific | 17504-044 | Store at -20 °C in 1-ml aliquots to avoid repeated freeze-thaw; warm at room temperature for media preparation |
| Murine Epidermal Growth Factor (EGF) | PeproTech | 315-09 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1xPBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| Murine Fibroblast Growth Factor (FGF)-basic | PeproTech | 450-33 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1x PBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| 50% glutaraldehyde | Amresco | M155 | Store at 4 °C |
| Sodium deoxycholate monohydrate (C24H39NaO4 · H2O) | Sigma Aldrich | D5670 | Store at RT |
| X-gal (5-bromo-4-chloro-3-indolyl-β-d-galactopyranoside) | Promega | V3941 | Store stock at -20 °C |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | 41639 | Store at RT |
| all-trans Retinoic Acid (at-RA) | Sigma Aldrich | R-2625 | Store 1 ml aliquots of stock in -80 °C; extremely sensitive to light |
| TrypLE Express | ThermoFisher Scientific | 12605-010 | Store at RT |
| 0.25% trypsin-EDTA | ThermoFisher Scientific | 25200-056 | alternative to TrypLE Express; aliquot and store at -20 °C |
| Hank's Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14170-112 | Store at 4 °C |
| 10x phosphate buffered solution (PBS) | ThermoFisher Scientific | 10010-023 | Store at 4 °C |
| Papain | Worthington | LK003176 | Store at 4 °C. |
| Trypsin | Worthington | LS003703 | Store in 1 ml aliquots at -20 °C. |
| Hyaluronic acid | Calbiochem | 385908 | Store 200 μl aliquots at -20 °C. |
| DNaseI | Worthington | LS002139 | Store in 200 μl aliquots at -20 °C |
| Kynurenic acid | Sigma Aldrich | K3375 | Store in 200 μl aliquots at -20 °C |
| 95% ethanol | |||
| Mr. Frosty Freezing container | ThermoFisher Scientific | 5100-0001 | |
| 10 cm culture dish (non-cell culture treated) | |||
| 10 cm culture dish (cell culture treated) | |||
| 6 cm culture dish (non-cell culture treated) | |||
| 96-well cell culture plates | |||
| 1.5 ml microcentrifuge tubes | |||
| 1.5 ml amber microcentrifuge tubes | |||
| 1.5 ml cryovials | |||
| 37 °C water bath | |||
| surgical scissors | |||
| fine surgical scissors | |||
| no. 5 forceps | |||
| blunt-ended forceps | |||
| scalpel blade | |||
| glass pasteur pipettes | |||
| cotton | |||
| alcohol lamp | |||
| ELISA plate reader | |||
| stereomicroscope |
참고문헌
- Vilhais-Neto, G. C., Pourquie, O. Retinoic acid. Curr Biol. 18 (5), R191-R192 (2008).
- Drager, U. C. Retinoic acid signaling in the functioning brain. Science Signalling. 324, 1-3 (2006).
- Lane, M. A., Bailey, S. J. Role of retinoid signalling in the adult brain. Prog Neurobiol. 75 (4), 275-293 (2005).
- Maden, M. Retinoid signalling in the development of the central nervous system. Nat Rev Neurosci. 3 (11), 843-853 (2002).
- Maden, M. Retinoids and spinal cord development. J Neurobiol. 66 (7), 726-738 (2006).
- Rhinn, M., Dolle, P. Retinoic acid signalling during development. Development. 139 (5), 843-858 (2012).
- Ang, H. L., Deltour, L., Hayamizu, T. F., Zgombic-Knight, M., Duester, G. Retinoic acid synthesis in mouse embryos during gastrulation and craniofacial development linked to class IV alcohol dehydrogenase gene expression. J Biol Chem. 271 (16), 9526-9534 (1996).
- Ang, H. L., Duester, G. Stimulation of premature retinoic acid synthesis in Xenopus embryos following premature expression of aldehyde dehydrogenase ALDH1. Eur J Biochem. 260, 227-234 (1999).
- Bastien, J., Rochette-Egly, C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 328, 1-16 (2004).
- Chatzi, C., Cunningham, T. J., Duester, G. Investigation of retinoic acid function during embryonic brain development using retinaldehyde-rescued Rdh10 knockout mice. Dev Dyn. 242 (9), 1056-1065 (2013).
- Sakai, Y., Drager, U. C. Detection of retinoic acid catabolism with reporter systems and by in situ hybridization for CYP26 enzymes. Methods Mol Biol. 652, 277-294 (2010).
- Yamamoto, M., Drager, U. C., McCaffery, P. A novel assay for retinoic acid catabolic enzymes shows high expression in the developing hindbrain. Dev Biol Res. 107, 103-111 (1998).
- Rossant, J., Zirngibl, R., Cado, D., Shago, M., Giguere, V. Expression of a retinoic acid response element-hsplacZ transgene defines specific domains of transcriptional activity during mouse embryogenesis. Genes & Dev. 5, 1333-1344 (1991).
- Wagner, M., Han, B., Jessel, T. M. Regional differences in retinoid release from embryonic neural tissue detected by an in vitro reporter assay. Development. 116, 55-66 (1992).
- Luo, T., Wagner, E., Crandall, J. E., Drager, U. C. A retinoic-acid critical period in the early postnatal mouse brain. Biol Psychiatry. 56 (12), 971-980 (2004).
- Luo, T., Wagner, E., Grun, F., Drager, U. C. Retinoic acid signaling in the brain marks formation of optic projections, maturation of the dorsal telencephalon, and function of limbic sites. J Comp Neurol. 470 (3), 297-316 (2004).
- Kelley, M. W., Xu, X. M., Wagner, M. A., Warchol, M. E., Corwin, J. T. The developing organ of Corti contains retinoic acid and forms supernumerary hair cells in response to exogenous retinoic acid in culture. Development. 119, 1041-1053 (1993).
- McCaffery, P., Drager, U. C. Hot spots of retinoic acid synthesis in the developing spinal cord. Proc Natl Acad Sci. 91, 7194-7197 (1994).
- Hu, L., Gudas, L. J. Cyclic AMP analogs and retinoic acid influence the expression of retinoic acid receptor alpha, beta, and gamma mRNAs in F9 teratocarcinoma cells. Mol Cell Biol. 10 (1), 391-396 (1990).
- Martin, G. R. Teratocarcinomas and mammalian embryogenesis. Science. 209 (4458), 768-776 (1980).
- Strickland, S., Mahdavi, V. The induction of differentiation in teratocarcinoma stem cells by retinoic acid. Cell. 15 (2), 393-403 (1978).
- Li, B. I., et al. The orphan GPCR, Gpr161, regulates the retinoic acid and canonical Wnt pathways during neurulation. Dev Biol. 402 (1), 17-31 (2015).
- Hogan, B., Constantini, F., Lacy, E. . Manipulating the Mouse Embryo: A Laboratory Manual. , (1986).
- Deleyrolle, L. P., Reynolds, B. A. Isolation, expansion, and differentiation of adult Mammalian neural stem and progenitor cells using the neurosphere assay. Methods Mol Biol. 549, 91-101 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유