JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생체 외에서 교정 무료 단백질 호모-oligomerization 상업 계측 및 무료, 오픈 소스 밝기 분석 소프트웨어를 사용 하 여의 정량화
요약
이 프로토콜 단백질 호모-oligomerization에서 체 외에 상업 조명 현미경 검사를 사용 하 여 형광 변동 분광학에 따라 측정을 위한 보정 없는 접근을 설명 합니다. 올바른 인수 설정 및 분석 방법을 표시 됩니다.
초록
수와 밝기 감지 단백질 호모-oligomerization에 대 한 교정 무료 형광 변동 분광학 (FFS) 기술입니다. 그것은 전통적인 confocal 현미경 디지털 감지기 장비를 사용 하 여 사용할 수 있습니다. 생체 외에서 기술 사용에 대 한 프로토콜 번호와 밝기를 dimerizing 약 AP20187의 추가 전후 mVenus 표시 FKBP12F36V의 oligomeric 상태를 정확 하 게 계량을 볼 수 있는 사용 사례에 의해 표시 됩니다. 정확한 현미경 수집 매개 변수를 사용 하 여 올바른 데이터 전처리 및 분석 방법의 중요성을 설명 합니다. 특히, photobleaching의 선택의 중요성은 강조 했다. 이 저렴 한 방법은 많은 생물학 문맥에서 단백질 단백질 상호 작용 연구에 사용할 수 있습니다.
서문
단백질-단백질 상호 작용 나 n 체 외
전통적으로, 결정학 및 cryo 전자 현미경 검사 법 (cryoEM)와 결합 하는 핵 자기 공명 실험은 정확 하 게 단백질의 3 차원 구조를 설명 하 고 그들의 기능을 추정 하는 것을 선택 하는 기술 그들의 높은 해상도 구조 세부 사항을 면밀히 그러나 단백질,, 정적 구조 하 시간과 공간에 다양 한 구조적 변화와 진동 받을 수 있습니다. 이 때문에 구조 결정학에서 정보 또는 CryoEM 데이터 (예: 분자 동역학 시뮬레이션 기술과 단일 분자) 다른 기술로 보완 될 필요가: 그 구조적 관련 단백질의 기능 변경 및 상호 작용, 그리고이 정보는 정적 구조에 존재. 내부 분자 역학 조사, 순서 기술 포스터 공명 에너지 전송 (smFRET) 단일 분자에 따라 매우 효과적인1있습니다. 이러한 방식을 복잡 한 매체에 있는 분자의 다른 부분 모집단을 평가할 수 있습니다. 이것은 매우 중요 하 고, 이러한 변경 신속 하 고 (즉, 두 번째 범위에 나노초) 데이터 수집 중에 발생.
두 가지 주요 방법을 감지 하 고 이러한 변화를 정량화 일반적으로 채택 된다: 솔루션 및 표면 immobilization 단백질. 감지 간의 분자 상호 작용의와 특히, 이합체 화, ligands에 의해 유도 된 과정에 대 한 smFRET은 항상는 최고의 도구가 아니다. 사실, 무서 워 거리 (≈10 nm)에 뿐만 아니라 두 개의 쌍 극 자 (기증자 및 수락자, χ2)의 방향에 따라 그리고 수락자의 흡수 스펙트럼2, 하지만 아마도이 마지막 조건 기증자 방출의 오버랩은 중요 한 하는 experimentalist 수 오른쪽 무서 워 몇 선택. 호모-이합체 화를 프로 빙에 대 한 smFRET의 특정 단점 관심사의 단백질의 라벨에서 온다: hetero smFRET, 이합체 화만 될 수 있습니다 감지 최대 50% (즉, hetero 무서 워만 기증자 수락자를 감지할 수 있을 것입니다 및 기증자 수락자 호모-이합체 하지 기증자 기증자 또는 수락자-수락자, 다른 50%는 이합체의). 형광 상관 분광학 (FCS) 및 파생 상품 (FCCS, 등3) 확인 단백질 보급 상수 및 바인딩 상수에서 생체 외에서 의 사용은 또 다른 대안 이다. 이러한 방식을 완전히 중 호모-이합체 화를 계량 수, 확산 입자의 FCS 한 측정 농도 확산, 반지름 및 확산 계수가 매우 저조한; 분자량에 의존 예를 들어 10 증가 분자량에만 확산 계수4에서 2.15 배 변화를 나타내며. 2 컬러 FCS 또는 FCCS, 호모 이합체의 50%만 위와 같은 이유로 볼 것입니다. 호모-이합체 화에서 생체 외에서 그리고 vivo에서 감지 하는 가장 실용적이 고 양적 접근은 호모 무서 워5 와 수와 명도 (N & B)6. 그 사실을 감안할 때 호모 무서 워 필요 이방성 값 (즉, 광학 요소/분석기 병렬 및 수직 분극 복구)의 특정 계측 복구, N & B 제공 됩니다 여기에 유리한 기술로 단백질 호모-이합체 화 및 집계 검색 합니다. 그것은 될 수 있다 생체 외에서 그리고 vivo에서 상업 설정 고용.
수와 밝기
N & B 최근 검토7되었습니다. 그 리뷰는 라이브 셀에서 기술의 응용 프로그램에 집중 했다. 그것은 가치가 재현이이 방정식으로 수학적 주의 여기 데이터에 적용 될 것입니다 수집 에 체 외. 첫째, 그것은 몇 가지 용어 및 수학 수량을 정의 하는 데 필요한:
- 엔터티가 바인딩되는 함께 분자의 집합입니다.
- 엔터티 밝기 ε (프레임) 당 단위 시간 당 방출 하는 광자의 수입니다.
- n 은 현재 엔터티 수입니다.
- 이미지 시리즈의 과정을 통해 주어진된 픽셀, < 나 > 의 의미와 σ2 은 그것의 강도에 대 한 분산입니다.
다음,와 광자 계산 탐지기 모바일 엔터티 및 아무 배경 가정
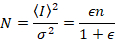
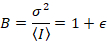
여기서 N 은 명백한 수 와 B 명백한 밝기입니다. 이 인해
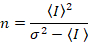
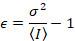
Dalal 외. 8 아날로그 장비와 함께 하나의 3 개의 교정 기간 요구 했다: S 요소, 배경 오프셋및 판독 잡음 σ02. 다음, 다시 모바일 엔터티, 가정
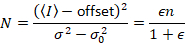
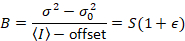
주는
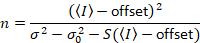

위의 방정식은 다른 Dalal 외 에 주어진 8 그리고 후속 검토입니다. 7 에 Dalal 외. S 분모에 오타 때문에 생략 되었다 그리고이 오류는 검토에서 재현 됐다. 위의 방정식 올바른 것 이다입니다. 지침 S측정, 오프셋 및 σ02 -그들의 의미-에 대 한 설명 Dalal 외 에 의해 주어진 다 8
밝기 ε 이다 oligomeric 확산 엔터티 상태에 비례: ε 그것은 단위체, 세 번 큰 trimers를 위한 trimers 등은 단위체, hexamers에 대 한 큰 두 번은 이합체에 대 한 큰 두 번 있을 것입니다. 이 방법에서는, 밝기 ε를 측정 하나 multimerization의 모든 종류를 계량 수 있습니다.
만약 oligomeric 국가의 혼합물, 수 있으며 밝기는 현재 개별 oligomeric 상태 복구의 수 있습니다. 이 기술의 한계입니다.
알고리즘 및 nandb 소프트웨어 detrend
Photobleaching는을 위한 교정의 중요성은 이전9를강조 했다. Photobleaching은 필연적으로 시간 경과 모드;에 가벼운 현미경 실험 중 발생 둘 다 라이브 세포에 생체 외에서. 많은 접근7표백에 대 한 올바른 문학에서 설명 했습니다. 트렌딩 매개 변수 T 의 자동 선택과 지 수 필터링 기술은 현재 최고입니다. 그것은 무료, 오픈 소스 소프트웨어 nandb9에 통합 된다. 실제로, 그들의 detrending 매개 변수를 수동으로 선택 하는 사용자를 필요로 하는 소프트웨어 임의적이 고 잘못 된 매개 변수 선택이 될 가능성이 있기 때문에 잘못 된 결과가 발생할 수 있습니다. 자동 알고리즘 데이터를 검사 하 고 사용자 개입9에 대 한 필요 없이, 그것에 대 한 적절 한 매개 변수를 결정 합니다. 부드럽게 매개 변수의 최선의 선택으로도 트렌딩는 한계가 하며 잘만 photobleaching 비율 25% 보다 낮은 시뮬레이션9와 같이 작동 합니다. 흥미롭게도, 자동 detrending 루틴을 사용 하 여, 그것의 정확도 하나 낮은 밝기 값을 사용할 수 있습니다 (심지어 B < 1.01), 따라서 낮은 농도, 그리고 아직 충분히 정확 하 게 계량 호모-이합체 화.
Photobleaching는 또한 또 다른 문제를 일으키는: multimer 복잡 한에 photobleached fluorophores의 존재. 이것은 예를 들어, 경우는 삼합체에 3 단위 중 하나 비 형광은 삼합체는 이합체 처럼 나타납니다. 허 고 뮬러10 이 해결 하는 방법 그리고이 수정 또한 후속 검토7에서 강조 되었다. Nandb 소프트웨어는이 보정9포함 되어 있습니다.
FKBP12 F36V 시스템
FKBP12F36V는 자연스럽 게 oligomerize 하지 않습니다 하지만 AP20187 약물 (구어체로 dimerizing ligand BB 라고도 함)11,12의 추가 따라 dimerize 알려져 있는 단백질 이다. 이것은 번호와 밝기에 대 한 이상적인 테스트 케이스: 이라는 FKBP12F36V와 oligomeric 상태의 두 배로 관찰 해야 BB의 추가에.
프로토콜
1. FKBP12 F36V-mVenus 정화
- Monomerized 인간 FKBP12F36V12 및 N 맨끝 His6 태그와 mVenus 태그 (요청에 사용할 수 있는 벡터)를 포함 하는 pET22b 벡터와 (DE3) pLysS 셀을 변환 합니다. 파운드 천 50 µ g/mL 암 피 실린과 34 µ g/mL 페니와 보완에 플레이트 세포.
- 100 mL 파운드 스타터 문화로 변환 된 식민지를 전송 하 고 떨고와 37 ℃에서 16 ~ 20 시간에 대 한 성장.
- 고밀도 스타터 문화를 희석 (OD600 > 1) 1: 100 파운드 매체 (2 x 500 mL 배치)에 OD600를 2-3 시간 동안 성장 = 0.6-0.8 (37 ° C, 200 rpm).
- 얼음에 멋진 문화입니다. 250 µ M IPTG 유발 하 고 21 ° C, 200 rpm에서 16-20 시간에 대 한 성장.
- 20 분 동안 2000 x g에서 원심 분리 하 여 세포를 수확.
- 아이맥 버퍼 (20 m m 인산 나트륨 pH 7.5, 500 m m NaCl, 이미 3 m m, 1mm β-mercaptoethanol) 보충 EDTA 무료 protease 억제제 (1 태블릿 셀 펠 릿 당) 40 mL에 펠 릿을 resuspend.
- 셀 sonicate (500w, 20 kHz, 40% 진폭, 9 초, 11 15 분 떨어져 s) 20000 x g에서 원심 분리 하 여 수확과 얼음 녹는 물자에.
- 전송 성 lysate 원뿔 플라스 크를 고 수 지의 2 개 mL를 추가 ( 재료의 표참조). 105 rpm 회전 1 시간 동안 품 어
참고: 니켈 sepharose 또한이 아이맥 단계에 사용할 수 있습니다. - 수 지를 수확 하 고 아이맥 버퍼는 (20 m m 인산 나트륨 pH 7.5, 500 mM NaCl, 7mm 이미, 1 m m β-mercaptoethanol) 아이맥 버퍼 B의 500 mL의 250 mL로 씻어.
참고: 50mm 이미 경우 니켈 sepharose 수 지를 사용 하 여 늘립니다. - 아이맥 버퍼 C (20 m m 인산 나트륨 pH 7.5, 500 mM NaCl, 이미 300 m m, 1mm β-mercaptoethanol)를 사용 하 여 His6 태그가 단백질 elute
- 크기 배제에 주사 열 10 mM HEPES pH 7.5, 150 m m NaCl, 1 mM DTT에에서 equilibrated ( 재료의 표참조). FKBP12F36V의 피크 차입을 87.71 mL 우리가 사용 하는 열에 있다.
- SDS 페이지 및 수영장을 통해 순도 평가 하 고 필요에 따라 집중.
2입니다. Multiwell 격판덮개 배열 준비
- 순화 FKBP12F36V를 녹여 (또는 관심사의 단백질 표시)-80 ° c.에서
- 100의 솔루션을 준비 nM 정화 FKBP12F36V (중간, 10 mM HEPES pH 7.5, 150 m m NaCl, 1 mM DTT). Sonicate 고 집계의 형성을 방지 (13000 rpm의 빠른 회전)을 원심.
- 100-200 µ L 유리 바닥 8 잘 관찰 챔버로 플라스틱.
- 10, 20, 40, 80, 100, 150, 300, 및 500 nM12,13의 최종 농도에 BB dimerizer를 추가 합니다.
- 참고로, 100의 솔루션 준비 혼자 잠재적인 집계 및 강 수 효과 평가 하 고 동일한 수집 설정으로는 단량체에 대 한 밝기 값을 복구 하는 mVenus의 nM.
3. 교정 무료 Confocal 수집
- 공초점 레이저 시스템 (그림 1)를 시작 합니다. 어떤 가벼운 현미경 confocal 시스템 스캔 디지털 감지기 또는 잘 특징이 아날로그 감지기8있고 유지의 지속적인 유지 시간 획득 하는 모든 픽셀을 작동 합니다.
- 여기 빔 경로 설정:
- 514 nm 레이저 및 세트 그것 20-100 베스트 팔 렌 (FKBP12F36V-mVenus)에 대 한 목표의 출구에 전원을 켭니다.
- 63X1.4NA 목표 또는 FCS를 위한 칼라 보정 물 침수 목표를 선택 합니다.
- 한 유압, APD 또는 보정된 PMT 검출기를 켭니다. 검출기의 광자를 세는 바람직 하 고,이 경우, 계산의 S, 오프셋 및 σ02 는 필요 하지 않습니다.
- 520-560 nm에서 방출 창 선택
- 1 공기 단위 해당 방출 ~ 545 nm에서 pinhole을 설정 합니다.
- 16 x 16 픽셀에 수집 모드를 설정
- 설정 된 픽셀 면만 시간 t연연 같은 t프레임 만족 >> TD >> t연연, 여기서 D 는 확산 단백질과 t의 체류 시간 프레임 은 프레임 속도. 이 ~ 13 µs 유지 시간 설정에 대응 했다.
참고: 일부 상용 제조업체 스캐너 픽셀 당 유지 시간 상수 유지 하지 했다 했다. 이 불변성은 작동 방법에 대 한 중요 합니다. - ~ 120에서 픽셀 크기를 설정 nm.
- Xyt 수집 모드를 선택 하 고 수집 및 잘 (예: 5000) 당 획득 프레임 수를 선택 합니다.
- 경우 시스템은 높은 처리량 모드, 프로세스를 자동화 하 각 잘하고 잘 당 인수 수의 좌표를 소개 합니다.
참고: 집중 목표를 사용 하는 경우는 물 디스펜서의 존재를 보장 하기 위해 주의 해야 합니다. - 시스템 설치 되어 있는 경우 관류 시스템 BB 솔루션을 로드 하 고 프로그램 오른쪽 후 시작을 관류의 예를 들어, 10000 이미지를 획득 하는 동안 이합체 화 활동 평가를 5000번째 프레임.
- 기름 침수 목표에 오일 한 방울을 추가/물 FCS를 위한 칼라 보정 물 침수 목표를 활용 하는 경우.
- 단계에 8 잘 관찰 챔버를 탑재 합니다.
- 정확한 음을 선택 하 고 솔루션에 초점.
참고: 중요 한: 반사와 분산을 피하기 위해 하단 유리 가까이 초점을 방지. 솔루션으로 깊은 초점, 자동된 포커스 옵션을 분리 합니다. - 인수를 시작 하 고 이미지의 결과 스택 TIFF 형식으로 저장.
4. detrend 및 R 패키지 nandb를 사용 하 여 밝기 분석
- 그림 2는에서 같이 전처리 품질 검사로 서 이미지를 보고 고 강도 프로필 복구 ImageJ14 를 사용 합니다. 너무 많은 photobleaching 발생 여부 확인에 유용 합니다. 너무 많이 표백 경우 데이터 추가 분석을 위해 부적 하다.
참고: ImageJ 상업 형식에서 tiff 이미지를 변환 하는 데 유용 수도 있습니다. 아래 설명 하는 nandb 소프트웨어 TIFF 파일에만 사용할 수 있습니다. - 다운로드 및 설치 R 및 RStudio15,16. 그것은 다운로드 하 고 설치 R 최고의 첫 번째, 다음 RStudio.
참고: 다음은 nandb R 패키지를 사용 하는 방법의 설명입니다. 그러나 R 언어의 기술 그것은 인생을 쉽게 만들 것입니다 nandb를 사용 하 여 필요 하지 않습니다. - Nandb 패키지를 설치 합니다.
- RStudio 및 콘솔에서 install.packages("nandb")를 입력 열고 설치를 기다립니다.
- Nandb를 알게
- 수동17검토 합니다.
- 다양 한 기능에 대 한 내장 된 RStudio 도움말을 검토 합니다. 가장 가능성이 기능을 사용할 수 있을 것입니다 사용 하 여 brightness() 될 것입니다. 입력 하 여이 기능에 대 한 도움말 파일을 보려면? 콘솔에서 brightness()입니다.
- 밝기를 계산
- 하나는 img001.tif (참고만 TIFF 파일 작동 하는 그 'nandb') 라는 바탕 화면에 있는 이미지 파일을 말한다. 하나는 그 이미지의 밝기를 계산할 수 있습니다.
b <-밝기 ("~/Desktop/img001.tif", 타우 = "자동")- 이 r에서 변수 b에는 이미지의 밝기를 할당 타우 = "자동" 보장 이미지 밝기 계산 하기 전에 detrended 올바르게. 여기에서 할 수 있는 가장 일반적인 일 평균 또는 이미지의 평균 명도 계산 하는 것입니다. 하나는 mean(b) 또는 median(b)를 입력 하 여 이것을 할 수 있다. 또한 바탕 화면 사용 하 여 밝기 이미지를 작성할 수 있습니다.
ijtiff::write_tif (b, "~/Desktop/whatever_img_name")
- 이 r에서 변수 b에는 이미지의 밝기를 할당 타우 = "자동" 보장 이미지 밝기 계산 하기 전에 detrended 올바르게. 여기에서 할 수 있는 가장 일반적인 일 평균 또는 이미지의 평균 명도 계산 하는 것입니다. 하나는 mean(b) 또는 median(b)를 입력 하 여 이것을 할 수 있다. 또한 바탕 화면 사용 하 여 밝기 이미지를 작성할 수 있습니다.
- 하나는 바탕 화면에 이미지 images_folder의 전체 폴더 하나 이러한 이미지의 brightnesses를 계산 하 고 밝기 이미지를 TIFF 파일로 쓸 필요가 말한다. 다음 참조? brightness_folder(). 이 함수는 한 번에 전체 폴더 처리:
brightness_folder ("~/Desktop/images_folder", 타우 = "자동")
이것은 특히 좋은 소프트웨어를 연구 하는 것을 선호 하는 사람들을 위해, 모든 파일 하나 하나의 명령, 처리 되 고 하나 갈 일 수 그들의 선택한 소프트웨어에 출력 밝기 TIFF 이미지, 때문에 그것 ImageJ14 Python 또는 뭔가 다른.
- 하나는 img001.tif (참고만 TIFF 파일 작동 하는 그 'nandb') 라는 바탕 화면에 있는 이미지 파일을 말한다. 하나는 그 이미지의 밝기를 계산할 수 있습니다.
결과
트렌딩 및 단위체 밝기
데이터 획득 되 면 하나의 솔루션에 관심사의 단백질의 oligomeric 상태를 확인 하려면 밝기 계산을 시작할 수 있습니다. 솔루션에서 표백의 효과 과감 한 되지 않을 수도 있습니다 경우에 그것으로 비보에있을 수 있습니다, 그리고 강도 추적 여전히 아마 없을 것 photophysical 효과 fluorophor...
토론
N & B multimerization 상업적인 빛 디지털 검출기를 장착 하는 confocal 현미경 검사를 사용 하 여 감지 하는 기술입니다. 이 방법은 단일 지점 FCS, FCCS, 및 smFRET 교정 무료 이며 밝기 계산 하기 때문에 간단 하 고 농도 독립6에 비해 매우 매력적 이다. 그러나 그것은 중요 한 중요성의, 밝기 계산9;를 수행 하기 전에 표백 및 장기 강도 변동에 대 한 수정 표백에 따른 휘도 ?...
공개
저자는 공개 없다.
감사의 말
이 작품 Wellcome 신망에 의해 지원 되었습니다 105278/Z/14/2 치료에 부여 Wellcome 신뢰 센터 인간 유전학에 의해 Wellcome 신뢰 코어 수상 203852/Z/16/2 자금입니다. 작업 씨에 스 그룹에 암 연구 영국 (C20724/A14414), 그리고 유럽 연합의 지평선 2020 연구 및 혁신 프로그램 그랜트 647278 유럽 연구 위원회에 의해 지원 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| RosettaTM (DE3) pLysS cells | Novagen | 70956-3 | |
| Ampicillin | Sigma Aldrich | PubChem Substance ID 329824407 | |
| Chloramphenicol | Sigma Aldrich | PubChem Substance ID: 24892250 | |
| LB starter culture | QIAGEN | ||
| LB medium | QIAGEN | https://www.sigmaaldrich.com/content/dam/sigma-aldrich/head/search/external-link-icon.gif | |
| IPTG | Sigma Aldrich | PubChem Substance ID 329815691 | |
| IMAC buffer | Medicago | 09-1010-10 | |
| EDTA-free protease inhibitors | Sigma Aldrich | 11873580001 | |
| TALON resin | Clonetech | ||
| Nickel sepharose | GE Healthcare | ||
| S200 16/60 column | GE Healthcare | ||
| Glass bottom 8 well observation dish | Ibidi | 80827 |
참고문헌
- Voith von Voithenberg, L., Lamb, D. C. Single pair forster resonance energy transfer: A versatile tool to investigate protein conformational dynamics. BioEssays. 40, (2018).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95, 2976-2988 (2008).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Dual-color fluorescence lifetime correlation spectroscopy to quantify protein-protein interactions in live cell. Microscopy Research and Technique. 74, 788-793 (2011).
- Muller, J. D., Chen, Y., Gratton, E. Fluorescence correlation spectroscopy. Methods in Enzymology. 361, 69-92 (2003).
- Tramier, M., Coppey-Moisan, M. Fluorescence anisotropy imaging microscopy for homo-FRET in living cells. Methods in Cell Biology. 85, 395-414 (2008).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94, 2320-2332 (2008).
- Nolan, R., Iliopoulou, M., Alvarez, L., Padilla-Parra, S. Detecting protein aggregation and interaction in live cells: A guide to number and brightness. Methods. , (2017).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy Research and Technique. 71, 69-81 (2008).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. , (2017).
- Hur, K. H., et al. Quantitative Measurement of Brightness from Living Cells in the Presence of Photodepletion. PLoS One. 9, (2014).
- Amara, J. F., et al. A versatile synthetic dimerizer for the regulation of protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 94, 10618-10623 (1997).
- Clackson, T., et al. Redesigning an FKBP-ligand interface to generate chemical dimerizers with novel specificity. Proceedings of the National Academy of Sciences of the United States of America. 95, 10437-10442 (1998).
- Rollins, C. T., et al. A ligand-reversible dimerization system for controlling protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 97, 7096-7101 (2000).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Molecular Reproduction and Development. 82, 518-529 (2015).
- . R: A Language and Environment for Statistical Computing. R Core. , (2017).
- . RStudio: Integrated Development Environment for R. R Team. , (2016).
- . nandb R package Available from: https://CRAN.R-project.org/package=nandb (2017)
- Jung, G., Wiehler, J., Zumbusch, A. The photophysics of green fluorescent protein: influence of the key amino acids at positions 65, 203, and 222. Biophysical Journal. 88, 1932-1947 (2005).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2, 905-909 (2005).
- Butkevich, A. N., et al. Hydroxylated fluorescent dyes for live-cell labeling: synthesis, spectra and super-resolution STED. Chemistry: A European Journal. 23, 12114-12119 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유