Method Article
Dictyostelium discoideum 셀 선택에 따라 성장과 박테리아에서의 유전 공학
요약
Dictyostelium discoideum 셀 마이그레이션, endocytosis, 개발 등 복잡 한 세포질 과정을 공부 하는 인기 모델 생물 이다. 생물의 유틸리티 유전자 조작의 가능성에 따라 달라 집니다. 여기, 우리가 transfect Dictyostelium discoideum 세포를 액체 매체에서 자란 셀의 기존 한계를 극복 하는 방법을 제시.
초록
Dictyostelium discoideum 개발, 세포 신호, 및 다른 중요 한 세포 생물학 질문 중 세포 분화 과정의 연구에 대 한 흥미로운 모델 유기 체 이다. Dictyostelium 세포를 유전자 조작에 사용할 수 있는 기술 개발은. Transfections는 다른 선택 가능한 마커 및 마커 다시 사이클링, 동종 재결합 하 고 insertional mutagenesis 포함을 사용 하 여 수행할 수 있습니다. 이 잘 주석 게놈에 의해 지원 됩니다. 그러나, 이러한 접근 axenic 셀 라인 액체 문화에서 성장에 대 한 최적화 하 고 박테리아에만 먹이 비 axenic 야생-타입 셀에 적용 하기 어려운. Axenic 긴장에 있는 변이 Ras 신호, 수 유에 필요한 과도 한 macropinocytosis를 일으키는 방해 하 고 손상 세포 마이그레이션, 신호 변환 및 그 변종에 chemotaxis 실험의 해석을 혼동 한다. 이전 비 axenic 세포를 유전자 조작 하려고 효율과 필요한 복잡 한 실험 절차 부족 했습니다. 우리는 처음으로 이러한 한계를 극복 하는 간단한 transfection 프로토콜을 개발 했습니다. Dictyostelium 분자 유전학에 큰 개선의 그 시리즈 야생-타입 표준 실험실 긴장으로 쉽게 조작할 수를 셀 수 있습니다. 손상 되지 않은 신호 및 운동 성 프로세스를 공부에 대 한 장점 이외에 macropinocytosis 기반 성장 방해 돌연변이 이제 쉽게 격리 수 있습니다. 또한, 전체 transfection 워크플로 크게 가속, 일 보다는 오히려 주에 생성 될 수 있는 재조합 세포. 또 다른 장점은 분자 유전학 더 갓 격리 된 야생-타입 Dictyostelium 샘플 환경에서 수행할 수 있습니다. 이 연구 분야에서 사용 하는 방법의 범위를 확장 시킬 수 있습니다.
서문
Dictyostelium 속은 주로 박테리아에 피드 토양 생활 사회 아메바. 문 Amoebozoa에에서 배치 되 고, 많은 종 고립 되어가 4 개의 다른 clades1로 그룹화 할 수 있습니다. 종 Dictyostelium discoideum (D. discoideum) 먹어서 셀 마이그레이션 등 복잡 한 세포질 과정을 공부 하는 인기 모델 유기 체 되고있다. 제어 하 고 표준화 실험 조건, 박테리아2의 부재에 복잡 하거나 정의 된 액체 매체에서 성장할 수 있다 axenic 셀 라인 개발 되었습니다. 특별 한 중요성의 Ax2, Ax3, 그리고 Ax4 종자를 모두 1970 년대에 생성 된 단일 야생에서 궁극적으로 파생 된 격리 NC43. 유전 공학에 대 한 도구는 결과 19874,5에서 첫 번째 게시 된 녹아웃에이 axenic 긴장에서 개발 되었다. 프로토콜 추가 개발 하 고 axenic 조건6,7에서 사용 하기 위해 최적화 되었다.
적응 야생-타입 디 discoideum 에 이러한 프로토콜 변종 액체 국물에서 성장할 수 있는 여러 실험실에 의해 시도 되었습니다. 그러나이 되지 완전히 성공적인 transfection 프로토콜 복잡 한 박테리아의 용량 선택 시 약8,9에 대 한 싱크 역할을 때문에 효율성 부족 때문. 그 결과, D. discoideum 에 기본적으로 모든 분자 데이터 단일 야생-타입 분리의 자손에서 온다. 우리가이 한계를 극복 하 고 유전자 액체 매체에서 성장 하는 그들의 능력의 독립적인 D. discoideum 셀을 수정 하는 방법을 개발 싶 었 어 요. 그러한 방법에 대 한 필요 axenic 확장할 수 변이 주로 중립 이었던 과거에 생각 했다을 세포 생리학을 손상 하지 않았다 관찰 설명할 수 있습니다. 이 가정은 단지 부분적으로 정확. 일반적으로, 거기 두 가지 주목할 만한 차이점이; 첫째, 다른 사이 고립 된 axenic 긴장, 및 두 번째 때 이러한 axenic 변종 비 axenic 야생 격리8,9와 비교 됩니다.
아마도 가장 중요 한 요소가 이다 주요 axenic 유전자, 도끼B, RasGAP n f 1로 최근 확인 했다. Ras 활동3를 억제 하는 RasGAP으로 n f 1의 주요 기능이입니다. 모든 axenic 긴장에서 효소의 삭제 큰 활성 Ras 패치 형성으로 서 각 성 하는 과도 한 Ras 활동 이끌어 낸다. 이러한 확대 Ras 패치 원형질 막에 PIP3의 축적으로 이어질. PIP3 및 활성 Ras의 동시적인 나타나는 패치는 결국 닫히고 macropinosomes10의 형성에 이르게 하는 원형 주름의 형성에 대 한 서식 파일. 결과는 macropinocytic 활동에 과도 한 증가 이다. Macropinocytosis는 말라 기반 프로세스입니다. Macropinosomes 또는 pseudopods의 형성에 대 한 cytoskeletal 구성 요소에 대 한 경쟁 결과입니다. 셀 행동에 미치는 영향 folate11식물 세포의 chemotaxis의 거의 완전 한 예방에 반영 됩니다. 대규모 확대 PIP3 패치는 아주 영구 있습니다. 굶 어 셀 에서도 PIP3 패치 남아 있으며 pseudopods, 캠프 chemotaxis에 대 한 연구를 해석 하는 문제가 발생할 수 있습니다으로 잘못 해석 될 수 있다.
경우에 따라 n f 1 돌연변이 실험적으로 유용 합니다. 이것은 우리가 bacterially 성장된 디 discoideum transfection 방법 개발에 대 한 두 번째 동기 부여 세포, axenic 세포 macropinocytosis 속도 있는 증가 게 유용한이 과정12의 근본적인 측면을 조사 하 고 이후 . 그러나, macropinocytosis, Ras 및 PI3 kinases10, 등에 필요한 유전자에 있는 돌연변이 박테리아에 성장을 통해 이러한 세포를 조작 하는 데 필요한 그것을 만드는 axenic 성장을 폐지 거의 있다. 귀중 한 박테리아 기반 transfections를 렌더링 하는 또 다른 이유는 멀티 cellularity13,14, 친척 인식15,16, 진화에서 질문을 탐구 하는 Dictyostelids의 사용 증가 그리고 주로 갓 격리 된 야생-타입의 사용에 의존 하는 타 적인 세포 행동 격리17. 모든 연구 분야는 비 axenic 액체 국물에서 성장 하지 않습니다 야생 격리의 유전자 조작에 대 한 효율적인 방법으로 촉진 될 수 있다 언급 했다.
우리의 프로토콜 설명된 한계의 극복을 위한 수 있습니다. 합쳐, 그것으로 인해 선택 과정의 단지 증가 속도 빠릅니다 경우에 디 discoideum 셀 보유 혜택 모든 Dictyostelium 연구원, 대 한 성장 하는 박테리아와 유전자 조작의 가능성 axenic 미디어 (10 h)에 시간을 두 배로 성장에 비해 박테리아에 아메바 (4 h 배로 시간)의 성장.
프로토콜
1입니다. 세포와 자료의 준비
-
SorMC 버퍼 준비
- 20.36 g KH2포4 (15 m m)의 고 5.47 g Na2HPO4·7 H2O (2mm) ddH2O 물 100 mL에 용 해 하 여 SorMC (MgCl2 등 CaCl2소 렌 슨 버퍼) 버퍼 x 100의 100 mL를 준비 합니다. 실 온 (RT)에서 솔루션을 저 어와 볼륨 dH2오 100ml
참고: 결과 버퍼는 6의 pH 및 더 이상 필요 하지 않습니다 조정. - DdH2오 추가 50 µ L 각 MgCl2 와 CaCl 50 µ M의 최종 농도 달성 하기 위해2 에서 솔루션을 일 x 1의 1000 mL를 생산. 필터는 0.22 μ m 필터를 사용 하 여 솔루션을 소독.
참고: 항상 MgCl2 와 CaCl2 재고 솔루션 x 100에 소금의 강 수를 피하기 위해 1 x 버퍼에 추가 합니다. - 또는, 50 µ M MgCl2 보충 주식2 버퍼 (KH2포4 2.2 g와 K2HPO4 버퍼의 1 L의 0.7 g)와 50 µ M, CaCl2 (여기 주식2MC 라고도 함)을 준비 합니다. SorMC 대신 전역이 버퍼를 사용 합니다.
- 20.36 g KH2포4 (15 m m)의 고 5.47 g Na2HPO4·7 H2O (2mm) ddH2O 물 100 mL에 용 해 하 여 SorMC (MgCl2 등 CaCl2소 렌 슨 버퍼) 버퍼 x 100의 100 mL를 준비 합니다. 실 온 (RT)에서 솔루션을 저 어와 볼륨 dH2오 100ml
-
D. discoideum 를 위한 음식 근원으로 박테리아의 준비
- K. aerogenes 의 단일 식민지를 사용 하 고 접종 파운드-매체 (lysogeny 국물) 1 리터. 2 L 플라스 크를 사용 합니다. 박테리아를 220 rpm에서 떨고와 37 ° C에서 하룻밤 성장 하자.
참고: 2xTY 같은 풍부한 미디어를 사용 하는 대량의 박테리아 필요한 경우 (효 모 추출 tryptone 매체) 또는 흐 느껴 울 다 (슈퍼 최적의 국물) 파운드 대신. K. aerogenes 박테리아의 사용은 안전 제한으로 인해 허용 되지 않습니다, 경우 대장균 BL21 대신 사용할 수 있습니다. - 다음 날 ~ 6, 600 x g 20 분 세척 박테리아 SorMC 버퍼의 500 mL와 함께 한 번에 두 개의 500 mL 원심 분리기 튜브에서 그들을 아래로 회전 하 여 세포를 수확.
- SorMC의 20 mL에 펠 릿을 resuspend. OD600 확인 (광학 밀도 600 nm) photometer를 사용 하 여. 약 100의 OD600 동일한 버퍼와 희석.
참고: K. aerogenes 박테리아는 박테리아 아래로 회전에 대 한 상대적으로 높은 속도 음식 박테리아의 손실을 방지 하는 데 필요한 그래서 작은, 어렵다. 결과 세균성 주식 솔루션 최대 4 개월 4 ° C에서 냉장고에서 저장 될 수 있다 고 디 discoideum에 대 한 음식 근원으로 그것의 유틸리티를 유지 합니다. 하룻밤 파운드 매체에서 일반적으로 재배 K. aerogenes 서 스 펜 션의 1 L 약 100의 OD600 의 20 mL를 생성 합니다.
주의: 되도록 준비 된 박테리아의 K. aerogenes단, 후드 아래 모든 단계를 수행 합니다.
- K. aerogenes 의 단일 식민지를 사용 하 고 접종 파운드-매체 (lysogeny 국물) 1 리터. 2 L 플라스 크를 사용 합니다. 박테리아를 220 rpm에서 떨고와 37 ° C에서 하룻밤 성장 하자.
-
H40 electroporation 버퍼의 준비
- 버퍼 솔루션의 100 mL를 준비, ddH2O 물, HEPES 0.952 g을 녹이 고 1 M 재고 솔루션에서 MgCl2 의 100 µ L를 추가. PH 7에 조정 적정에 대 한 코를 사용 하 여. 0.22 μ m 필터 또는 오토 클레이 브를 사용 하 여 버퍼를 소독. 산이 없는 HEPES 및 나트륨 소금 안 사용 합니다.
- 플라스 미드 준비 제조 업체의 프로토콜을 따르고 및 재료의 테이블에서에서 요약 하는 키트를 사용 하 여 수행 합니다. 표 1에 요약 하는 플라스 미드를 사용 합니다.
참고: Transfection에 사용 되는 DNA의 품질이 매우 중요 합니다. D. discoideum transfectants 박테리아에의 선택은 선택과 식 카세트를 운전 하는 발기인에 대 한 특정 요구 사항 (내용 참조).
| 플라스 미드 이름 | 박테리아에 저항/선택 | Dictyostelium에 저항/선택 | 태그 |
| extrachromosomal 식 플라스 미드 | |||
| pDM1203 | Ampicilin | G418 | 아니요 |
| pDM1207 | Ampicilin | G418 | N 맨끝 GFP |
| pDM1208 | Ampicilin | G418 | N-터미널 mCherry |
| pPI159 | Ampicilin | G418 | N-터미널 mNeon |
| pPI437 | Ampicilin | G418 | N-터미널 mScarlet |
| pPI54 | Ampicilin | G418 | N-터미널 mTurquoise2 |
| pDM1209 | Ampicilin | G418 | C-터미널 GFP |
| pDM1210 | Ampicilin | G418 | C-터미널 mCherry |
| pPI143 | Ampicilin | G418 | C-터미널 mNeon |
| pPI459 | Ampicilin | G418 | C-터미널 mScarlet |
| pPI142 | Ampicilin | G418 | C-터미널 mTurquoise2 |
| 셔틀 플라스 미드 | |||
| pDM344 | Ampicilin | 아니요 | 아니요 |
| pDM1019 | Ampicilin | 아니요 | N 맨끝 GFP |
| pDM1018 | Ampicilin | 아니요 | N-터미널 mCherry |
| pPI152 | Ampicilin | 아니요 | N-터미널 mNeon |
| pPI418 | Ampicilin | 아니요 | N-터미널 mScarlet |
| pPI150 | Ampicilin | 아니요 | N-터미널 mTurquoise2 |
| pDM1021 | Ampicilin | 아니요 | C-터미널 GFP |
| pDM1020 | Ampicilin | 아니요 | C-터미널 mCherry |
| pPI153 | Ampicilin | 아니요 | C-터미널 mNeon |
| pPI457 | Ampicilin | 아니요 | C-터미널 mScarlet |
| pPI151 | Ampicilin | 아니요 | C-터미널 mTurquoise2 |
| 유도할 수 있는 extrachromosomal 식 플라스 미드 | |||
| pDM1038 | Ampicilin | Hygromycin | 아니요 |
| pDM1047 | Ampicilin | Hygromycin | N 맨끝 GFP |
| pDM1046 | Ampicilin | Hygromycin | N-터미널 mCherry |
| pPI450 | Ampicilin | Hygromycin | N-터미널 mNeon |
| pPI452 | Ampicilin | Hygromycin | N-터미널 mScarlet |
| pPI449 | Ampicilin | Hygromycin | N-터미널 mTurquoise2 |
| pDM1049 | Ampicilin | Hygromycin | C-터미널 GFP |
| pDM1048 | Ampicilin | Hygromycin | C-터미널 mCherry |
| pPI470 | Ampicilin | Hygromycin | C-터미널 mNeon |
| pPI460 | Ampicilin | Hygromycin | C-터미널 mScarlet |
| pPI469 | Ampicilin | Hygromycin | C-터미널 mTurquoise2 |
| act5 안전한 피난처 플라스 미드를 대상으로 | |||
| pDM1501 | Ampicilin | Hygromycin | 아니요 |
| pDM1513 | Ampicilin | Hygromycin | N 맨끝 GFP |
| pDM1514 | Ampicilin | Hygromycin | N-터미널 mCherry |
| pPI231 | Ampicilin | Hygromycin | N-터미널 mNeon |
| pPI419 | Ampicilin | Hygromycin | N-터미널 mScarlet |
| pPI228 | Ampicilin | Hygromycin | N-터미널 mTurquoise2 |
| pDM1515 | Ampicilin | Hygromycin | C-터미널 GFP |
| pDM1516 | Ampicilin | Hygromycin | C-터미널 mCherry |
| pPI230 | Ampicilin | Hygromycin | C-터미널 mNeon |
| pPI458 | Ampicilin | Hygromycin | C-터미널 mScarlet |
| pPI229 | Ampicilin | Hygromycin | C-터미널 mTurquoise2 |
| 레미 식 플라스 미드 | |||
| pDM1220 | Ampicilin | Hygromycin | 아니요 |
| pDM1351 | Ampicilin | Hygromycin | N 맨끝 GFP |
| pDM1259 | Ampicilin | Hygromycin | N-터미널 mCherry |
| pPI465 | Ampicilin | Hygromycin | N-터미널 mNeon |
| pPI468 | Ampicilin | Hygromycin | N-터미널 mScarlet |
| pPI466 | Ampicilin | Hygromycin | N-터미널 mTurquoise2 |
| pDM1352 | Ampicilin | Hygromycin | C-터미널 GFP |
| pDM1305 | Ampicilin | Hygromycin | C-터미널 mCherry |
| pPI471 | Ampicilin | Hygromycin | C-터미널 mNeon |
| pPI467 | Ampicilin | Hygromycin | C-터미널 mScarlet |
| pPI472 | Ampicilin | Hygromycin | C-터미널 mTurquoise2 |
| 플라스 미드 프레임에서 대상 | |||
| pDM1355 | Ampicilin | Hygromycin | C-터미널 GFP |
| pPI461 | Ampicilin | Hygromycin | C-터미널 mCherry |
| pPI462 | Ampicilin | Hygromycin | C-터미널 mNeon |
| pPI464 | Ampicilin | Hygromycin | C-터미널 mScarlet |
| pPI463 | Ampicilin | Hygromycin | C-터미널 mTurquoise2 |
| 노크 아웃 플라스 미드 | |||
| pDM1079 | Ampicilin | Blasticidin | 아니요 |
| pDM1080 | Ampicilin | Nourseothricin | 아니요 |
| pDM1081 | Ampicilin | Hygromycin | 아니요 |
| pDM1082 | Ampicilin | G418 | 아니요 |
| CRE 식 플라스 미드 | |||
| pDM1483 | Ampicilin | Nourseothricin | 아니요 |
| pDM1489 | Ampicilin | Hygromycin | 아니요 |
| pDM1488 | Ampicilin | G418 | 아니요 |
표 1: 비 axenic transfections에 대 한 플라스 미드 목록.
-
Dictyostelium 세포 transfection에 대 한 설정
- K. aerogenes SM 매체 (영양분이 풍부한 매체)에 합류를 성장 실시간 문화에서 하룻밤 4 ° c.에 최대 2 주 동안 저장 될 수 있다
- SM 한 천 격판덮개에이 세균 현 탁 액의 약 400 µ L 추가 (펩 10 g/L, 1 g/L; 추출 효 모 포도 당 10 g/L; KH2포4 1.9 g/L; K2HPO4 x 3 H2O, 1.3 g/L; MgSO4 무수 0.49 g/L; 1.7 %agar) 균등 하 게 확산. 메 마른 루프를가지고 고 Dictyostelium 세포와 예방. 접시의 한 가장자리에 세포 확산.
- Transfection에 대 한 충분히 큰 성장 영역을 보장 하기 위해 2 일 동안 22 ° C에서 접시를 품 어.
참고: (예: Ax3, DH1, 또는 JH10), 큰 성장 영역을 확인 하거나 미숙한 경험에 대 한 사용 하지 않는 Dictyostelium 변종에 대 한 접시를 대신 지우기. 이 위해, 단계 1.5.4 1.5.6의 지침을 따르십시오. - 메 마른 루프를가지고 고 Dictyostelium 세포 (약 2-4 x 105 셀)와 예방. 고밀도 K. aerogenes 의 800 µ L 셀 전송 SM. 혼합 셀 아래로 pipetting으로 현 탁 액.
- 신선한 SM 한 천 배지에서 400 µ L, 200 µ L, 100 µ L, 그리고 50 µ L를 전송. 추가 SM K. aerogenes 서 스 펜 션의 모든 접시 400 µ L을 추가 하 고 균등 하 게, 건조.
- 플레이트 반투명 될 때까지 약 2 일 동안 22 ° C에서 번호판을 품 어.
참고: 그들의 빠른 성장 속도, 인 박테리아는 처음 confluent 잔디를 생산 하 고는 amoebae 이후에 "지우기" 박테리아의 접시. 이 프로세스에 필요한 시간 변형 배경 및 박테리아에 성장 하는 돌연변이 세포의 능력에 따라 달라질 수 있습니다.
2. 세균의 선택에 따라 Dictyostelium 세포의 transfection
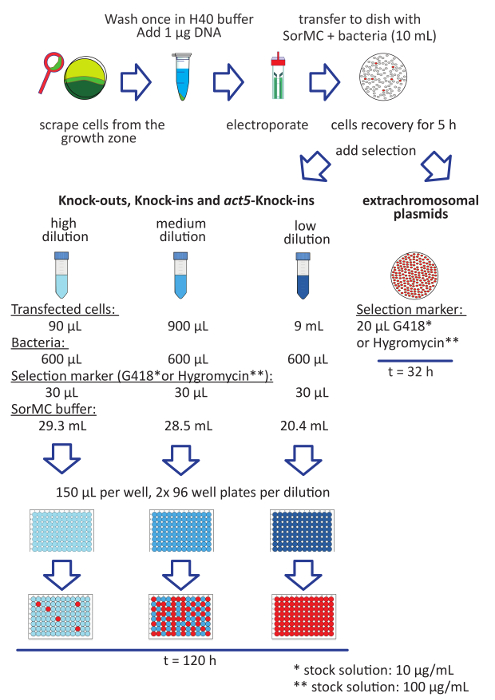
그림 1 : 박테리아 성장 Dictyostelium 세포의 transfection에 대 한 워크플로. Transfection에 대 한 단계는 다음과 같이 나열 됩니다. K. aerogenes 박테리아와 시드 SM 접시에 D. discoideum 세포 성장 (빨간색). 이미 (진한 녹색)을 개발 하 고는 셀 피만 먹이 앞에서 (녹색), 세포를 수확. 워시 H40 셀. 107 셀/mL x 2-4의 최종 밀도에 셀 resuspend 1-2 µ g의 DNA와 세포 현 탁 액을 섞는다. Electroporation 베트와 펄스 셀에 혼합물을 전송 합니다. SorMC와 박테리아 접시 electroporation 후 직접 셀을 전송. 선택 가능한 마커를 추가 하기 전에 5 h에 대 한 복구를 셀 수 있습니다. Extrachromosomal 플라스 미드에 대 한 접시에 직접 선택 항목을 추가 합니다. Transfectants ~ 2 일 후에 일반적으로 볼 수 있습니다. 게놈에 단일 통합을 목표로 하는 구문에 대 한 선형화, 표시 된 대로 3 희석 설정 및 선택 추가. 박테리아는 OD600 에서 찍은 100 재고 솔루션 =. 튜브를 잘 혼합 하 고 바닥이-96-잘 빠진 조직 문화 접시에 셀을 전송. 희석 당 두 접시를 사용 합니다. 모든 우물에 세포 현 탁 액의 150 µ L 플라스틱. 그것은 꽉 식민지 표시 될 때까지 약 5 일 걸립니다. 빨간 우물 성공적으로 변환 된 셀 얻은 (위 패널에서 이전 게시22수정)의 일반적인 금액의 예를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- K. aerogenes 서 스 펜 션 플레이트를 준비 하려면 OD600 의 밀도를 K. aerogenes 박테리아를 포함 하는 SorMC 버퍼의 10 mL를 추가 = 2 (추가 준비 OD600 의 200 µ L = 100 K. aerogenes 재고 솔루션을 원하는 박테리아 농도) 10 cm로 조직 문화 배양 접시 처리.
참고: 이 접시는 transfected 육성 필요가 나중 D. discoideum 셀. 또는, 6 잘 조직 문화 접시를 사용할 수 있습니다. Extrachromosomal 플라스 미드의 transfection, 경우 6 잘 조직 문화 접시 리소스를 더 효율적입니다. K. aerogenes SorMC의 2 개 mL를 사용 하 여 (OD600 = 2) 잘 당 정지. -
Dictyostelium 셀의 준비
- 10 µ L 일회용 접종 루프를 사용 하 여, 문화 접시 (선택 영역의 가장자리) 또는 접시를 비운의 성장 영역 (약 3 cm)에서 세포를 다쳤어요. 얼음 처럼 차가운 H40 버퍼의 1 mL를 포함 하는 1.5 mL 튜브에 세포를 전송 합니다.
참고: 삭제 판에서 셀의 타이밍은 결정적 이다. 늦은 증가에 수확 하는 동안 너무 초기 수율의 셀의 너무 작은 금액 수확 부분적으로 저조한의 위험 셀을 개발 했다. - 1000 x g 또는 플래시-2 회전에서 2 분 동안 아래로 회전 하 여 세포를 씻어 10000 x g에서 s. 삭제는 상쾌한 고 셀 107 셀/mL x 2-4의 최종 밀도 H40 버퍼에 resuspend. 셀 전체 transfection 절차 동안 차가운 유지. 얼음 물 슬러리를 사용 하 여 튜브와 얼음의 직접 접촉을 보장 하기 위해.
- 10 µ L 일회용 접종 루프를 사용 하 여, 문화 접시 (선택 영역의 가장자리) 또는 접시를 비운의 성장 영역 (약 3 cm)에서 세포를 다쳤어요. 얼음 처럼 차가운 H40 버퍼의 1 mL를 포함 하는 1.5 mL 튜브에 세포를 전송 합니다.
-
Electroporation
- 1-2 µ g의 DNA 튜브에 세포의 100 µ L를 추가 합니다. 아래로 pipetting으로 신중 하 게 믹스.
- 미리 냉장된 electroporation 베트 (2 mm 간격)으로 셀/DNA 혼합물을 전송 합니다.
- 다음 구형 파 설정을 사용 하 여 셀을 펄스: 350 V, 8 리, 2 펄스와 1 s 펄스 간격.
참고: 2 개 이상의 µ g의 DNA 추가 하지 마십시오. 더 높은 금액 세포에 독성 고 transfection 효율을 감소. 총 추가 DNA 볼륨 5 µ L를 초과 하지 않아야 합니다. - 이전 준비 10 cm K. aerogenes SorMC와 페 트리 접시에 세포를 즉시 전송 하 고 5 h에 대 한 복구 세포 허용.
참고: 거꾸로 현미경 페 트리 접시에 셀을 확인 합니다. 셀 라운드 electroporation 후 직접 나타나지만 그들은 표면에 제대로 연결 하려면 충분 한 시간이 없 었 때 약 30 분 후 그들의 amoeboid 모양에 반환 됩니다.
-
Transfectants의 선택: 여부 transfection 목적으로 또는 생성 하는 노크, 노크에서 act5 노크-에서 또는 extrachromosomal 플라스 미드에서 형광 기자 단백질을 표현 하기 위해, 따라 중 하나를 통해 선택 프로세스 수행 다음 방법을 설명합니다.
참고: Axenically 성장된 세포와 달리 bacterially 성장된 세포는 blasticidin에 저항력. 선택, 그러므로, 항상 수행 됩니다 G418 또는 hygromycin를 사용 하 여 (내용 참조).- 노크 아웃, 노크 기능 및 act5 노크 기능
- 반복적으로 표면에 피 펫에서 액체를 강제 페 트리 접시에서 신중 하 게 셀을 분리 합니다.
- 3 희석 SorMC K. aerogenes 정지에서 설정 (OD600 = 2)는 저항 사용된 (그림 1참조)에 따라 선택적 에이전트를 추가 하 고.
- 낮은 희석: 20.4 mL SorMC의 K. aerogenes 재고 솔루션의 600 µ L로 세포 현 탁 액의 9 mL를 혼합.
- 중간 희석: 28.5 mL SorMC의 K. aerogenes 재고 솔루션의 600 µ L로 세포 현 탁 액의 900 µ L를 혼합.
- 높은 희석: 29.3 mL SorMC의 K. aerogenes 재고 솔루션의 600 µ L로 세포 현 탁 액의 90 µ L를 혼합.
- 선택 가능한 마커 (재고 솔루션 x 100)의 30 µ L를 추가 합니다.
- 각 우물에 세포 현 탁 액의 pipetting 150 µ L에 의해 바닥이-96-잘 빠진 조직 문화 접시에 준비 된 희석을 배포 합니다.
참고: 이 절차는 화면 단일 클론 보다는 인구를 목표로합니다. 선택 구문 사용에 따라 5-7 일 정도 걸립니다.
- Extrachromosomal 플라스 미드
- 10 mL 접시에 직접 선택 가능한 마커를 추가 ( 그림 1참조).
참고: 클론 인구에 대 한 욕망이 희석, 설정할 필요가 있다. Extrachromosomal 플라스 미드의 선정 과정은 빠르게 높은 복사 번호 D. discoideum 세포에 존재 때문 이다. Transfectants 32 h 2 일 후 예상 될 수 있다.
주의: 선택 가능한 표식으로 사용 하는 항생제는 독성이 있다. 장갑을 착용 한다.
- 10 mL 접시에 직접 선택 가능한 마커를 추가 ( 그림 1참조).
- 노크 아웃, 노크 기능 및 act5 노크 기능
-
긍정적인 tranfectants에 대 한 획득된 클론 화면. 노크 아웃 또는 노크에 시도 대 한 단계 2.5.1에서에서 지침을 따릅니다. Transfection 성공을 단계 2.5.2에서에서 지침을 사용 하 여 extrachromosomal 플라스 미드에 대 한 확인 하십시오.
- 노크 아웃, 노크 기능 및 act5 노크 기능, PCR 확인 정확한 genomic 소재 시에는 구조물의 통합을 통해 초기 화면을 수행 합니다.
참고: 클론 인구의 가능성을 최대화 하려면 가장 높은 희석 가능한 선택 후 transfectants를 생성 하는 사용 합니다. 웰 스 점령의 최대 1/3는 번호판에 대 한 목표.- 클론 인구 확장을 genomic DNA의 분리에 대 한 충분 한 세포를 성장 하는 12 음 조직 문화 접시에 96-잘 조직 배양 접시에서 선택 후 자란 클론을 전송 합니다. SorMC K. aerogenes 의 1 mL와 함께 각 잘 공급 (OD600 = 2)와 신선한 선택 가능한 마커.
참고: 1 일은 DNA 분리에 잘 적합 합칠을 일반적으로 충분 합니다. - 미니 genomic DNA 분리를 수행 하려면 confluent 잘의 세포 수확 하 고 제조업체의 지침에 따라 미니 DNA 추출 키트를 사용 하 여 게놈 DNA를 분리 합니다.
- 적당 한 뇌관 함께 고립 된 genomic DNA와 Taq를 사용 하 여-중 합 효소 ( 재료의 표참조) 긍정적인 integrands에 대 한 PCR 화면.
참고: 정확한 genomic 소재 시에 긍정적인 통합의 확인, 후 남쪽 오 점 분석을 수행 되어야 합니다. 그러면 큰 자신감 난다 게놈 지역에 추가 삽입 이벤트 발생 하지 않은.
- 클론 인구 확장을 genomic DNA의 분리에 대 한 충분 한 세포를 성장 하는 12 음 조직 문화 접시에 96-잘 조직 배양 접시에서 선택 후 자란 클론을 전송 합니다. SorMC K. aerogenes 의 1 mL와 함께 각 잘 공급 (OD600 = 2)와 신선한 선택 가능한 마커.
- 형광 기자 단백질에 대 한 시각적으로 긍정적인 형광 셀을 식별 하 고 형광 현미경으로 확인 합니다. 또는 생 화 확 적인 식별에 대 한 적합 한 항 체와 서쪽 오 점을 수행 합니다.
- 노크 아웃, 노크 기능 및 act5 노크 기능, PCR 확인 정확한 genomic 소재 시에는 구조물의 통합을 통해 초기 화면을 수행 합니다.
| PCR 프로그램 | ||
| 단계 | 온도 | 시간 |
| 초기 변성 | 94 ° C | 30 s |
| 30 사이클 | 94 ° C | 15-30 s |
| 42 ° C | 15-60 s | |
| 68 ° C | 1 분/kb | |
| 마지막 확장 | 68 ° C | 5 분 |
| 보류 | 4-10 ° C | |
| 반응의 구성 | ||
| 구성 요소 | 25 μ 반응 | 최종 농도 |
| 10 µ M 앞으로 뇌관 | 0.5 Μ L | 0.2 Μ M |
| 10 µ M 역 뇌관 | 0.5 Μ L | 0.2 Μ M |
| 템플릿 DNA | 변수 (ca. 5 µ L) | < 1000 ng |
| 중 합 효소를 포함 하 여 표준 버퍼 마스터 믹스 x 2 (자료의 표 참조) | 12.5 Μ L | 1 x |
| Nuclease 무료 물 | 25 µ L를 | < 1000 ng |
표 2:의 증폭에 대 한 PCR 프로그램 및 샘플 구성 D. discoideum genomic DNA.
결과
Extrachromosomal 플라스 미드 기자 연구, 셀 또는 돌연변이 세포의 세포질 구조에 변경 내 특정 단백질의 지 방화를 식별 하는 데 사용 됩니다. 세포 주기의 모니터링 등 많은 방법을 동시에 두 기자를 표현 하기 위해 중요 하다. 이것은 지금 우리의 듀얼 기자 extrachromosomal 플라스 미드 시스템 (표 1)를 사용 하 여입니다. 하루에 1, 5 h (그림 1) 후 선택 가능한 마커 G418를 추가 하기 전에 셀 페 했다. 예, NC4, DdB, Ax2, 및 독립적으로 파생된 야생 격리 V12M2 및 WS2162 (보충 표 1) microtubules 및 mCherry-PCNA, 즉 단백질 마커 GFP TubulinA에 인코딩하는 플라스 미드 pPI289와 페 했다 세포 주기 (그림 2A) 모니터링을 위해 사용. 32 h 후 세포는 현미경 관찰 되었다. 대부분의 세포 표현 모두 형광 표시 된 융해 단백질 일관 이전으로 보고 그 표현의 동일한 플라스 미드 쇼 유사한 식 수준에서 두 기자 두 개의 다른 플라스 미드 를 사용 하는 경우는 거의 불가능 하다 18,19. 대표 셀 각 셀 라인 (NC4, DdB, Ax2, V12M2, 및 WS2162) 원하는 듀얼 기자 표현 그림 2B에 표시 됩니다. Transfection 효율 그림2 C에 요약 되어 있습니다. NC4 파생 셀 라인 최고의 transfection 효율을 보여줍니다. 그러나, 셀 라인 V12M2 및 WS2162, transfectants의 상당히 높은 수 얻은 했다.
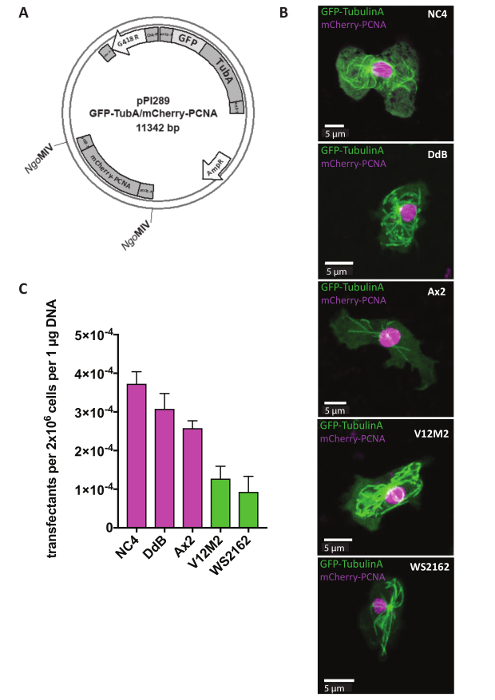
그림 2 : Extrachromosomal 플라스 미드의 식. (A) Extrachromosomal 플라스 미드 원형 형태로 직접 페는. 예를 들어, 듀얼 기자 pPI289 표시 됩니다. NgoMIV 사이트의 두 번째 기자 extrachromosomal 식 플라스 미드에 삽입을 나타냅니다. (B) Z-프로젝션 GFP-TubulinA (세포질)와 mCherry-PCNA (주로 핵) 5 개의 서로 다른 야생-타입 셀 라인 사용 (NC4, DdB, Ax2, V12M2, WS2162)에 대 한 대표적인 셀의. (B)에서 그림 5 셀 라인 (C)는 transfection 효율 계산 했다. 표시 된 두 실험의 의미가 이다. 오차 막대 표시 ± sd. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
지정 된 genomic 소재 시에 대상 벡터의 통합 더 도전 이며 생성 된 셀 라인의 더 주의 깊은 분석이 필요 합니다. 그림 3에서는 act5mCherry NC4에 기를 시도 합니다. 첫째, 플라스 미드 transfection 다음 재결합 사건의 빈도를 늘릴 오는지 해야 합니다. 이 위해, 플라스 미드 pDM1514 NgoMIV를 잘라입니다. 2 개의 악대는 agarose 젤에 다이제스트를 실행 한 후 얻을 수 있습니다. 4127 bp 밴드는 원하는 구문을 (그림 3)에 포함 되어 있습니다. Transfection, 소화 DNA 및 제조업체의 지침에 따라 젤 추출 키트를 사용 하 여 정화 젤에서 추출 해야 합니다.
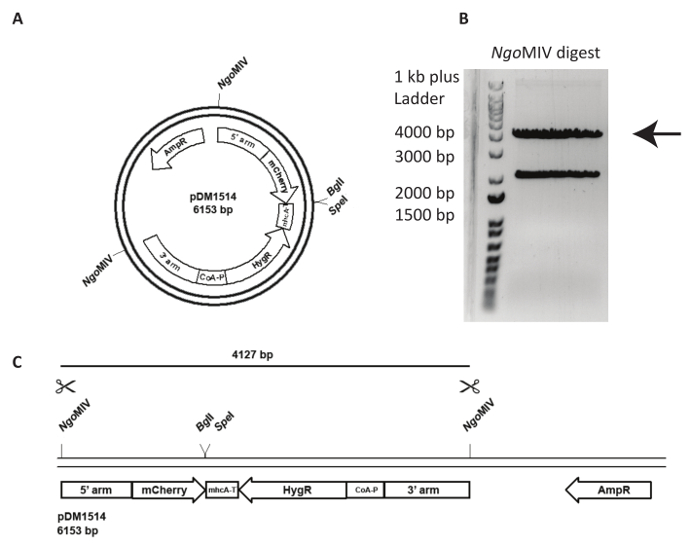
그림 3 : Transfection act5 노크 및 DNA의 준비. 5 행동노크에는의 사용의 예를 들어 플라스 미드 pDM1514 표시 됩니다. 준비 하는 단계는 다음과 같이 나열 됩니다. (A) 지정 된 NgoMIV 사이트를 사용 하 여 플라스 미드를 선형화 electroporation, 전에. (B, C) 두 예상된 밴드는 제대로 분리 될 때까지 agarose 젤에 컷된 플라스 미드를 실행 합니다. 재결합 팔, mCherry, 그리고 저항-카세트, 4127 bp 밴드를 잘라 하 고 DNA를 추출 하는 젤. DNA는 이제 transfection에 대 한 준비가 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
순화 된 DNA NC4 세포의 transfection 사용 되었다. 5-6 일 후 선택, 클론 획득 했다. 여러 act5 노크 시도 대 한 긍정적인 확인 된 클론의 양과 대표 transfection 효율 표 3에 요약 되어 있습니다. NC4 transfection의 두 클론 선택 무작위로 되었고 PCR(그림 4)에 의해 분석 그리고 둘 다 보여주었다 예측된 밴드 패턴 노크에서의 예상 및 단일 통합 되도록 남쪽 오 점 분석 검증 추가 했다 게놈20로 구성의 이벤트. 오 점 원하는 act5 로커 스 (그림 4B)에 명확한 단일 통합을 보여 줍니다. 생성 된 NC4::act5 mCherry 셀 라인 이제 실험에 사용할 수 있습니다.
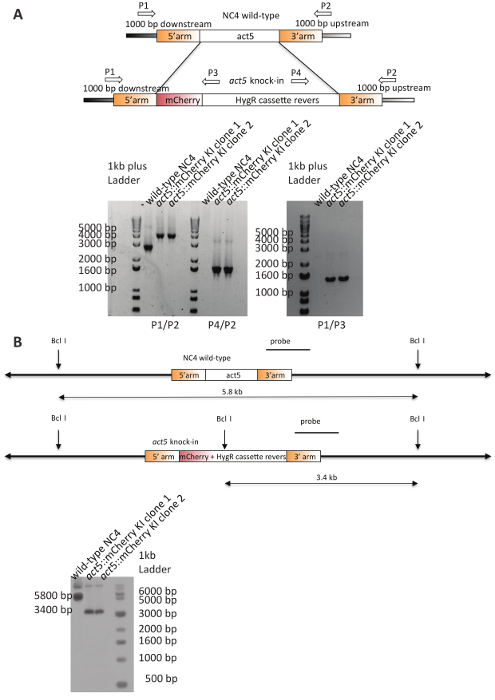
그림 4 : Act5-mCherry NC4에 KIs의 유효성 검사. (A) 및 제어 PCRs act5 로커 스에 긍정적인 통합의 유효성 검사에 대 한. 표시 된 뇌관은 두 개의 독립적인 클론 부모를 분석 하 사용 되었다. 두 클론 부모의 스트레인에 존재 하지 않는 저항-카세트 및 다운스트림 (P1) 또는 업스트림 뇌관 (P2)에 대 한 예상된 밴드를 표시 합니다. 뇌관 조합 (P1/P2) act5 로커 스에 mCherry 및 저항 카세트의 올바른 통합을 확인합니다. 야생-타입 NC4 두 기 클론이이 밴드를 부족 하 고 대신 큰 1400 기본적인 쌍에 대 한 PCR 제품을 표시 하는 동안 예상된 2800 bp 밴드를 보여줍니다. 사용된 제한 다이제스트 및 남쪽 오 점 (B) 체계. 5 행동로커 스 구성의 통합의 결과, 특히 추가 Bclhygromycin 저항 카세트에 사이트 모두 노크 클론 보여 작은 3400 bp 밴드. 야생-타입 컨트롤 쇼 두 다운스트림 위치 Bcl에서 발생 예상된 5.8 kb 사이트. 오 점 자른 고 선명도 대 한 접합. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| act5 로커 스에 대상된 구성 | 플라스 미드 이름 | 점령된 우물의 수 | 선택 된 클론의 수 | 긍정적인 복제품 | 올바른 클론 (%) | Dictyostelium 변형 사용 | transfection 효율 (transfectants / 2 x 10 ^6/1 µ g의 DNA) |
| LifeAct-mCherry | pPI226 | 7 | 7 | 1 | 14.2 | AX2 | 3.5 x 10 ^-6 |
| LifeAct-GFP | pPI227 | 12 | 12 | 5 | 41.6 | AX2 | 6 x 10 ^-6 |
| GFP | pDM1513 | 3 | 3 | 2 | 66.6 | AX2 | 1.5 x 10 ^-6 |
| mCherry | pDM1514 | 3 | 3 | 1 | 33.3 | AX2 | 1.5 x 10 ^-6 |
| GFP | pDM1513 | 66 | 9 | 5 | 55.5 | AX2 | 3.3 x 10 ^-5 |
| mCherry | pDM1514 | 221 | 12 | 10 | 83.3 | AX2 | 1.1 x 10 ^-4 |
| H2B-mCherry | pPI420 | 3 | 3 | 1 | 33.3 | AX2 | 1.5 x 10 ^-6 |
| H2B-mCherry | pPI420 | 7 | 7 | 6 | 85.7 | AX2 | 3.5 x 10 ^-6 |
| mCherry | pDM1514 | 10 | 10 | 7 | 70 | DdB | 5 x 10 ^-6 |
| mCherry | pDM1514 | 240 | 12 | 11 | 91.6 | DdB | 1.2 x 10 ^-4 |
| mCherry | pDM1514 | 320 | 12 | 12 | 100 | NC4 | 1.6 x 10 ^-4 |
표 3:의 양과 Transfection 효율의 세대에 대 한 긍정적인 transfectants을 얻은 act5 다른 변형 배경에서 KIs 22 .
5 행동로커 스 통합된 기자21의 상대적으로 균질 성 표현을 제공합니다. 생성 된 NC4::act5 mCherry 셀 혼합 실험을 다른 act5 노크 기능 GFP 등 다른 형광 단백질을 사용 하 여 수행할 수 있습니다. 이 시스템의 가장 큰 장점은 강조 Ax2::act5 GFP 와 혼합 실험 표시 됩니다. 비 axenic 야생-타입 셀 transfect에 무 능력 때문에이 종류의 접근 전에 수행 되지 수 없습니다. 그들은 다른 세포 라인 동일 실험 조건 발생 사이 직접적인 비교를 허용 하기 때문에 혼합 실험 셀 동작 분석을 중요 한 도구입니다. NC4 셀 Ax2 셀 (그림 5A) 보다 세균 잔디에 빨리 성장 한다. 이 phagocytose 박테리아 또는 이동 하 고 식량을 향해 chemotaxis를 표시 향상 된 능력을 더 높은 용량이 원인일 수 있습니다. -한 천 엽 산 chemotaxis 분석 결과 사용 하 여, NC4::act5-mCherry 및 Ax2::act5 GFP 의 인구의 직접 비교 수행 되었다, NC4::act5-mCherry 는 훨씬 더 효율적인 folate 감지에 보여주는. 4 h 후 NC4::act5 mCherry 셀 agarose Ax2::act5 GFP 셀 (그림 5B) 보다 아래에 크롤 링을 수 있었다. Chemotaxis는 agarose에서 마이그레이션 셀의 표준 통계 분석 밝혔다 NC4::act5 mCherry 셀 빨리 했다 Ax2::act5 GFP 셀 (그림 5C-E 보다 강한 혈 응답을 보여주었다 ).
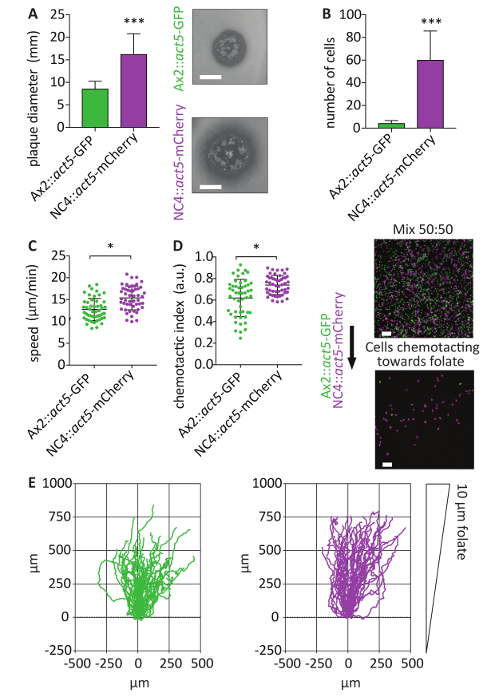
그림 5 : 5 행동KIs를 사용 하 여 이미지 기반 chemotaxis 믹스 실험. (A) NC4::act5 mCherry 그리고 Ax2::act5 GFP 표현 행동5 로커 스에서 표시 된 형광 단백질 세균성 잔디에 성장 하는 능력에 대 한 분석 했다. 4 일 후 독방 도금된 Dictyostelium 세포에서 발현 패 직경 측정 되었다. 비 axenic act5:: NC4 셀 만들기 axenic Ax2::act5 GFP 세포 보다 훨씬 더 큰 플 라크 (± SD, 의미 * * * p < 0.0001, n = 3, 5 mm 바 확장). (B) 아래 agarose folate chemotaxis의 사용22 NC4::act5-mCherry Ax2::act5-GFP (a) 사용의 혈 능력을 직접 비교 분석 결과, 위해 박테리아 amoebae 두 종자의 성장 했다 혼합 50: 50 비율. 세포는 agarose 아래에 크롤 링을 허용 되었다. 4 h, 후 엽 산 그라디언트를 마이그레이션 했다 셀 confocal 현미경을 사용 하 여 몇 군데 있었다. NC4::act5-mCherry 및 Ax2::act5 GFP 셀 수 다음 결정 했다. NC4::act5-mCherry 셀 folate를 감지에 더 효율적 이었다. 10 더 많은 NC4::act5 mCherry 에 대 한 셀 Ax2::act5 GFP 셀에 비해 발견 했다 (± SD, 의미 * * * p < 0.0001, n = 6, 눈금 막대 100 µ m). (C, D) 세포는 60 분 동안 촬영 되었다 하 고 그들의 속도 혈 인덱스 계산 했다. (만 그는 agarose에서 마이그레이션) 가장 chemotactically 반응 셀의 사전 선택, 후 Ax2::act5 GFP 세포 셀 속도 chemotaxis에 대 한 낮은 값을 보였다. 셀 라인 당 50 셀 분석 되었다. (평균 ± SD, * p < 0.01, n = 3). (E) NC4::act5 mCherry Ax2::act5 GFPact5 노크 ins의 트랙 60 분 이상, NC4::act5-mCherry 세포의 chemoattractent 소스 쪽으로 더 감독된 움직임을 보여주는 플롯 (평균 ± SD, * * * p < 0.0001, n = 6). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Act5 노크 셀 라인 cytometry에 사용할 수 있습니다. 성장 박테리아에, 것과 같이 axenic 긴장과 비 axenic 야생-종류 사이 개발에 주요 다름이 있다. 개발 후 NC4 셀의 fruiting 몸은 대략 두번 그 만큼 큰 Ax2 셀에서 파생 된. 셀 혼합 되 면, 중간 크기의 fruiting 몸은 얻은 것입니다. 두 셀 라인의 기여를 더 양적 분석, cytometry 사용 되었다. 이러한 분석 두 셀 라인에서 공헌의 다른 수준 때문에 중간 크기의 fruiting 시체는 명확 하 게 보여주었다. NC4::act5 mCherry 셀 측정된 포자의 약 75%를 하는 동안, Ax2::act5 GFP 공개 비 axenic 긴장 (그림 6)에 대 한 잠재적인 피트 니스 이용만 25%에 기여. 분석은 줄기 세포 인구를 모니터링 하지 않습니다, 때문에 개발 Ax2 NC4 사이 불균형을 설명 하기 위해 두 가지 가능성이 있다. 1 개의 가능성은 Ax2 셀 스 포어 세포 인구를 입력 하는 것 보다는 줄기 세포 인구에 주로 기여. 또는, 더 NC4 셀 Ax2 상대적으로 지연 된 개발 주기를 입력할 수 있습니다 그리고 그들은 따라서 fruiting 바디의 조립에 기여할 수 있습니다. 비 axenic 야생-타입 셀 transfect 가능성 더 다른 접근을 개발 하 고 실험 절차 간소화.
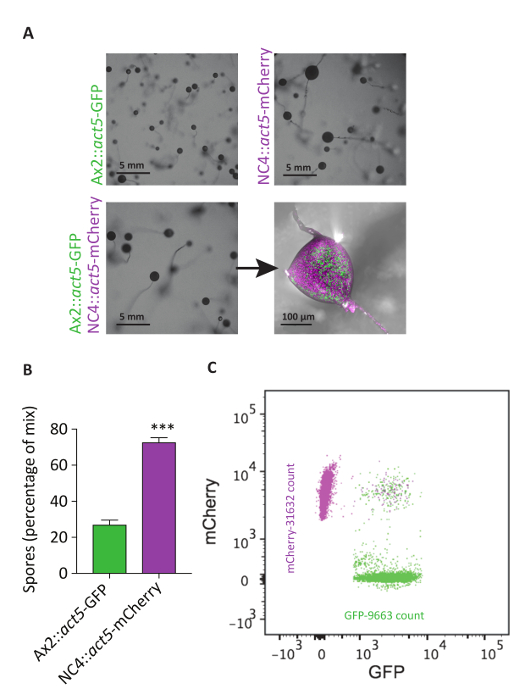
그림 6: 법5 KIs cytometry 사용 하 여 혼합 실험의 분석 수. (A) NC4::act5 mCherry 및 Ax2::act5 GFP 별도로 또는 비 양분 한 천 배지에서 50: 50 혼합물에서 개발 되었다. NC4::act5-mCherry 셀 Ax2::act5 GFP보다 큰 fruiting 시체를 형성합니다. 믹스 대신 표시는 중간 크기 (5mm 바 스케일). 공초점 형광 가벼운 현미경 검사 법 혼합에서 파생 된 포자 머리에 NC4::act5-mCherry 포자의 더 높은 금액을 제안 합니다. (B)이이 관찰, (a) 혼합 실험에서 cytometry에 의해 분석 되었다 수확 포자에서 포자의 양을 계량. 포자의 약 75% Ax2::act5 GFP 셀에서 25%만 NC4::act5 mCherry 세포에서 유래. 대표적인 유통 흐름 cytometry 분산형에 표시 된 두 셀 라인에서 포자의 (C). 약 0.05% 보여 긍정적인 mCherry 및 GFP 신호, 제안 parasexual 퓨전 프로세스 발생 했 나 포자 서로 숨어 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 셀 라인 | 유전자 배경 | 참조 번호 | 전에 게시 | 유형 |
| AX2 (카) | DBS0235521 | 블 룸 필드 외., 2008 | 야생 타입 | |
| NC4 (S) | 블 룸 필드 외., 2008 | 야생 타입 | ||
| act5::mCherry 복제 5 | NC4 | HM1912 | Paschke 그 외 여러분, 2018 | act5 노크에 |
| act5::GFP 복제 2 | AX2 | HM1930 | Paschke 그 외 여러분, 2018 | act5 노크에 |
| V12M2 | 블 룸 필드 외., 2008 | 야생 타입 | ||
| WS2162 | 블 룸 필드 외., 2008 | 야생 타입 |
보충 표 1:의 다른 긴장 Dictyostelium 공부.
토론
비 axenic, 야생-타입 Dictyostelium 세포를 사용 하 여 분자 연구에 지금까지 매우 제한 되었습니다. 이러한 긴장의 유전 공학에 대 한 사용할 수 있는 방법을 신뢰성과 효율23, 그들의 일반적인 채용 방지 부족 있다. 액체 매체에서 성장 능력의 독립적인 어떤 디 discoideum 긴장에 대 한 생성 된 자료와 여기에 제시 된 프로토콜을 사용할 수 있습니다. 그것은이 프로토콜 NC4 파생 셀 라인에 대 한 최적화는 언급 되어야 합니다. 우리가 전에 관찰 하 고 V12M2 및 WS21628,9여기에 표시 됩니다 야생에서 갓 고립 된 긴장에 대 한 transfection 효율 NC4에서 다. Electroporation 조건 특히 transfection 효율성에 상당한 영향을 미칠 것이 고 약간 긴장에 대 한 최적화 더 필요할 수 있습니다. 일반적으로, transfectants의 충분 한 양은 보여주는이 메서드는 실행할 수 있는 지금까지 테스트 모든 긴장에서 관찰 되었습니다. 긍정적인 transfectants NC4 파생 된 종자를 사용 하 여 얻을 수 다른 비 axenic 야생-타입 긴장 하지만 모든 경우에 비해 높은, transfectants의 충분 한 숫자 추가 실험에 대 한 있도록 얻습니다. 플러스, 우리의 프로토콜의 단순은 이전 시도8,9에 비해 주요 개선 이다.
이러한 새로운 비-axenic 프로토콜 모든 표준 유전 절차를 커버 하 고 transfections 수 있습니다 신속 하 고 효율적으로 동시에 수행할 수 있기 때문에 더 이점은 추가 합니다. 긍정적인 복제품은 성장 박테리아 반쪽에 사단 시간 이후 주, 보다는 오히려 일에 얻어질 수 있다. 새로 설립된 된 플라스 미드는 또한 axenic 조건 하에서 작동 하 고 수 있습니다 일상적으로 사용 모두 성장 조건 하에서이 methology22의 또 다른 발전은. 프로토콜에 도입, 플라스 미드 박테리아에 선택에 사용 되는 transfection의 성공에 대 한 중요 한 특별 한 요구 사항이 있다. 특히, 식 및 저항 카세트를 운전 하는 발기인은 성공적인 transfection 중요 합니다. 구동 저항 또는 식 카세트 자주 사용된 act6 (걸 6) 발기인24 세포는 박테리아에 성장 될 때 효율성을 결여 된다. 플라스 미드 시스템에서 높은 활성 act15 (말라 15) 발기인 드라이브 모든 식 카세트, 저항 카세트 coA (coactosin A) 발기인, 모두는 axenic 조건 및 활성의 통제는 성장 박테리아에 셀입니다. 노크에 뿐만 아니라 리포터의 표현에 대 한 요구 사항을 생성 하 고 노크 아웃 구문 그것 우리의 플라스 미드 레 퍼 토리를 사용 해야 하지만 불행히도 이미 만든 비효율적인 act6 발기인을 사용 하는 벡터의 사용을 제한.
모터 효율성은 정확한 genomic 소재 시에 단일 통합 이벤트에 의존 하는 transfections에 대 한 특히 중요 합니다. 저항 유전자 발현을 운전 하는 발기인의 우리의 개선으로 인해 충분 한 저항 단백질 단일 로커 스 통합에서 생산 됩니다. 주요 관심사 때 hygromycin 또는 G418 설명 된 대로 사용 하 여 게놈에 여러 통합의 선호 했다. 여러 통합의 애 용 관찰 되었습니다 지금까지 이전 G418 선택 이전 발기인 시스템25를 사용 하 여에 대 한 보고. 즉 모두 hygromycin G418 있으며 적당 한 선택 가능한 마커 깨끗 한 노크-아웃 및 노크 기능 생성에 대 한 불행히도, 선택 가능한 마커 blasticidin axenic 비 조건에서 작동 하지 않습니다. 이것은 우리의 방법의 주요 불리 blasticidin 저항 카세트는 정기적으로 디 discoideum에 노크 아웃 구문을 생성 하는 데 사용 됩니다. Blasticidin 저항 카세트와 이미 생성 된 구문을 실행할 수 있는 선택 가능한 마커 중 하나를 사용 하 여 rederived 될 필요 합니다. 이 제한을 극복 하기 위해 또 다른 가능성은 최근에 설립 된 axenic D. discoideum CRISPR 결합이 transfection 프로토콜26기술. 적당 한, 단일 가이드 RNAs (sgRNAs)의 생성은 간단 하 고 완전 한 노크 아웃 구문의 재건 보다 빠르게. 미래 방향, 가능성에 대 한 다중 노크 아웃 생성의 CRISPR/Cas9 결합이 transfection 프로토콜을 사용 하 여 매력적 이며 Dictyostelium 지역 사회에서 많은 연구원을 위한 길을 닦은 수 있습니다. 그러나, CRISPR/Cas9 axenic 재배 셀에 사용 되는 설립된 과도 식 시스템의 가공은 신중 하 게 시험 되어야 한다.
시스템에서 노크 act5 제시 유사 사이트에 다른 유기 체22설립의 D. discoideum 에서 안정적인 셀 라인의 세대에 대 한 안정적이 고 안전한 통합 시스템을 제공 합니다. 그것은 또한 그리고 게놈에 있는 단일 통합 이벤트에 따라 다른 연구 방향에 대 한 많은 가능성을 제공 합니다. Act5 발기인 강력 하 게 활성화 하 고 거의 균일 식27 재배 조건의 독립 보장. 형광 기자 단백질 설계 대상 플라스 미드를 사용 하 여이 안전한 피난처 로커 스에 쉽게 통합 될 수 있습니다. 이 유용할 수 있습니다, 예를 들어 셀 추적 목적을 위해 혼합 실험에서 그림과 같이. 셀 표시 최소 셀 식 가변성, 추적 하는 자동화 된 셀에는 도움을 줄 수 있습니다. 중요 한 것은, 5 행동궤적으로 원하는 시퀀스의 삽입 phenotypically 중립28,29나타납니다. 로 식 임의의 integrants 또는 extrachromosomal 벡터 베어링 셀 라인에서 보듯이 단백질 식이 유지 하기 위해 선택 가능한 표식에 의존 하지 않는, act5 시스템 구조 실험을 위해 유용할 수 있습니다. 셀 라인 균질 성 때문에, 모든 세포를 분석할 수 있습니다. 이것에 상당한이 질 식에서 식에 대 한 extrachromosomal 플라스 미드를 사용 하 여 불가능 합니다.
모든 변종에 대 한 이러한 일반적인 개선 뿐만 아니라 분자 연구에 대 한 비 axenic 야생-타입 셀을 사용할 수는 현재 실험실 긴장에 축적 된 돌연변이의 효과의 평가 수 있습니다. 이전에 게시 microarray 분석26여 같이 여러 유전자 재배열 1970 년에, Ax2 스트레인의 채택 이후 발견 되었습니다. 합성 고기 이러한 변이의 존재 때문에 관찰 된다. 예를 들어 보고 phg2 돌연변이 한 실험실 긴장 배경 및 다른3에 증가 접착 줄된 접착을 보여줍니다. 이러한 충돌 데이터 (이 경우, DdB)에서 일반적인 조상 스트레인에 실험을 반복 하 여 이제 해결할 수 있습니다. 이 접근 방법의 강도 최근 작은 GTPase RasS30,31표시 되었습니다.
어떤 디 discoideum 긴장에서 유전자 실험을 수행 하는 능력 특히 그 사회 진화, 킨 인식과 성적 사이클22사건 야생 격리의 사용에 의존 하는 새로운 연구 방향의 잠재력을 확장 합니다.
공개
저자는 공개 관심의 없습니다 충돌 있다.
감사의 말
저자가이 방법에 대 한 입력에 대 한 케이 연구소와는 LMB 현미경 흐름 cytometry 시설과 우수한 과학 및 기술 지원에 대 한 감사합니다. 이 작품은 의료 연구 위원회 그랜트 MC_U105115237 R. R. 케이, BBSRC (생명 공학 및 생물 과학 연구 협의회)를 부여 BB/K009699/1 R. R. 케이 의해 투자 되었다, 암 연구 영국 R. H. Insall, Wellcome 신뢰 수석 친목을 A15672 부여 202867/Z/16/Z 조나단 R 첩, 및 MRC UCL에서 MRC LMCB 대학 단위 (MC_U12266B)을 자금.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Eppendorf Microcentrifuges 5424/5424R | ThermoScientific | 05-400-002 | |
| Eppendorf 5702R Centrifuges with A-4-38 Model Rotor | ThermoScientific | 12823252 | |
| Eppendorf Mastercycler Nexus Thermal Cyclers | Sigma Aldrich | EP6331000025 | |
| Gene Pulser X Cell, including CE & PC modules | BioRad | 1652660 | |
| Safety Cabinet Foruna - SCANLAF | Labogene | ||
| BioPhotometer Plus | Eppendorf | ||
| CLSM 710 | Zeiss | ||
| Media & Agaroses | |||
| LoFlo Medium | Formedium | LF0501 | |
| Seakem GTG Agarose | Lonza | 50071 | |
| Low EEO Agarose | BioGene | 300-200 | |
| Purified Agar | Oxoid | LP0028 | |
| SM broth | Formedium | SMB0102 | |
| 2x LB broth | Formedium | LBD0102 | |
| Chemicals | |||
| SYBR Safe DNA Gel Stain | ThermoScientific | S33102 | |
| 1 Kb Plus DNA Ladder | ThermoScientific | 10787018 | |
| 1 Kb DNA Ladder | NEB | N3232L | |
| HEPES free acid | Sigma Aldrich/Merck | 391340 EMD | |
| KH2PO4 | VWR | P/4800/53 | |
| Na2HPO4 * 2 H2O | VWR | 10028-24-7 | |
| MgCl2 * 6 H2O | Sigma Aldrich/Merck | 5982 EMD | |
| CaCl2 * 2 H2O | Sigma Aldrich | 442909 | |
| Folic Acid | Sigma Aldrich | F7876 | |
| KOH | VWR | 26668.263 | |
| Cultur Dishes | |||
| 96 Well Cell Culture Cluster, Flat Bottom with Low Evaporation Lid, Tissue Culture Treated | Corning Incorporated | 3595 | |
| 6 Well Cell Culture Cluster, Flat Bottom with Lid, Tissue Culture Treated | Corning Incorporated | 3516 | |
| 100 x 20 mm style Tissue Culture Dish, Tissue Culture Treated | Corning Incorporated | 353003 | |
| 50 mm Glass Bottom Microwell Dishes No1.5 | MatTek Corporation | P50G-1.5-30-F | |
| Antibiotics | |||
| Geneticin G418-sulphate | Gibco by Life Technologies | 11811-023 | |
| Hygromycin B Gold | InvivoGen | ant-hg-1 | |
| Additional Consumables | |||
| 2 mm gap electroporation cuvettes, long electrode | Geneflow Limited | E6-0062 | |
| 10 µL Inoculating Loop, Blue 10 Micro L | ThermoScientific | 129399 | |
| Spreader, L-shaped, sterile | greiner bio-one | 730190 | |
| Combitips advanced 5 mL | Eppendorf BIOPUR | 30089669 | |
| Kits | |||
| ZR Plasmid Miniprep Classic | Zymoresearch | D4016 | |
| Quick DNA Miniprep Kit | Zymoresearch | D3025 | |
| Zymoclean DNA Recovery Kit | Zymoresearch | D40002 | |
| Enzymes | |||
| Restriction enzymes | NEB | ||
| OneTaq 2X Master Mix with Standard Buffer | NEB | M0482L | |
| T4 DNA Ligase | NEB | M0202S | |
| PrimeSTAR Max DNA Polymerase | TakaraBio | R045A |
참고문헌
- Schaap, P. Evolutionary crossroads in developmental biology: Dictyostelium discoideum. Development. 138 (3), 387-396 (2011).
- Sussman, R., Sussman, M. Cultivation of Dictyostelium discoideum in axenic culture. Biochemical and Biophysical Research Communications. 29, 53-55 (1967).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), 75 (2008).
- Witke, W., Nellen, W., Noegel, A. Homologous recombination in the Dictyostelium alpha-actinin gene leads to an altered mRNA and lack of the protein. The EMBO Journal. 6, 4143-4148 (1987).
- De Lozanne, A., Spudich, J. A. Disruption of the Dictyostelium myosin heavy chain gene by homologous recombination. Science. 236, 1086-1091 (1987).
- Howard, P. K., Ahern, K. G., Firtel, R. A. Establishment of a transient expression system for Dictyostelium discoideum. Nucleic Acids Research. 16, 2613-2623 (1988).
- Knecht, D., Pang, K. M. Electroporation of Dictyostelium discoideum. Methods in Molecular Biology. 47, 321-330 (1995).
- Wetterauer, B., et al. Wild-type strains of Dictyostelium discoideum can be transformed using a novel selection cassette driven by the promoter of the ribosomal V18 gene. Plasmid. 36, 169-181 (1996).
- Lloyd, M. M., Ceccarelli, A., Williams, J. G. Establishment of conditions for the transformation of nonaxenic Dictyostelium strains. Developmental Genetics. 11, 391-395 (1990).
- Bloomfield, G., et al. Neurofibromin controls macropinocytosis and phagocytosis in Dictyostelium. eLife. 4, (2015).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. eLife. 5, (2016).
- Veltman, D. M., Lemieux, M. G., Knecht, D. A., Insall, R. H. PIP(3)-dependent macropinocytosis is incompatible with chemotaxis. The Journal of Cell Biology. 204 (4), 497-505 (2014).
- Hoeller, O., Kay, R. R. Chemotaxis in the absence of PIP3 gradients. Current Biology. 17, 813-817 (2007).
- Chubb, J. R., Wilkins, A., Thomas, G. M., Insall, R. H. The Dictyostelium RasS protein is required for macropinocytosis, phagocytosis and the control of cell movement. Journal of Cell Science. 113, 709-719 (2000).
- Schaap, P., et al. Molecular phylogeny and evolution of morphology in the social amoebas. Science. 314, 661-663 (2006).
- Du, Q., Kawabe, Y., Schilde, C., Chen, Z. H., Schaap, P. The Evolution of Aggregative Multicellularity and Cell-Cell Communication in the Dictyostelia. Journal of Molecular Biology. 427 (23), 3722-3733 (2015).
- Hirose, S., Benabentos, R., Ho, H. I., Kuspa, A., Shaulsky, G. Self-recognition in social amoebae is mediated by allelic pairs of tiger genes. Science. 333 (6041), 467-470 (2011).
- Strassmann, J. E., Queller, D. C. Evolution of cooperation and control of cheating in a social microbe. Proceedings of the National Academy of Sciences of the United States of America. 108 (2), 10855-10862 (2011).
- Wolf, J. B., et al. Fitness Trade-offs Result in the Illusion of Social Success. Current Biology. 25 (8), 1086-1090 (2015).
- Veltman, D. M., Akar, G., Bosgraaf, L., Van Haastert, P. J. A new set of small, extrachromosomal expression vectors for Dictyostelium discoideum. Plasmid. 61 (2), 110-118 (2009).
- Southern, E. M. Detection of specific sequences among DNA fragments separated by gel electrophoresis. Journal of Molecular Biology. 98 (3), 503-517 (1975).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), 0196809 (2018).
- Woznica, D., Knecht, D. A. Under-agarose chemotaxis of Dictyostelium discoideum. Methods in Molecular Biology. 346, 311-325 (2006).
- Dubin, M., Nellen, W. A versatile set of tagged expression vectors to monitor protein localisation and function in Dictyostelium. Gene. 465 (1-2), 1-8 (2010).
- de Hostos, E. L., et al. Dictyostelium mutants lacking the cytoskeletal protein coronin are defective in cytokinesis and cell motility. Journal of Cell Biology. 120, 163-173 (1993).
- Sekine, R., Kawata, T., Muramoto, T. CRISPR/Cas9 mediated targeting of multiple genes in Dictyostelium. Scientific Reports. 8 (1), 8471 (2018).
- Sadelain, M., Papapetrou, E. P., Bushman, F. D. Safe harbours for the integration of new DNA in the human genome. Nature Reviews Cancer. 12 (1), 51-58 (2011).
- Rosengarten, R. D., et al. Leaps and lulls in the developmental transcriptome of Dictyostelium discoideum. BMC Genomics. 16, 294 (2015).
- Tunnacliffe, E., Corrigan, A. M., Chubb, J. R. Promoter-mediated diversification of transcriptional bursting dynamics following gene duplication. Proc Natl Acad Sci USA. 115 (33), 8364-8369 (2018).
- Gebbie, L., et al. Phg2, a kinase involved in adhesion and focal site modeling in Dictyostelium. Molecular Biology of the Cell. 15, 3915-3925 (2004).
- Jeon, T. J., Lee, D. J., Merlot, S., Weeks, G., Firtel, R. A. Rap1 controls cell adhesion and cell motility through the regulation of myosin II. Journal of Cell Biology. 176, 1021-1033 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유