JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
게놈 전체 상호 Hemizygosity 분석을 통해 사카로 마이스 효모의 종 간의 열내성 차이의 유전 매핑
요약
시퀀싱 (RH-seq)을 통한 상호 반심은 종 간의 특성 차이의 유전적 기초를 매핑하는 강력한 새로운 방법입니다. hemizygotes의 풀은 트랜스포종 돌연변이 발생에 의해 생성되고 그들의 체력은 높은 전반에 걸쳐 시퀀싱을 사용하여 경쟁적인 성장을 통해 추적됩니다. 결과 데이터의 분석은 특성의 근본적인 유전자를 찾아낸다.
초록
현대 유전학의 핵심 목표는 야생의 유기체가 표현형이 다른 방법과 이유를 이해하는 것입니다. 현재까지, 필드는 종의 개별 사이 짝짓기에서 재조합 자손을 통해 DNA 서열 이체 및 표현형 사이 관계를 추적하는 연결및 협회 매핑 방법의 힘에 크게 진보했습니다. 이러한 접근법은 강력하지만 생식적으로 고립된 종 간의 특성 차이에 적합하지 않습니다. 여기에서 우리는 호환되지 않는 종에 쉽게 적용될 수 있는 자연적인 형질 변이의 게놈 전체 해부를 위한 새로운 방법을 기술합니다. 우리의 전략, RH-seq는, 상호 hemizygote 시험의 게놈 전체 구현입니다. 우리는 그것의 자매 종 S.역설에 상대적으로 효모 Saccharomyces cerevisiae의 눈에 띄는 고온 성장에 책임 있는 유전자를 확인하기 위하여 그것을 이용했습니다. RH-seq는 트랜스포손 돌연변이 발생을 이용하여 상호 반혈구 풀을 생성한 다음 고처리량 시퀀싱을 통해 고온 경쟁을 통해 추적합니다. 여기에 명시된 RH-seq 워크플로우에서는 신진 효모 클래드에서 고대의 복잡한 특성을 해부하는 엄격하고 편견없는 방법을 제공하며, 유전 매핑을 위한 게놈 커버리지를 보장하기 위해 자원 집약적인 깊은 시퀀싱이 필요하다는 경고와 함께 합니다. 시퀀싱 비용이 감소함에 따라 이 접근 방식은 진핵생물 전반에 걸친 향후 사용에 대한 큰 약속을 지니고 있습니다.
서문
필드의 새벽부터, 그것은 야생 개인에 걸쳐 변화의 기계론적 기초를 이해하는 유전학의 주요 목표되었습니다. 우리가 관심의 특성의 근본적인 loci를 지도로, 신흥 유전자는 진단과 약에 대한 표적으로 즉시 사용될 수 있고, 진화의 원리에 빛을 비출 수 있습니다. 이를 향한 업계 표준은 연결 또는 협회 1을 통해 인구에 걸쳐 유전자형과표현형 사이의 관계를 테스트하는 것입니다. 이러한 접근법은 강력한, 그들은 하나의 주요 제한-그들은 방해 개인 사이 십자가에서 재조합 자손의 큰 패널에 의존. 그(것)들은 처음에 자손을 형성하기 위하여 짝을 지을 수 없는 종의 연구 결과에서 아무 소용이 없습니다. 이와 같이, 필드는 생식 고립 된 종 사이의 특성 차이의 편견해부에 대한 작은 용량을 가지고있다 2.
이 작품에서 우리는 새로운 방법의 기술적 기초를보고, RH-seq3,종 사이의 형질 변이의 유전 적 기초의 게놈 규모 설문 조사. 이 접근법은 상호 반심고트 시험4,5의대규모 병렬 버전이며, 이는 처음에 두 개의 유전적으로 구별되는 두 가지 배경 사이의 유전적으로 구별되는 배경 사이의 유전적으로 구별되는 차이의 현상학적 효과를 평가하는 방법으로 생각되었다. 특정 궤적(그림1A). 이 계획에서, 2개의 발산한 개별은 그 게놈의 각각에게서 오는 그들의 게놈의 반을 형성하기 위하여 첫째로 짝짓기됩니다. 이 백그라운드에서는 각 계개의 대절의 중단되거나 삭제된 복사본을 포함하는 여러 균주가 생성됩니다. 이 균주는 관심의 궤적에서 제외 한 게놈의 사방에 diploid 남아 있기 때문에 hemizygous, 어디 그들은 haploid 간주 됩니다., 그리고 상호 로 불린다 각 하나의 부모의 eele 부족 하기 때문에, 그것의 나머지 eele파생 다른 부모. 이러한 상호 hemizygote 균주의 표현형을 비교함으로써, 하나는 조작 된 궤적에서 DNA 서열 변이체가 관심의 특성에 기여하는지 여부를 결론을 내릴 수 있습니다, 궤적에서 변이체는 상호 사이의 유일한 유전 적 차이이기 때문에 헤미지고테 균주. 이런 식으로, 잘 통제된 실험 적인 설치에 있는 그들 사이 phenotypic 차이에 종 사이 유전 적 차이를 연결하는 것이 가능합니다. 이 시험의 응용은 후보 유전자 프레임 워크에 있었다 현재까지- 즉, 후보 궤적의 자연 변이가 특성에 영향을 미칠 수 있다는 가설이 이미 손에있는 경우.
다음에, 우리는 모델 시스템으로 효모를 사용하여 게놈 규모의 상호 hemizygosity 스크린을 위한 프로토콜을 배치합니다. 우리의 방법은 종 사이 실행 가능한, 멸균 F1 하이브리드를 생성하고 트랜스 포종 돌연변이 유발에 복종하여 hemizygote 돌연변이의 게놈 보완을 만듭니다. 우리는 hemizygotes를 풀링하고, 시퀀싱 기반 분석에서 표현형을 측정하고, 주어진 유전자의 두 부모의 대식가를 가진 풀의 클론 사이의 주파수 차이를 테스트합니다. 결과는 종 사이의 변이체가 관심의 특성에 영향을 미치는 loci의 카탈로그입니다. 우리는 두 개의 신진 효모 종, 사카로 미세세세와 S. 역설사이의 열내성 차이의 유전 적 기초를 해명하기 위해 RH-seq 워크플로우를 구현, 이는 ~ 5 백만 년 전6.
프로토콜
1. 변형을위한 돼지 박 함유 플라스미드의 준비
- 단일 콜로니에 밖으로 줄무늬 대장균 균주 항포 플라스미드 pJR487 LB + 카르베니실린 한천 접시에. 37 °C에서 1 박 동안 또는 단일 식민지가 나타날 때까지 배양하십시오.
참고 : 플라스미드 pJR487이 복제 된 방법에 대한 설명은이전 작업 3에서 찾을 수 있습니다. - 100 μg/mL에서 LB + 카르베니실린 1L을 2 L 유리 플라스크에 pJR487을 함유하는 대장균의 단일 콜로니로 접종합니다. 포화 될 때까지 200 rpm에서 흔들어 37 °C에서 하룻밤 성장 (OD600 ≥ 1.0).
- 제조업체의 게시된 프로토콜에 지시된 대로 대규모 플라스미드 준비 키트를 사용하여 배양물로부터 플라스미드 DNA를 정화한다(자세한 내용은 재료 표 참조). 용출 완충액 5 mL로 10분 배양 후 DNA를 37°C로 데운 후 용출 완충액을 적당히 한다.
- 분광광도계로 플라스미드 DNA의 양과 품질을 측정합니다(자세한 내용은 재료 표 참조).
- 반복 단계 1.2 – 1.4 적어도 의 총까지 11 A에서 mg 플라스미드 DNA260:A280 적어도 1.8의 비율은 격리된다. 이 몇 가지 준비를 걸릴 수 있습니다., 효율성에 따라.
- 모든 플라스미드 프렙을 단일 튜브에 혼합하고 용출 완충제 또는 물로 총 부피를 최대 20 mL까지 가져옵니다. 분광광도계로 최종 수량과 품질을 다시 측정합니다. 플라스미드의 농도는 최종 20 mL 부피에서 적어도 538 ng/μL이어야 한다. 농도가 538 ng/μL보다 높으면 용출 완충제 또는 물로 플라스미드를 538 ng/μL로 희석합니다. 플라스미드는 사용 전까지 4°C에서 최대 몇 주까지 보관할 수 있다.
2. 표적없는 게놈 전체 의 풀 만들기
- 변형을 위한 하이브리드 효모 세포의 준비
- YPD 한천 플레이트에 단일 콜로니에 -80 °C 냉동고 재고 변형에서 JR507을 행진. 26 °C에서 2일 동안 또는 식민지가 나타날 때까지 배양합니다.
참고: JR507은 S. 세레비시아 DBVPG1373 및 S. 역설 Z1(테트라드 해부 현미경 사용)의 하플루이드 포자의 단일 세포 결합을통해 이루어진 하이브리드 균주 3. - JR507의 단일 콜로니와 250 mL 유리 플라스크에 액체 YPD의 100 mL를 접종하고 28 °C, 200 rpm에서 24 시간 동안 흔들거나 고정 상에 도달 할 때까지.
- 다음날, 야간 배양물의 600 nm(OD600)에서광학 밀도를 측정한다. 신선한 액체 YPD를 새로운 1 L 유리 플라스크에 사용하여 하룻밤 문화의 일부를 0.2의 OD600 및 부피 500 mL로 백 희석하여 새로운 문화를 창조합니다.
참고: 야간 배양권에 5.0의 OD600이 있고 C가 광학 밀도이고 V가 부피인 경우 백 희석계산의 예: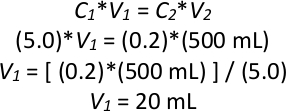
따라서, 포화 박수 배양의 20 mL은 0.2의 OD 600에서 총 500 mL의 배양을 만들기 위해 액체 YPD의 480 mL에 첨가될 것이다. - 2.1.3단계를 3회 더 반복하여 4개의 새로운 배양물 모두에 대해 동일한 야간 배양을 사용하여 4개의 1L 글라스 플라스크에서 0.2의 OD600에서 총 500 mL 배양액을 만든다. 200 rpm에서 6 시간 (2-3 세대)에 대해 28 °C에서 모두 배양하십시오.
- 500mL 문화중 두 가지를 결합하여 1L 배양을 만듭니다. 나머지 두 개의 500mL 배양을 결합하여 또 다른 1L 배양을 만듭니다. 이 시점에서 두 개의 1 L 문화가 있습니다. 이러한 1L 문화권각각은 다음 단계에서 pJR487로 변형될 수 있습니다.
- YPD 한천 플레이트에 단일 콜로니에 -80 °C 냉동고 재고 변형에서 JR507을 행진. 26 °C에서 2일 동안 또는 식민지가 나타날 때까지 배양합니다.
- 하이브리드 효모 세포로 pJR487의 변환
- 1L 배양액을 20개의 플라스틱 원엽 튜브에서 20mL aliquots로 분할하여 총 40개의 튜브를 구성합니다. 20개의 튜브를 따로 놓고 한 번에 20개의 튜브에서 다음 단계를 수행합니다.
- 1,000 x g에서 3분 동안 20개의 튜브를 각각 원심분리하여 효모 세포를 펠렛한다. 상급제는 버리십시오.
- 소용돌이에 의해 멸균 H2O의 25 mL로 각 펠릿을 다시 일시 중단. 1,000 x g에서 3 분 동안 원심 분리기 . 상급제는 버리십시오.
- 1x TE의 5 mL, 0.1 M LiOAc 버퍼로 각 펠릿을 소용돌이에 의해 다시 일시 중단합니다. 1,000 x g에서 3 분 동안 원심 분리기 . 상급제는 버리십시오.
- 2.2.4단계를 반복합니다. 세포가 원심분리되는 동안, 39.52% 폴리에틸렌 글리콜, 0.12 M LiOAc 및 1.2x 트리스-EDTA 완충액(12 mM Tris-HCl 및 1.2 mM EDTA)의 용액의 적어도 120 mL을 준비한다. 얼음에 보관하십시오.
- 플라스미드 DNA를 변형시키기 위해 먼저 100°C에서 4 mL의 연어 정자 DNA를 5분간 끓이고 얼음에서 5분간 식힙니다. 이어서, pJR487의 20 mL(섹션 1에서 수득)을 538 ng/μL의 농도에서 24 mL의 총 부피동안 냉각된 연어 정자 DNA의 4 mL와 혼합한다. 사용할 때까지 얼음을 유지하십시오.
- 각 세포 펠릿 위에 연어 정자 DNA와 혼합된 플라스미드 DNA 600 μL을 추가합니다. 아직 다시 일시 중단하지 마십시오.
- 각 펠릿에 2.2.5단계로 만들어진 PEG-LiOAc-TE 용액 3mL를 추가합니다. 위아래로 파이펫팅하고 소용돌이를 피펫팅하여 펠릿을 다시 일시 중단합니다.
- 실온에서 각 튜브를 10 분 동안 배양하십시오.
- 39 °C로 설정된 수조에서 각 튜브를 26 분 동안 가열합니다.
참고 : 몇 분마다 각 튜브를 반전하여 세포가 튜브 바닥에 침전되는 것을 방지하십시오. - 원심 분리기 각 튜브에 대 한 3 분 에서 1,000 x g. 상급체를 버리고 소용돌이에 의해 YPD의 10 mL에 각 펠릿을 다시 일시 중단. 20개의 튜브를 모두 새로운 유리 플라스크에 결합합니다. 세포의 총 부피는 ~ 200 mL이어야합니다.
- 66.6 mL의 세포를 새로운 1 L 유리 플라스크로 옮기고 액체 YPD로 최대 500 mL의 부피를 가져옵니다. 형질전환된 셀의 전체 200mL를 사용하려면 두 번 더 반복합니다. 각각의 새로운500 mL 배양의 OD 600을 측정합니다(~0.35-4의 OD600예상).
- 28°C에서 3개의 플라스크를 모두 흔들어 200rpm에서 200rpm에서 회복(&1세대)합니다.
- 3개의 플라스크 각각에 300 mg/mL G418의 0.5 mL을 추가하고, 최종 농도인 300 μg/mL G418에 넣고 28°C, 200 rpm에서 다시 흔들어 줍니다.
참고: 이 단계 이전에는 변형된 하이브리드 셀이 변형에서 복구되고 있습니다. G418을 첨가하면 플라스미드 pJR487의 존재가 선택된다. 변환 하는 동안 플라스미드를 차지 하지 않은 모든 세포는 죽기 시작 합니다. - 2.2.2 – 2.2.14 단계를 나머지 20개의 원엽 세포 튜브로 반복합니다. 이 시점에서 6 개의 1 L 유리 플라스크가 있어야하며, 각각 G418이 추가 된 500 mL의 세포가 있습니다.
- 28°C에서 6개의 플라스크를 모두 배양하고, 200 rpm에서 흔들며, 약 2일 동안 또는 각 플라스크에서 ~2.3의 OD600에 도달할 때까지 배양한다. 여섯 개의 플라스크를 모두 결합하여 단일 문화가 만들어내도록 합니다.
참고: 이 배양물의 모든 셀이 다운스트림 단계에서는 사용되지 않지만 이러한 대량의 셀을 사용하는 목적은 가능한 한 많은 고유한 변환 이벤트를 만들고 모든 변형을 풀링하여 단일 변환에서 모든 편향을 정규화하는 것이 목표였습니다. 함께. - 2.2.16에서 생성된 배양을 사용하여 YPD + G418(300 μg/mL)의 500mL로 두 개의 새로운 1L 플라스크를 0.2의 OD600으로 접종합니다. 폐기할 수 있는 남은 문화가 있을 것입니다.
- 1L 플라스크를 28°C에서 밤새 배양하고, 200 rpm에서 흔들어 각각 ~2.2의 OD600에 도달할 때까지 (~3.5세대). 두 배양액을 단일 배양액으로 결합하고 결합배양의 OD600을 다시 측정합니다.
참고: 이 시점에서, 배양은 거의 전적으로 플라스미드 pJR487을 품고 있는 세포로 이루어져야 한다. 세포의 집단의 일부에서, PiggyBac 트랜스포손은 플라스미드에서 발현된 트랜스포사아제에 의해 플라스미드로부터 게놈으로 전치될 것이다. 그러나, 트랜스포세아제의 지속적인 발현은 선택의 과정 동안 전치로 이어질 수 있으며, 이는 유전자형과 표현형 사이의 관계를 모호하게 할 것이다. 다음 몇 단계의 목표는 플라스미드의 존재에 대한 반대 선택을 수행하여 트랜스포세아제의 더 이상 발현이 없도록 하는 것입니다. 생성된 풀은 게놈에 통합된 트랜스포슨의 유무에 관계없이 세포의 혼합이지만, 후속 매핑 단계 동안 트랜스포슨을 포함하는 세포만 검출된다. 플라스미드 인코딩이 손실되기 전에 트랜스포세아제가 발현되는 동안의 변환시간, 돌연변이 발생 후 주어진 클론이 하나 이상의 트랜스포지션 삽입을 망설일 가능성을 지배할 수 있다. 한 번에 하나의 유전자를 분석할 때 "이차적" 돌연변이로 나타나는 이들의 빈도는 돌연변이 발생 후 정의된 수의 식민지를 배열한 다음 DNA와 서열을 결합하여 독립적인 삽입 수를 확인함으로써 추정될 수 있습니다. 풀의 위치. - 원심 분리기 25 mL이 배양 3 분 에서 1,000 x g. 25mL에 있는 셀의 총 OD600 단위 수를 계산합니다(아래 예제 계산 참조). 상급체를 버리고 충분히 H2O에서 재중단하여 소용돌이에 의해 1.85 OD 600/mL의 셀서스펜션을생성한다.
참고: 결합 배양물의 OD600이 2.2인 경우 물 에서 세포의 재현탁액계산예: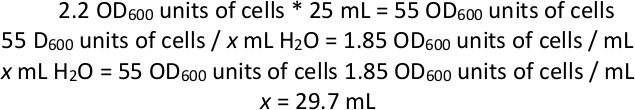
따라서, 세포 배양 25 mL을 회전시키고 상황을폐기한 후, 세포에 충분한 H2 O를 추가하여 세포와 물의 총 부피를 ~29.7 mL까지 가져온다(세포 펠렛은 또한 부피를 가질 것이기 때문에, H2 O의 29.7 mL 미만을 첨가). - 유리 구슬을 사용하여, 5-FOA와 12 개의 큰 사각형 완전한 합성 한천 접시에 물에 재 중단 된 세포의 플레이트 1 mL. 각 플레이트를 28°C에서 1-2일 동안 또는 플레이트에 잔디가 형성될 때까지 배양합니다.
- 작은 멸균 스퀴지를 사용하여 6 개의 플레이트 각각에서 세포를 긁어 내고 35 mL의 멸균 수로 튜브에 넣습니다. 다른 6 개의 플레이트와 함께 반복하여 총 2 개의 세포와 물 튜브를 반복합니다. 모든 셀 현탁액을 단일 튜브에 결합합니다. 물을 비칸으로 사용하여 이 현탁액의 OD600을 측정합니다. OD600/mL의 세포 농도를 물과 함께 44.4 OD600 단위/mL로 가져옵니다. 우리의 경험에서, 전위 효율 (URA-인 KAN + 세포의 비율)은 평균 50 %입니다.
- 저장할 세포의 -80°C 냉동고 스톡수를 결정합니다. 각 알리쿼트는 단일 실험에 대해 미래에 사용될 수 있습니다.
참고: 풀 생성에 시간이 얼마나 소요되는지 감안할 때 실수로 오용하거나 복제 실험을 수행할 경우 여러 개의 바이알을 저장합니다. 20-30 주식은 합리적인 수입니다. - 각 냉동고 스톡에는 1mL의 1mL에 40 개의 OD600 단위의 셀이 포함됩니다. 900 μL의 세포를 DMSO 의 100 μL에 추가합니다. 생성된 총 냉동고 주식 수에 대해 반복합니다. 나중에 사용할 수 있는 각 것을 -80°C에 보관하십시오.
3. 풀풀 형식의 상호 반미고트 선택
- -80°C 냉동고에서 실온에서 섹션 2로부터 풀린 상호 반점액의 단일 aliquot를 해동한다.
참고 : 알리쿼트가 해동되면 실온에서 오랫동안 앉지 말고 즉시 사용하십시오. - 전체 1 mL aliquot를 사용하여 250 mL 유리 플라스크에서 액체 YPD 150 mL을 접종하십시오. 이 배양물의 OD600을 측정한 다음, 28°C에서 배양하고, 200 rpm에서 흔들어, ~7시간 동안, 또는 배양이 2-3인구를 두 배로 통과할 때까지. 이 시점에서 문화는 선택을 받는 문화를 접종하는 데 사용할 준비가 되어 있습니다.
참고: 예제 계산: 원래 플라스크의 OD600이 0.25를 측정하는 경우, 적어도 1.0의 OD600에 도달할 때까지 배양어를 배양합니다. 어떤 견본 점도 선택의 앞에 hemizygote 인구를 조사하는 방법으로 "시간 제로"(T-0)에서 원하는 경우에, 세포 펠릿은 3 분 동안 1,000 x g에 있는 펠릿 당 배양의 5-10 mL를 원심분리해서 지금 취할 수 있습니다, 상복부를 폐기하고 -80 °C에서 동결. - 성장한 헤미지고테 풀을 사용하여 고온(39°C) 및 허용 온도(28°C)에서 적합한 복제 방식으로 선택을 위한 배양을 접종합니다. 최소한, 각 온도에서 총 6개의 선택 배양에 대해 3개의 생물학적 복제 선택 배양을 설정합니다.
- 액체 YPD가 있는 2L 유리 플라스크에 총 500mL의 각 선택 문화를 만들고 0.02의 OD600에 접종합니다. 28°C 또는 39°C에서 100 rpm에서 각 선택 배양액을 흔들어 6-7인구의 이중이 발생합니다(~1.28-2.56의 OD600에 해당). 모든 선택 문화어의 최종 OD600을 가능한 한 가깝게 일치시키려고 합니다.
참고: 28°C에서의 선택 배양은 39°C에서 선택 배양물보다 빠르게 성장합니다. 따라서, 39°C에서의 선택 배양은 인큐베이터에서 더 긴 기간을 소비할 것이다. 인큐베이터에서 보낸 총 시간에 관계없이 준비가 되면 각 플라스크를 사용하여 다음 단계를 진행합니다. 우리의 경험에서, 28 °C 또는 39 °C에서 배양하는 것은 각각 ~ ~ 2.0의 OD에 도달하기 위하여 ~ 12 또는 ~18 시간이 걸렸습니다. 긴 선택은 작은 적당 효력을 증폭의 이점을 가질 수 있고, 또한 어떤 1개의 유전자/eele에 있는 transposon 돌연변이에 걸쳐 적당의 마지막 분포로 소음을 소개할 de novo 배경 돌연변이가 생기는 것을 허용할 수 있었습니다. 따라서 RH-seq 실험에서 선택 시간을 제한하는 것이 중요합니다.
- 액체 YPD가 있는 2L 유리 플라스크에 총 500mL의 각 선택 문화를 만들고 0.02의 OD600에 접종합니다. 28°C 또는 39°C에서 100 rpm에서 각 선택 배양액을 흔들어 6-7인구의 이중이 발생합니다(~1.28-2.56의 OD600에 해당). 모든 선택 문화어의 최종 OD600을 가능한 한 가깝게 일치시키려고 합니다.
- 각 선택 배양물로부터 세포 펠릿을 수확한다. 라이브러리 준비 및 시퀀싱을 위한 기술적 복제본으로 각 선택 문화에서 이 부피의 최소 4개 펠릿을 1,000 x g에서 1,000 x g에서 7개의 OD600 단위의 세포와 원심분리기를 얻는 데 필요한 부피를 계산합니다(섹션 4 및 5 참조) 아래). 상급체를 버리고 -80 °C에 보관하십시오.
참고: 선택 플라스크에 최종 OD600이 2.0인 경우예: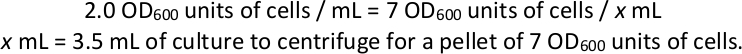
4. Tn-seq 도서관 건설 및 일루미나 시퀀싱은 트랜스포종 돌연변이 헤미지고이의 풍부를 결정하기 위해
- 얼음에 해동 각 세포 펠 릿 섹션에서 3 그 순서가 될 것입니다.
- 효모 gDNA 정제 키트를 사용하여 각 세포 펠릿에서 총 게놈 DNA(gDNA)를 분리하여 제조업체의 지시에 따라 분리합니다. 65°C로 예열된 용출 완충제의 50 μL에서 DNA를 재중단시켰다.
- 형량계를 사용하여 각 펠릿에서 gDNA의 양을 정량화합니다. 다음 절차를 사용하여 Tn-seq에 대한 차세대 염기서열 분석(NGS) 라이브러리를 생성하기 위해 각 세포 펠릿에 필요한 gDNA의 최소 총 량은 1 μg이다.
참고: gDNA 의 1 μg 미만은 라이브러리를 만드는 데 사용할 수 있지만 라이브러리의 최종 양과 품질은 저하됩니다. - Tn-seq 라이브러리 7을 만들기위한 확립된 프로토콜을 따르십시오. 이 프로토콜에 고유한 다음 관련 정보에 유의하십시오.
- gDNA 전단, 최종 수리 및 어댑터 결찰 후, PCR을 통해 트랜스포슨을 함유하는 gDNA를 증폭시다. 해당 PCR의 경우 PiggyBac 트랜스포종 및 NGS 어댑터에 대해 각각 특정한 다음 순방향 및 후진 프라이머를 사용합니다.
앞으로 (N – 무작위 뉴클레오티드)
5' 아가타크그치카카가트CTCTACACGACG
CTCTTCTGATCTNNNNagCAATTTCAAGAATGCGCGCCAAT 3'
리버스(Ns의 스트레치)는 멀티플렉싱에 사용되는 고유한 6-bp 인덱스를 나타냅니다. 인덱스에 대한 자세한 내용은 아래를 참조하십시오.
5' 카카가가가가가가가아카카카가가트가트가트가
ACGTGTGCCTTCCGATCT 3' - 크기 선택적 비드와 함께 포함된 정리 단계를 사용하여 최종 라이브러리에서 복제된 조각의 비율을 최소화하여 너무 짧아서 음흉한 게놈 서열을 포함할 수 없습니다.
참고: 선택 문화에 대해 지금까지 최소 복제 요구 사항을 따랐을 때 시퀀싱을 위한 개별 gDNA 샘플은 24개입니다. 현재 시퀀싱 비용을 감안할 때 각 샘플이 자체적으로 실행될 가능성은 거의 없습니다. 동일한 레인에서 샘플을 결합하려면 각각 고유한 6베이스 쌍 인덱스를 사용하여 여러 개의 역방향 프라이머를 만듭니다. 인덱스가 다른 샘플은 동일한 시퀀싱 레인에 결합하고 나중에 계산하여 분리할 수 있습니다.
- gDNA 전단, 최종 수리 및 어댑터 결찰 후, PCR을 통해 트랜스포슨을 함유하는 gDNA를 증폭시다. 해당 PCR의 경우 PiggyBac 트랜스포종 및 NGS 어댑터에 대해 각각 특정한 다음 순방향 및 후진 프라이머를 사용합니다.
- 8개의 레인에서 NGS 기술을 사용하여 각 라이브러리에서 시퀀스 싱글 엔드 150bp 읽기.
참고 : 필요한 시퀀싱 읽기의 양은 이전 단계에서 준비된 라이브러리의 품질에 크게 좌우됩니다 (즉, 실제로 트랜스포손 DNA를 포함하는 라이브러리의 DNA 비율, 상호 편광에서 오는 DNA를 나타냅니다). 이에 기여하는 두 가지 주요 요인이 있습니다. 첫째, 통합 된 트랜스 포슨이없는 셀은 풀 생성 중에 반대선택되지 않기 때문에 각 배양은 트랜스포슨과 유무에 관계없이 셀의 혼합이 될 것입니다. 둘째, 트랜스포손 함유 상호 편광골의 게놈 내에서도, 대부분의 게놈은 서열을 포함하는 트랜스포손이 아니며, 이 gDNA는 불가피하게 라이브러리 준비의 일부가 될 것이다. 트랜스포종 함유 DNA의 최종 PCR 증폭의 목표는 배경 gDNA의 이 2개의 근원에 트랜스포종 함유 DNA의 비율을 증가시키는 것입니다. 이 증폭의 효율성이 높을수록 다운스트림 분석에 더 높은 읽기 비율을 사용할 수 있습니다. 라이브러리의 품질이 낮을수록 읽기의 증가 비율이 트랜스포전 DNA를 포함하지 않으며 유용하지 않기 때문에 더 많은 시퀀싱이 수행되어야 합니다. 위의 제약을 감안할 때, 시퀀싱의 8 차선은 적당한 정도로 상호 hemizygote 풍부를 추적 할 수 있었다. 시퀀싱이 많을수록 더 심층적인 분석이 허용됩니다.
5. 트랜스포슨 삽입 및 RH-seq 분석위치 매핑
참고: 다음 데이터 분석은 사용자 지정 Python 스크립트(https://github.com/weiss19/rh-seq 온라인 에서 발견됨)로 수행되었지만 다른 스크립팅 언어를 사용하여 다시 사용할 수 있습니다. 아래에서 프로세스의 주요 단계에 대해 설명합니다. 결합할 필요가 없는 한 각 개별 복제 읽기 파일에 대해 다음 단계를 수행합니다.
- 어댑터 시퀀스를 읽기에서 잘라내고 인덱스에 따라 각 복제의 읽기를 분리합니다.
- 트랜스포슨 게놈 접합부가 포함된 읽기를 찾습니다. 이를 위해 트랜스포종의 마지막 20개의 기본 쌍인 CAGACTATCTCTTGTTAA에 대해 각 읽기 내에서 검색합니다. 이 시퀀스를 포함하지 않는 모든 읽기를 삭제합니다.
참고 : 우리의 경험에서, 트랜스 포종의 끝에 매핑 읽기의 비율은 83-95 %입니다. - 나머지, 트랜스포슨 함유 읽기를 트리밍하여 트랜스포슨의 3' 말단의 하류서열만 포함한다. 이 서열을 효모 게놈에 매핑함으로써, 각 판독에 대한 트랜스포전 삽입의 게놈 컨텍스트를 결정한다(아래 5.4단계).
- BLAT 또는 동등한 매핑 도구를 사용하여 트랜스포손의 시퀀스 다운스트림을 S. 세레비시아에 DBVPG1373 x S. 역설 Z1 하이브리드 게놈(스크립트 이름: map_and_pool_BLAT.py)에 매핑합니다.
- 트랜스포종의 3' 끝의 사용 가능한 시퀀스 다운스트림이 50개 미만인 모든 읽기를 폐기합니다. 짧은 시퀀스는 고유하게 매핑하기가 어렵습니다.
- BLAT를 사용하는 경우 ID = 95, 타일 크기 = 12 : 다음 매개 변수를 사용합니다.
- S. 세레비시아 S288c 및 S. 역설 CBS432의 참조 게놈의 최신 버전을 연결하여 매핑에 사용할 기본 하이브리드 게놈을 만듭니다.
참고: 하이브리드 게놈에 걸쳐 개별 유전자의 게놈 경계를 설명하는 기본 어노미 파일은 위에 나열된 Github 저장소에서 찾을 수 있습니다 (파일 이름: YS2 +CBS432+plasmid_clean). 하이브리드 게놈의 단일 위치에 매핑되는 맵만 사용합니다(즉, S. 세레비시아 또는 S. 역설에 고유함). 게놈전반에 걸친 삽입 이벤트의 균일한 빈도가 예상됩니다. 게놈에 걸쳐 삽입 위치의 분포는 다른 곳에서보고된다3.
- 각 고유 트랜스포지온 삽입 위치에 매핑되는 총 판독 횟수를 집계하여 단일 트랜스포지온 삽입 돌연변이 클론의 세포에서 유래한 모든 것을 추론합니다. 단일 라이브러리에서 이러한 모든 값의 합계를 해당 라이브러리에 대한 매핑된 읽기의 총 수라고 합니다.
- 서로 3개의 기본 쌍 내에 여러 삽입 매핑이 있는 경우 모든 삽입 지점을 단일 삽입 지점에 결합하여 모든 읽기를 가장 높은 읽기 횟수로 단일 위치에 할당합니다. 이 값,n 삽입은 gDNA가 서열된 세포 펠릿에서 의 삽입 클론의 풍부를 나타낸다. 이 시점에서, n 삽입의목록이있을 것이다, 각각의 독특한 매핑 된 트랜스 포지셔닝의 풍부, 시퀀스 된 모든 세포 펠릿에 대한 하나의 목록.
참고: PiggyBac 트랜스포종은 게놈의 TTAA 서열에 삽입, 4 염기 쌍 서열. 따라서 서로 3개의 기본 쌍 내에 삽입 매핑이 동일한 TTAA 사이트에서 시작되어야 한다고 추론합니다. - 각 시퀀스 라이브러리에서 들어오는 총 읽기 의 수가 약간 다르므로 비교할 경우 모든 파일에서 n삽입 값을 정규화합니다. 이렇게 하면 각 개별 라이브러리에서 매핑된 읽기의 총 수를 표로 하여, n펠릿,모든 라이브러리에 걸쳐 모든 n펠릿의 평균을 가지고, 펠릿>. 개별 라이브러리의 데이터에 각 n인서트를 펠릿>/n펠릿의 비율로 곱하여삽입을계산하고, 주어진 트랜스포세 삽입 클론의 정규화된 풍부도를 곱합니다.
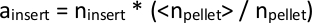
또는 DESeq2 8(스크립트 이름: total_reads_and_normalize.py)과 같은 사용 가능한 도구를 사용하여 라이브러리 크기를 추정할 수 있습니다. - 모든 라이브러리에 매핑된 모든 삽입 집합을 표로 작성합니다. 일부 라이브러리에서 발견되지만 다른 라이브러리에서는 삽입되지 않는 삽입의 경우 다운스트림 계산에대해 삽입 = 1을 설정합니다.
- 읽기를 필터링하여 추가 파일(스크립트 이름: remove_NC_and_plasmid_inserts.py)에 따라 유전자 내에 속하는 삽입을 찾습니다.
- 고유한 삽입마다 각 선택 영역(각 배양물 28°C 또는 39°C)의 기술적 복제에 대한평균 풍요로움을 계산합니다(스크립트 이름: combine_tech_reps_V2.py).
- 각 고유 삽입에 대해 각 온도에서 모든 인서트>기술의 평균을 취하여 각 온도의 생물학적 복제물,삽입>합계의평균 풍부도를 계산합니다. 동시에 각 삽입, CV삽입, 삽입> 기술(스크립트 이름: combine_bio_reps.py)에 대한 합계에 대한 변동 계수를 계산합니다.
참고: 이 시점에서, 각 온도, 28°C 및 39°C, 독특한 트랜스포존 삽입, 그들의 평균 풍부성 및 각각에 대한 생물학적 복제물 사이의 변이계의 목록이 있다. 우리의 실험에 대한 이러한데이터는 다른 곳에서보고3 . - 28°C 또는 39°C, 인서트>총 > 1.1 및 CV 삽입,총 ≤ 1.5(스크립트 이름: filter_inserts.py)가 있는 삽입물의 목록을 필터링합니다.
- 각 고유 삽입에 대해 로그 2를 계산합니다(삽입>총 28°C / 인서t>총 39°C). 이 값은 주어진 트랜스포종 삽입 돌연변이 클론의 "열내성"을 나타냅니다(스크립트 이름: fitness_ratios.py).
- 유전자와 대열유전자(S.세레비시아 또는 S.역설)에 의한 모든 독특한 삽입을 정렬하고 각 알레르에 삽입수를 표로 정리합니다. 각 eele에 적어도 5 개의 삽입이 있는 유전자만 분석되도록 유전자를 필터링합니다(스크립트 이름: organize_and_filter_genes.py).
참고: 각 대일러에 여러 개의 고유한 삽입을 통해 상호 반미소테의 열내성을 보다 정확하게 측정할 수 있습니다. Eele 당 요구되는 삽입의 수를 낮추는 것은 가능하지만 이 측정의 정확도를 손상시키고 더 많은 유전자를 시험할 수 있게 함으로써 다중 시험 부담을 증가시킬 것입니다. 추가적으로, 말절 당 너무 적은 삽입으로 유전자를 여과하는 것은 아주 이질적인 표현형을 부여하는 이차 사이트 돌연변이를 품고 있는 어떤 개별 hemizygote 클론의 시험 결과에 충격을 감소시키는 것을 도울 것입니다. - 상기 필터링 후 데이터 세트에 남아 있는 각 유전자에 대해, Mann-Whitney U 검정을 사용하여 S. 역설 우대 알레일내의 모든 삽입물의 열내성(log2 ratios)을 비교한다. 또는 DESeq2 8(스크립트 이름: mann_whitney_u.py)에서 적응된 회귀 모델을 구현할 수 있습니다.
- Benjamini-Hochberg 방법을 사용하여 여러 테스트를 위한 p-값을 수정합니다.
- 유의한 p-값(예: ≤ 0.01)을 가진 유전자는 두 종 사이의 열내성 차이에 중요한 유전자에 대한 후보이다.
결과
우리는 S. cerevisiae와 S. 역설을 교배하여 멸균 하이브리드를 형성하여 트랜스포종 돌연변이 발생을 실시했습니다. 각각의 돌연변이화된 클론은 하나의 유전자의 하나의 알레르가 중단되는 헤미지고테, 디플로이드 하이브리드였다(도1A, 도2). 우리는 39°C에서 성장하여 헤미지고테스를 서로 경쟁하고, 대조군으로서 별도의 실험...
토론
RH-seq의 장점은 이전의 통계적 유전적 방법에 비해 여러 배입니다. 연결 및 연결 분석과는 달리 RH-seq는 단일 유전자 매핑 해상도를 제공합니다. 이와 같이, 그것은 가능성이 주어진된 종의 개인에 걸쳐 특성 변화의 연구에서 중요 한 유틸리티의 될 것입니다., 뿐만 아니라 상호 특이적 차이. 또한, 게놈 전반에 대한 상호 hemizygosity 분석에서 이전의 시도는 유전자 결실 돌연변이체의 수집을 사용했으...
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 J. Roop, R. Hackley, I. Grigoriev, A. Arkin 및 J. Skerker가 원래 연구에 기여한 것에 대해 감사드립니다, F. AlZaben, A. Flury, G. Geiselman, J. Hong, J. Kim, M. Maurer, 및 L. Oltrogge는 그의 관대함을 위해, D. Savage는 그의 관대함을 위해 B. 블랙맨, S. 코라데티, A. 플램홀츠, V. 구아치, 디 코스흘랜드, C. 넬슨, A. 사시쿠마르가 토론을 위해; 우리는 또한 PiggyBac 플라스미드에 대한 J. 듀버 (생명 공학학과, UC 버클리)에게 감사드립니다. 이 작품은 R01 GM120430-A1과 지역 사회 시퀀싱 프로젝트 1460에 의해 미국 에너지 공동 게놈 연구소의 RBB에 의해 지원되었다, 과학 사용자 시설의 DOE 사무실. 후자에 의해 수행 된 작업은 계약 번호에 따라 미국 에너지부의 과학 사무실에 의해 지원되었다. DE-AC02-05CH11231.
자료
| Name | Company | Catalog Number | Comments |
| 1-2 plasmid Gigaprep kits | Zymo Research | D4204 | The number of kits required depends on how efficient your preps are in each kit. This kit comes with 5 individual plasmid prep columns. Run 1 L of saturated E. coli culture through each prep column, as using more than 1 L per column can cause clogging of the prep filter, leading to low yield and poor quality DNA. |
| 10X Tris-EDTA (TE) buffer (100 mM Tris-HCl and 10 mM EDTA) | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| 1M LiOAc | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| 300 mg/mL Geneticin (G418) | Gibco | 11811023 | |
| 52% polyethylene glycol (PEG) 3350 | Sigma | 1546547 | Dissolve in water and filter sterilize through a 0.22 μm filter before use. 1X trafo mix: 228 uL 52% PEG, 36 uL 1M LiOAc, 36 uL 10X TE buffer |
| Autoclaved LB liquid broth | BD Difco | 244620 | Make LB liquid broth using your powder from any brand, and milliQ water. Autoclave it before use. |
| Carbenicillin stock in water (100 mg/mL) | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| Complete synthetic agar plates (24.1cm x 24.1cm) with 5-fluoroorotic acid (5-FOA) [0.2% drop-out amino acid mix without uracil or yeast nitrogen base (YNB), 0.005% uracil , 2% D-glucose, 0.67% YNB without amino acids, 0.075% 5-FOA] | 5-FOA: Zymo Research, Drop-out mix: US Biological, Uracil: Sigma, D-glucose: Sigm), YNB: Difco | 5-FOA: F9001-5, Drop-out mix: D9535, Uracil: U0750, D-glucose: G8270, YNB: DF0919 | |
| DMSO | Any | N/A | |
| E. coli strain carrying pJR487 (CEN-/ARS+ piggyBac-containing plasmid) | N/A | N/A | Request from Brem lab. |
| Hybrid yeast strain JR507 (S. cerevisiae DBVPG1373 x S. paradoxus Z1, URA-/URA-) | N/A | N/A | Request from Brem lab. |
| Illumina Hiseq 2500 | used for SE-150 reads | ||
| Large shaking incubators with variable temperature settings | Any | N/A | |
| LB + carbenicillin agar plates (100 μg/mL) | Agar: BD Difco | Agar: 214010 | Make LB agar plates as normal and add carbenicillin to 100 μg/mL before drying. |
| Nanodrop spectrophotometer | Thermo Scientific | ND-2000 | |
| Qubit Fluorimeter | Thermo Scientific | Q33240 | |
| Salmon sperm DNA | Invitrogen | 15632011 | |
| Water bath at 39°C | Any | N/A | |
| Yeast fungal gDNA prep kit | Zymo Research | D6005 | |
| Yeast peptone dextrose (YPD) liquid media | BD Difco | Peptone: 211677, Yeast Extract: 212750 | Add filter-sterilized D-glucose to 2% after autoclaving. |
| YPD + G418 agar plates (300 μg/mL) | Agar: BD Difco | Agar: 214010 | Make YPD agar plates as normal and add G418 to 300 μg/mL before drying. |
| YPD agar plates | Agar: BD Difco | Agar: 214010 |
참고문헌
- Flint, J., Mott, R. Finding the molecular basis of quantitative traits: successes and pitfalls. Nature Reviews Genetics. 2, 437-445 (2001).
- Allen Orr, H. The genetics of species differences. Trends in Ecology and Evolution. 16, 343-350 (2001).
- Weiss, C. V., et al. Genetic dissection of interspecific differences in yeast thermotolerance. Nature Genetics. 50, 1501-1504 (2018).
- Stern, D. L. Identification of loci that cause phenotypic variation in diverse species with the reciprocal hemizygosity test. Trends in Genetics. 30, 547-554 (2014).
- Steinmetz, L. M., et al. Dissecting the architecture of a quantitative trait locus in yeast. Nature. 416, 326-330 (2002).
- Scannell, D. R., et al. The Awesome Power of Yeast Evolutionary Genetics: New Genome Sequences and Strain Resources for the Saccharomyces sensu stricto Genus. G3 (Bethesda). 1, 11-25 (2011).
- Wetmore, K. M., et al. Rapid quantification of mutant fitness in diverse bacteria by sequencing randomly bar-coded transposons. MBio. 6, e00306-e00315 (2015).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15, 550 (2014).
- Wilkening, S., et al. An evaluation of high-throughput approaches to QTL mapping in Saccharomyces cerevisiae. Genetics. 196, 853-865 (2014).
- Kim, H. S., Huh, J., Riles, L., Reyes, A., Fay, J. C. A noncomplementation screen for quantitative trait alleles in saccharomyces cerevisiae. G3 (Bethesda). 2, 753-760 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유