Method Article
조정 가능한 모터 구동 역학 및 역학을 사용한 Actin-Microtubule 복합재 재구성 및 특성화
Erratum Notice
요약
이 논문은 공동 얽힌 액틴 필라멘트와 미세 소관의 조정 가능한 3차원 복합 네트워크를 엔지니어링하고 특성화하기 위한 프로토콜을 제시합니다. 복합 재료는 미오신 II 및 키네신 모터에 의해 구동되는 능동적 구조 조정 및 탄도 운동을 거치며 액틴, 미세 소관, 운동 단백질 및 수동 가교제의 상대적 농도에 의해 조정됩니다.
초록
반유연한 액틴 필라멘트와 단단한 미세소관의 상호 작용 네트워크로 구성된 복합 세포 골격은 미오신 II 및 키네신과 같은 운동 단백질을 사용하여 이동, 세포질 분열, 접착 및 기계 감지와 같은 주요 프로세스를 구동하는 힘을 재구성하고 생성합니다. 액틴-미세소관 상호작용은 세포골격의 다양성과 적응성의 핵심이지만, 미오신 및 키네신 활성과의 상호작용에 대한 이해는 아직 초기 단계입니다. 이 작업은 미오신 II 및 키네신 모터에 의해 구동되고 액틴, 미세 소관, 운동 단백질 및 수동 가교제의 상대적 농도에 의해 조정되는 활성 구조 조정 및 탄도 운동을 겪는 공동 얽힌 액틴 필라멘트 및 미세 소관의 조정 가능한 3 차원 복합 네트워크를 엔지니어링하는 방법을 설명합니다. 다중 스펙트럼 컨포칼 이미징을 사용하여 복합 구조 조정 및 모션을 가장 효과적으로 시각화하기 위한 미세소관 및 액틴 필라멘트의 형광 라벨링 프로토콜도 자세히 설명되어 있습니다. 마지막으로, 비평형 구조, 역학 및 역학을 정량적으로 특성화하는 데 사용할 수있는 데이터 분석 방법의 결과가 제시됩니다. 이 조정 가능한 생체 모방 플랫폼을 재현하고 조사하면 결합 된 운동 활동, 복합 역학 및 필라멘트 역학이 유사 분열에서 분극, 기계 감각에 이르기까지 무수한 세포 과정으로 이어질 수있는 방법에 대한 귀중한 통찰력을 얻을 수 있습니다.
서문
세포 골격은 세포에 구조적 및 기계적 지원을 제공하는 상호 작용하는 생체 고분자의 동적 복합 네트워크입니다. 관련 분자 모터와 결합 단백질은 세포 골격을 재구성하고 적응시켜 세포가 성장하고, 모양을 바꾸고, 뻣뻣해지고, 움직이고, 심지어 자가 치유될 수 있도록 하여 이동 및 분열에서기계 감지에 이르는 무수한 세포 과정을 가능하게 합니다1,2. 세포 생물 물리학에서의 중요성 외에도 세포 골격은 상처 치유 및 약물 전달에서 여과 및 소프트 로봇공학 1,3,4,5,6,7,8,9에 이르기까지 잠재적 인 재료 응용 분야에서 활성 물질의 전형적인 예입니다.
세포 골격에 고유 한 구조적 및 기계적 다양성과 다 기능성을 부여하는 두 가지 주요 특성은 다음과 같습니다 : 1) 반 유연한 액틴 필라멘트 및 경질 미세 소관과 같은 여러 상호 작용 단백질 필라멘트와 관련 결합 및 가교 결합 단백질을 포함하는 복합 특성 3,5,10; 2) 필라 멘트 단백질 1,7,11,12,13을 밀고 당기는 미오신 및 키네신과 같은 에너지 소비 모터를 통해 지속적으로 재구성, 이동, 거칠게 만들고 작업을 수행하는 능력. 이러한 우아한 복잡성은 세포 골격이 세포 운동성, 세포질 분열 및 상처 치유 3,6,7,11과 같은 다양한 과정을 매개할 수 있게 하지만, 재구성된 시험관 내 시스템에서 세포골격의 생체 내 특성을 재현하는 연구자의 능력을 방해합니다.
현재의 프론티어 재구성 노력은 얽히고 가교된 액틴 필라멘트 및 미세소관 3,10,14,15,16,17, 힘 생성 액토미오신 네트워크2,8,18,19,20,21 및 키네신-미세소관에 의해 구동되는 활성 네마틱스의 복합체에 중점을 둡니다. 상호 작용 22,23,24,25,26. 정상 상태 액틴-미세소관 복합체는 단일 성분 시스템(27)에 비해 향상된 필라멘트 이동성 및 증가된 강성과 같은 창발적 기계적 특성(15,16,27)을 나타내는 것으로 나타났다. 시험관내 액토미오신 시스템에 대한 연구는 액틴, 미오신 및 가교결합제 28,29,30,31의 농도에 의존하는 광범위한 구조적 및 역학적 특성을 보고하였다. 예를 들어, 충분한 가교가 있는 경우 액토미오신 네트워크는 대규모 수축 및 조잡함 2,28,30,32,33,34,35,36을 겪는 반면, 가교결합이 없으면 네트워크는 빠르고 불안정한 흐름과 파열을 나타냅니다.19,29 . 키네신 모터 클러스터를 사용하여 미세소관 다발을 가교결합하고 당기는 재구성된 미세소관 기반 활성 네마틱스는 오래 지속되는 난류, 확장, 좌굴, 파쇄 및 치유를 나타내는 것으로 보고되었습니다. 12,22,23,24,25,37,38,39,40,41, 42,43,44,45,46,47.
보다 최근에, 미오신 II 미니-필라멘트에 의해 구동되는 액틴-미세소관 복합체는 가교결합제가 없는 액토미오신 네트워크가 17,26,48을 나타내는 무질서한 흐름 및 네트워크 파열에 비해 더 질서 있는 수축 및 네트워크 무결성을 유도하는 것으로 나타났다. 또한, 복합 견고성과 힘 생성의 조합은 액틴과 미세소관이 유사한 농도로 존재할 때 최적화됩니다. 제형 공간의 이 영역에서 주요 출현 특징은 향상된 기계적 강도(26), 액틴 및 미세소관(26)의 배위 운동(26), 꾸준한 지속 수축 및 메조스케일 재구성(17)을 포함한다.
여기에서는 각각 액틴 필라멘트와 미세소관에 작용하는 미오신 II 미니 필라멘트와 키네신 클러스터에 의해 평형 밖으로 밀려나는 미세소관과 액틴 필라멘트의 얽히고 가교된 복합체를 엔지니어링하고 조정하는 프로토콜이 설명됩니다(그림 1). 이 종류의 복합 재료의 역학, 구조 및 역학은 필라멘트, 모터 및 가교 결합기의 상대적 농도에 의해 조정되어 대류 및 난류 흐름, 등방성 수축, 가속, 감속, 탈혼합, 경화, 이완 및 파열. 이 연구의 초점은이 종류의 활성 세포 골격 복합체를 준비하고 조정하는 것입니다. 그러나 연구자가 설명된 활성 복합재를 벤치마킹하고 특성화하는 데 도움이 되도록 다중 스펙트럼 컨포칼 현미경을 사용하는 효과적인 이미징 방법도 자세히 설명합니다. 마지막으로 복합 재료의 역학, 구조 및 역학을 측정하는 데 사용할 수 있는 주요 계산 분석 방법의 결과를 제시합니다. 연구원들은 복합재 17,26,49의 복잡한 역학 및 구조적 다양성을 특성화하도록 최적화되었으므로 차동 동적 현미경(DDM), 공간 이미지 자기 상관(SIA) 및 입자 이미지 속도계(PIV)를 포함하는 이러한 방법을 채택하는 것이 좋습니다.
아래에 설명된 단계는 복합재를 준비하고 컨포칼 현미경을 사용하여 이미징하는 데 중점을 둡니다. 획득 후 데이터 분석 및 광학 핀셋 측정을 설명하는 프로토콜은 이전 작업 17,26,48,50에서 찾을 수 있으며 요청시 제공됩니다. 모든 자료는 제공된 자료표에 나열되어 있습니다.
프로토콜
1. 실란 처리 된 커버 슬립과 현미경 슬라이드를 준비하여 챔버 표면에 단백질이 흡착되는 것을 방지합니다.
참고: 이 과정은 2일입니다. 실란 화 된 슬라이드는 사용 1 개월 전에 준비 할 수 있습니다.
- 1번 커버슬립(24mm x 24mm)과 현미경 슬라이드(1인치 x 3인치)를 플라즈마 클리너에 맞는 지정된 랙에 놓습니다. 랙을 플라즈마 클리너에 넣고 20분 동안 실행합니다.
- 커버슬립과 슬라이드를 실란 전용으로 지정된 새 랙으로 옮기고 랙을 유리 용기에 넣어 아래 설명된 대로 안경을 청소합니다.
- 커버슬립과 슬라이드를 100% 아세톤에 1시간 동안 담그십시오. 커버 슬립과 슬라이드를 100 % 에탄올에 10 분 동안 담그십시오.
- 커버슬립과 슬라이드를 탈이온수(DI)에 5분 동안 담그십시오. 청소 단계를 두 번 더 반복하십시오.
- 커버슬립과 슬라이드를 새로 준비한 0.1M KOH에 15분 동안 담그십시오. 커버슬립과 슬라이드를 신선한 DI에 5분 동안 담그십시오. 이 단계를 두 번 더 반복합니다.
- 커버슬립과 슬라이드를 10분 동안 자연 건조합니다. 청소된 커버슬립과 슬라이드를 실란으로 처리하여 아래 설명된 대로 소수성 표면을 생성합니다.
알림: 흄 후드에서 다음 단계를 완료하십시오.- 건조된 커버슬립과 슬라이드를 2% 실란(톨루엔에 용해됨)에 5분 동안 담그십시오. 깔때기를 사용하여 실란을 지정된 병에 다시 부어 최대 5 번 재사용하십시오.
- 커버슬립과 슬라이드를 100% 에탄올에 5분 동안 담그십시오. 에탄올을 신선한 에탄올로 교체하십시오. 커버슬립과 슬라이드를 5분 동안 담그십시오.
- 커버슬립과 슬라이드를 신선한 DI에 5분 동안 담그십시오. 에탄올 및 DI 세척 단계를 매번 신선한 에탄올과 DI를 사용하여 2회 더 반복한다. 커버슬립과 슬라이드를 10분 동안 자연 건조합니다.
2. 미오신 미니 필라멘트에 의해 구동되는 활성 액틴-미세소관 복합체 제조
- 액틴 필라멘트 결합을 통해 비활성 미오신 을 제거하고 아래 설명된 대로 초원심분리 를 통해 풀다운을 수행합니다.
- 액틴을 필라멘트로 중합하십시오. 정밀 마이크로피펫과 멸균 피펫 팁을 사용하여 DI 1.87μL, 10x G 버퍼 1.3μL, 10x F-버퍼 1.3μL, 4M KCl 1.63μL, 액틴 4.53μL(47.6μM) 및 100μM 팔로이딘 1.08μL를 마이크로 원심분리 튜브에 결합합니다.
참고: 충분한 중합을 위해 액틴 농도와 액틴:팔로이딘 몰비는 각각 18.4μM 및 2:1이어야 합니다. - 용액을 위아래로 부드럽게 파이핑하여 혼합한 다음 어둠 속에서 얼음 위에 ≥1시간 동안 놓습니다. 초원심분리기를 4°C로 냉각합니다. -80 °C에서 미오신 분취량을 제거하고 얼음 위에 올려 놓으십시오.
알림: 액틴이 중합되는 동안이 시점에서 2.2 단계를 완료하십시오. - 액틴 중합 ≥1 시간 후, 10 mM ATP 1.3 μL 및 19 μM 미오신 2 μL를 중합 된 액틴에 첨가한다.
알림: 액틴:미오신 몰비는 비활성 미오신 모터(즉, 죽은 머리)를 충분히 제거하기 위해 >5여야 합니다. - 용액을 위아래로 부드럽게 파이핑하여 혼합합니다. 초원심분리기 등급 튜브로 옮깁니다.
4°C 및 121,968 x g 에서 30분 동안 원심분리합니다.
- 액틴을 필라멘트로 중합하십시오. 정밀 마이크로피펫과 멸균 피펫 팁을 사용하여 DI 1.87μL, 10x G 버퍼 1.3μL, 10x F-버퍼 1.3μL, 4M KCl 1.63μL, 액틴 4.53μL(47.6μM) 및 100μM 팔로이딘 1.08μL를 마이크로 원심분리 튜브에 결합합니다.
- 아래에 설명된 대로 액틴 필라멘트와 미세소관의 얽힌 복합 네트워크를 준비합니다.
알림: 미오신 스핀 다운 30 분 전에 시작하십시오 (2.1.4 단계).- 열 블록을 37°C로 설정합니다. 정밀 마이크로피펫과 멸균 피펫 팁을 사용하여 마이크로원심분리 튜브에 다음을 추가합니다: PEM 13.9μL, 1% 트윈20 3μL, 47.6μM 액틴 1.55μL, 34.8μM R-액틴 0.36μL, 250mM ATP 0.3μL, 100μM 팔로이딘 0.87μL, 5-488-튜불린 1.91μL, 100mM GTP 0.3μL, 및 0.75 μL의 200 μM 탁솔, 23 μL의 총 부피를 포함한다.
알림: 나열된 액틴과 튜불린의 농도는 2.9μM 액틴과 2.9μM 튜불린이 있는 복합체에 대한 것입니다. 총 단백질 농도는 c = ca + c T = 5.8 μM이고 몰 액틴 분획은ca / (ca + cT) = ΦA = 0.5입니다. 이러한 값을 조정하려면 2.5단계를 참조하십시오. - 용액을 위아래로 부드럽게 파이펫하여 혼합하고 빛으로부터 보호되는 37°C 열 블록에 1시간 동안 놓습니다.
- 열 블록을 37°C로 설정합니다. 정밀 마이크로피펫과 멸균 피펫 팁을 사용하여 마이크로원심분리 튜브에 다음을 추가합니다: PEM 13.9μL, 1% 트윈20 3μL, 47.6μM 액틴 1.55μL, 34.8μM R-액틴 0.36μL, 250mM ATP 0.3μL, 100μM 팔로이딘 0.87μL, 5-488-튜불린 1.91μL, 100mM GTP 0.3μL, 및 0.75 μL의 200 μM 탁솔, 23 μL의 총 부피를 포함한다.
- 아래 설명된 대로 컨포칼 이미징 실험을 위한 샘플 챔버를 준비합니다.
참고: 대기 기간 동안 2.1.4 및 2.2.2단계를 완료하십시오.- 두 개의 실란 화 된 슬라이드를 핫 플레이트 (꺼짐)에 나란히 놓고 슬라이드를 가로 질러 ~ 3mm 간격으로 열가소성 밀봉 필름 두 스트립을 놓고 열가소성 밀봉 필름 위에 두 개의 실란 처리 된 커버 슬립을 놓아 샘플 챔버를 형성합니다.
- 커버슬립이 녹은 열가소성 밀봉 필름이 있는 슬라이드에 단단히 결합될 때까지 핫 플레이트를 낮은 설정으로 돌립니다(~1-2분). 두 표면 사이에 ~100μm 간격을 유지하면서 접착을 보장하기 위해 균일한 압력으로 아래로 누릅니다.
- 챔버를 제거하고 핫 플레이트를 끕니다. 챔버에 (+) 및 (-)를 표시합니다. (+) 챔버는 활성 샘플(미오신 포함)용이고 (-) 챔버는 대조군(미오신 없음)입니다. 각 챔버가 ≤10μL의 유체를 수용할 수 있는지 확인합니다.
- 아래 설명된 대로 이미지를 만들 샘플을 준비합니다.
참고: 2.1 및 2.2단계를 완료한 직후에 이 단계를 완료하는 것이 중요합니다.- 초원심분리기(단계 2.1.4)에서 미오신 액틴 샘플을 조심스럽게 제거하고 즉시 상청액의 상단 7.5μL를 파이퍼팅하고 새로운 미세원심분리 튜브로 옮깁니다.
- 열 블록에서 액틴-미세소관 샘플을 제거하고 1.5μL의 10x D-포도당, 1.5μL의 10x GOC 및 1.5μL의 1mM 블레비스타틴을 부드럽게 혼합합니다. 용액을 두 개의 13.7 μL 분취량으로 나누고 (+) 및 (-)로 표시합니다.
- 단계 2.4.1의 상청액 1.28 μL를 (+) 분취량으로 혼합한다. 1.28 μL의 DI를 (-) 분취량에 혼합한다. 모세관 작용을 통해 각 용액을 해당 챔버로 천천히 흐르게합니다 (단계 2.3). 채널에 기포가 유입되지 않도록 주의하십시오.
- 속건성 에폭시 또는 UV 접착제로 각 채널의 두 열린 끝을 밀봉하십시오. 현미경에 놓기 전에 접착제가 완전히 건조되었는지 확인하십시오. 3단계에서 설명한 대로 즉시 이미지화합니다.
알림: UV 접착제는 UV 노출 시 거의 즉시 경화되기 때문에 유리합니다. 그러나 블레비스타틴은 UV에 민감하기 때문에 블레비스타틴이 비활성화되지 않도록 작은 UV 막대를 사용하여 접착제(샘플 챔버 가장자리)만 국부적으로 조명하는 것이 중요합니다.
- 선택 사항: 단백질 농도를 변경하여 복합 재료의 역학과 구조를 조정합니다.
알림: 다음 단계는 원하는 경우 액틴, 미세소관 및 미오신 농도를 변경하기 위해 위의 단계를 변경하는 것이 좋습니다.- 2.2.1 및 2.4.3단계에서 다음 수정 사항을 제외하고 위에서 설명한 단계를 따릅니다.
- 액틴 및 미세소관의 농도를 변화시키고, c 및 ΦA를 조정하고, 원하는 대로 단계 2.2.1에서 사용된 액틴, R-액틴 및 5-488-튜불린의 부피를 증가 또는 감소시킨다(26). 액틴 농도를 변경할 때 R- 액틴과 팔로 이딘 몰 농도를 비례 적으로 조정하여 액틴과 동일한 몰 비율을 유지하십시오. 혼합물의 최종 부피가 23μL로 유지되도록 PEM의 부피를 조정하십시오. 다른 모든 성분의 부피와 농도는 동일하게 유지됩니다.
- 미오신 농도를 변화시키려면, 단계 2.4.3에서 (+) 분취량에 첨가된 미오신의 부피를 원하는 대로 조정한다. 그에 따라 (-) 부분 표본에 추가된 DI 볼륨을 조정합니다. 2.2.1단계에서 PEM 부피를 조정하여 미오신 (+) 및 DI (-) 부피의 증가 또는 감소를 고려하여 각 샘플(+) 및 (-))의 최종 부피가 14.98μL가 되도록 합니다.
3. 컨포칼 현미경을 사용한 활성 복합재의 이미징 및 특성화
- 2단계에서 준비한 액토미오신-미세소관 복합체를 이미지화하려면 60x 1.4 NA 오일 이멀젼 대물렌즈가 있는 레이저 스캐닝 컨포칼 현미경(LSCM) 또는 유사한 현미경을 사용하십시오. 별도의 형광 채널에서 액틴 필라멘트와 미세소관을 동시에 시각화하려면 565/591nm 여기/방출 필터가 있는 561nm 레이저와 488/525nm 여기/방출 필터가 있는 488nm 레이저를 사용하십시오.
- 제어 채널이 대물렌즈 바로 위에 위치하도록 샘플 챔버를 현미경에 놓습니다. 대물렌즈와 커버슬립 사이에 오일 인터페이스가 있는지 확인하십시오.
- 스테이지 컨트롤을 사용하여 컨트롤 복합재에 초점을 맞춘 다음 샘플 챔버의 양쪽 표면을 찾습니다. z 위치를 샘플 챔버의 중앙으로 이동합니다. 그림 2와 같이 명확한 필라멘트 네트워크가 있는지 확인합니다.
- 제어 챔버를 시각화하면서 각 레이저의 강도를 조정하여 액틴 필라멘트와 미세 소관을 동시에 시각화 할 수 있습니다. 광퇴색(액틴 채널에서 더 많이 발생)과 출혈(일반적으로 미세소관에서 액틴 채널로)을 방지하기 위해 가능한 가장 낮은 레이저 강도를 유지합니다.
- 비활성 대조군 샘플을 특성화하려면 총 ≥1000프레임에 대해 2.65fps에서 256 x 256제곱픽셀(213μm x 213μm) 이미지의 시계열(비디오) 3개를 수집합니다. ≥500 μm로 분리된 샘플 챔버의 다른 영역에서 각 시계열을 수집합니다. 감지 가능한 움직임이 최소화되고 흐름이나 구조 조정이 없는지 확인합니다.
- 488nm 레이저를 셔터로 끄고 스테이지 컨트롤을 사용하여 (+) 챔버로 이동합니다.
- 568nm 레이저를 사용하여 (+) 채널의 미세소관을 시각화하여 적절한 네트워크 형성을 보장하고(그림 2) 샘플 챔버의 축 중심(제어 챔버의 중심 z 위치와 다를 수 있음)을 식별합니다.
- 488nm 레이저를 켜고 위의 3.5단계를 반복하여 다음과 같이 수정합니다. 최대 45분 동안 시계열을 수집하여 샘플이 시야를 벗어나거나 파열되거나 광표백되면 수집을 중지합니다. 5-10개의 시계열을 기록하고 첫 번째 시계열의 시작을 기준으로 각 시계열이 시작되는 시간을 추적합니다.
- 그림 3, 그림 4, 그림 5 및 이전17,48,50,51에 설명된 대로 DDM, SIA 및 PIV를 사용하여 데이터를 분석합니다.
참고: 488nm 레이저는 블레비스타틴을 비활성화하여 미오신 ATPase 활성을 국부적으로 활성화하므로 t = 0이 시계열의 시작 부분에 있도록 데이터 수집 시작 시에만 켜야 합니다. 이러한 획득 파라미터는 이전에 수행된 바와 같이 시차 동적 현미경(DDM) 분석에 최적화되어 있습니다(26).
4. 키네신 모터에 의해 구동되는 활성 액틴-미세소관 복합재의 제조
참고: 다음 단계는 키네신 모터 또는 키네신과 미오신50의 조합에 의해 평형을 벗어나는 액틴-미세소관 복합체를 생성합니다.
- 아래 설명 된대로 키네신 및 미오신 모터를 준비하십시오.
- 미오신을 포함하는 경우 2.1단계를 따르십시오.
- 한 쌍의 미세소관 사이에 결합하고 힘을 가하는 키네신 모터 클러스터를 형성하려면 마이크로피펫과 멸균 피펫 팁을 사용하여 멸균 1.5mL 미세원심분리 튜브에 다음을 추가합니다: 1.16 μL PEM, 2.74 μL 8.87 μM 키네신 이량체, 7.29 μL 83.3 μM 뉴트라비딘, 0.81 μL 2mM DTT . 용액을 위아래로 피펫팅하여 부드럽게 혼합하고 4°C에서 30분 동안 빛으로부터 보호(검은색 미세 원심분리기 튜브 사용 또는 호일로 싸서 사용)합니다.
참고: 키네신 이량체와 NA의 몰비는 1:25입니다.
- 2.3 단계에 따라 샘플 챔버를 준비하고 2 개가 아닌 3 개의 챔버를 만듭니다. 키네신 배양(단계 4.1.2) 및 미오신 초원심분리(단계 4.1.1) 동안 이 단계를 수행한다.
- 액틴 필라멘트와 미세 소관의 얽힌 복합 네트워크를 준비하십시오.
- 열 블록을 37 ° C로 설정하십시오. 마이크로피펫과 멸균 피펫 팁을 사용하여 멸균 1.5mL 마이크로원심분리 튜브에 PEM 3.21μL, 1% 트윈20 4.5μL, 47.6μM 액틴 2.18μL, 5-R-튜불린 3.46μL, 100mM ATP 4.5μL, 10mM GTP 4.5μL, 200μM 탁솔 1.13μL, 20μM 488-팔로이딘 1.57μL를 추가합니다. 총 부피가 25μL인지 확인합니다.
- 용액을 위아래로 부드럽게 파이펫하여 혼합하고 빛으로부터 보호되는 37°C 열 블록에 1시간 동안 놓습니다. 열 블록에서 튜브를 제거하고 마이크로피펫을 사용하여 0.84μL의 100μM 팔로이딘을 부드럽게 혼합합니다. 빛으로부터 보호되는 실온에서 5-10 분 동안 배양하십시오.
참고: 4.3.1단계가 아닌 이 단계에서 팔로이딘을 추가하면 488-팔로이딘이 액틴 결합 부위에 대해 표지되지 않은 팔로이딘과 경쟁할 필요가 없기 때문에 액틴 필라멘트의 형광 표지가 향상됩니다.
- 컨포칼 이미징을 위한 활성 복합재를 준비합니다.
- 4.3.2단계의 용액에 200μM 블레비스타틴 1.13μL, 10x Glu 1.35μL, 10x GOC 1.35μL를 넣고 위아래로 피펫팅하여 부드럽게 혼합합니다. 용액을 3개의 10μL 분취량으로 나누고 (K), (K+M) 및 (-)로 라벨을 붙입니다.
- 2.1.4단계의 미오신 2.54μL를 (K+M) 분취량에 혼합합니다. 2.54 μL PEM을 (K) 및 (-) 분취량에 혼합합니다.
- 마이크로피펫과 멸균 피펫 팁을 사용하여 4.1.2단계의 키네신 클러스터 2.5μL를 (K) 및 (K+M) 분취량에 추가합니다. 위아래로 피펫하여 혼합합니다. 동일한 기술을 사용하여 2.5 μL PEM에서 (-)로 혼합합니다.
참고: 나열된 액틴과 튜불린의 농도는 2.32μM 액틴과 3.48μM 튜불린이 있는 복합체에 대한 것입니다. 총 단백질 농도는 c = ca + c T = 5.8 μM이고 몰 액틴 분획은ca / (ca + cT) = ΦA = 0.4입니다. 키네신 및 미오신 농도는 각각 0.35 μM 및 0.47 μM이다. ca, ct, c 및 ΦA를 조정하기 위한 일반 지침은 2.5단계를 참조하십시오. - 마이크로피펫을 사용하여 모세관 작용을 통해 준비된 샘플 챔버의 해당 채널(단계 4.2)로 각 용액을 천천히 흐릅니다. 채널에 기포가 유입되지 않도록 피펫을 매우 천천히 부드럽게 누릅니다.
- 속건성 에폭시 또는 UV 경화 접착제로 각 채널의 두 열린 끝을 밀봉하십시오. 현미경에 놓기 전에 접착제가 완전히 건조되었는지 확인하십시오.
알림: 키네신이 모니터링되지 않고 작용하는 시간을 최소화하기 위해 이 단계를 신속하게 수행하는 것이 중요합니다. 이러한 이유로 1 분 (5 분 또는 10 분이 아닌)에 경화되는 에폭시를 권장합니다. UV 경화형 접착제는 UV 노출 시 거의 즉시 경화되기 때문에 이와 관련하여 유리합니다.
- 이미지는 다음과 같은 중요한 수정을 제외하고 3단계에 따라 즉시 샘플을 준비했습니다. kinesin은 광 활성화에 의해 제어되지 않기 때문에 4.4.3 단계 직후에 작동하기 시작하므로이 시간을 t = 0으로 표시하십시오. 컴포지트를 가능한 한 초기 비활성 상태(t = 0)에 가깝게 이미지화하려면 먼저 (K) 및 (K+M) 채널을 이미징하고 4.4.3단계와 데이터 수집 시작 사이에 경과된 시간을 기록합니다(3.8단계). 실제로이 경과 시간은 ~ 5 분입니다.
5. 수동 가교제를 활성 복합재에 통합
참고: 이 단계에서는 4단계에 설명된 활성 복합체에서 액틴을 액틴(A-A)으로 또는 미세소관을 미세소관(M-M)에 수동적으로 가교하기 위해 비오틴화된 액틴 및 튜불린 소단위체와 NeutrAvidin(NA)을 사용하는 방법을 설명합니다.
- 비오틴-액틴/튜불린:비오틴:NA의 비율로 비오틴화 단백질(비오틴-액틴 또는 비오틴-튜불린), NA 및 비오틴과 함께 A-A 또는 M-M 가교제 복합체를 준비합니다. 4단계 전에 이 프로세스를 시작합니다.
- A-A 가교제의 경우 마이크로피펫과 멸균 피펫 팁을 사용하여 2μL의 11.6μM 비오틴-액틴, 1.39μL의 8.33μM NA, 2.27μL의 1.02μM 비오틴 및 4.34μL의 PEM을 미세 원심분리 튜브에 추가합니다. 위아래로 피펫팅하여 부드럽게 섞습니다.
- M-M 가교결합제의 경우 마이크로피펫과 멸균 피펫 팁을 사용하여 1.86μL의 4.55μM 비오틴-튜불린, 1.11μL의 8.33μM NA, 1.82μL의 1.02μM 비오틴 및 5.21μL의 PEM을 미세 원심분리 튜브에 추가합니다. 위아래로 피펫팅하여 부드럽게 섞습니다.
- 5.1.1단계 및/또는 5.1.2단계의 튜브를 열가소성 밀봉 필름으로 감싸 방수 밀봉을 만듭니다. 4°C로 설정된 온도 제어 초음파 처리기 수조에서 부유 선광 뗏목에 넣습니다.
- 4 °C에서 90 분 동안 초음파 처리하십시오. 실제로 초음파 처리기를 차가운 방에 넣고 저온을 유지하기 위해 초음파 처리 욕조에 얼음 팩을 추가하는 것이 가장 좋습니다.
- 이미징을 위해 가교결합 복합체를 샘플에 통합하려면 A-A 가교결합(단계 5.2.1) 또는 M-M 가교결합(단계 5.2.2)에 대해 아래에 설명된 대로 단계 4.3.1을 수정하여 단계 4.3을 수행합니다.
- A-A 가교결합의 경우, 다음을 마이크로원심분리 튜브에 결합한다: PEM 1.94μL, 1% Tween20 4.50μL, 47.6μM 액틴 2.18μL, 45.5μM 5-R-튜불린 3.46μL, A-A 가교결합제 1.13μL(단계 5.1.1), 100mM ATP 4.50μL, 10mM GTP 4.50μL, 200μM 탁솔 1.13μL, 및 1.57 μL의 20 μM 488-팔로이딘. 총 부피가 25μL인지 확인합니다.
- M-M 가교결합의 경우, 다음을 마이크로 원심분리 튜브에 결합한다: 1.97 μL의 PEM, 4.50 μL의 1% Tween20, 2.18 μL의 47.6 μM 액틴, 3.76 μL의 45.5 μM 5-R-튜불린, 1.13 μL의 1:4 M-M 가교결합제 희석(단계 5.1.2), 4.50 μL의 100 mM ATP, 4.50 μL의 10 mM GTP, 1.13 μL의 200 μM 탁솔, 및 1.57 μL의 20 μM 488-팔로이딘. 총 부피가 25μL인지 확인합니다.
- 가교결합제:액틴 몰비 RA = 0.02 및 가교결합제:튜불린 몰비 RT = 0.005에 대한 특정 농도로 4.3.2-4.5단계를 수행합니다. 이들RA 및 RT 값은 액틴 필라멘트 및 미세소관을 따라 가교결합제 사이의 유사한 길이를 초래하며(dA 60 nm 및 d MT 67 nm), dA = I 단량체/2RA
 를 사용하여 추정되며, 여기서 I 단량체는 액틴단량체의 길이이고, dMT
를 사용하여 추정되며, 여기서 I 단량체는 액틴단량체의 길이이고, dMT  = I 고리/26RT, 여기서 I 고리는 13개의 튜불린15의고리의 길이이고, 17.
= I 고리/26RT, 여기서 I 고리는 13개의 튜불린15의고리의 길이이고, 17.
결과
활성 복합재의 성공적인 준비를 결정하고(그림 1) 그 역학 및 구조를 특성화하기 위해 최소 2개의 형광 채널이 있는 레이저 주사 형광 현미경을 사용하여 액틴 필라멘트와 미세소관을 동시에 시각화합니다(그림 2 및 그림 6). 복합 재료의 모든 액틴 필라멘트와 미세 소관은 시험관 내 연구에서 종종 수행되는 것처럼 추적자 밝은 필라멘트에서 도핑하는 대신 드물게 표지됩니다. 이 방법은 측정된 역학 및 구조가 복합재와 다른 조건에서 형성된 트레이서가 아닌 복합재 자체를 대표하도록 합니다. 이러한 이유로 개별 액틴 필라멘트와 미세소관은 일반적으로 분해할 수 없으며 이미지는 메조스케일 네트워크 구조를 묘사합니다(그림 2 및 그림 6).
이 라벨링 접근법은 상호 푸리에 공간 (그림 4, 그림 5 및 그림 8) 52,53,54,55에서 역학 및 구조를 검사하는 공간 이미지 자기 상관 (SIA) 및 차동 동적 현미경 (DDM) 분석에 최적화되었습니다. 입자 이미지 속도계(PIV)는 역학 및 유동장(그림 3 및 그림 7)을 묘사하고 특성화하는 데에도 사용할 수 있지만, 밀도가 높은 저신호 이미지의 노이즈로 인해 발생하는 잘못된 벡터를 제거하려면 SIA 및 DDM보다 픽셀 비닝(낮은 공간 분해능)과 더 큰 지연 시간 증가(낮은 시간 분해능)가 필요합니다. 그럼에도 불구하고 PIV는 유동장의 정성적 검사와 DDM 결과의 확증에 권장됩니다(그림 4 및 그림 8)26,50.
이러한 분석(즉, DDM, SIA, PIV)을 사용하여 설명된 네트워크의 샘플 특성화는 연구자가 샘플을 벤치마킹하고 특성화하기 위해 유사한 분석을 채택하는 데 도움이 되도록 제공됩니다. 그러나 이러한 기술에 대한 자세한 설명은 이 작업의 범위를 벗어납니다. 사용자 친화적인 Python 코드를 포함하여 이러한 시스템 및 기타 유사한 시스템에서 DDM을 수행하는 방법에 대한 자세한 설명은 이전 작업 17,26,49,50 및 그 안의 참조를 참조하십시오. 여기에 설명 된 시스템에서 SIA 및 PIV를 수행하는 방법에 대한 자세한 내용은 독자는 이전 작업17,50으로 이동합니다.
복합재가 예상대로 작동하는지 확인하기 위해 아래에 설명된 몇 가지 컨트롤을 수행해야 합니다. 미오신 또는 키네신이 없는 복합재는 최소한의 열 변동이나 드리프트로 본질적으로 정적으로 보여야 합니다. 액틴 필라멘트와 미세소관은 ~200μm x 200μm의 시야 전체에서 액틴과 미세소관의 묶음, 응집 또는 상 분리를 최소화하면서 함께 얽히고 균일하게 분포된 것처럼 보여야 합니다(그림 2, 맨 왼쪽)17. 미오신을 함유하고 있지만 488nm 빛에 노출되지 않은 복합 재료 (블레 비 스타틴을 비활성화하기 위해)에 대해서도 유사한 결과를 기대해야합니다.
미오신이 통합되고 488nm 빛에 노출되면 복합 재료는 미오신 활동 전후에 찍은 현미경 이미지(그림 2)와 활동 중 다양한 시간에 대한 해당 PIV 유동장(그림 3)에서 볼 수 있듯이 액틴 및 미세소관에 대해 대체로 등방성이고 유사한 수축을 겪습니다. 운동이 탄도, 확산, 아 확산 등인지 확인하기 위해 DDM에서 결정된 특성 비 상관 시간 τ (q)는 파동 벡터 (즉, 역수 공간)의 함수로 평가됩니다. 앞서 17,26,49에서 상세히 설명한 바와 같이 참조한다. 그림 4는 또한 DDM을 사용하여 이러한 복합재를 특성화하는 방법을 보여줍니다. 멱법칙 스케일링 τ(q)~1/vqβ, β = 1인 경우 속도 v의 탄도 운동을 나타냅니다. 참고로 β = 2는 v가 확산 계수인 확산 역학을 나타냅니다. 모든 활성 복합 재료는 액틴과 미오신 (그림 4B)의 농도에 의해 조정되는 속도로 탄도 스케일링 (그림 4A)을 나타내며 활동 중 가속 또는 감속 (그림 4C, D) 시간에 따라 달라질 수 있습니다.
도 2에서 볼 수 있고 더 높은 액틴 및 미오신 농도에 대해 더 분명한 네트워크 구조 조정 및 클러스터링은 도 5에 도시된 바와 같이 SIA를 사용하여 특성화할 수 있으며 이전에 17,48,50에서 설명하였다. 간단히 말해서, 이미지에서 특징의 특성 크기를 측정 한 상관 길이 ξ는 각 공간 강도 자기 상관 곡선 g (r)을 픽셀 사이의 거리 r의 지수 함수에 피팅하여 결정할 수 있습니다. 더 먼 거리에서 지속되는 더 큰 g(r) 피크는 더 큰 구조적 특징(즉, 개별 필라멘트의 번들링, 클러스터링)을 나타냅니다. 그림 5에서 볼 수 있듯이 액틴 분획 및 미오신 농도가 높을수록 상당한 구조 조정 및 응집이 시간 경과에 따른 ξ의 증가에 반영됩니다.
활성 복합재의 점탄성 특성 및 비선형 기계적 반응은 광학 핀셋 미세 유변학(OTM)을 사용하여 측정할 수도 있습니다. 그러나 이러한 실험에 대한 프로토콜 및 대표 결과는이 작업의 범위를 벗어납니다. 관심있는 독자는 OTM 측정을 수행하는 방법과 예상 결과를 철저히 설명하는 이전 작업48,56을 참조합니다.
위에서 설명한 것과 동일한 실험 및 분석 도구 프로그램을 사용하여 다음 섹션에서는 키네신 모터와 비오틴-NA 가교제가 복합 재료에 통합될 때 역학 및 구조가 어떻게 변하는지 설명합니다(그림 6, 그림 7 및 그림 8). 그림 6은 액틴 필라멘트 또는 미세소관의 수동 가교(XL) 유무에 관계없이 키네신 전용(K) 또는 키네신 및 미오신 (K+M)에 의해 구동되는 복합재의 대표적인 컨포칼 이미지를 보여줍니다.
키네신을 복합재에 통합하면 처음에 그림 7(클래스 1)의 맨 윗줄에서 볼 수 있듯이 미오신 구동 복합재와 유사한 역학 및 구조 조정이 발생합니다. 그러나 역학은 일반적으로 대규모 이방성 흐름(그림 7 중간 행, 클래스 2), 가속 및 감속(그림 7 맨 아래 줄, 클래스 3)으로 전환됩니다. 이러한 특성은 5-30분 후에 메조스케일 클러스터링 및 집계와 결합됩니다(그림 6 및 그림 8B). 그림 7에 표시된 PIV 생성 흐름 필드 및 시간 색상 맵은 등방성 구조 조정 (클래스 1, 상단 패널), 방향 흐름 (클래스 2, 중간 패널) 및 양방향 가속 (클래스 3, 하단 패널)의 예를 보여줍니다.
τ(q) 곡선에 대한 피팅을 통해 결정된 활동 중 다양한 시점에서 액틴 및 미세소관의 속도는 가교에 따른 가속 후 감속을 보여줍니다(그림 8). 그림 8에서 볼 수 있듯이 두 모터 단백질이 통합되면 역학은 실제로 키네신 전용 복합체보다 느리고 메조 스케일 흐름의 시작이 지연됩니다. Myosin은 또한 활동 기간 동안 액틴과 미세 소관 네트워크의보다 균일 한 상호 침투뿐만 아니라 응집 및 구조 조정을 줄입니다. 이러한 효과는 그림 6의 이미지에서 볼 수 있으며 SIA를 통해 계산 된 시간에 따라 변하는 상관 길이로 정량화되며, 이는 일반적으로 미오신이있는 경우 더 작습니다 (그림 8B).
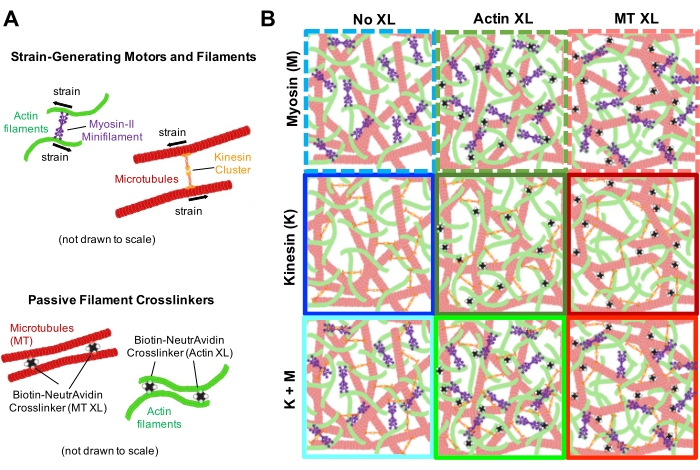
그림 1. 여러 개의 힘 발생 모터와 수동 가교제를 사용하는 능동 액틴-미세소관 복합재의 설계 및 특성화. (A) 액틴 단량체 및 튜불린 이량 체는 0.73-11.6 μM의 몰 농도 ca 및 c T와 액틴 Φ A = c A / (ca+ c T) = 0, 0.25, 0.5, 0.75 및 1의 몰 분율에서 공동 중합되어 액틴 필라멘트 (녹색) 및 미세 소관 (적색)의 공동 얽힘 네트워크를 형성합니다. 수동 가교는 NA를 사용하여 비오틴화 액틴 필라멘트 (액틴 XL) 또는 미세 소관 (MT XL)을 가교 결합제 : 액틴 및 미세 소관에 대해 각각 RA = 0.01-0.08 및 RMT= 0.001-0.01의 단백질 몰비로 연결합니다. 미오신 -II 미니 필라멘트 (보라색) 및 키네신 클러스터 (주황색)는 c M = 0.12 - 0.48 μM 및 cK = 0.2 - 0.7 μM의 농도에서 필라멘트를 밀고 당겨 복합 재료를 정상 상태에서 몰아냅니다. (B) 제형 공간의 개략도. 미오신 II 미니 필라멘트(M), 키네신 클러스터(K) 또는 두 모터(K+M)는 수동 가교제(XL 없음), 액틴-액틴 가교결합(액틴 XL) 및 미세소관-미세소관 가교결합(MT XL)이 없는 복합재에 통합됩니다. 모든 만화는 규모에 맞게 그려지지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
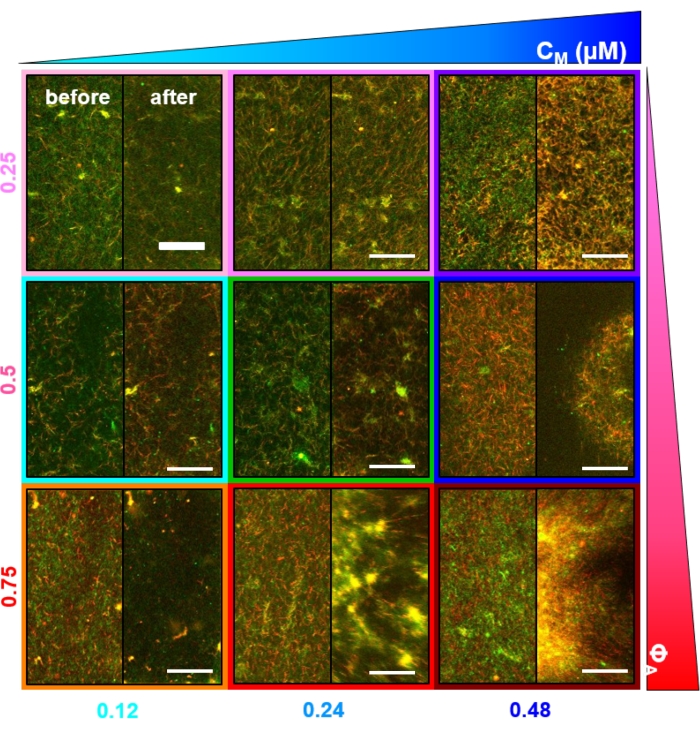
그림 2. 다양한 미오신 농도 cM 및 몰 액틴 분획 ΦA를 갖는 미오신 구동 세포 골격 복합체의 2 색 컨포칼 이미징. (A) 256 x 128 정사각형 픽셀 (212 x 106 μm 2)2색 컨포칼 현미경 이미지는 액틴 필라멘트(녹색)와 미세소관(빨간색)의 합성물이 미오신 운동 활동을 통해 어떻게 재배열되는지 보여줍니다. 키네신 모터 또는 수동 가교제가 없습니다. 각 패널에는 45분 미오신 활성화(블레비스타틴을 비활성화하기 위해 488nm 광으로 조명을 통해)의 시작(왼쪽, 전)과 끝(오른쪽, 후)에 촬영된 이미지가 표시됩니다. 패널은 왼쪽에서 오른쪽으로 이동하는 미오신 (cm)의 몰 농도를 증가시키고 위에서 아래로 이동하는 액틴의 몰 분율 (ΦA)을 증가시켜 정렬됩니다. 각 패널의 윤곽선을 그리는 색은 그림 4와 그림 5에 사용된 색 구분과 일치합니다. 스케일 바는 50μM입니다. 분석을 위한 역학 및 구조를 가장 잘 캡처하기 위해 수축 및 재배열 속도에 따라 1-5fps의 프레임 속도, 50-250μm 측면의 ROI, 5-45분의 시계열 지속 시간을 사용합니다. 전후 이미지가 비슷하게 보이는 패널은 분홍색, 자홍색 및 청록색 패널에서 볼 수 있듯이 최소한의 구조 조정을 나타냅니다. 증가된 이질성과 밝은 점상 특징의 존재로 입증되는 소규모 클러스터링은 주황색, 녹색 및 빨간색 패널에서 볼 수 있습니다. 균일하게 축소되는 네트워크로 보이는 대규모 수축은 파란색과 보라색 패널에서 분명합니다. 이 그림은 참고자료17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
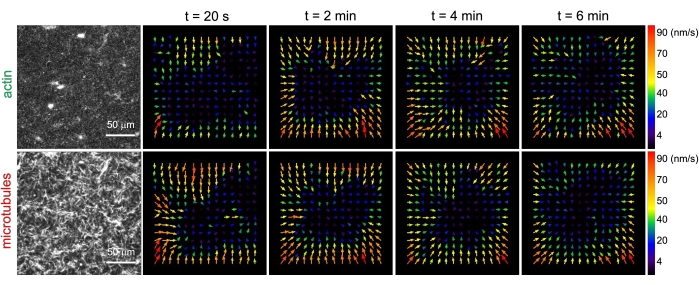
그림 3. 입자 이미지 속도계(PIV)는 액토미오신 활성이 함께 얽힌 복합체에서 액틴과 미세소관의 조정된 수축 역학을 유발한다는 것을 보여줍니다. 6분 시계열 동안 증가하는 시간에 (ΦA, cm) = (0.5, 0.24)인 미오신 구동 복합체의 액틴(맨 위 행) 및 미세소관(맨 아래 줄)에 대한 PIV 유동장. 플로우 필드는 피지/ImageJ PIV 플러그인을 사용하여 20초의 지연 시간과 2픽셀 x 2픽셀 비닝을 사용하여 생성되었습니다. 액틴과 미세소관 모두 영화 지속 시간 동안 시야의 중앙 영역을 향한 일관된 움직임을 보여줍니다. 모든 이미지의 스케일 바는 50μm입니다. 다른 화살표 색상은 벡터 필드의 오른쪽에 있는 색상 눈금에 표시된 대로 다른 속도에 해당합니다. 이 그림은 참고자료26에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
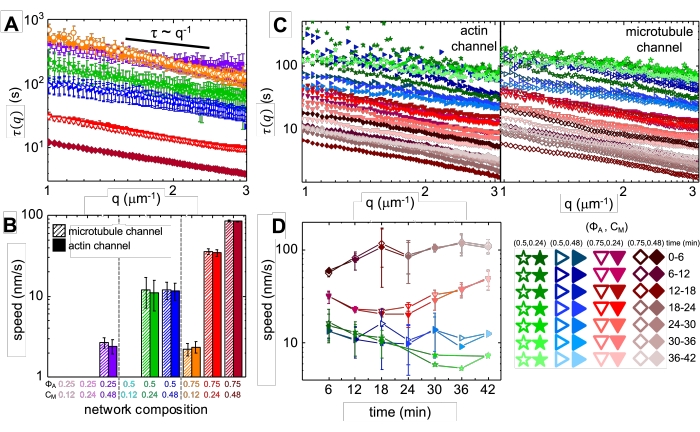
그림 4. 시간 분해능 시차 동적 현미경(DDM)은 활성 복합재에서 액틴 및 미세소관의 운동 속도와 유형을 측정합니다. (A) DDM은 시계열의 미세 소관 (상단, 개방 기호) 및 액틴 (하단, 채워진 기호) 채널에서 수행되어 앞서 설명한 바와 같이 액틴 (채워진 기호) 및 미세 소관 (열린 기호) 모두에 대해 특성 붕괴 시간 τ 대 파수 q를 결정합니다17,26. 모든 곡선은 τ ~ q-1 스케일링을 따르며 탄도 운동을 나타내며 속도 v는 τ(q) = (vq)-1에 대한 피팅을 통해 결정됩니다. 더 빠른 속도는 주어진 q에 대해 더 작은 τ(q) 값에 해당합니다. 기호 색상과 모양은 B에 표시된 (Φ A, cm) 조합에 해당합니다. (B) 수축 속도 v는 A에 표시된 τ(q) 곡선에 대한 피팅을 통해 결정되며, 이는 각 45분 시계열 기간 동안 모든 지연 시간에 대해 평균됩니다. (C) 시간 분해 DDM (trDDM)은 45 분 활성화 시간 동안 연속 6 분 간격 (동일한 색상의 다른 음영으로 표시됨) 동안 액틴 (채워진 기호, 왼쪽) 및 미세 소관 (열린 기호, 오른쪽)에 대한 τ (q)를 평가하여 역학이 시간에 따라 어떻게 변하는 지 정량화합니다. trDDM은 오른쪽 하단의 범례에 설명된 대로 각 (ΦA, cm) 조합(다른 기호 및 색상으로 표시됨)에 대해 수행됩니다. C에 표시된 τ(q) 곡선은 A와 유사한 스케일링 및 추세를 따르지만 특정(ΦA, cm) 조성, 특히 ΦA= 0.75에 대해서도 시간 의존성을 보여줍니다. (D) 액틴 필라멘트 (닫힌 기호) 및 미세 소관 (열린 기호)의 수축 속도는 해당 τ (q) 곡선에 대한 피팅에서 결정됩니다. 모든 그림의 오차 막대는 3-5번의 반복실험에 걸친 값의 표준 오차를 나타냅니다. 이 그림은 참고자료17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
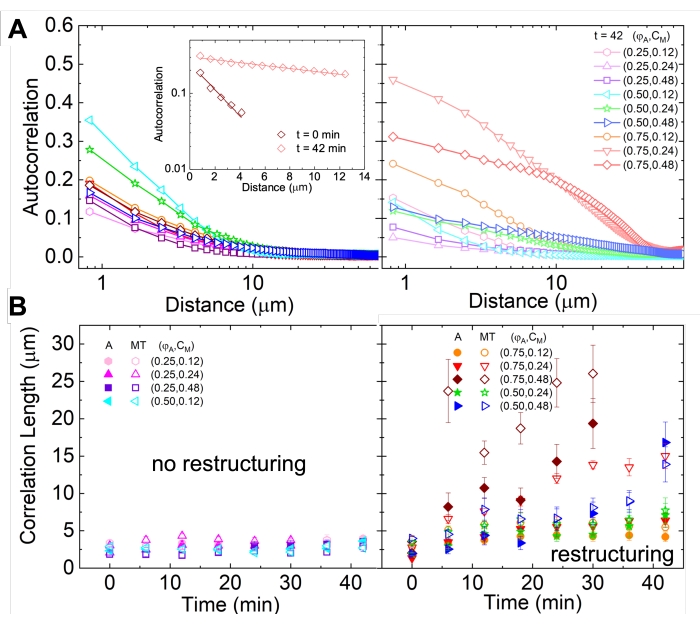
그림 5. 공간 이미지 자기 상관 (SIA) 분석은 활성 세포 골격 복합체의 모터 구동 구조 조정을 정량화합니다. (A) 범례에 나열된 (ΦA, cm) 제형에 대한 실험의 시작 (왼쪽, t = 0 분, 어두운 음영)과 끝 (오른쪽, t = 42 분, 밝은 음영)의 미세 소관에 대한 자기 상관 g (r). 삽입 : (ΦA, cm) = (0.75, 0.12)에 대한 초기 및 최종 시간에 대한 데이터 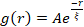 피팅의 예입니다. (B) A의 삽입물에 표시된 것처럼 각 g(r) 곡선의 지수 피팅을 통해 결정된 각각(ΦA, cm)에 대한 액틴(닫힌 기호) 및 미세소관(열린 기호)에 대한 평균 상관 길이 ξ. 데이터는 최소(왼쪽) 대 실질적(오른쪽) 구조 조정을 나타내는 데이터로 나뉩니다. A와 B의 오차 막대는 3-5번의 반복실험에 걸친 표준 오차를 나타냅니다. 이 그림은 참고자료17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
피팅의 예입니다. (B) A의 삽입물에 표시된 것처럼 각 g(r) 곡선의 지수 피팅을 통해 결정된 각각(ΦA, cm)에 대한 액틴(닫힌 기호) 및 미세소관(열린 기호)에 대한 평균 상관 길이 ξ. 데이터는 최소(왼쪽) 대 실질적(오른쪽) 구조 조정을 나타내는 데이터로 나뉩니다. A와 B의 오차 막대는 3-5번의 반복실험에 걸친 표준 오차를 나타냅니다. 이 그림은 참고자료17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
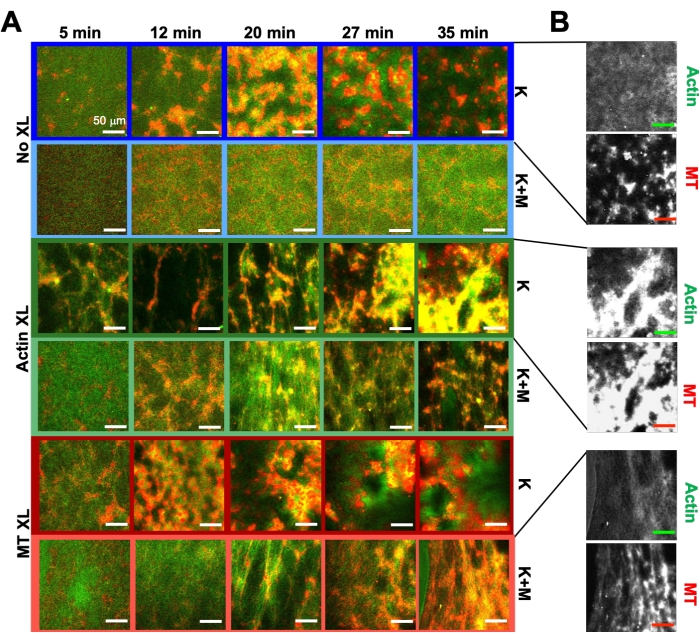
그림 6. 키네신 모터와 수동 가교제를 능동 복합재에 통합하여 프로그래밍 가능성을 높이고 역학 및 구조의 위상 공간을 확장합니다. (A) 활성 복합재에서 액틴(녹색)과 미세소관(빨간색)의 2색 컨포칼 이미지는 시간이 지남에 따라 복잡한 제형 의존적 구조 조정을 보여줍니다(최소 나열). 각 행의 5개 이미지는 키네신(K, 행 1, 3, 5) 또는 키네신과 미오신 (K+M, 행 2, 4, 6)에 의해 구동되는 합성물에 대해 획득한 2000프레임 시계열의 5개 프레임에 해당하며, 수동 가교결합이 없음(No XL, 행 1, 2), 액틴-액틴 가교결합(Actin XL, 행 3, 4) 또는 미세소관-미세소관 가교결합(MT XL, 행 5, 6). 스케일 바는 모두 50 μm입니다. 윤곽선 색상은 그림 8의 색 구성표와 일치합니다. (B) 키네신 전용 복합체에 대한 별도의 액틴 및 미세소관 형광 채널은 액틴-MT 공동 국소화 및 미세상 분리 모두에서 다양한 구조를 보여줍니다. 표시된 이미지는 ca= 2.32μM, cT= 3.48μM, cK = 0.35μM, cm= 0.47μM(행 2, 4, 6), RA= 0.02(행 3, 4) 및 RMT = 0.005(행 5, 6)인 복합재에 대한 것입니다. 모든 복합 재료는 액틴과 미세 소관의 균일하게 분포 된 상호 침투 네트워크로 시작합니다 (열 1). 가교결합제가 없는 Kinesin 구동 복합재(행 1)는 MT가 풍부한 느슨하게 연결된 비정질 클러스터를 형성합니다. Actin은 처음에는 이러한 응집체의 중심에 공동 국소화되지만 계속해서 수축하고 서로 분리되는 MT가 풍부한 지역에서 압착됩니다. 액틴-액틴 가교결합(3행)은 이러한 마이크로 스케일 액틴-MT 분리를 방해하며, 대신 MT가 풍부한 응집체는 긴 액틴 가닥을 통해 연결됩니다. 액틴 가교는 또한 MT가 풍부한 영역으로 액틴을 느리게 흡수하여 복합체가 공동 국소화 된 액틴 및 MT 클러스터의 연결된 네트워크가되도록합니다. 미세소관 가교결합(행 5)은 시간이 지남에 따라 병합되는 MT의 비정질 클러스터링으로 이어져 액틴과 MT의 더 큰 규모의 상 분리를 초래합니다. 미오신 (행 2, 4, 6)을 추가하면 키네신 구동 탈혼합 및 구조 조정이 줄어듭니다. 가교제가 없는 경우(2행), 복합재는 몇 시간 동안 재배열이 거의 없습니다. 가교는 액틴과 미세 소관의 구조 조정 및 공동 국소화를 증가시킵니다 (행 4, 6). 특히, 미세소관이 가교결합될 때(행 6), 웹과 같은 섬유 네트워크로의 상당한 상호 침투 및 재구성이 있습니다. 이 그림은 참고자료50에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
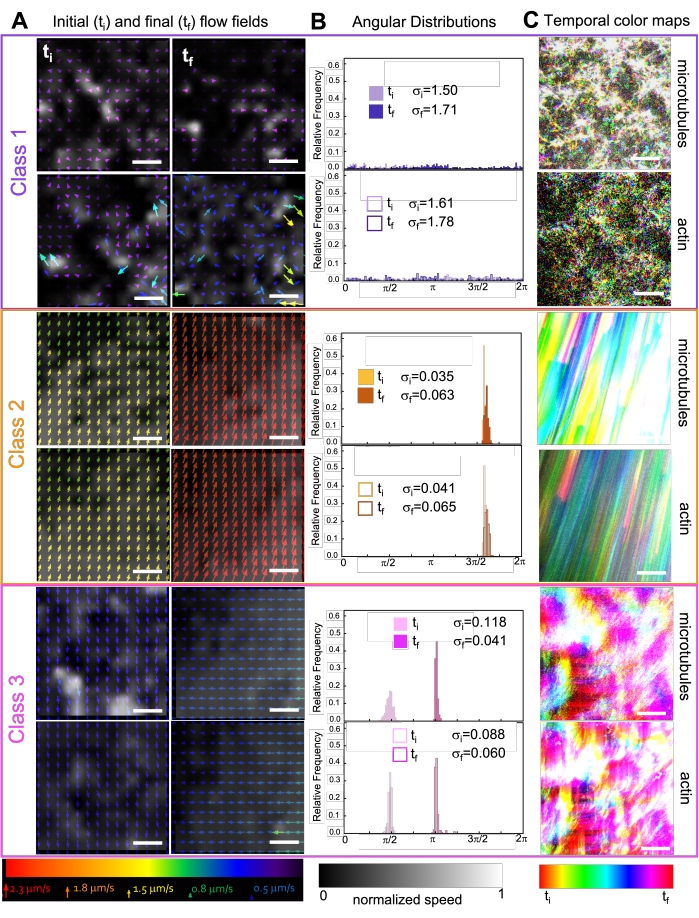
그림 7. PIV는 활성 복합 재료가 시공간적으로 구별되는 유동장의 세 가지 클래스를 나타낸다는 것을 보여줍니다. (a) 3개의 대표적인 시계열의 첫 번째(ti) 및 마지막(cf) 프레임에 대한 PIV 유동 필드는, 도 6에 도시된 합성물이 나타내는 상이한 동적 클래스를 나타낸다. 클래스 1(상단, 보라색), 클래스 2(중간, 주황색) 및 클래스 3(하단, 마젠타색)에 대한 미세소관(상단) 및 액틴(하단)에 대한 PIV 흐름 필드(하단에는 범용 속도 눈금에 해당하는 화살표 색상이 있고, 하단에 표시된 스케일에 따라 각 유동장에 대해 별도로 정규화된 공간 속도 분포를 보여주는 회색조 컬러맵)에 대한 PIV 흐름 필드가 있습니다. 스케일 바는 모두 50μM입니다. (B) 나열된 초기 및 최종 표준 σ편차가 i 및 σf인 A(라디안 단위)의 속도 벡터의 각도 분포. (C) A와 B에서 분석 된 비디오의 시간 색상 맵은 시작점을 기준으로 각 픽셀의 프레임 간 위치를 보여줍니다. 클래스 1 맵은 소규모 랜덤 모션을 보여줍니다. 클래스 2 맵은 최소한의 공간적 또는 시간적 변화로 빠른 단방향 움직임을 묘사합니다. 클래스 3 맵은 클래스 1과 2의 특징을 모두 보여줍니다. 이 그림은 참고자료50에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
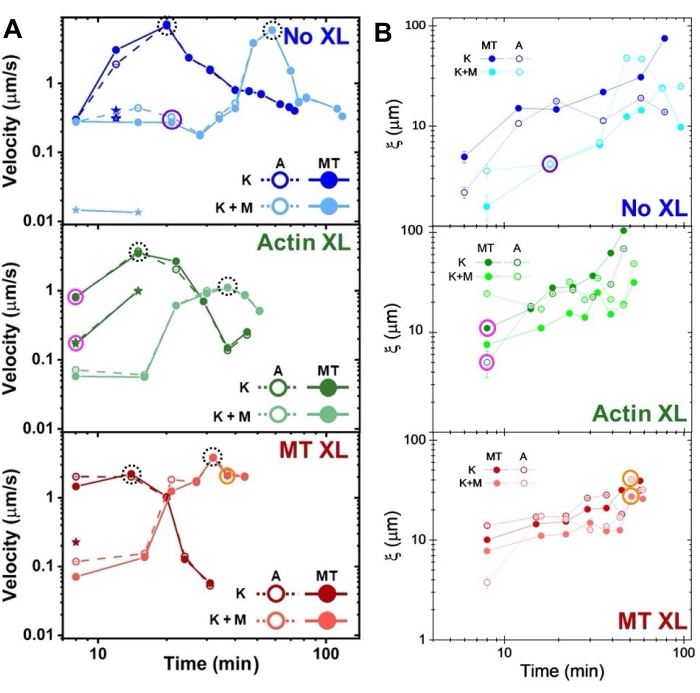
그림 8. DDM 및 SIA는 2모터 액틴-미세소관 복합재의 시간에 따라 변하는 역학과 구조를 측정합니다. (A) DDM을 통해 측정된 그림 6 및 그림 7에 설명된 복합 재료의 속도는 가교 및 미오신 활동에 의해 프로그래밍된 복합 재료의 가속 및 감속을 보여줍니다. 미세소관(MT, 닫힌 원) 및 액틴(A, 열린 원)의 속도는 가교가 없는 복합재(상단, 파란색), 액틴 가교결합(중간, 녹색), 미세소관 가교결합(하단, 빨간색), 미오신 없음(K, 어두운 음영) 및 미오신 미오신(K+M, 밝은 음영)이 있는 복합 재료에서 활동 시간의 함수로 표시됩니다. 두 가지 속도가있는 클래스 3의 경우 느린 속도는 별표로 표시됩니다. 검은색 파선으로 둘러싸인 데이터 포인트는 각 공식의 최대 속도 vmax에 해당합니다. 오차 막대(대부분 너무 작아서 볼 수 없음)는 해당 τ(q)의 멱법칙 피팅에 대한 표준 오차입니다. (B) A에서 평가 된 동일한 시계열 세트에 대해 SIA를 통해 결정된 구조적 상관 길이 ξ 대 활동 시간. 각 데이터 포인트는 해당 시계열의 첫 번째 및 마지막 프레임에 대해 결정된 상관 관계 길이의 평균입니다. 일반적으로, ξ는 모든 복합 재료 시스템에서 액틴과 미세 소관 모두에 대해 시간이 증가하며, 키네신에 의해서만 구동되는 복합체는 미오신이 존재하는 것보다 더 큰 상관 길이를 갖는다. 그림 7에서 분석된 세 개의 시계열에 해당하는 A와 B의 데이터 포인트는 해당 클래스 색상(1 = 보라색, 2 = 주황색, 3 = 자홍색)으로 동그라미로 표시됩니다. 이 그림은 참고자료50에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
위에서 설명한 재구성 시스템의 주요 발전은 모듈성과 조정 가능성이므로 사용자는 특정 세포 공정을 에뮬레이트하거나 특정 기능 또는 기계적 특성을 가진 재료를 엔지니어링하는 등 원하는 결과에 맞게 단백질, 모터, 가교제 등의 농도를 수정하는 것이 좋습니다. 액틴과 튜불린의 농도 범위에 대한 제한은 액틴(~0.2μM)57,58,59 및 튜불린(~3 - 4μM)60을 중합하는 데 필요한 임계 농도에 의해 하한으로 설정되고, 액틴 필라멘트(~90μM)61,62 또는 미세소관(~35μM)63의 네마틱 정렬로의 전환에 의해 상한으로 설정됩니다. . 액틴 단량체와 튜불린 이량체는 중합 후 함께 혼합되지 않고 함께 필라멘트로 중합되어 서로를 상승적으로 지지하는 균일하게 상호 침투하는 퍼콜레이션 네트워크를 형성해야 합니다. 합성물이 보여주는 새로운 역학은 이러한 상호 작용에 의존합니다. 표시된 결과를 성공적으로 재현하려면 프로토콜에 설명된 대로 모든 단계를 따르는 것이 일반적으로 중요하지만 일부 단계는 더 엄격하고 다른 단계는 특정 요구 사항과 사용 가능한 리소스에 맞게 수정 및 조정할 여지가 있습니다.
예를 들어, 재현 가능한 결과를 보장하는 한 가지 중요한 단계는 재료 표에 제공된 지침에 따라 시약을 적절하게 준비하고 보관하는 것입니다. 세포골격 단백질(액틴, 튜불린, 미오신, 키네신)은 불안정하므로 분취하고, 액체 질소로 급속 냉동하고, 일회용 분취량으로 -80°C에서 보관해야 합니다. -80 ° C에서 제거한 분취량은 얼음 위에 보관해야합니다. 세포골격 단백질은 추가적인 동결-해동 주기 후에 기능을 안정적으로 유지하지 못합니다.
미세소관은 액틴보다 해중합 및 변성에 더 민감합니다. -80 ° C에서 제거 된 후에는 중합 전에 튜 불린을 얼음에 보관하고 12 시간 이내에 사용해야합니다. 일단 중합되면 미세소관은 실온에서 보관해야 합니다. 해중합을 방지하기 위해 탁솔로 미세소관을 안정화하는 것도 중요합니다. 액틴 필라멘트의 팔로이딘 안정화는 미오신 및 키네신 활성과 경쟁하는 ATP 소비 액틴 트레드밀링을 억제하는 데에도 마찬가지로 중요합니다.
미오신 모터의 초 원심 분리는 비활성 미오신 죽은 머리를 제거하기 때문에 또 다른 중요한 단계입니다. 효소적으로 불활성인 단량체를 제거하지 않으면 액틴 네트워크의 수동 가교결합과 활성의 손실이 발생합니다. 모터의 ATPase 활성을 연장하기 위해, 크레아틴 포스페이트 및 크레아틴 포스포키나제64 와 같은 ATP 재생 시스템이 혼입될 수 있다.
마지막으로, 복합 활성을 유지하려면 샘플 챔버의 벽에 대한 필라멘트 및 모터의 흡착을 억제해야 하며, 이는 현미경 커버슬립 및 슬라이드의 패시베이션으로 달성할 수 있습니다. 모터 단백질은 특히 흡착되기 쉽기 때문에 복합체가 샘플 챔버의 표면으로 당겨져 시야를 벗어나 2D로 붕괴되고 더 이상 활동하지 않습니다. 커버슬립과 슬라이드를 실란화하는 것은 표면을 부동태화하고 흡착을 방지하는 효과적인 방법입니다(1단계 참조). 시험관내 세포골격 실험에서 효과적으로 사용되는 대안적인 패시베이션 방법은 표면을 세포막(18)과 유사한 지질 이중층으로 코팅하는 것이다. 이 방법은 단백질을 표면에 묶거나 다른 특정 단백질-표면 상호 작용을 도입하려는 경우 이중층이 기능화 될 수 있기 때문에 유리합니다. 광학 핀셋 실험의 경우, 마이크로스피어의 패시베이션도 중요하며, 카르보디이미드 가교결합제화학 48을 통해 카르복실화된 마이크로스피어를 BSA 또는 PEG로 코팅함으로써 달성될 수 있다.
제시된 프로토콜에는 연구자가 필요에 맞게 변경하는 것을 고려할 수있는 몇 가지 측면이 있습니다. 첫째, 연구자들은 비 천연 비오틴 -NA 가교 결합제를 액틴과 미세 소관을 각각 가교 결합하는 알파-액티닌 또는 MAP65와 같은 생물학적 가교제로 대체하도록 선택할 수 있습니다 28,65,66. 여기에 설명된 복합재에서 비네이티브 가교결합제를 사용하는 것은 천연 가교결합제에 비해 향상된 재현성, 안정성 및 조정 가능성에 의해 동기가 부여됩니다. 강한 비오틴-NA 결합으로 인해, 가교결합제는 광범위한 회전율로 일시적으로 결합하는 대부분의 천연 가교결합제보다는 영구적인 것으로 가정할 수 있다. 과도 가교의 역학은 가교제와 모터에서 역학에 대한 기여를 구문 분석하는 것을 복잡하게 만듭니다. 또한, 비오틴-NA 링커는 액틴과 미세소관 모두를 가교결합하고 액틴을 미세소관에 가교결합하는 데 다용도로 사용할 수 있습니다. 이러한 방식으로, 가교 모티프들 사이의 명확한 비교가 이루어질 수 있고, 다른 모든 변수들(예를 들어, 가교결합자 크기, 결합 친화도, 화학량론 등)을 고정시킬 수 있다. 마지막으로, 비오틴-NA 링커를 혼입하는 데 필요한 시약은 널리 상업적으로 이용 가능하고 잘 특성화되어 있으며 많은 생물물리학 실험실에서 일반적으로 사용됩니다. 그러나 여기에 설명된 체외 플랫폼의 주요 강점 중 하나는 모듈성이므로 연구원은 원하는 경우 비오틴-NA 링커를 기본 링커로 원활하게 대체할 수 있어야 합니다.
둘째, 현재 프로토콜에서 액틴 단량체와 튜불린 이량체는 샘플 챔버에 추가하기 전에 원심분리 튜브에서 함께 필라멘트로 중합됩니다. 얽힌 필라멘트 단백질의 용액을 샘플 챔버로 흐르게 하면 특히 미세소관의 흐름 정렬이 발생하여 복합체의 원하는 등방성과 균질성이 깨질 수 있습니다. 실제로, 정상 상태 액틴-미세소관 복합체에 대한 이전 연구의 주요 발전은 액틴과 미세소관15,16,27의 등방성 상호 침투 네트워크의 형성을 보장하기 위해 액틴과 미세소관을 제자리에서(샘플 챔버에서) 공동 중합하는 능력이었습니다. 그러나 이러한 접근 방식을 활성 복합 재료로 확장하려면 액틴 및 튜불린 중합 전에 샘플에 모터를 추가하고 실험 전에 전체 샘플을 37°C에서 함께 배양해야 합니다. 프로토콜에 대한 이러한 변화에 대한 테스트는 경쟁하는 ATPase 활성 및 모터의 연장된 37°C 배양으로 인해 액틴 중합이 감소하고 식별 가능한 모터 활성이 없음을 초래했습니다. 다행히도 그림 2, 그림 3 및 그림 6에서 볼 수 있듯이 현재 프로토콜을 따를 때 복합 재료의 흐름 정렬을 식별할 수 없습니다. 그럼에도 불구하고 연구자들은 활성 복합 재료의 현장 형성을 허용하는 프로토콜을 설계하는 것이 좋습니다.
또 다른 고려 사항은 형광 표지 체계로, 네트워크의 모든 액틴 필라멘트와 미세 소관에 희박하게 라벨링하는 것을 수반합니다. 이 라벨링 접근 방식은 추적 필라멘트 또는 마이크로스피어를 통해 구조와 역학을 추론하는 대신 네트워크의 구조를 직접 시각화하도록 최적화되었습니다. 그러나 단점은 개별 필라멘트가 밝게 레이블링되고 분해 될 수 없다는 것입니다. 연구자들이 단일 필라멘트를 해결하고 네트워크 구조를 시각화하기 위해 취할 수있는 한 가지 접근법은 다른 형광단으로 표지 된 미리 형성된 필라멘트에 도핑하여 주변 네트워크와 개별 필라멘트를 동시에 이미징 할 수 있도록하는 것입니다. 그러나 두 개 이상의 형광단과 여기/방출 채널을 사용하는 경우 채널 간 블리드스루를 제거하기 어려운 경우가 많으므로 형광단, 필터 및 레이저 강도를 선택할 때 주의해야 합니다.
관련 한계는 복합 재료에서 미오신 또는 키네신 모터를 시각화 할 수 없다는 것입니다. 사용된 형광 표지된 액틴 단량체와 튜불린 이량체는 상업적으로 이용 가능한 반면, 복합재에서 미오신 또는 키네신을 시각화하려면 자체 라벨링이 필요합니다. 연구원들은 이전에18,67에서 수행한 것처럼 모터에 레이블을 지정하는 다음 단계를 수행하여 모터 활동과 결합을 복합 재료가 나타내는 역학 및 구조에 명확하게 연결할 수 있도록 하는 것이 좋습니다.
마지막으로, 현재 프로토콜에서 키네신 활성의 시작 및 지속 기간은 제어되지 않는다는 점에 유의하는 것이 중요합니다. 미오신 활성은 상기 기재된 바와 같이 블레비스타틴의 광불활성화를 사용하여 제어되기 때문에, 키네신의 유사한 광활성화를 구축하기 위해, 광-활성화된 ATP를 혼입시킬 수 있다.
여기에 설명된 설계의 복잡성을 구축하고 세포 조건을 더 잘 모방하고 동적 구조-기능 매개변수 공간을 넓히기 위해 향후 작업은 비멘틴68,69와 같은 중간 필라멘트와 다인 13,70과 같은 다른 모터를 통합하는 데 중점을 둘 것입니다. 겔솔린은 또한 액틴 길이14를 조절하기 위해 다양한 농도로 통합될 뿐만 아니라 미세소관 경직을 조절하기 위한 타우 단백질도 포함될 것입니다.
요약하면, 제시된 프로토콜은 단일 시스템에서 서로 다른 기질에 작용하는 두 개의 개별 활성력 생성 구성 요소를 포함하는 세포 골격에서 영감을 받은 활성 물질 시스템의 역학, 구조 및 역학을 설계, 생성 및 특성화하는 방법을 설명합니다. 이 조정 가능한 모듈식 플랫폼은 재구성 노력을 세포 세포 골격을 모방하는 데 한 걸음 더 가까이 다가가게 하고 다양한 구성 요소를 독립적으로 통합, 제거 및 조정하여 넓은 위상 공간에 걸쳐 특성을 프로그래밍할 수 있는 고유한 기능을 제공합니다. 더욱이, 이 다용도 시스템의 모든 구성 요소는 상업적으로 입수가능하며(재료 표 참조), 앞서50에서 설명한 바와 같이 Ross Lab에서 정제되고 요청 시 제공되는 키네신 이량체를 제외하고. 마지막으로 모든 분석 코드는 GitHub49 를 통해 무료로 사용할 수 있으며 무료 프로그래밍 언어 및 소프트웨어(Python 및 피지)를 기반으로 합니다. 이러한 시스템을 설계하기위한 프로토콜의 투명한 보급은 다양한 전문 지식, 배경, 기관 제휴 및 연구 목표를 가진 다양한 사용자 그룹이이 플랫폼에 더 쉽게 액세스 할 수 있기를 바랍니다.
공개
저자는 공개 할 것이 없습니다
감사의 말
데이터 분석에 도움을 준 Maya Hendija와 Jonathan Michel 박사, 유용한 토론과 안내를 해주신 Janet Sheung 박사, Moumita Das 박사, Michael Rust 박사에게 감사드립니다. 이 연구는 RMRA 및 JLR에 수여되는 William M. Keck Foundation Research Grant 및 NSF DMREF Award (DMR 2119663)와 RMR-A 및 RJM에 수여 된 National Institutes of Health R15 Grants (R15GM123420, 2R15GM123420-02)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin Abbreviation used in paper: blebbistatin | Sigma Aldrich | B0560 | Stock Concentration: 200 μM in DMSO Storage: dessicated, in DMSO, -20ºC Stock and Experiment Recipes: dissolve 1 mg of powder to 200 μM in DMSO Storage, Handling, Troubleshooting Notes: limited shelf-life, typically stops functioning reliably after 3-4 months. purchase and prepare new solution every 3 months. |
| 1:20 488-tubulin:tubulin mixture Abbreviation used in paper: 5-488-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and 488-tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| 1:20 R-tubulin:tubulin mixture Abbreviation used in paper: 5-R-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and rhodamine tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| actin (biotin): skeletal muscle Abbreviation used in paper: biotin-actin | Cytoskeleton | AB07 | Stock Concentration: 1 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: (1) immediately prior to use dilute to 0.5 mg/ml in PEM, (2) once removed from -80ºC, store aliquot on ice at 4ºC for up to 1 week |
| actin (rhodamine): rabbit skeletal muscle Abbreviation used in paper: R-actin | Cytoskeleton | AR05 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| adenosine triphosphate Abbreviation used in paper: ATP | Thermo Fisher Scientific | A1048 | Stock Concentration: 100 mM Storage: in solution (pH 7), -20ºC Stock and Experiment Recipes: reconsitute in DI H20, bring pH to 7 with NaOH Storage, Handling, Troubleshooting Notes: routinely check pH and adjust as needed, hydrolyzes over time, replace every ~6-12 months |
| AlexaFluor488 Phalloidin Abbreviation used in paper: 488-phalloidin | Thermo Fisher Scientific | A12379 | Stock Concentration: 100 μM DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 20 μM in PEM (1 μL in 4 μL PEM) |
| AlexaFluor488–labeled actin Abbreviation used in paper: 488-actin | Thermo Fisher Scientific | A12373 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: this item has been discontinued |
| Basic Plasma Cleaner Abbreviation used in paper: plasma cleaner | Harrick Plasma | PDC-32G | |
| Bemis Parafilm M Laboratory Wrapping Film Abbreviation used in paper: transparent film | Thermo Fisher Scientific | 13-374-5 | |
| D-(+)-Glucose Abbreviation used in paper: | Thermo Fisher Scientific | A1682836 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: reconstitute powder to 4.5 mg/ml in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should 45 μg/mL |
| D-Biotin Abbreviation used in paper: biotin | Fisher Scientific | BP232-1 | Stock Concentration: 1.02 mM in PEM Storage: dessicated, 4ºC |
| deionized nanopure water Abbreviation used in paper: DI | |||
| Dimethyldichlorosilane Abbreviation used in paper: silane | Thermo Fisher Scientific | D/3820/PB05 | Stock Concentration: 2% dissolved in Toulene |
| Dithiothreitol Abbreviation used in paper: DTT | Thermo Fisher Scientific | R0861 | Stock Concentration: 1 M in DMSO Storage: dessicated, -20ºC Stock and Experiment Recipes: dilute to 2 mM in PEM immediately before each experiment |
| DMSO Anhydrous Abbreviation used in paper: DMSO | Thermo Fisher Scientific | D12345 | |
| F-Buffer Abbreviation used in paper: F-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 10 mM Imidazole (pH 7.0), 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 0.2 mM ATP |
| G-Buffer Abbreviation used in paper: G-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 2.0 mM Tris (pH 8), 0.2 mM ATP, 0.5 mM DTT, 0.1 mM CaCl2. Store at -20°C. |
| glass microscope slide Abbreviation used in paper: slide | Thermo Fisher Scientific | 22-310397 | |
| Glucose oxidase + catalase + β-mercaptoethanol Abbreviation used in paper: GOC | Sigma Aldrich | G2133-250KU, C1345, 63689 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: For 100x: 4.3 mg/ml glucose oxidase, 0.7 mg/ml catalase, 0.5% v/v β-mercaptoethanol in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should be: 0.005% β-mercaptoethanol, 43 μg/mL glucose oxidase, 7 μg/mL catalase |
| glu-GOC oxygen scavenging system Abbreviation used in paper: glu-GOC | NA | NA | Stock Concentration: 100x Storage: prepare fresh each time Stock and Experiment Recipes: mix equal parts Glu and GOC and add at 1/100 final sample volume immediately before imaging Storage, Handling, Troubleshooting Notes: prepare from Glu and GOC immediately before imaging |
| Guanosine triphosphate Abbreviation used in paper: GTP | Thermo Fisher Scientific | R0461 | Stock Concentration: 100 mM Storage: 100 μL aliquots at -20ºC |
| Instant Mix 1-minute epoxy Abbreviation used in paper: epoxy | Loctite | 1366072 | |
| Kinesin-1 401 BIO 6x HIS Abbreviation used in paper: kinesin | Prepared in JL Ross Lab at Syracuse University | NA | Stock Concentration: 8.87 μM in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Storage, Handling, Troubleshooting Notes: biotinylated dimers form kinesin clusters, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| NeutrAvidin Abbreviation used in paper: NA | Thermo Fisher Scientific | 31000 | Stock Concentration: 5 mg/ml in PEM Storage: dessicated, -20ºC Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM |
| No 1. glass coverslips (24 mm x 24 mm) Abbreviation used in paper: coverslip | Thermo Fisher Scientific | 12-548-CP | |
| Paclitaxel Abbreviation used in paper: Taxol | Thermo Fisher Scientific | P3456 | Stock Concentration: 2 mM in DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 2 mM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 200 μM in DMSO (0.4 μL in 3.6 μL DMSO) |
| PEM-100 Abbreviation used in paper: PEM | NA | NA | Stock Concentration: 1x Storage: room temperature (RT) Stock and Experiment Recipes: 100 mM K-PIPES (pH 6.8), 2 mM EGTA, 2 mM MgCl2 Storage, Handling, Troubleshooting Notes: use KOH to adjust pH to 6.8, recheck pH often and adjust accordingly |
| phalloidin Abbreviation used in paper: phalloidin | Thermo Fisher Scientific | P3457 | Stock Concentration: 100 μM in DMSO Storage: protected from light, dessicated, -20ºC, adhere closely to storage/handling conditions Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: susceptible to impurities in its preparation and denaturing, identifiable as large amorphous aggregates of actin in samples |
| porcine brain tubulin Abbreviation used in paper: tubulin | Cytoskeleton | T240 | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Potassium Chloride Abbreviation used in paper: KCl | Thermo Fisher Scientific | AM9640G | Stock Concentration: 4 M Storage: RT |
| Rabbit skeletal actin Abbreviation used in paper: actin | Cytoskeleton | AKL99 | Stock Concentration: 2 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 2 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| Rabbit skeletal myosin II Abbreviation used in paper: myosin | Cytoskeleton | MY02 | Stock Concentration: 10 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 10 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: monomers form minifilaments at low KCl, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Tubulin (biotin): porcine brain Abbreviation used in paper: biotin-tubulin | Cytoskeleton | T333P | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 0.5 mg/ml in PEM |
| Tubulin (fluorescent HiLyte 488): porcine brain Abbreviation used in paper: 488-tubulin | Cytoskeleton | TL488M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| tubulin (rhodamine): porcine brain Abbreviation used in paper: R-tubulin | Cytoskeleton | TL590M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| Tween 20 Abbreviation used in paper: Tween20 | Thermo Fisher Scientific | J20605.AP | Stock Concentration: 1% v/v in DI H20 Storage: RT |
| ultracentrifuge grade microtubes Abbreviation used in paper: Beckman-Coulter Optima Max XP | Beckman Coultier | 343776 | Storage, Handling, Troubleshooting Notes: 8x34 mm PC |
| UV light curing glue Abbreviation used in paper: UV glue | Pharda | SKG-2869 |
참고문헌
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Koenderink, G. H., Paluch, E. K. Architecture shapes contractility in actomyosin networks. Current Opinion in Cell Biology. 50, 79-85 (2018).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Burla, F., Mulla, Y., Vos, B. E., Aufderhorst-Roberts, A., Koenderink, G. H. From mechanical resilience to active material properties in biopolymer networks. Nature Reviews Physics. 1 (4), 249-263 (2019).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State and Materials Science. 15 (5), 177-182 (2011).
- Xiao, Q., Hu, X., Wei, Z., Tam, K. Y. Cytoskeleton molecular motors: structures and their functions in neuron. International Journal of Biological Sciences. 12 (9), 1083-1092 (2016).
- Ajeti, V. et al. Wound healing coordinates actin architectures to regulate mechanical work. Nature Physics. 15 (7), 696-705 (2019).
- Jung, W. et al. Dynamic motions of molecular motors in the actin cytoskeleton. Cytoskeleton. 76 (11-12), 517-531 (2019).
- Pollard, T. D., O'Shaughnessy, B. Molecular mechanism of cytokinesis. Annual Review of Biochemistry. 88 (1), 661-689 (2019).
- Huber, F., Boire, A., López, M. P., Koenderink, G. H. Cytoskeletal crosstalk: when three different personalities team up. Current Opinion in Cell Biology. 32, 39-47 (2015).
- Rivero, F. et al. The role of the cortical cytoskeleton: F-actin crosslinking proteins protect against osmotic stress, ensure cell size, cell shape and motility, and contribute to phagocytosis and development. Journal of Cell Science. 109 (11), 2679-2691 (1996).
- Duclos, G. et al. Topological structure and dynamics of three-dimensional active nematics. Science. 367 (6482), 1120-1124 (2020).
- Baclayon, M. et al. Optical tweezers-based measurements of forces and dynamics at microtubule ends. Optical Tweezers. 1486, 411-435 (2017).
- Gurmessa, B., Fitzpatrick, R., Falzone, T. T., Robertson-Anderson, R. M. Entanglement density tunes microscale nonlinear response of entangled actin. Macromolecules. 49 (10), 3948-3955 (2016).
- Francis, M. L. et al. Non-monotonic dependence of stiffness on actin crosslinking in cytoskeleton composites. Soft Matter. 15 (44), 9056-9065 (2019).
- Ricketts, S. N. et al. Varying crosslinking motifs drive the mesoscale mechanics of actin-microtubule composites. Scientific Reports. 9 (1), 12831 (2019).
- Lee, G. et al. Active cytoskeletal composites display emergent tunable contractility and restructuring. Soft Matter. 17 (47), 10765-10776 (2021).
- Murrell, M. P., Gardel, M. L. F-actin buckling coordinates contractility and severing in a biomimetic actomyosin cortex. Proceedings of the National Academy of Sciences. 109 (51), 20820-20825 (2012).
- Soares e Silva, M. et al. Active multistage coarsening of actin networks driven by myosin motors. Proceedings of the National Academy of Sciences. 108 (23), 9408-9413 (2011).
- Sonn-Segev, A., Bernheim-Groswasser, A., Roichman, Y. Dynamics in steady state in vitro acto-myosin networks. Journal of Physics: Condensed Matter. 29 (16), 163002 (2017).
- Ideses, Y., Sonn-Segev, A., Roichman, Y., Bernheim-Groswasser, A. Myosin II does it all: assembly, remodeling, and disassembly of actin networks are governed by myosin II activity. Soft Matter. 9 (29), 7127 (2013).
- Fürthauer, S. et al. Self-straining of actively crosslinked microtubule networks. Nature Physics. 15 (12), 1295-1300 (2019).
- Lemma, L. M. et al. Multiscale microtubule dynamics in active nematics. Physical Review Letters. 127 (14), 148001 (2021).
- Fan, Y., Wu, K.-T., Aghvami, S. A., Fraden, S., Breuer, K. S. Effects of confinement on the dynamics and correlation scales in kinesin-microtubule active fluids. Physical Review E. 104 (3), 034601 (2021).
- Triclin, S. et al. Self-repair protects microtubules from destruction by molecular motors. Nature Materials. 20 (6), 883-891 (2021).
- Lee, G. et al. Myosin-driven actin-microtubule networks exhibit self-organized contractile dynamics. Science Advances. 7 (6), eabe4334 (2021).
- Ricketts, S. N., Ross, J. L., Robertson-Anderson, R. M. Co-entangled actin-microtubule composites exhibit tunable stiffness and power-law stress relaxation. Biophysical Journal. 115 (6), 1055-1067 (2018).
- Bendix, P. M. et al. A quantitative analysis of contractility in active cytoskeletal protein networks. Biophysical Journal. 94 (8), 3126-3136 (2008).
- Linsmeier, I. et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7 (1), 12615 (2016).
- Stam, S. et al. Filament rigidity and connectivity tune the deformation modes of active biopolymer networks. Proceedings of the National Academy of Sciences. 114 (47), E10037-E10045 (2017).
- Yadav, V. et al. Filament nucleation tunes mechanical memory in active polymer networks. Advanced Functional Materials. 29 (49), 1905243 (2019).
- Ennomani, H. et al. Architecture and connectivity govern actin network contractility. Current Biology. 26 (5), 616-626 (2016).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (9), 591-597 (2013).
- Alvarado, J., Cipelletti, L., Koenderink, G. H. Uncovering the dynamic precursors to motor-driven contraction of active gels. Soft Matter. 15 (42), 8552-8565 (2019).
- Jung, W., Murrell, M. P., Kim, T. F-actin cross-linking enhances the stability of force generation in disordered actomyosin networks. Computational Particle Mechanics. 2 (4), 317-327 (2015).
- Lenz, M., Thoresen, T., Gardel, M. L., Dinner, A. R. Contractile units in disordered actomyosin bundles arise from f-actin buckling. Physical Review Letters. 108 (23), 238107 (2012).
- Memarian, F.L. et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), e2117107118 (2021).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Foster, P. J., Fürthauer, S., Shelley, M. J., Needleman, D. J. Active contraction of microtubule networks. eLife. 4, e10837 (2015).
- Thijssen, K. et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), e2106038118 (2021).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Colen, J. et al. Machine learning active-nematic hydrodynamics. Proceedings of the National Academy of Sciences. 118 (10), e2016708118 (2021).
- Mitchell, K. A., Tan, A. J., Arteaga, J., Hirst, L. S. Fractal generation in a two-dimensional active-nematic fluid. Chaos: An Interdisciplinary Journal of Nonlinear Science. 31 (7), 073125 (2021).
- Pandolfi, R. J., Edwards, L., Johnston, D., Becich, P., Hirst, L. S. Designing highly tunable semiflexible filament networks. Physical Review E. 89 (6), 062602 (2014).
- Tan, A. J. et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Roostalu, J., Rickman, J., Thomas, C., Nédélec, F., Surrey, T. Determinants of polar versus nematic organization in networks of dynamic microtubules and mitotic motors. Cell. 175 (3), 796-808.e14 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sheung, J. Y. et al. Motor-driven restructuring of cytoskeleton composites leads to tunable time-varying elasticity. ACS Macro Letters. 10 (9), 1151-1158 (2021).
- McGorty, R. PyDDM v0.2.0. Zenodo. (2022).
- Achiriloaie, D. H. et al. Kinesin and myosin motors compete to drive rich multi-phase dynamics in programmable cytoskeletal composites. arXiv. (2021).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), eaay5912 (2019).
- McGorty, R. Image-Correlation. at <https://github.com/rmcgorty/Image-Correlation>. (2020).
- Robertson, C. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- McGorty, R. Differential Dynamic Microscopy - Python. at <https://github.com/rmcgorty/Differential-Dynamic-Microscopy---Python>. (2021).
- Cerbino, R., Trappe, V. Differential dynamic microscopy: probing wave vector dependent dynamics with a microscope. Physical Review Letters. 100 (18), 188102 (2008).
- Robertson-Anderson, R. M. Optical tweezers microrheology: from the basics to advanced techniques and applications. ACS Macro Letters. 7 (8), 968-975 (2018).
- Pollard, T. D. Polymerization of ADP-actin. Journal of Cell Biology. 99 (3), 769-777 (1984).
- Coué, M., Brenner, S. L., Spector, I., Korn, E. D. Inhibition of actin polymerization by latrunculin A. FEBS Letters. 213 (2), 316-318 (1987).
- Pollard, T. D. Actin and actin-binding proteins. Cold Spring Harbor Perspectives in Biology. 8 (8), a018226 (2016).
- Kumar, N. Taxol-induced polymerization of purified tubulin. Mechanism of action. Journal of Biological Chemistry. 256 (20), 10435-10441 (1981).
- Käs, J. et al. F-actin, a model polymer for semiflexible chains in dilute, semidilute, and liquid crystalline solutions. Biophysical Journal. 70 (2), 609-625 (1996).
- Viamontes, J., Narayanan, S., Sandy, A. R., Tang, J. X. Orientational order parameter of the nematic liquid crystalline phase of F -actin. Physical Review E. 73 (6), 061901 (2006).
- Hitt, A. L., Cross, A. R., Williams, R. C. Microtubule solutions display nematic liquid crystalline structure. Journal of Biological Chemistry. 265 (3), 1639-1647 (1990).
- Andexer, J. N., Richter, M. Emerging enzymes for ATP regeneration in biocatalytic processes. ChemBioChem. 16 (3), 380-386 (2015).
- Farhadi, L. et al. Actin and microtubule crosslinkers tune mobility and control co-localization in a composite cytoskeletal network. Soft Matter. 16 (31), 7191-7201 (2020).
- Falzone, T. T., Lenz, M., Kovar, D. R., Gardel, M. L. Assembly kinetics determine the architecture of α-actinin crosslinked F-actin networks. Nature Communications. 3 (1), 861 (2012).
- Thoresen, T., Lenz, M., Gardel, M. L. Reconstitution of contractile actomyosin bundles. Biophysical Journal. 100 (11), 2698-2705 (2011).
- Sanghvi-Shah, R., Weber, G. F. Intermediate filaments at the junction of mechanotransduction, migration, and development. Frontiers in Cell and Developmental Biology. 5, 81 (2017).
- Shen, Y. et al. Effects of vimentin intermediate filaments on the structure and dynamics of in vitro multicomponent interpenetrating cytoskeletal networks. Physical Review Letters. 127 (10), 108101 (2021).
- Laan, L., Roth, S., Dogterom, M. End-on microtubule-dynein interactions and pulling-based positioning of microtubule organizing centers. Cell Cycle. 11 (20), 3750-3757 (2012).
Erratum
Formal Correction: Erratum: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and Mechanics
Posted by JoVE Editors on 10/11/2022. Citeable Link.
An erratum was issued for: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and Mechanics. The Authors section was updated.
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Christopher Currie1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
to:
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Maya Hendija1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유