Method Article
C57BL/6J 마우스의 중심삭증후군 모델 확립
요약
마우스에서 중심 탯줄 증후군(CCS)을 시뮬레이션하는 본 프로토콜은 반복성을 개선하고 실험 동물에 대한 수술 손상을 최소화하여 해부학적 구조가 과도하게 파괴되는 것을 방지했습니다. 이 연구의 전략은 일관된 결과를 도출하여 부상 메커니즘에 대한 연구를 가능하게 하기 때문에 유리합니다.
초록
중심성 탯줄 증후군(CCS)의 동물 모델은 전임상 연구에 상당한 도움이 될 수 있습니다. 식별 가능한 해부학적 경로는 최소 침습적 노출 접근 방식을 제공하고 수술 중 실험 동물의 추가 부상을 줄일 수 있으므로 실험 중 일관되고 안정적인 해부학적 형태를 유지하여 개체 간의 행동 및 조직학적 차이를 최소화하여 실험의 재현성을 향상시킬 수 있습니다. 이 연구에서 C6 수준의 척수는 척수 손상 동축 플랫폼(SCICP)과 최소 침습 기술과의 조합을 사용하여 노출되었습니다. 척추 안정기의 도움으로 척추뼈를 고정하고 SCICP로 5g/mm2 및 10g/mm2 무게로 C57BL/6J 마우스의 척수를 압박하여 다양한 정도의 C6 척수 손상을 유도했습니다. CCS에 대한 이전 설명과 일치하게, 결과는 이 모델의 병변이 중심 탯줄 주변의 회백질에 집중되어 있음을 밝혀 CCS에 대한 추가 연구를 가능하게 합니다. 마지막으로, 조직학적 결과는 독자를 위한 참고 자료로 제공됩니다.
서문
최근 몇 년 동안 척수 손상(SCI)의 발병률이 지속적으로 증가하고 있으며, 덜 폭력적인 타우마로 인한 노인의 부상이 더 많다1. 이러한 부상은 경추를 침범하는 경우가 더 많으며, 불완전한 신경학적 기능 장애로 이어지는 경우가 더 많다2.
21세기에 CCS는 모든 SCI의 절반 이상을 차지하는 가장 흔한 유형의 불완전 SCI이다. 기존의 불완전한 SCI와 비교했을 때, CCS는 하지보다 상지의 손상이 불균형적으로 더 많은 것이 특징이다3. 주로 상지 약화가 특징이며 감각 및 방광 기능 장애는 덜 심각합니다. CCS는 외상 후 중추부 출혈 및 부종에 의해 발생하거나 최근에 제안된 바와 같이 척관 협착증에서 척수 압박으로 인한 월러리안 퇴행에 의해 발생하는 것으로 생각됩니다. CCS의 관리는 높은 수준의 근거가 부족하며, 이를 위해서는 병태생리학에 대한 포괄적인 이해가 필요하다4. 그러나 CCS의 모델은 보고되지 않았습니다. 적절한 동물 모델은 병태생리학을 이해하는 데 필수적이며, 이는 임상 및 전임상 연구를 위한 연구 기반을 제공할 수 있다 5,6,7,8,9,10.
이 연구에서는 척수 손상 동축 플랫폼(SCICP)과 최소 침습 수술 계획으로 생쥐의 CCS 모델을 설정하여 CCS에 대한 추가 연구와 이해를 가능하게 합니다. 이 모델은 조직학적, 자기공명영상(MRI) 및 면역형광 분석을 통해 연구 과정에서 유효한 것으로 입증되었습니다.
프로토콜
실험은 산동대학교 치루 의과대학 실험동물윤리복지위원회(승인번호: 22021)의 승인을 받았다. 이들은 미국 국립보건원(National Institutes of Health)에서 발행한 실험동물의 관리 및 사용 가이드(Guide for the Care and Use of Laboratory Animals)(NIH Publications No. 85-23, revised 1996)에 따라 수행되었다. 본 연구에 사용된 모든 마우스는 Jinan Pengyue Experimental Animal Company(중국 지난)에서 구입한 9-10주 된 암컷 C57BL/6J 마우스였습니다. 이 연구에 참여한 총 9마리의 마우스는 대조군, 경증 및 중증 그룹에 동등하게 무작위 배정되었습니다. 부상 후 7일, 28일, 70일이 지났을 때, 각 그룹에서 한 마리의 쥐가 희생되었다.
1. C6 후궁 절제술 및 척수 노출
알림: 노출은 현미경으로 수행되었습니다. 출혈은 두 가지 측면에 주의를 기울임으로써 피할 수 있다: (i) 모든 혈관은 피해야 한다. (ii) 근육은 근육의 원점과 종점에서 분리되어야 합니다.
- 수술 기구와 SCICP를 준비합니다.
참고: SCICP의 구조는 이전 연구11에서 보고되었습니다. 선행 연구와 다른 점은 본 프로토콜이 압박에 의한 척수 손상을 달성한다는 것이다. 이 플랫폼의 두 가지 무게(10.4g 및 20.8g)는 각각 5g/mm2 및 10g/mm2의 압축을 생성할 수 있습니다(그림 1). 척수 노출 및 압박 단계는 그림 2에 나와 있습니다. - 노즈콘을 이용한 흡입으로 마우스에 이소플루란을 투여한다(유도: 3%-5%, 유지: 1.5%-2%).
- 마취가 효과를 발휘한 후 쥐의 목 뒤 정중선에 있는 작은 돌출부를 탐색하는데, 이는 두 번째 흉추(T2)의 가시 돌기입니다.
- 이 부풀어 오른 부분 주위의 머리카락을 면도하십시오. 요오드포 용액을 세 번 번갈아 바른 다음 피부 소독제 75% 에탄올을 번갈아 가며 피부를 소독합니다.
- 마우스를 수술대에 엎드려 놓습니다. 눈을 보호하기 위해 눈 연고를 바르십시오.
- 흉부 아래에 3-4mm 두께의 패드를 깔아 경추 곡선이 아치형이 되도록 하여 수술 중 층간 공간과 기도가 막히지 않도록 합니다. 수술 전 진통제로 부프레노르핀을 주사합니다(0.05-0.1mg/kg, SQ).
- 1-1.5cm의 세로로 절개하여 제2 흉추 가시돌기를 중심으로 멸균 메스를 사용하여 근막층을 노출시킵니다(그림 2A).
- 멸균 마이크로 가위로 T2 위의 지방 조직 일부를 제거하여 T2 가시 돌기를 찾습니다.
- 마이크로 가위로 정중선을 따라 C5-T2에서 양측 승모근과 능형근을 분리합니다(그림 2B).
- 마이크로 가위로 C5-T2 척추 라미나의 근육을 분리하고 멸균 마이크로 견인기를 사용하여 근육층을 측면으로 후퇴시킵니다(그림 2C).
- 척추 표면의 다열근과 경추 척추 근육을 자릅니다.
- 가시돌기의 가장 높은 지점에 따라 T2를 찾습니다. C6을 찾기 위해 T2에서 rostral end를 향해 가시 돌기를 연속적으로 조사합니다(그림 3).
- 집게로 C6 라미나를 들어 올리고 라미나를 잘라내면 척수가 노출됩니다(그림 2D).
2. 경추 척수 압박 손상
- 척추 안정기로 C6-7 패싯 조인트를 고정하고 잠급니다(그림 2E).
- 멸균 웨이트 팁을 노출된 척수를 향하게 하고 팁의 평평한 바닥이 척수의 등쪽 표면과 평행하게 위치하도록 합니다(그림 2F).
- 무게가 척수를 압박하도록 소매를 조정합니다. 체중이 척수와 일정한 상대 위치를 유지하면 조정을 중지합니다(그림 2G).
알림: 무게가 척수에 타박상을 가하는 경우 이 과정을 너무 격렬하거나 빠르게 만들지 마십시오. - 5분 압축 후 추와 척추 안정기를 제거합니다.
- 현미경으로 압박 후 척수의 색상 변화를 관찰합니다(그림 2H).
- 멸균 PBS로 헹구고 석션을 사용하여 작업 부위를 청소합니다.
- 폴리프로필렌 비흡수성 봉합사(크기: 6-0)를 사용하여 근육과 피부를 층으로 봉합합니다.
- 수술 부위를 소독하고 마우스가 완전한 의식을 회복할 때까지 따뜻한 패드에 마우스를 놓은 다음 마우스를 마우스 케이지에 다시 넣습니다.
- 진통을 위해 부프레노르핀(0.05-0.1mg/kg, SQ)을 3일 동안 8-12시간마다 주사합니다.
3. 조직학적 분석
- 부상 후 7일, 28일 또는 70일에 1.25% 트리브로모에탄올(체중 0.02mL/g)을 복강 내 주사하여 마우스를 마취합니다. 마우스에 60mL의 인산염 완충 식염수(PBS)와 20mL의 4% 파라포름알데히드를 심혈관 경전으로 주입합니다11.
- 척수를 병변 중심에서 0.5cm 떨어진 양쪽에서 마이크로 가위로 절제하고 1cm 길이의 부분을 보존합니다.
- 보존된 척수 절편을 4°C에서 48시간 동안 30% 자당에 담그십시오.
- OCT로 조직을 삽입하고 냉동체로 조직을 6μm 두께로 절단한 다음 유리 슬라이드에 절편을 수집합니다.
- 헤마톡실린 및 에오신 염색
- 6μm 절편을 1x PBS로 5분 동안 3회 헹구어 잔류 OCT를 제거합니다.
- 섹션을 헤마톡실린에 90초 동안 담그십시오. 흐르는 물에 3분 동안 섹션을 씻습니다.
- 섹션을 4분 동안 eosin에 담그십시오. 과도한 에오신을 제거하기 위해 95% 알코올에 30초 동안 담그십시오.
- 마지막으로 슬라이드를 알코올(95% 알코올 및 100% 알코올 2회, 연속)로 30초 동안 탈수하고 슬라이드를 크실렌 욕조에 넣어 2분 동안 청소합니다. 그런 다음 커버 유리와 수지 젤로 섹션을 밀봉합니다.
- 프러시안 블루 염색
- 페로시아나이드칼륨(20%)과 염산(10%)을 균등하게 섞은 슬라이드를 10분 동안 담그십시오.
- 증류수로 3번 헹구고 Nuclear Fast Red로 5분 동안 카운터 스테인합니다.
- 증류수로 세 번 헹군 다음 95% 알코올로 한 번 헹구고 100% 알코올로 5분 동안 두 번 헹굽니다.
- 크실렌 부분을 각각 3분 동안 두 번 청소한 다음 수지 젤12로 밀봉합니다.
- 면역형광 염색
- 37 °C에서 1 시간 동안 다음과 같은 1 차 항체로 슬라이드를 배양합니다 : 토끼 항 이온화 칼슘 결합 어댑터 분자 1 (Iba-1) (1 : 500), 신경 손상 후 미세 아교세포에서 상향 조절되었습니다. 중추 신경계의 성상교세포에서 발현되는 마우스 항신경교세포(GFAP)(1:300); 토끼 항 신경 필라멘트 -200 (NF-200) (1 : 2000), 신경 필라멘트로 발현됩니다.
- 실온(RT)에서 1시간 동안 2차 항체로 배양: Alexa Fluor488 goat anti-mouse 및 Alexa Fluor594 goat anti-rabbit (1:1,000).
- 사진을 찍고 형광 현미경으로 추가 분석13.
4. 자기공명영상(MRI)
- 미니 마스크를 통해 투여된 이소플루란 마취(1%-2% 이소플루란, 20%-30%O2)로 부상 후 7일에 마우스를 마취합니다.
- 시상 방향으로 경추 척수를 스캔합니다. MRI 이미징에는 TR/TE = 2500/12ms, 시야(FOV)에 대한 획득 매트릭스 = 256 x 128 매트릭스 = 12 x 8mm2, 슬라이스 두께 = 1mm, 여기 수(NEX) = 2인 멀티슬라이스 및 인터리브 방식의 스핀 에코(SE) 시퀀스 설정을 사용합니다.
알림: 호흡 관련 이미지 아티팩트를 제거하기 위해 스캔하는 동안 마우스의 호흡수를 10-15/min으로 유지하십시오14.
결과
시상 HE 섹션은 회백질의 손상된 영역이 심한 그룹에서 더 넓었음에도 불구하고 백질에 대한 연속성이 존재했음을 시사합니다. 또한 중증 그룹과 경증 그룹 간의 손상된 회백질 면적의 차이는 프로토콜에서 그룹 설정의 합리성을 뒷받침합니다(그림 4).
관상동맥 HE 절편은 병변이 주로 두 그룹의 회백질에 존재한다는 것을 보여줍니다. 중증 그룹에서는 회백질을 둘러싼 백질의 구조가 영향을 받을 가능성이 더 높았지만 백질의 윤곽은 여전히 유지되었습니다(그림 5). NF-200 면역형광은 중증군에서 회백질을 둘러싼 백질이 영향을 받았음에도 불구하고 백질은 여전히 비교적 온전한 것으로 나타났다. 이러한 결과는 이전 연구4 에서 CCS에 대해 설명한 특성과 일치합니다(그림 6).
경증 또는 중증 그룹의 부상 후 7일에 시상 HE 절편에서 적혈구가 발견되지 않았습니다. 프러시안 블루 염색 결과 경증 그룹에서는 혈구증이 나타나지 않았지만 중증 그룹에서는 혈구증이 발견되었습니다. 이러한 결과는 출혈을 유발하기 위해서는 비교적 심각한 정도의 손상이 필요할 수 있음을 시사한다(그림 7).
면역형광은 경증 및 중증 손상 모두에서 GFAP 및 Iba-1 발현이 증가한 부위를 밝혀냈으며, 이는 염증 반응과 병변에 신경교 흉터의 형성을 시사합니다. 또한 중증 그룹은 경증 그룹보다 더 큰 병변 면적을 나타냈습니다(그림 8).
MRI는 척수를 관찰하기 위한 비교적 최소 침습적 방법입니다. 그 결과, 경증 그룹과 중증 그룹 모두에서 병변에 저강도 신호 변화가 있고 신호 윤곽이 높다는 것을 시사합니다. 중증 그룹은 저강도 신호 영역이 상당히 더 큰 것으로 나타났습니다(그림 9). 저강도 신호는 이 부위의 망상적혈구 용해물에서 침전물을 암시하고, 주변의 고강도 신호는 염증 반응을 암시합니다. 우리는 이전 연구에서 몇 가지 행동 테스트를 수행했습니다. 예를 들어, 앞다리의 악력 테스트는 유의한 차이를 보여줍니다15.

그림 1: SCICP의 슬리브 및 무게. 팁의 표면적은 C6 후궁 절제술 후 측정된 척수의 노출 영역을 기준으로 1.3mm x 1.6mm로 설계되었습니다. 무게는 PTFE로 코팅되어 슬리브의 내벽과 무게 사이의 마찰을 효과적으로 줄입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
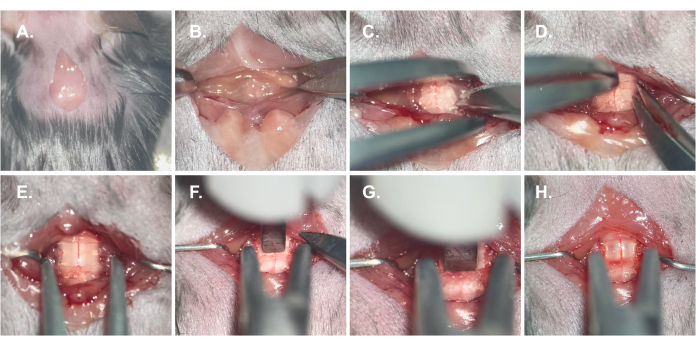
그림 2: 척수의 노출과 압박. (A) 피부의 세로 절개; (B) T2 가시돌기에서 근육을 연발로 분리합니다. (C) 층판 위의 근육을 분리합니다. (D) C6 후궁 절제술; (E) 척추체를 고정하는 단계; (F) 압축 위치를 결정하는 단계; (G) 척수의 압박; (H) 척수 압박 후 척수 위의 백질에 심각한 손상이 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
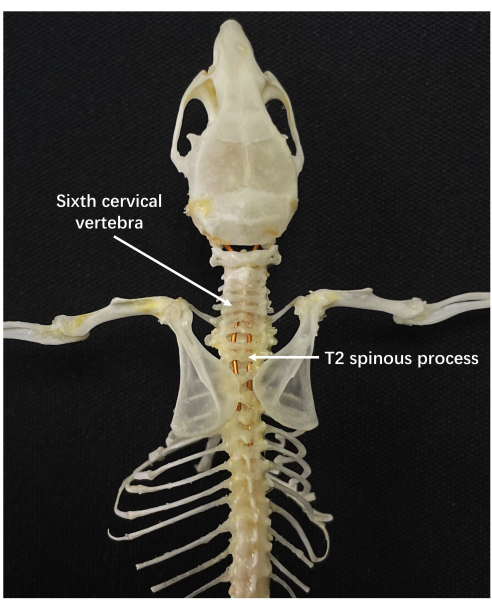
그림 3: 쥐의 자궁 경부 골격 해부학. 화살표로 표시된 부위는 T2 가시돌기입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
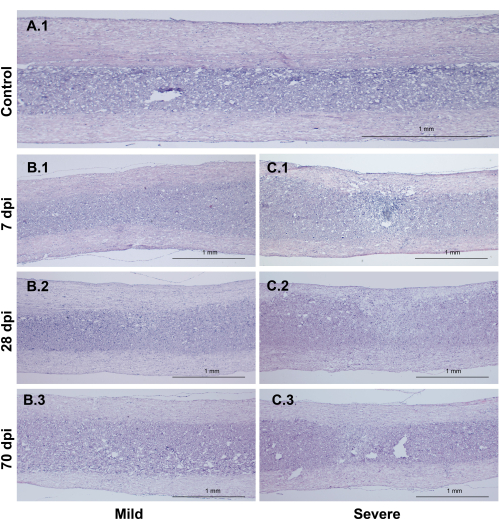
그림 4: 시상 HE 염색 섹션. (A) 경추 척수 시상 단면. (나,씨) 중증 그룹은 경증 그룹보다 더 심각한 손상을 입었지만 둘 다 중앙 탯줄 주변의 회백질에 초점을 맞췄습니다. 7, 28, 70dpi 영상은 동일한 손상군에서 서로 다른 시기에 손상의 발현에 유의한 차이가 없으며 상척수와 하척수에서 백질의 연속성이 유지됨을 시사한다. 축척 막대: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
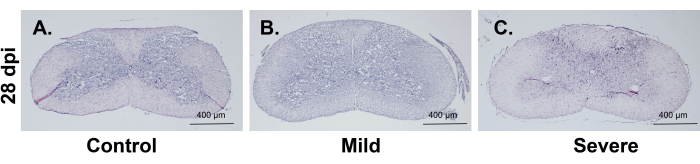
그림 5: 경추 척수 손상 관상동맥 HE 염색 절편. (A-C) 부상은 주로 패널 B와 C에서 볼 수 있듯이 중앙 코드를 둘러싼 회백질에 영향을 미칩니다. 중증 부상 그룹은 경증 부상 그룹보다 더 광범위한 손상을 입어 백질에 영향을 미칠 가능성이 더 큽니다. 척도 막대: 400 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
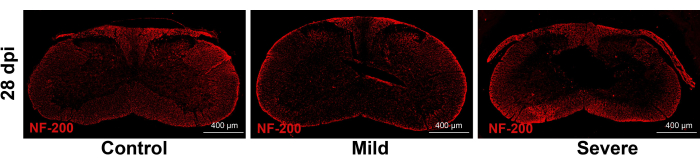
그림 6: 손상 후 NF-200 관상 면역형광. NF-200 반응은 백질 개요에서 큰 차이가 없습니다. 척도 막대: 400 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
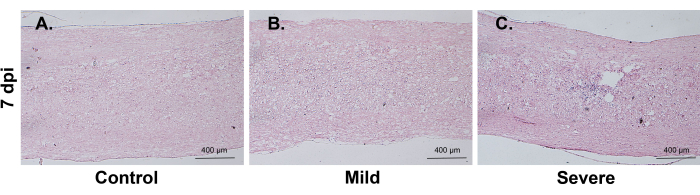
그림 7: 프러시안 블루 염색. (A-C) 혈구증은 중증군에서 관찰되었으나 경증군에서는 관찰되지 않았다. 척도 막대: 400 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
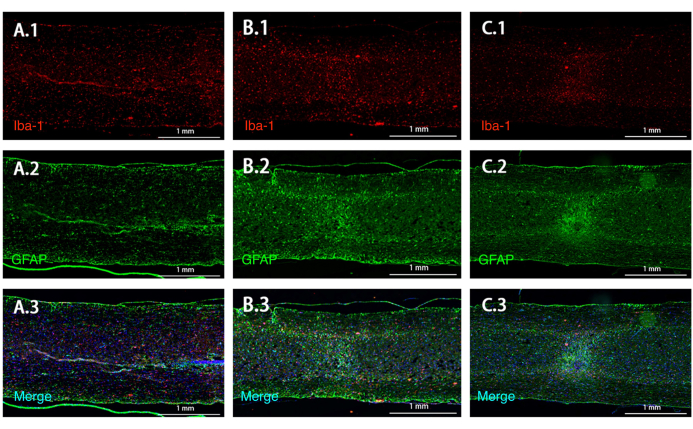
그림 8: 손상 후 시상 GFAP 및 Iba-1 면역형광. (A-C) 부상 정도가 증가함에 따라 GFAP 및 Iba-1 반응 영역이 증가합니다. 축척 막대: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
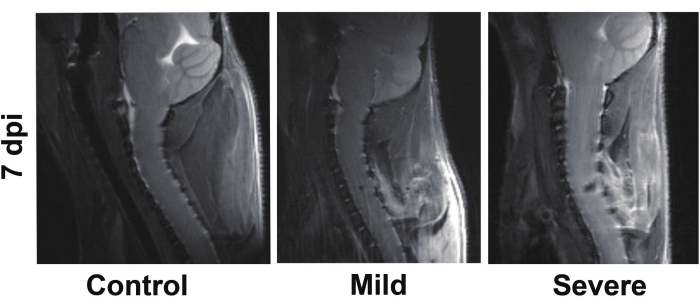
그림 9: 경추 척수 손상 후 시상 MRI(T2 가중 이미지). 부상 부위는 경증 및 중증 부상 그룹에서 저강도 신호로 관찰되었으며, 중증 부상 그룹에서는 저강도 신호 영역이 상당히 넓었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
척수 손상의 수많은 유형 중에서, CCS는 가장 잠재적으로 치료할 수 있는 손상 유형 중 하나이다 3,4. 실험실 연구 모델이 부족했기 때문에 1950년대의 CCS에 대한 연구는 임상 연구와 사체 해부 조사에 중점을 두었습니다 3,16,17. 본 연구는 호환 가능한 도구와 최소 침습 절차를 사용하여 마우스의 CCS 모델을 확립하는 방법을 보여줍니다. 기술적인 관점에서 이 플랫폼은 강력한 조작성과 우수한 재현성을 가지고 있습니다. 실험 결과가 타당성을 입증한다는 점을 감안할 때, 이전 연구에서 CCS4에 대해 정의한 표준에 가장 가까운 모델을 설정하는 기술이 있습니다.
압박 손상에 대한 이전 연구에서는 주로 동맥류 클립, 풍선 및 보정된 겸자를 사용했다 9,10,18. 더욱이, 대부분의 부상은 흉부 척수 수준에서 발생했다18. CCS의 특성을 조사하기 위해 이 연구에서 C6 수준의 척수를 손상된 부분으로 선택했습니다. CCS 모델의 생존율도 실험의 일관성을 보장하는 데 필수적인 요소라는 점에 주목할 필요가 있습니다. 본 연구는 쥐의 경추 척수에 양측 압박 손상을 유발하는 반면, 높은 수준의 척수 외상성 손상, 특히 양측 손상은 너무 심각할 경우 실험 동물에게 치명적일 수 있다고 보고했습니다. El-Bohy에 따르면, C4/5 척수는 하행 구근 척수관 및 호흡기 관련 운동 뉴런에 영향을 미칠 가능성이 더 높으며, 이는 실험 동물을 호흡 억제 및 사망으로 이끈다 18,19,20,21,22,23., 이 연구에서, C6 경추 척수의 압박 정도가 다른 마우스는 다음과 같이 제안하는 상당히 차별화된 손상 특성을 가지고 있습니다. 조직학적 검사. Forgione에 의해 보고된 마우스 경추 척수 클램핑 모델에는 상당한 행동 및 조직학적 차이가 있었지만, 변형된 클램프로 척수를 고정하기 위해서는 척추경, 관절 돌기, 층판, 심지어 신경근의 파괴가 필요했으며, 이는 자궁 경부 구조의 안정성에 상당한 영향을 미쳤다24. 자궁경부 손상에 대한 또 다른 연구에서는 횡돌기를 고정 부위로 사용하는 것으로 보고되었다5. 관절 돌기가 손상되는 것을 막았지만, 근육 조직이 과도하게 파괴되면 척수의 안정성에 영향을 미칠 수 있습니다. 본 연구에서는 경추 척수의 안정성을 유지하기 위해 6번째 경추 층만 절제하고 인접한 관절을 보존하고 과도한 근육 손상을 방지했습니다. 동시에 척수 위에서의 압박은 신경근의 손상을 방지합니다.
HE 결과는 각 그룹에서 마우스의 경추 척수 손상 부위가 주로 CCS를 특징짓는 중앙 코드 근처의 회백질에 있음을 시사하며, 다른 그룹 간에 손상 범위에 상당한 차이가 있음을 시사합니다. 특히, 우리가 표시한 병리학적 단면은 부상 후 며칠 후에 표본을 수집했기 때문에 부상 징후를 완화했을 수 있습니다. 면역형광(NF-200)은 척수 백질 영역의 신경관 손상이 적음을 보였으며, CCS의 손상이 주로 척수 주변에 집중되어 있음을 확인했습니다. 면역형광 결과는 병리학의 이전 조직학적 결과에 의해 복합되었습니다. 이전 연구에 따르면 CCS는 중심 척수 부근의 부종을 유발하여 혈종을 유발하고 궁극적으로 외측 피질 척수로의 내측 부분의 기능 장애를 초래한다3. 출혈은 CCS의 전형적인 구성 요소로 보고되었으나 후속 영상 및 부검 연구에서는 거의 나타나지 않았다17. 이 연구에서 부상 후 7일 후의 HE 결과는 모든 그룹에서 조직 부종의 징후를 시사했습니다. 그러나 부상 부위에 잔류 적혈구는 발견되지 않았다. 따라서 프러시안 블루를 사용하여 손상 부위의 출혈을 검사한 결과, 그 결과는 부상 후 7일에 중증 부상군의 손상 부위에서 관찰된 혈구증과 일치한 반면, 경증 그룹은 그렇지 않았습니다. MRI T2 영상은 경증 및 중증 부상 모두 부상 후 7일에 부상 손상 부위의 신호가 낮은 영역을 가지고 있음을 보여주었습니다. 여기에 망상적혈구 용해물의 침착을 나타냅니다. 이러한 결과는 이전에 보고된 소견들 사이의 불일치가 아마도 MRI 검사가 조직학적 검사(14)보다 잠재적으로 더 민감하기 때문이며, 부상의 중증도에 더하여, 손상 부위의 출혈량에 영향을 미칠 수 있다는 정황적 증거를 제공한다. GFAP는 또한 손상된 부위에서 광범위하게 발현되었습니다. 동시에 Iba-1 발현은 온전한 부위에서도 관찰되어 염증 반응의 지속성을 시사하며, MRI 결과와 일치하며, 병변의 저강도 신호 영역 주변의 고강도 신호 고리는 염증 반응의 존재를 시사합니다. 궁극적으로, 본 연구의 결과에 기초하여, 모델의 손상 부위는 중앙 탯줄 주위의 회백질에 초점을 맞추었으며, 이는 일반적으로 이전에 보고된 설명과 일치한다13. 불행히도, 우리는 부상 부위가 시간에 따라 어떻게 역동적으로 변하는지 보여주기 위해 모든 실험 동물에서 MRI를 반복적으로 수행하지 않았습니다. 미래의 연구자들은 CCS에 대한 더 나은 조사를 위해 이를 연구에 포함할 수 있습니다. 또한 회백질을 정의하는 NeuN과 같은 신경 마커를 사용한 면역 표지가 연구에 포함될 수 있습니다.
결론적으로, 병리학 및 MRI 스캔에 대한 결과의 특성은 이전 연구에서 CCS에 대해 설명한 것과 매우 유사하다4. CCS를 모델링하는 본 프로토콜은 CCS에 대한 추가 연구와 이해를 가능하게 합니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 줄기세포 및 형질전환 연구의 국가 핵심 연구 개발 프로젝트(2019YFA0112100)와 중국 국가 자연과학 국가 핵심 프로그램(81930070)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4% fixative solution | Solarbio | P1110 | 4% |
| Anti-Neurofilament heavy polypeptide antibody | Abcam | ab8135 | Dilution ratio (1:2000) |
| Eosin Staining Solution (water soluble) | Biosharp | BL727B | |
| Ethanol | Fuyu Reagent | ||
| Fluorescent microscope | KEYENCE | BZ-X800 | |
| Frozen Slicer | Leica | ||
| GFAP (GA5) Mouse mAb | Cell Signaling TECHNOLOGY | #3670 | Dilution ratio (1:600) |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher SCIENTIFIC | A32723TR | Dilution ratio (1:1000) |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 594 | ThermoFisher SCIENTIFIC | A32740 | Dilution ratio (1:1000) |
| Hematoxylin Staining Solution | Biosharp | BL702A | |
| Mice | Jinan Pengyue Experimental AnimalCompany | C57BL/6J | |
| Microsurgery apparatus | Shandong ULT Biotechnology Co., Ltd | All the surgey instruments are custom-made | Ophthalmic scissors, micro mosquito forceps, microsurgery forceps, micro scissors |
| Normal sheep serum for blocking (working solution) | Zhong Shan Jin Qiao | ZLI-9022 | working solution |
| O.C.T. Compound | SAKURA | 4583 | |
| Phosphate buffered solution (PBS) | Solarbio | P1020 | pH 7.2–7.4 |
| Prussian Blue Iron Stain Kit (With Eosin) | Solarbio | G1424 | |
| RWD Laboratory inhalation anesthetic station | RWD Life Science Co., Ltd | R550 | |
| Small animal in vivo microCT imaging system | PerkinElmer | Quantum GX2 | |
| Spinal cord injury coaxial platform | Shandong ULT Biotechnology Co., Ltd | Custom-made(Feng's standard) | https://shop43957633.m.youzan.com/wscgoods/detail/367x5ovgn69q18g?banner_id=f.81386274~goods.7~ 1~b0yRFKOq&alg_id= 0&slg=tagGoodList-default%2COpBottom%2Cuuid% 2CabTraceId&components_ style_layout =1&reft=1659409105184&spm= g.930111970_f.81386274&alias= 367x5ovgn69q18g&from_uuid= 1362cc46-ffe0-6886-2c65-01903 dbacbba&sf=qq_sm&is_share= 1&shopAutoEnter=1&share_cmpt =native_wechat&is_silence_auth=1 |
| Surgery microscope | Zumax Medical Co., Ltd. | zumax, OMS2355 | |
| Tris Buffered Saline+Tween (TBST) | Solarbio | T1082 | Dilution ratio (1:19) |
| Xylene | Fuyu Reagent |
참고문헌
- Liu, C., et al. Survival in 222 Patients With Severe CSCI: An 8-Year Epidemiologic Survey in Western China. Archives of Physical Medicine and Rehabilitation. 100 (10), 1872-1880 (2019).
- Qi, C., Xia, H., Miao, D., Wang, X., Li, Z. The influence of timing of surgery in the outcome of spinal cord injury without radiographic abnormality (SCIWORA). Journal of Orthopaedic Surgery and Research. 15 (1), 223 (2020).
- Brooks, N. P. Central cord syndrome. Neurosurgery Clinics of North America. 28 (1), 41-47 (2017).
- Avila, M. J., Hurlbert, R. J. Central cord syndrome redefined. Neurosurgery Clinics of North America. 32 (3), 353-363 (2021).
- Forgione, N., Chamankhah, M., Fehlings, M. G. A mouse model of bilateral cervical contusion-compression spinal cord injury. Journal of Neurotrauma. 34 (6), 1227-1239 (2017).
- López-Dolado, E., Lucas-Osma, A. M., Collazos-Castro, J. E. Dynamic motor compensations with permanent, focal loss of forelimb force after cervical spinal cord injury. Journal of Neurotrauma. 30 (3), 191-210 (2013).
- Allen, L. L., et al. Phrenic motor neuron survival below cervical spinal cord hemisection. Experimental Neurology. 346, 113832 (2021).
- Reinhardt, D. R., Stehlik, K. E., Satkunendrarajah, K., Kroner, A. Bilateral cervical contusion spinal cord injury: A mouse model to evaluate sensorimotor function. Experimental Neurology. 331, 113381 (2020).
- Ropper, A. E., Ropper, A. H. Acute spinal cord compression. The New England Journal of Medicine. 376 (14), 1358-1369 (2017).
- Sun, G. D., et al. A progressive compression model of thoracic spinal cord injury in mice: function assessment and pathological changes in spinal cord. Neural Regeneration Research. 12 (8), 1365-1374 (2017).
- Elzat, E. Y., et al. Establishing a mouse contusion spinal cord injury model based on a minimally invasive technique. Journal of Visualized Experiments. (187), 64538 (2022).
- Lu, J., Xu, F., Lu, H. LncRNA PVT1 regulates ferroptosis through miR-214-mediated TFR1 and p53. Life Sciences. 260, 118305 (2020).
- Zeng, H., et al. Lentivirus-mediated downregulation of α-synuclein reduces neuroinflammation and promotes functional recovery in rats with spinal cord injury. Journal of Neuroinflammation. 16 (1), 283 (2019).
- Bilgen, M., Al-Hafez, B., Berman, N. E., Festoff, B. W. Magnetic resonance imaging of mouse spinal cord. Magnetic Resonance in Medicine. 54 (5), 1226-1231 (2005).
- Yilihamu, E. E., et al. A novel mouse model of central cord syndrome. Neural Regeneration Research. 18 (12), 2751-2756 (2023).
- Chikuda, H., et al. Effect of early vs delayed surgical treatment on motor recovery in incomplete cervical spinal cord injury with preexisting cervical stenosis: A randomized clinical trial. JAMA Network Open. 4 (11), e2133604 (2021).
- Jimenez, O., Marcillo, A., Levi, A. D. A histopathological analysis of the human cervical spinal cord in patients with acute traumatic central cord syndrome. Spinal Cord. 38 (9), 532-537 (2000).
- Menezes, K., et al. Human mesenchymal stromal/stem cells recruit resident pericytes and induce blood vessels maturation to repair experimental spinal cord injury in rats. Scientific Reports. 10 (1), 19604 (2020).
- Hutson, T. H., Di Giovanni, S. The translational landscape in spinal cord injury: focus on neuroplasticity and regeneration. Nature Reviews. Neurology. 15 (12), 732-745 (2019).
- El-Bohy, A. A., Schrimsher, G. W., Reier, P. J., Goshgarian, H. G. Quantitative assessment of respiratory function following contusion injury of the cervical spinal cord. Experimental Neurology. 150 (1), 143-152 (1998).
- El-Bohy, A. A., Goshgarian, H. G. The use of single phrenic axon recordings to assess diaphragm recovery after cervical spinal cord injury. Experimental Neurology. 156 (1), 172-179 (1999).
- Gonzalez-Rothi, E. J., Lee, K. Z. Intermittent hypoxia and respiratory recovery in preclinical rodent models of incomplete cervical spinal cord injury. Experimental Neurology. 342, 113751 (2021).
- Locke, K. C., Randelman, M. L., Hoh, D. J., Zholudeva, L. V., Lane, M. A. Respiratory plasticity following spinal cord injury: perspectives from mouse to man. Neural Regeneration Research. 17 (10), 2141-2148 (2022).
- Forgione, N., et al. Bilateral contusion-compression model of incomplete traumatic cervical spinal cord injury. Journal of Neurotrauma. 31 (21), 1776-1788 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유