적정 소개
Overview
출처: 예니탄 박사 연구소 — 과학기술 연구기관
적정은 확인된 분석물의 알 수 없는 농도를 정량적으로 결정하는 데 사용되는 일반적인 기술이다. 1-4 적층에서 볼륨 측정이 중요하기 때문에 체적 분석이라고도 합니다. 그들이 악용하는 반응의 유형에 따라 적정의 많은 유형이 있습니다. 가장 일반적인 유형은 산염-베이스 적정 및 레독스 적정입니다. 5-11
일반적인 적정 과정에서, 부렛의 적재물의 표준 용액은 점차적으로 Erlenmeyer 플라스크에서 알 수없는 농도로 마취제와 반응하도록 적용됩니다. 산염-염기 적층의 경우, pH 표시기는 일반적으로 적층의 종점을 나타내기 위해 해석물 용액에 첨가된다. 12 pH 표시기를 추가하는 대신, pH는 적정 과정에서 pH 미터를 사용하여 모니터링할 수 있으며 끝점은 pH 적정 곡선에서 그래픽으로 결정됩니다. 끝점에 기록된 적재물의 부피는 반응 스토이치오메트리에 기초하여 분석물의 농도를 계산하는 데 사용될 수 있다.
이 비디오에 제시된 산염-베이스 적정의 경우, 적재제는 표준화된 수산화나트륨 용액이며, 아닐리바이트는 국내 식초이다. 식초는 요리 조미료 나 향료로 자주 사용되는 산성 액체입니다. 식초는 주로 아세트산(CH3COOH)과 물로 구성됩니다. 상업용 식초의 아세트산 함량은 크게 다를 수 있으며, 이 실험의 목적은 적정에 의해 상업용 식초의 아세트산 함량을 결정하는 것이다.
Principles
식초에 아세트산의 결정은 산염 제티티네이션 방법의 원리를 기반으로 합니다. NaOH와 CH3COOH 사이의 반응은 방정식 1에표시됩니다 :
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2 (aq) (1)
표준화된 NaOH 용액은 끝점에 도달할 때까지 알 수 없는 아세트산 농도를 가진 식초에 점진적으로 첨가됩니다. 산염-염기 적층 동안, pH는 첨가된 적재물의 부피의 함수로서 플롯될 수 있다. 곡선의 변곡점은 용액에 동일한 양의 산과 염기가 있는 지점인 등가점이라고 합니다. 대부분의 산과 염기는 무색이며, 등가지점에서 눈에 보이는 반응이 발생하지 않습니다. 등가점에 도달한 시기를 관찰하기 위해 pH 표시등이 추가됩니다. 끝점은 동등점이 아니라 pH 표시기가 색상을 변경하는 지점입니다. 종점이 적정의 동등점에 최대한 가깝도록 적절한 pH 표시기를 선택하는 것이 중요합니다.
이 반응의 끝에서, 컨쥬게이트 베이스 NaCH3CO2는 약간 기본이다. Phenolphthalein 표시기는 pH 8.2 위의 산성 용액 및 마젠타에서 무색인 8.3-10.0의 작동 pH 범위를 가지고 있습니다. 따라서 페놀펜트할린은 이 조건에서 무색에서 분홍색으로 변하기 때문에 바람직한 지표이다. 실험을 수행할 때 pH 지표 자체는 일반적으로 베이스와 반응하는 약한 산이기 때문에 pH 지표의 농도를 낮게 유지하는 것이 가장 좋습니다.
상기 방정식의 스토이치오메트리에 기초하여 아세트산의 어금니 농도를 계산하기 위해 엔드포인트에 추가된 표준화된 NaOH 용액의 부피를 사용할 수 있다. 이 실험에서, titrant NaOH는 강한 알칼리성이고 분석아세트산은 약한 산이다.
실험을 수행하기 전에 NaOH의 히스테리 성품을 고려하는 것이 중요합니다. 이 특성은 칼륨 수소 프탈레이트(KHC8H 4 O4)와같은안정적인 기본 표준으로 솔루션을 표준화해야 합니다. NaOH 용액의 정확한 어금니 농도는 표준화 후 정확하게 결정될 수 있습니다. 1차 산 표준과 NaOH 간의 반응은 수학식 2에표시됩니다.
KHC8H4O4 (aq) + NaOH(aq) → H2O(l) + NaKC8H4O4 (aq) (2)
자세한 단계별 적정 프로토콜은 다음 섹션에 표시됩니다.
Procedure
1. 칼륨 수소 프탈레이트와 NaOH의 표준화 (KHC8H4O4)
- 우선, 적성, 수산화 나트륨은 표준화되어야 합니다. 100mL의 탈수에 NaOH 펠릿 약 4g을 용해시켜 재고 NaOH 용액을 준비합니다. NaOH는 피부에 부식성 및 자극성 인 유해 화학 물질로 피부나 눈접촉을 피하기 위해 신중하고 적절한 개인 보호 장비 (PPE)를 착용하십시오.
- 수산화나트륨 용액의 25mL를 500mL 병에 첨가하여 수산화나트륨 용액의 1:10 희석을 한다. 수산화 나트륨은 이산화탄소를 흡수합니다. 삶은, 탈이온 된 물, 오븐 건조 병을 사용하고 병을 빨리 캡으로써이를 방지하는 것이 중요합니다. 탈이온된 물로 최대 250mL의 용액을 만들고 흔들어 섞어 줍니다.
- 1차 표준산의 4-5g을 건조하고, KHC8H4O4는 건조 오븐에서 4시간 동안 110°C에서 건조한 다음 1시간 동안 건조기에서 고체를 식힙니다.
- 건조 된 KHC8H4O4의 약 4 g를 250 mL에 탈온 화 된 물. 질량을 정확하게 기록합니다. KHC8H 4 O4 용액의 어금니 농도를 계산합니다.
- KHC8H 4 O4의파이펫 25 mL은 깨끗하고 건조한 에를렌마이어 플라스크에 넣습니다. 페놀펜트할린 2방울을 넣고 부드럽게 소용돌이어 잘 섞습니다. 페놀펜트할린은 독성이 있고 자극적이며 피부나 눈접촉을 피하기 위해 주의하십시오.
- 50mL 버렛과 세제와 물로 깔때기를 철저히 청소하십시오. 부렛을 물로 씻어 내고 3배를 탈수물로 헹구세요. 희석된 NaOH 용액을 3배로 부로를 헹구고 NaOH가 내부 표면 전체를 적시고 팁을 통해 폐기물을 배출합니다. 클램프가 달린 링스탠드에 세척된 버렛을 장착하고 수직으로 서 있는지 확인합니다.
- 희석된 NaOH 용액으로 깨끗한 부렛을 채웁니다. 희석된 NaOH의 양은 정확히 0마크에 있어야 하지만 스케일 내에 있어야 하며 적어도 하나의 적정에 충분해야 합니다. 기포는 부피 판독의 정확도에 영향을 줄 수 있습니다. 조심스럽게 거품에 대한 부렛을 확인하고, 부드럽게 그들을 해제하고 티트란트의 몇 mL을 통해 흐르고 동시에 갇혀 공기를 해제 할 수 있도록 스톱콕을 엽니 다. 10s 이후 반월 상연연의 바닥을 확인하여 볼륨을 읽으십시오. 이 초기 볼륨을 기록합니다. 독서의 중요한 수치에주의를 기울이라. 값을 mL에서 소수점 두 개로 기록합니다.
- 부렛 아래에 칼륨 수소 프탈레이트(KHC8H4O4)가함유된 Erlenmeyer 플라스크를 배치하고 부렛의 높이를 적절히 조정합니다. KHC8H4O4 용액을 1-2mL 증분에 천천히 추가하여 스톱콕을 조정하여 유속을 조절하고 다른 하나는 플라스크를 소용돌이시다.
- 끝점에 가까워지면 적점 드롭을 추가하여 추가합니다. 솔루션이 희미하고 지속적인 분홍색 색상을 전환하면 끝점에 도달합니다. 버렛에 희석된 NaOH의 최종 부피를 기록합니다.
- 일관된 데이터를 얻으려면 적정을 적어도 두 번 이상 반복합니다. 희석된 NaOH 용액의 어금니 농도를 계산합니다.
2. 표준화된 수산화나트륨 용액으로 식초의 적정
- 수산화 나트륨 용액이 표준화되어 식초를 분석하는 적재물로 사용할 수 있습니다. 식초의 매운 향기를 줄이기 위해 식초 용액의 10mL를 1:10 로 100 mL의 총 부피로 희석시 하십시오.
- 파이펫 25 mL의 질산, 깨끗하고 건조한 에를렌마이어 플라스크 (VA로언급). 페놀펜탈린 2방울을 넣습니다.
- 프로시저의 첫 번째 부분에서 표준화된 NaOH 솔루션으로 부렛을 채웁니다. 초기 적부(V1)를기록합니다.
- 표준화된 NaOH 용액을 식초에 점진적으로 추가합니다. 적음부가 예상 값에 접근할 때 스톱콕을 조정하여 적음 방울을 추가합니다. 한 손으로 플라스크를 계속 소용돌이침하고 다른 한 손으로 스톱콕을 닫을 준비를 하십시오. Aalyte 솔루션이 밝은 분홍색 색상으로 변경되면 몇 초 동안 소용돌이하여 색상이 페이드 될지 확인합니다. 색상이 지속되면 적정이 끝점에 도달합니다. 티란트(V1')의최종 볼륨을 기록합니다. 솔루션 색상이 페이드인 경우 한 방울의 적갈색을 더 추가합니다. 워시 병을 사용하여 버렛의 바닥 끝을 씻으세요. 세척 된 혼합물을 수집하고 마취용액의 색상 변화를 지켜보십시오. 끝점까지 적정을 계속합니다. 필요한 적중량(Vt1 = V 1 ' V1)을기록합니다.
- 서로의 0.1 mL 이내의 3개의 일치값이 얻어질 때까지 적어도 두 번 적정을 반복한다(Vt2 및 Vt3).
- 세 가지 다른 적정에서 얻은 세 가지 값을 사용하여 적판 볼륨의 평균 값을 계산: Vt = (Vt1 + Vt2 + Vt3)/3. 식초에 아세트산의 어금니 농도는 따라서 방정식 3을사용하여 계산될 수 있다.
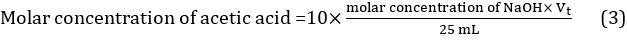
Results
| 단위 | 평가판 1 | 평가판 2 | 평가판 3 | |||
| 희석 식초산의 부피 (VA) | mL | 25.00 | ||||
| 나오의 몰 농도 (cNaOH) | mol/L | 0.09928 | ||||
| NaOH의 초기 버렛 읽기 | mL | 0.10 | 0. 05 | 1.20 | ||
| NaOH의 최종 burette 읽기 | mL | 18.75 | 18.60 | 19.80 | ||
| 나오의 볼륨분배 | mL | 18.65 | 18.55 | 18.60 | ||
| NaOH 디스펜싱(Vt)의평균 부피 | mL | 18.60 | ||||
표 1. 적정 결과.
샘플 계산:
KC8H5O4 = 4.0754 g의 질량
KC8H5O4 = 204.22 g/mol의 몰 질량
25.00 mL 표준 솔루션에서 KC8H5O4의 두더지 수 = 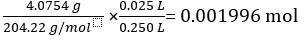
방정식 2에 따르면,
희석된 NaOH 용액의 농도 = 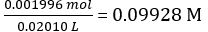
NaOH의 몰 = NaOH의 농도 = NaOH × 평균 부피 = 0.09928 mol/L × 18.60 mL = 1.847 × 10-3 mol
방정식 1에 따르면,
희석 식초 25.00mL에서 CH3COOH의 두더지 수 = 1.847 × 10-3 mol
희석 식초의 농도 = 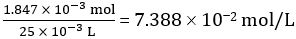
따라서 희석되지 않은 식초의 농도 = 10 × 7.388 102 mol /L = 0.7388 mol /L
위의 단계는 계산 절차를 설명하기 위해 제공됩니다. 우리는 단순히 한 단계에서 희석되지 않은 식초의 농도를 얻기 위해 방정식 3을 적용 할 수 있습니다.
따라서 희석되지 않은 식초 1.000 L에는 CH3COOH의 0.7388 몰이 들어 있습니다.
CH3COOH의 부피 =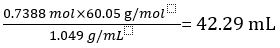
식초의 볼륨 퍼센트 =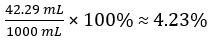
Application and Summary
적정은 현재 화학 연구에서 자주 적용되는 중요한 화학 방법입니다. 예를 들어, 산염 염기 적층은 시료의 아민 또는 하이드록실 값을 결정하기 위해 적용됩니다. 아민 값은 샘플 의 한 그램에 아민 함량에 상응하는 KOH의 밀리그램의 수로 정의된다. 하이드록실 값을 결정하기 위해 분석체는 먼저 아세트 성 무수화물을 사용한 다음 KOH와 함께 적정됩니다. KOH의 밀리그램의 질량은 1 그램의 샘플에서 하이드록실 그룹에 해당합니다. 13 또 다른 예는 윙클러 시험, 수질 연구를 위한 수질 연구를 위한 물에 용존산소의 농도를 결정하는 데 사용되는 특정 유형의 레독스 적정이다. 용존 산소는 망간 (II) 황산염을 사용하여 감소, 다음 요오드 칼륨과 반응요오드를 생산. 방출된 요오드는 산소 함량에 직접적으로 비례하기 때문에 산소 농도는 전분 표시기를 사용하여 티오술파테와 요오드를 적정하여 결정됩니다. 14
기본 화학 연구의 응용 프로그램 외에도, 적정은 또한 널리 산업 및 일상 사용에 채택되고있다. 바이오 디젤 산업에서, 폐기물 식물성 기름 (WVO) 먼저 바람직하지 않은 비누를 만들기 위해 일반적으로 반응 하는 무료 지방산을 제거 하기 위해 중화 해야 합니다. WVO의 일부는 시료 산도를 결정하기 위해 베이스로 화티처리되므로 나머지 배치는 적절히 중화될 수 있습니다. 15 베네딕트의 방법, 소변 포도당 수준의 정량화에 대 한 테스트, 의료에서 적정의 중요성을 보여주는 또 다른 예입니다. 이 적정에서, 컵 리온은 포도당에 의해 컵 이온으로 감소, 다음 백색 침전을 형성 하기 위해 칼륨 티오야네이트와 반응, 끝점을 나타내는. 16
References
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
적정 소개
General Chemistry
425.1K Views

일반적인 실험실 유리 제품 및 사용
General Chemistry
657.3K Views

솔루션 및 농도
General Chemistry
274.6K Views

고체 및 액체밀도 결정
General Chemistry
556.5K Views

수성 솔루션에서 질량 백분율 구성 결정
General Chemistry
383.7K Views

경험적 공식 결정
General Chemistry
182.8K Views

이온 화합물의 용해도 규칙 결정
General Chemistry
141.5K Views

pH 미터 사용
General Chemistry
346.5K Views

이상적인 가스 법
General Chemistry
78.6K Views

평형 상수의 분광측정 결정
General Chemistry
158.6K Views

르 샤텔리에의 원리
General Chemistry
265.7K Views

알 수 없는 화합물을 결정 하는 동결 포인트 우울증
General Chemistry
160.7K Views

금리법 및 대응 순서 결정
General Chemistry
196.2K Views

차동 스캐닝 열량측정을 사용하여 엔탈피의 변화를 측정합니다.
General Chemistry
44.5K Views

조정 화학 단지
General Chemistry
91.6K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유