Method Article
Multi-fotão imagem de invasão das células tumorais em um modelo de camundongo ortotópico de carcinoma epidermóide oral
Neste Artigo
Resumo
Uma visão abrangente das técnicas envolvidas na geração de um modelo do rato de câncer oral e monitorização quantitativa de invasão tumoral dentro da língua por meio de microscopia multi-fotão de células marcadas é apresentado. Este sistema pode servir como uma plataforma útil para a avaliação molecular e eficácia de drogas anti-invasivos compostos.
Resumo
Loco-regional invasão do câncer de cabeça e pescoço está ligada ao risco metastático e representa um difícil desafio na concepção e implementação de estratégias de manejo do paciente. Modelos de ratos ortotópico de câncer bucal foram desenvolvidos para facilitar o estudo dos fatores que a invasão de impacto e servir como sistema modelo para a avaliação da terapêutica anti-tumor. Nestes sistemas, a visualização de células tumorais disseminadas dentro dos tecidos da cavidade oral tem sido tipicamente conduzida por um ou outro histologia convencional ou com métodos in vivo bioluminescente. A principal desvantagem dessas técnicas é a incapacidade inerente à precisão visualizar e quantificar a invasão de células do tumor inicial decorrente do site principal em três dimensões. Aqui nós descrevemos um protocolo que combina um modelo estabelecido para o carcinoma de células escamosas da língua (SCOT), com imagens de dois fótons para permitir a multi-vectorial visualização de disseminação do tumor lingual. O OSC-19 de cabeça e pescoço linha celular do tumor foi projetado de forma estável para expressar a F-actina LifeAct peptídeo de ligação fundida à proteína fluorescente mCherry (LifeAct-mCherry). Fox1 nu / nu camundongos injetados com essas células de forma confiável formam tumores que permitem a língua para ser visualizado pelo ex-vivo aplicação de dois fótons de microscopia. Esta técnica permite a visualização ortotópico da massa tumoral e localmente invadir as células excisadas em línguas sem interrupção do microambiente do tumor regional. Além disso, este sistema permite a quantificação de invasão das células tumorais, calculando distâncias que invadiu mover células a partir do local do tumor primário. Em geral, este procedimento fornece um sistema modelo avançado para análise dos fatores que contribuem para SCOT invasão e tratamentos terapêuticos adaptados para evitar a invasão local e metástase distante. Este método também tem o potencial para ser, em última análise combinada com outras modalidades de imagem em uma configuração em vivo.
Protocolo
1. Linhas de celular, Construção Vector e Produção Lentivirus
- Cabeça humana e células pescoço tumor linhas (OSC19 ou UMSCC1) foram cultivados em meio completo composto por DMEM (Cellgro gato # 50-003-PB) suplementado com 10% de soro fetal bovino FBS (Hyclone # cat SH30070.03), penicilina 1% / estreptomicina (Cellgro gato # 30-002-CI), e 1% não-aminoácidos essenciais (Cellgro gato # 25-025-CI).
- Para transferir a seqüência LifeAct-mCherry codificação no vetor pLL7.0 lentiviral, o sítio de reconhecimento Sbf1 na mCherry pai cDNA foi alterado pela introdução de três mutações em silêncio na seqüência de reconhecimento usando mutagênese sítio-dirigida (Stratagene cat # 200518-5). O resultado modificado seqüência LifeAct-mCherry foi então PCR amplificados com acompanhamento EcoR1/Sbf1 sites e subclonado em pLL7.0 para gerar a construção pLL7.0-LifeAct-mCherry.
2. pLL7.0-LifeAct-mCherry Produção Virus
- Produção viral foi conduzido de acordo com a Expressão Lentivirus Sistemas manual (versão do sistema Bioscience 2-051018).
- A linhagem celular embalagem 293T/17 células (ATCC # cat CRL-11268) foi cultivado a confluência de 40% na mesma mídia utilizada para completar linhas CECP.
- As células foram transfectadas com o pLL7.0-LifeAct-mCherry, psPAX2 e pVSV-G vetores em uma proporção de 03:02:01, respectivamente usando CalPhos (Clontech cat # 631312).
- Após 24 horas, a mídia inicial do transfecção foi substituído com a mídia fresco.
- Mídia foi coletado e reabastecidos a cada 12 horas para 72 horas e armazenadas a 4 ° C.
3. Produção de Cabeça e Pescoço linhagens de células com expressão LifeAct mCherry-Stable
- A mídia coletado foi centrifugado a 2000 rpm por 10 minutos a 4 ° C.
- Um ml de mídia esclareceu que contenham vírus foi adicionado diretamente OSC19 ou UMSCC1 células por 12 horas. As células foram então lavadas, e um adicional de um mL de vírus foi adicionado por um novo período de 12 horas.
- Células foram tratadas com a mídia contendo puromicina 200mg/ml durante duas semanas para selecionar colônias resistentes.
- Clones sobreviventes foram examinados visualmente para LifeAct-mCherry expressão por microscopia de fluorescência. Individuais colônias positivas foram typsinized usando discos estéreis clonagem 3mm (Fisher cat # 0790710A).
- Células positivas foram mantidas em meios contendo puromicina 200mg/ml até congelados para trás ou utilizadas para a injeção ortotópico.
4. Formação Xenoenxerto ortotópico Tumor
- Todos os procedimentos com animais foram conduzidos de acordo com um protocolo (09-0821), aprovado pelo Animal Care West Virginia University e do Comitê Use.
- LifeAct-mCherry células tumorais que expressam foram tripsinizados, centrifugado e 2,5 x 10 4 células foram ressuspendidas em 50 mL de mídia completo.
- Células tumorais foram carregados para uma seringa ml um ligado a uma agulha de calibre 27 ½.
- Feminino atímicos fox1 nu / nu ratos de 8 semanas de idade (Harlan Laboratories) foram anestesiados com a combinação de 80mg/kg de ketamina e 10mg/kg de xilazina. Ratos anestesiados foram mantidos entre 37-40 ° C em uma almofada de aquecimento.
- Utilizando uma pinça estéril, a ponta da língua foi gentilmente agarrou e cuidadosamente retirado da cavidade oral.
- As células foram injetadas lentamente em um lado de cada língua para criar uma massa bulbosa no centro da língua, evitando as artérias lingual.
- Camundongos foram injetados com ioimbina 2.1mg/kg e voltou para a almofada de aquecimento, onde foram monitorados por 2-3 horas durante a recuperação da anestesia.
- Uma vez reviveu, os camundongos foram colocados em gaiolas estéreis, contendo uma dieta massa macia transgênicos (Bioserve cat # S3472).
- Camundongos foram pesados a cada 2-3 dias e monitorada visualmente para o surgimento do tumor.
5. Preparação de Línguas do mouse para Ex-vivo de imagens
- Camundongos portadores de tumores em momentos diferentes (tipicamente 2-4 semanas após a injecção) foram sacrificados por inalação de dióxido de carbono.
- As línguas foram extraídas, lavadas com PBS 1X e anexado a um lado de uma cassete convencional parafina tecido (StatLab Cat # H104), utilizando linhas de costura de monofilamento de uma loja local do passatempo e um tamanho de agulha de costura 8.
- Uma vez que as línguas foram imobilizados, o conjunto de cassetes inteira foi colocada em um prato de 30 milímetros de cultura de tecidos e imerso em 1X PBS.
- Línguas processadas foram imediatamente utilizados para dois fótons de microscopia de excitação.
6. Imagem de Tumores Tongue com dois fótons Microscopia
- Cassetes língua foram submersas em um prato de 60 milímetros contendo 1X PBS garantido em um suporte personalizados em um braço cantilever retrátil (Câmara Shuttle, Siskiyou instrumentos) posicionada no âmbito do objectivo de um microscópio vertical (Microscópio móveis (MOM); Instruments Sutter).
- A água 40X/0.8NA lente objetiva de imersão foi colocada diretamente ou sobre tum visívelou lesões. Línguas foram fotografadas ao microscópio de dois fotões com o Ti: safira laser (Mira, Coherent) de intensidade de 60 mW e comprimento de onda de entrada de 755 nm para otimizar o sinal mCherry.
- Serial 1 milímetro digitalização de imagens a laser foram coletadas em profundidades de 1 mícron incremental em uma profundidade de tecido total entre 15 e 100 mm (dependendo do volume do tumor). As imagens foram capturadas scanimage, um programa de código aberto baseado na plataforma MATLAB, que foi desenvolvido pela Svoboda Karel laboratório (Janelia Farms, HHMI). Scanimage gera uma saída de dois canais de padrões raster scan para controlar a x / y espelhos galvanométricos scan, e ao mesmo tempo, capta um sinal de entrada máxima de quatro canais simultaneamente a partir de tubos fotomultiplicadores (PMTs) através de uma placa de aquisição de dados (PCI-6610S , National Instruments). A PMT sinais são amplificados por amplificadores de baixo ruído de corrente (SR570, Stanford Research System) antes da alimentação na placa NI-DAQ para exibição na tela do monitor. Scanimage coleta z-stack imagens por meio do controle do eixo z do objectivo e coleta de lapso de tempo imagens em um único modo ou de bicicleta. As imagens foram salvas em um único arquivo TIFF com 16 bits de profundidade.
7. Análise de imagem usando Amira Software
- Amira imagem para a quantificação do tumor: Em software Aimra, abra o arquivo TIFF que contém o conjunto de z-stack imagens.
- Realce o nome do arquivo, selecionar e aplicar a função Voltex para gerar um rendering tridimensional. A imagem primária grande tumor com vários menores, dissociada grupos invasiva (IG) de células coletivamente invadido é tipicamente evidente na imagem processada (Figura 6A).
- Para selecionar a massa do tumor primário, selecione "Open Data", então "rotulagem", então "Campo Label".
- Limiarização do tumor primário-selecionar todas as imagens z-stack e percorrer as imagens do z-plano para assegurar a inclusão de apenas massa tumoral primária em três dimensões. Isto é tipicamente a maior imagem de tamanho no campo e muitas vezes aparece segmentado como o imaginado é percorrido através do z-plano.
- Use a função wand / limiar mágico para corrigir fluorescência de fundo e eliminá-la a partir da imagem, sem descartar nenhum dos sinais do tumor. Destacar a "Inside File" etiqueta e clique no botão ⊕. Selecione a opção "Todas as Slices" caixa de seleção. Isso produz uma borda colorida ao redor da área do tumor primário em thresholded cada incremento z-stack.
- Para selecionar IGs, escolha a função "Novo". Selecione um IG única e garantir que ele não está associado com o tumor primário percorrendo a z-plano.
- Selecione "Todas as Slices" e clique no botão ⊕. Renomeie o arquivo (ex: IG 1)
- Repita o procedimento de limiarização em 7,4 eo passo destacando em 7.5 para o IG determinado. Selecione uma cor de contorno diferente do que a cor usada para designar a massa do tumor primário.
- Repita conforme necessário para cada IG adicionais em toda a imagem, a digitalização através do z-plano para garantir que todos IGs são indicadas. Usando cores diferentes para cada uma identificada IG auxilia na identificação futura sobre a imagem.
- Uma vez que o tumor primário e todos os IGs são selecionados, selecione "segmentação" no menu suspenso, selecione "Estatísticas Material". Isso proporciona a medição de volume, bem como o X, Y e X núcleo tumor coordenadas para o tumor primário a fim de calcular distâncias de IGs a partir do ponto central do tumor.
- Com os volumes calculados, determine a distância para cada IG a partir do núcleo central do tumor primário. Selecione "segmentação", depois em "Estatísticas Material". Este passo calcula todas as medidas em pixels. Converter os pixels para micrômetros com base na calibração da objetiva do microscópio e qualquer aumento adicional na ampliação (ou seja, funções de zoom). Para o microscópio e as configurações utilizadas nesses experimentos, a objetiva de 40X foi usado sem zoom, dando uma calibração de 1 pixel = 0,298 mM. Importar dados para uma planilha do Excel, o que dá parâmetros para o tumor primário em três dimensões (X1, Y1, Z1) e para cada IG (ex: X2, Y2, Z2 para o IG primeiro).
- A distância invadido em microns para cada IG a partir do centro do tumor primário é calculado pela fórmula √ ((X2-X1) 2 + (Y2-Y1) 2 + (Z2-Z1) 2).
- O índice de tumor invasivo (T I) é calculado pela fórmula I = T N T x V x T D T, onde T = N o número total de IGs na imagem, V T = o volume total de todas as IGs, D T = distância total percorrida de todos os grupos invasivos do centro do tumor primário.
8. Três dimensões, com renderings Nikon Software NIS Elements
- Três representações tridimensionais com maior detalhe topográfico pode ser gerada por meio da importação do original de 16 bits arquivos TIFF monocromático da imagem tumor inteiro para o software Nikon NIS Elementspacote (Nikon, Melville, NY). Selecione "File", depois em "Key", depois "Criar arquivo ND da seqüência de arquivo". Selecione a imagem TIFF pilha z-series e especificar o tamanho do passo adequado.
- Calibrar o documento ND no plano xy. Especificar o tamanho de um pixel usando uma calibração manual.
- Escolha a opção "Ver Volume". Use o "HQ" função para calcular fatias adicionais no z-plano para maior qualidade. Na seção "Configurações 3D Renderer", use o "Advanced Renderer" com uma qualidade de "Ultra Alta Detalhes" e "Resolução Full". Escolha "Alpha Blending" para acentuar as superfícies tumor.
- Otimizar a imagem tridimensional para a apresentação. Dê um zoom no tumor e IGs associados e de culturas, conforme necessário. Rodar a imagem no plano xyz e ajustar o LUTs.
- Capturar a imagem de apresentação. Selecione "Edit-Criar Ver Snapshot (8 bit RGB)". Nome e salvar o arquivo em conformidade.
9. Resultados representante
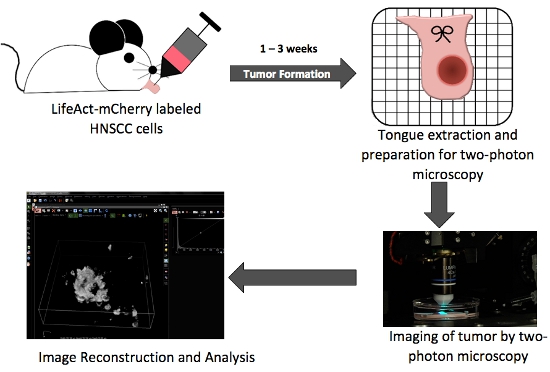
Figura 1. Esquemática geral ilustrando passos-chave na produção ortotópico língua tumor in situ e imagens de dois fótons.
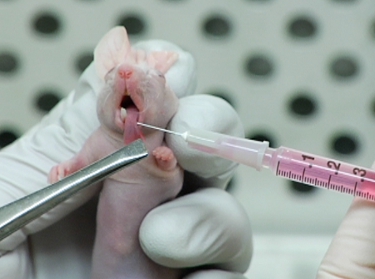
Figura 2. Injeção de LifeAct-mCherry expressar OSC19 células para a língua mouse.
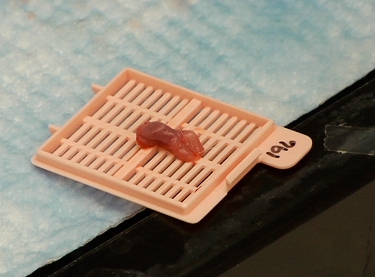
Figura 3 ressecado língua do mouse tumor contendo preparado para duas imagens fóton.

Figura 4. Orientação de língua tumor contendo na posição em um microscópio dois fótons pronto para geração de imagens.
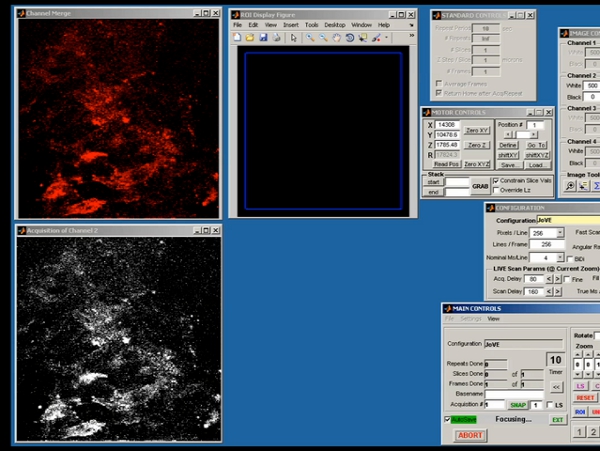
Figura 5. Ecrã Representante tiro de scanimage demonstrando aquisição de dados brutos da imagem de dois fótons inicial.
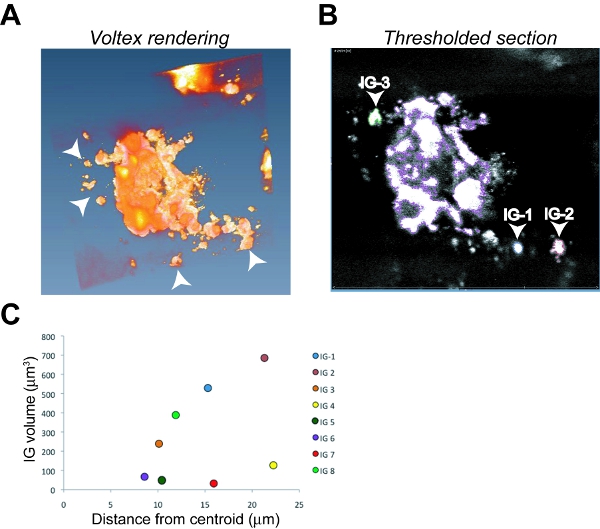
Figura 6. Análise de Imagens e quantificação de invasão do tumor em um tumor OSC19 ortotópico. Imagens da tela representante tiro de Amira renderização Voltex (A) e um único thresholded z-seção (B) com o tumor primário primário descrito no grupo, roxo invasivos 1 (IG-1) descrito no azul, IG-2 destacados em vermelho e IG -3 delineada em verde como um exemplo do procedimento de identificação. Setas indicam IGs em (A) e (B). Plots C. de volume versus invadiu a distância para oito IGs individuais utilizados para calcular o índice de invasão do tumor (Ti).
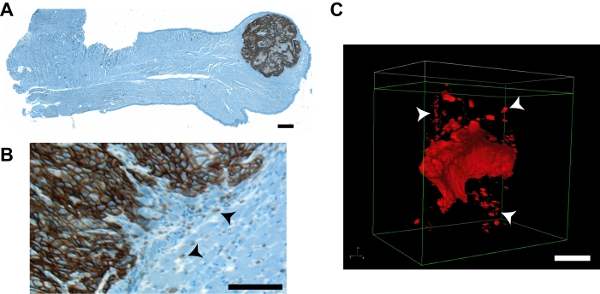
Imagens figura 7. Representante de tumores e invadiu grupos tumor a partir deste protocolo, em relação com imagens de uma abordagem IHC convencionais. A. seção de parafina de uma língua do mouse toda abrigar um tumor UMSCC1 ortotópico. Coloração imuno-histoquímica foi realizada utilizando os procedimentos convencionais com um anticorpo primário contra o CECP específicos de células marcador emmprin (Zymed; cat # 34-5600) a 1:1000 de diluição e visualizados usando o OmniMap DAB anti-Rb detecção kit (Ventana cat # 760 -149), seguido de coloração com hematoxilina de ferro. Imagens englobando a área da língua total foram coletados individualmente com ampliação de 4X em um microscópio Olympus Provis ZX70 com uma câmera CCD MicroFire Optronics e reconstruído usando o pacote de imagens StereoINvestigator (MBF Bioscience). O tumor é evidente na ponta da língua. Uma região alargada mostrando o front invasivo e grupos individuais de células tumorais (setas) é mostrado em (B). Nikon C. renderização NIS-Elementos de um tumor OSC19 representante. Detalhes do contorno aprimorado e visualização clara de IGs (setas) é evidente. Bares em todas as imagens = 100 mm.
Discussão
Modelos de ratos ortotópico provaram ser úteis para o estudo de muitos aspectos da cabeça e pescoço 1,2. Nós combinamos um sistema bem estabelecido ortotópico de SCOT 3 com imagens de microscopia de dois fótons de células-mCherry rotulado como um sistema para estudar os eventos iniciais da cabeça e pescoço invasão das células tumorais. Neste procedimento, observamos que as células podem vazar a partir do local da injeção do tumor, especialmente em ratos seis semanas ou mais jovens devido ao tamanho da língua insuficiente. Nós usamos ratos mais velhos para evitar esse problema. O tamanho maior língua com ratos mais velhos também ajuda a evitar a ruptura de uma artéria lingual e hemorragia excessiva da língua. Tirar tumor é muito maior quando a língua incha dramaticamente no local da injeção inicial. Este inchaço desaparece dentro de 1-2 horas, como o fluido injetado é absorvido. O crescimento do tumor parece evidente 1-2 semanas pós-injeção com o número de células injetadas indicado como uma pequena protuberância branca na superfície da língua. Observamos também que na objetiva de 40X utilizado em nossos estudos aqui apresentados, não podemos distinguir células tumorais individuais, mas se identificam IGs como aglomerados de células invasoras que recapitulam o modo típico de invasão CECP.
Até o momento este modelo tem sido amplamente utilizada para testar o papel de moléculas específicas, bem como várias drogas anti-tumorais sobre o crescimento SCOT uma invasão, com eficácia medida por metástase de linfonodo cervical monitorados usando IHC ou bioluminescente métodos 4-7. Tumores formados nesta manifestar sistema perto da superfície da língua (Figura 7), permitindo a aplicação de dois fótons de microscopia para tumores imagem inteira in situ como invasivos multi-celular clusters. O procedimento também pode ser utilizada para visualizar a invasão do tumor com resolução de celular. Microscopia de dois fótons foi previamente utilizada para estudar tratamentos experimentais para câncer de cabeça e pescoço em 8,9 ortotópico e xenoenxerto 8,10 modelos. No entanto, existem duas grandes diferenças entre esses relatórios e nosso protocolo. Em primeiro lugar, esses estudos utilize etiquetas extracelular para target / cabeça e identificar células tumorais no pescoço, possivelmente limitando a detecção apenas para células tumorais, com amplo acesso à circulação. Invasão, segundo as células do tumor próximo ao local primário que recapitula provável atividade metastática precoce não foi avaliada como um parâmetro experimental. Nosso protocolo fornece a capacidade de quantificar diretamente a invasão das células tumorais em qualquer ponto durante a progressão do tumor em línguas mouse. Enquanto o método descrito aqui descreve o procedimento usando línguas dissecados, estamos atualmente no processo de adaptar este método para a invasão do tumor em ratos de imagem ao vivo para uso em combinação com a bioluminescência para monitorar simultaneamente a invasão inicial, participação do nó de linfa locais e metástases à distância no mesmo animal. Alterações ao protocolo para in vivo de imagens requerem projeto de uma fase adequada para o posicionamento e manutenção de ratos durante o exame, bem como um sistema prático para irrigar adequadamente na cavidade oral de ratos anestesiados durante o procedimento de imagem. Uma vez otimizado, essas adaptações irá fornecer a capacidade de estudar o papel do potencial pro-invasivo moléculas e os testes anti-invasivo de compostos em invasão local e mais distantes envolvimento metastático em animais em períodos de tempo prolongado.
Divulgações
Agradecimentos
Apoiado por um subprojeto do NIH conceder P20 RR16440 e uma subvenção ponte entre o Ocidente de Correios Universidade Virginia de Pesquisa e Pós-Graduação em S. Weed. Assistência técnica de L. Lopez-Skinner durante as fases iniciais do desenvolvimento do projeto é reconhecido agradecimento. Os autores também são gratos pela assistência técnica e OSC19 células de J. Myers e Younes M. (Departamento de Cirurgia de Cabeça e Pescoço, MD Anderson Cancer Center, Houston, TX); P. Turner e K. Secrest (West Virginia University Departamento de Patologia Banco de Tecidos) para processamento histológico e procedimentos, R. Wysolmerski (West Virginia University, Departamento de Neurobiologia e Anatomia) para a construção LifeAct-mCherry e Bear J. (University of North Carolina) para o vetor pLL7.0 lentiviral. O uso da Universidade de West Virginia Facilidade de imagens de microscopia (apoiado pelo NIH conceder P20 RR16440 ea Mary Babb Randolph Cancer Center) e sua não-linear de laboratório de microscopia óptica (NLOM; apoiado por uma colaboração conjunta entre a West Virginia University Center for Neuroscience e da West Virginia University Departamento de Física / West Virginia Nanociência Initiative) também é reconhecido agradecimento. O NLOM é apoiado em parte pelo NIH conceder P30 RR031155 para o Centro de Neurociências.
Referências
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados