Method Article
Многофотонная изображений опухолевой инвазии сотовый в Ортотопическая Модель мыши устного плоскоклеточный рак
В этой статье
Резюме
Всесторонний обзор методов, участвующими в подготовке мышиной модели рака полости рта и количественного мониторинга опухолевой инвазии в язык через многофотонной микроскопии меченых клеток представлена. Эта система может служить в качестве полезной платформой для молекулярной оценка и эффективность препарата по борьбе с инвазивными соединений.
Аннотация
Loco-регионального вторжения рака головы и шеи связан с метастатическим риска и представляет трудную задачу в разработке и реализации стратегии лечения пациента. Ортотопическая модели мыши рака полости рта были разработаны с целью облегчить изучение факторов, что вторжение воздействие и служить в качестве модельной системы для оценки противоопухолевой терапии. В этих системах визуализации распространены опухолевых клеток тканей полости рта в полость как правило, были проведены либо обычные гистологии или в естественных условиях биолюминесцентного методами. Основной недостаток этих методов присущи неспособность точно визуализировать и количественно ранней инвазии опухоли ячейки, связанные с основной площадки в трех измерениях. Здесь мы опишем протокол, который сочетает в себе создана модель для плоскоклеточного рака языка (SCOT) с двухфотонного изображения, чтобы мульти-векторная визуализация языках распространения опухоли. OSC-19 головы и шеи, опухоли клеточная линия была стабильно спроектирован, чтобы выразить F-актин обязательным LifeAct пептид, слитый с mCherry флуоресцентный белок (LifeAct-mCherry). Fox1 ню / ню мышей вводили эти клетки надежно формы опухоли, которые позволяют язык, чтобы быть визуализированы бывшим естественных условиях применения двухфотонной микроскопии. Эта техника позволяет ортотопической визуализации опухоли и локально вторжения в клетки вырезали языки без прерывания работы региональных микроокружения опухоли. Кроме того, эта система позволяет количественного опухолевой инвазии ячейки путем вычисления расстояния, которые вторглись в клетках перейти от первичной опухоли. В целом, это процедура обеспечивает усовершенствованная система модели для анализа факторов, которые способствуют SCOT вторжения и лечебных процедур с учетом, чтобы предотвратить вторжение местных и отдаленных метастазов. Этот метод также имеет потенциал, чтобы быть в конечном счете, в сочетании с другими методами визуализации в в установлении естественных условиях.
протокол
1. Клеточных линий, Vector Строительство и производство лентивирусов
- Человек головы и шеи опухолевых клеток линий (OSC19 или UMSCC1) культивировали в полной средств массовой информации, состоящий из DMEM (Cellgro кошка № 50-003-PB) с добавлением 10% эмбриональной телячьей сыворотки FBS (Hyclone кошка # SH30070.03), 1% пенициллина / стрептомицин (Cellgro кошка № 30-002-CI), и 1% без незаменимых аминокислот (Cellgro кошка № 25-025-ДИ).
- Для передачи LifeAct-mCherry кодирующей последовательности в pLL7.0 лентивирусов вектор, Sbf1 сайта узнавания в родительском mCherry кДНК была изменена путем введения три молчащих мутаций в узнаваемой последовательности использованием сайт-направленного мутагенеза (Stratagene кошка # 200518-5). В результате изменения LifeAct-mCherry последовательности тогда ПЦР усиливается фланговые EcoR1/Sbf1 сайтов и субклонировали pLL7.0 генерировать pLL7.0-LifeAct-mCherry конструкции.
2. pLL7.0-LifeAct-mCherry Вирус производства
- Вирусный производства была проведена в соответствии с лентивирусов Выражение системы руководства (система Bioscience версии 2-051018).
- Упаковочная линия ячейки 293T/17 клетки (АТСС кошка # CRL-11268) вырос на 40% слияния в той же полной среды, используемые для HNSCC линий.
- Клетки трансфицированных pLL7.0-LifeAct-mCherry, psPAX2 и pVSV-G векторов в 3:02:01 соотношение, соответственно использовании CalPhos (Clontech кошка # 631312).
- После 24 часов, первоначальный носитель из трансфекции была заменена свежей информации.
- СМИ тогда собрана и пополняется каждые 12 часов в течение 72 часов и хранили при 4 ° C.
3. Производство головы и шеи линии Ячейка с Стабильный LifeAct-mCherry Выражение
- Собранных средствах массовой информации было выделено на 2000 оборотов в минуту в течение 10 минут при 4 ° C.
- Один мл уточнил средах, содержащих вирус непосредственно добавлены OSC19 или UMSCC1 клетки в течение 12 часов. Затем клетки промывают и еще на один мл вирус был добавлен еще на 12 часа.
- Клетки обрабатывали средах, содержащих 200мг/мл пуромицин в течение двух недель, чтобы выбрать устойчивые колонии.
- Выжившие клоны были показаны визуально для LifeAct-mCherry выражения флуоресцентной микроскопии. Индивидуальные положительные колонии typsinized использованием стерильных 3 мм диски клонирования (Fisher кошка # 0790710A).
- Положительные клетки поддерживается в среде, содержащей 200мг/мл пуромицин пока замороженных обратно или использованы для ортотопической инъекции.
4. Ортотопическая опухолей ксенотрансплантата
- Все животные процедуры были проведены в соответствии с протоколом (09-0821), утвержденных Университета Западной Виргинии уходу и использованию животных комитета.
- LifeAct-mCherry выражения опухолевых клеток трипсином, центрифугировали и 2,5 х 10 4 клеток ресуспендировали в 50 мкл полной информации.
- Опухолевые клетки были загружены в один мл шприц прилагается к 27 ½ иглы.
- Женский athymic Fox1 ню / ню мышей 8-недельного возраста (Харлан лабораторий) анестезировали сочетание 80mg/kg кетамин и 10mg/kg ксилазина. Наркозом мышам поддерживаться между 37-40 ° С на грелку.
- Использование стерильного пинцета, кончик языка мягко схватил и осторожно вытащил из полости рта.
- Клетки вводят внутривенно медленно в одну сторону каждого языка, чтобы создать луковичных массы в центре языка, избегая языковых артерий.
- Мышам вводили йохимбин 2.1mg/kg и вернулся в грелку, где они наблюдали в течение 2-3 часов во время восстановления после анестезии.
- Как только возродилась, мышей помещали в стерильные клетки содержащих трансгенные мягкой диетой тесто (Bioserve кошка # S3472).
- Мыши были взвешены каждые 2-3 дня и контролируется визуально на опухоль начала.
5. Подготовка Мышь языки для экс-естественных изображений
- Мыши укрывательство опухолей в различные моменты времени (обычно 2-4 недели после инъекции) были подвергнуты эвтаназии углерода вдыхания газа.
- Языки были извлечены, промывают 1X PBS и прикреплен к одной стороне обычных кассет ткани вложение парафин (StatLab Cat # H104,), используя нить мононити швейные из местного магазина хобби и размер 8 швейные иглы.
- Как только языки не могли двигаться, вся сборка кассеты был помещен в 30-мм блюдо культуры ткани и погружают в 1X PBS.
- Обработанные языки сразу же были использованы для двухфотонного возбуждения микроскопии.
6. Визуализация опухолей языка с Двухфотонное микроскопии
- Язык Кассеты были погружены в 60 мм блюдо с 1X PBS закреплены в специально созданных держатель на руку выдвижной консоли (палаты Шаттла, Сиския инструменты) расположен под цель прямой микроскоп (Передвижной микроскоп (MOM); Саттер Instruments).
- Воды 40X/0.8NA погружением объектива была помещена непосредственно на или за видимой квантовойили поражений. Языки были обследованы по двухфотонной микроскопии с титан-сапфирового лазера (Мира, Когерентные) интенсивность на 60 мВт и ввода длиной волны 755 нм для оптимизации mCherry сигнала.
- Последовательные образы 1мм лазерного сканирования были собраны на 1 мкм дополнительных глубинах более общую глубину ткани от 15 до 100 мкм (в зависимости от объема опухоли). Изображения были получены с помощью ScanImage, программа с открытым исходным кодом, основанная на платформе MATLAB, который был разработан Карел Свобода лаборатории (Janelia Хутора, HHMI). ScanImage генерирует два-канальный выход растровых шаблонов сканирования для контроля х / у гальванометрические сканирования зеркала, и в то же время захватывает максимум четыре-канальный входной сигнал одновременно от фотоэлектронных умножителей (ФЭУ) с помощью сбора данных платы (PCI-6610S , National Instruments). PMT сигналы усиливаются низким уровнем шума текущей предусилители (SR570, Stanford Research System) перед подачей в NI-DAQ платы для отображения на экране монитора. ScanImage собирает Z-Stack изображения, контролируя Z-оси объектива и собирает покадровой изображений в одно-или цикл режиме. Изображения были сохранены в отдельный файл TIFF с 16-битной глубины.
7. Анализ изображений с использованием программного обеспечения Amira
- Амира визуализации опухоли количественная: В программном обеспечении Aimra, откройте файл TIFF, содержащий набор Z-Stack изображений.
- Выделите имя файла, выбрать и применить Voltex функции для генерации трехмерного рендеринга. Большой первичной опухоли изображения с несколько более мелких, диссоциированных инвазивных группы (ИГ) коллективно вторглись в клетках, как правило, проявляется в изображении (рис. 6А).
- Чтобы выбрать основной массы опухоли, выберите пункт "Open Data", затем "Маркировка", затем "Метка".
- Выбор порога первичной опухоли-выбрать все Z-Stack изображения и прокрутки изображения в плоскости г, чтобы обеспечить включение только основной массы опухоли в трех измерениях. Как правило, это крупнейший размера изображения в поле и часто появляется в качестве сегментированной отображаемого проходится через г-плоскости.
- Используйте волшебную палочку / порог функцию коррекции фоновой флуоресценции и устранения его из образа, не отбрасывая любые опухоли сигнала. Выделите "Внутри файла" ярлык и нажмите на кнопку ⊕. Выберите "Все фрагменты" флажок. Это производит цветной рамкой вокруг thresholded первичной опухоли в области каждый Z-Stack прирост.
- Чтобы выбрать ИГ, выберите "Новый" функцию. Выберите одну IG и убедиться, что он не связан с первичной опухолью, прокрутив г-плоскости.
- Выберите "Все фрагменты" и нажмите на кнопку ⊕. Переименовать файл (например: И. Г. 1)
- Повторите процедуру порога в 7.4 и подсветка шагом в 7.5 для определяться IG. Выберите цвет контура отличается от цвета используются для обозначения основной массы опухоли.
- При необходимости повторите для каждого дополнительного ИГ по всему изображению, сканирование через г-плоскости для обеспечения всех ИГ обозначены. Использование разных цветов для каждой определенной ИГ помогает в будущем идентификации по изображению.
- После первичной опухоли и всех ИГ выбраны, выберите "сегментации" в выпадающем меню, затем выберите "Материал Статистика". Это обеспечивает измерение объема, а также X, Y и X опухоли основные координаты для первичной опухоли для расчета расстояний ИГ из центральной точки опухоли.
- С объемы рассчитывается, определять расстояние для каждого из ИГ центральное ядро первичной опухоли. Выберите "сегментация", затем "Материал Статистика". Этот шаг вычисляет все измерения в пикселях. Преобразование пикселей мкм на основе калибровки объектива микроскопа и любое дополнительное увеличение увеличение (то есть, функции масштабирования). Для микроскопа и параметры, используемые в этих экспериментах, 40X целью было использовать без зума, давая калибровки 1 пиксель = 0,298 мкм. Импорт данных в таблицы Excel, которая дает параметры первичной опухоли в трех измерениях (X1, Y1, Z1) и для каждого IG (например: X2, Y2, Z2 в первый IG).
- Вторглись расстояние в микронах для каждого ИГ от центра первичной опухоли рассчитывается по формуле √ ((X2-X1) 2 + (Y2-Y1) 2 + (Z2-Z1) 2).
- Инвазивных опухолей индекс (T I) рассчитывается по формуле Т И Н Т = х V Т х D T, где N T = Общее число ИГ по образу и подобию, V T = общий объем всех ИГ, D T = общее расстояние, пройденное всех инвазивных групп из центра первичной опухоли.
8. Трехмерная визуализация с Nikon NIS-Elements программное обеспечение
- Трехмерная визуализация с большей топографические подробности могут быть получены за счет импорта оригинальных 16-разрядных монохромных файлов TIFF всего изображения опухоли в Nikon NIS-Elements программное обеспечениепакет (Nikon, Мелвилл, штат Нью-Йорк). Выберите "Файл", затем "НД", затем "Создать ND файла из файла Sequence". Выберите TIFF Z-серии изображений стека и указать соответствующий размер шага.
- Калибровка ND документ в плоскости ху. Укажите размер одного пикселя использованием ручной калибровки.
- Выберите "Объем View". Используйте "HQ", чтобы вычислить дополнительные ломтики в г-плоскости для более высокого качества. В "Параметры 3D Renderer", используйте "Advanced Renderer" с качеством "сверхвысокого Детали" и "полное разрешение". Выберите "Альфа-смешение", чтобы подчеркнуть опухоли поверхностей.
- Оптимизация трехмерного изображения для презентации. Увеличить на опухоль и связанные с ИГ и обрезать по мере необходимости. Поворот изображения в плоскостях хуг и корректировать ТМП.
- Захват изображений для презентации. Выберите "Правка-Создать представление Snapshot (8 бит RGB)". Назовите и сохраните файл соответственно.
9. Представитель Результаты
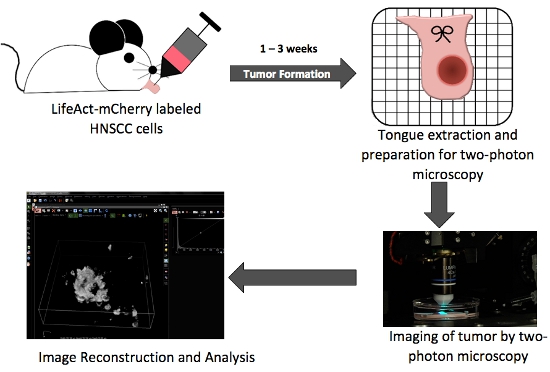
Рисунок 1. В целом схема иллюстрирующие основные этапы производства ортотопической опухоли языка и на месте два изображения фотона.
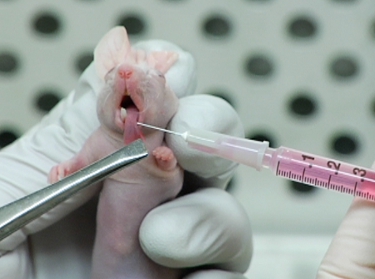
Рисунок 2. Инъекция LifeAct-mCherry выражения OSC19 клеток в мышь язык.
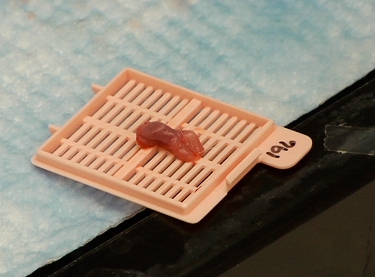
Рисунок 3 резекции опухоли содержащих мыши язык подготовлен в течение двух фотонов изображений.

Рисунок 4. Ориентация опухоли содержащих язык в положении на два фотона микроскопии готовы для работы с изображениями.
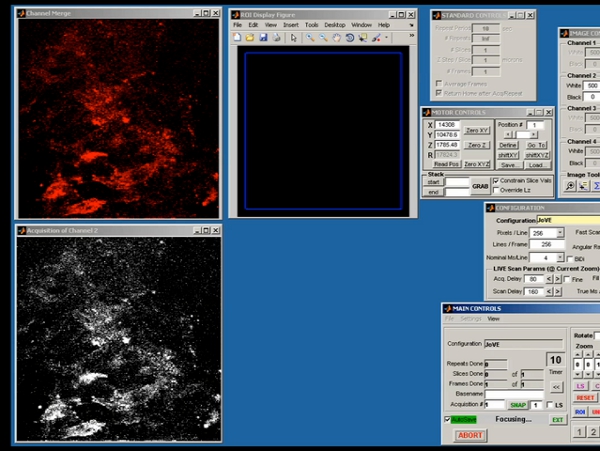
Рисунок 5. Представителю скриншот из ScanImage демонстрируя сырые сбора данных начального двухфотонного изображения.
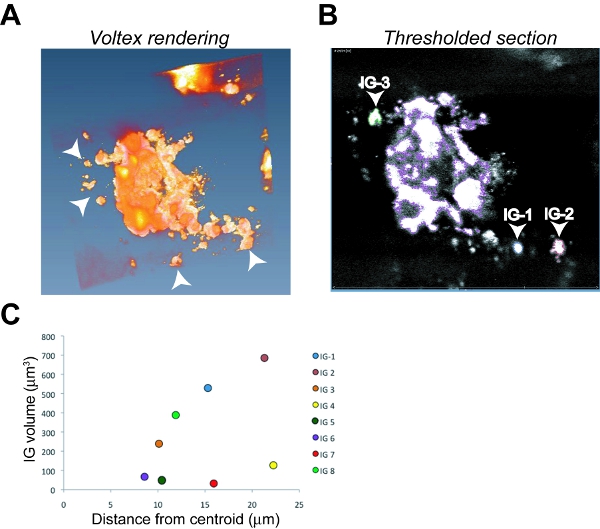
Рисунок 6. Анализ изображений и количественной оценки опухолевой инвазии в ортотопической опухоли OSC19. Представитель снимок экрана изображения Амира Voltex рендеринга () и одного thresholded Z-секции (В) с основной первичной опухоли, изложенные в фиолетовый, инвазивные 1-й группы (ИГ-1), изложенные в синий, ИГ-2, изложенных в красный и И. Г. -3, изложенные в зеленый в качестве примера процедуру идентификации. Стрелки обозначают ИГ в (А) и (Б). С. Земельные объема от расстояния вторглись на восемь отдельных ИГ используется для расчета индекса опухоли вторжения (Ti).
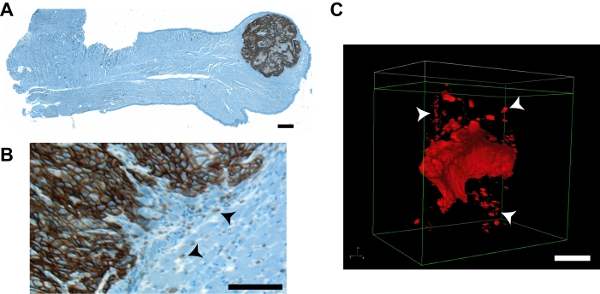
Рисунок 7. Представителю изображения опухоли и опухоли вторглись групп из этого протокола по сравнению с изображениями из традиционного подхода IHC. Парафин А. раздел весь язык мыши укрывательство UMSCC1 ортотопической опухоли. Иммуногистохимическое окрашивание был проведен с использованием обычных процедур с первичными антителами против HNSCC конкретной ячейки маркера emmprin (Zymed; кошка # 34-5600) в разведении 1:1000 и визуализируется с помощью OmniMap DAB анти-Rb обнаружения комплект (Вентана кошка # 760 -149) с последующим окрашиванием железным гематоксилином. Изображения охватывающий общую площадь языку были собраны индивидуально 4X увеличение на Олимп ZX70 Провис микроскоп с камерой Optronics MicroFire CCD и реконструировано с использованием пакета StereoINvestigator томография (ФМС Bioscience). Опухоль очевидна на кончик языка. Увеличены региона показывает инвазивных передней и отдельные группы клеток опухоли (наконечники стрел) показана на (В). С. Nikon NIS-Elements оказание представитель опухоли OSC19. Расширенные подробно контура и ясно визуализации ИГ (наконечники стрел) очевидна. Бары в все изображения = 100 мкм.
Обсуждение
Ортотопическая модели мыши оказались полезными для изучения многих аспектов головы и шеи 1,2 рака. Мы объединили хорошо ортотопической системы SCOT 3 с двумя-фотонной микроскопии изображений mCherry-меченых клеток в качестве системы для изучения ранних событий головы и шеи, опухоли вторжения. В этой процедуре, мы отметили, что клетки могут вытекать из места инъекции опухоли, особенно у мышей, шесть недель и младше из-за недостаточного размера языка. Мы используем старых мышей, чтобы избежать этой проблемы. Чем больше размер язык со взрослыми мышами также помогает избежать разрыва языками артерии и чрезмерное кровотечение из языка. Опухоль принять значительно усиливается, когда язык сильно набухает в месте начального инъекции. Этот отек стихает в течение одного-двух часов в качестве вводимой жидкости не впитается. Рост опухоли представляется очевидной одну-две недели после инъекции с указанными вводят номер ячейки, как маленький белый выпуклость на поверхности языка. Отметим также, что в 40х цель, используемые в наших исследованиях, представленных здесь, мы не можем выделить отдельные клетки опухоли но определить ИГ как инвазивные кластеров ячейки, повторять типичных способа HNSCC вторжения.
На сегодняшний день эта модель широко используется для тестирования роли специфических молекул, а также несколько противоопухолевых препаратов на SCOT роста вторжения, с эффективностью измеряется шейки метастазов лимфатических узлов контролировать с помощью ИГХ или биолюминесцентного методов 4-7. Опухоли образуются в этой системе проявляется близко к поверхности языка (рис. 7), что позволяет применение двух-фотонной микроскопии для изображения всей опухоли на месте как инвазивные многоклеточных кластеров. Процедура также может быть использован для визуализации опухолевой инвазии с сотовыми разрешения. Двухфотонное микроскопии был ранее использован для исследования экспериментальных методов лечения рака головы и шеи в ортотопической 8,9 и 8,10 ксенотрансплантата моделей. Однако Есть два основных различия между эти отчеты и наш протокол. Во-первых, эти исследования используют внеклеточной метки цели / определить головы и шеи клетки опухоли, возможно, ограничивающий обнаружения только опухолевые клетки с достаточным доступом к циркуляции. Во-вторых, вторжение в опухолевых клетках рядом с основной сайт, вероятно, повторяет ранние метастатическим деятельность не была оценена как экспериментальный параметр. Наш протокол обеспечивает возможность непосредственного количественного опухолевой инвазии ячейки в любой момент во время прогрессирования опухоли у мышей языках. В то время как метод, описанный здесь описывает процедуру, используя расчлененный язык, мы в настоящее время в процессе адаптации этого метода для изображения вторжения опухоли в живых мышей для использования в сочетании с биолюминесценции одновременно контролировать раннее вторжение, участие местных лимфатических узлов и отдаленных метастазов в то же животное. Внесены изменения в протокол для прижизненного изображения требуют проектирования соответствующем этапе для размещения и поддержания мышей во время съемки, а также практическая система правильно орошения полости рта под наркозом мышей во время процесс создания образа. Как только оптимизировать, эти адаптации обеспечит возможность для изучения роли потенциальных про-инвазивных молекул и тестирование по борьбе с инвазивными соединений на местной инвазии и более отдаленных метастазов участие в животных в течение длительного периода времени.
Раскрытие информации
Благодарности
Supported by a subproject of NIH grant P20 RR16440 and a bridge grant from the West Virginia University Office of Research and Graduate Education to S. Weed. Technical assistance from L. Lopez-Skinner during the early phases of project development is gratefully acknowledged. The authors are also grateful for technical assistance and OSC19 cells from J. Myers and M. Younes (Department of Head and Neck Surgery, M.D. Anderson Cancer Center, Houston, TX); P. Turner and K. Secrest (West Virginia University Department of Pathology Tissue Bank) for histological processing and procedures, R. Wysolmerski (West Virginia University, Department of Neurobiology and Anatomy) for the LifeAct-mCherry construct and J. Bear (University of North Carolina) for the pLL7.0 lentiviral vector. The use of the West Virginia University Microscopy Imaging Facility (supported by NIH grant P20 RR16440 and the Mary Babb Randolph Cancer Center) and its non-linear optical microscopy laboratory (NLOM; supported by a joint collaboration between the West Virginia University Center for Neuroscience and the West Virginia University Department of Physics/West Virginia Nanoscience Initiative) is also gratefully acknowledged. The NLOM is supported in part by NIH grant P30 RR031155 to the Center for Neuroscience.
Ссылки
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены