Method Article
구강 편평 세포 암종의 Orthotopic 마우스 모델에서 종양 세포 침략의 다중 광자 이미징
요약
표시 셀 다중 광자 현미경을 통해 혀를 이내 구강 암 종양 침략의 양적 모니터링 마우스 모델을 생성에 관련된 기술의 포괄적인 개요는 제공됩니다. 이 시스템은 침입 방지 화합물의 분자 평가 및 약물 효능을위한 유용한 플랫폼이 될 수 있습니다.
초록
머리와 목 암의 로코 - 지역 침공은 전이성 위험에 연결되어 설계 및 환자 관리 전략을 구현 어려운 도전을 선물합니다. 구강 암 Orthotopic 마우스 모델은 해당 요소의 연구를 촉진하기 위해 개발되었습니다 영향을 침공 및 안티 종양 치료제를 평가하기위한 모델 시스템으로 제공하고 있습니다. 이러한 시스템에서는 구강 조직 내에 전파 종양 세포의 시각화는 일반적으로 기존의 조직학하거나 또는 생체내 발광 생물 방식에 함께 실시되었습니다. 이러한 기술의 주요 단점은 정확하게 3 차원에 기본 사이트에서 발생하는 초기 종양 세포 침공을 시각화하고 계량하는 고유의 무능력이다. 여기 우리는 언어를 구사하는 종양 확산의 멀티 vectorial 시각화를 허용하도록 두 개의 광자 이미징과 혀의 편평 세포 암종 (스콧)를 설립 모델을 결합하여 프로토콜을 설명합니다. OSC - 19 머리와 목의 종양 세포 라인은 안정 mCherry 형광 단백질 (LifeAct - mCherry)에 융합 F - 굴지 결합 펩티드 LifeAct을 표현할 수 있도록 설계되었습니다. 이러한 세포로 주입 Fox1 뉴 / 뉴 생쥐가 안정적으로 혀가 두 광자 현미경의 전 생체내 응용 프로그램에 의해 시각 수 있도록 종양을 형성. 이 기술은 종양 질량 orthotopic 시각화 및 로컬 지역 종양의 microenvironment의 중단없이 excised 방언 세포를 침입 수 있습니다. 또한이 시스템은 기본 종양 사이트에서 세포 이동을 침공 거리를 계산하여 종양 세포 침공의 부량 수 있도록합니다. 전체이 절차는 스콧의 침략과 지역 침략과 멀리 전이성 확산을 방지하기 위해 맞춤형 치료 요법에 기여하는 요인을 분석하는 향상된 모델 시스템을 제공합니다. 이 방법은 궁극적으로 생체내 설정에 다른 영상 modalities과 결합 될 가능성이있다.
프로토콜
1. 셀 라인, 벡터 건설과 Lentiviral 제작
- 인간의 머리와 목의 종양 세포 라인 (OSC19 또는 UMSCC1) 10 % 태아 소 혈청 FBS (Hyclone 고양이 # SH30070.03), 1 % 페니실린과 보충 (Cellgro 고양이 # 50-003 - PB) DMEM으로 구성된 완벽한 매체 교양되었습니다 / 스트렙토 마이신 (Cellgro 고양이 # 30-002 - CI), 1 %가 아닌 필수 아미노산 (Cellgro 고양이 # 25-025 - CI).
- pLL7.0 lentiviral 벡터로 LifeAct - mCherry 코딩 순서를 전송하기 위해 cDNA 부모 mCherry에 Sbf1 인식 사이트는 사이트 이동 돌연변이 유발 (Stratagene 고양이 # 200518-5)를 사용하여 인식 순서로 3 자동 변이를 도입함으로써 변경되었습니다. 그 결과 수정된 LifeAct - mCherry 순서는 다음 PCR은 EcoR1/Sbf1 사이트를 측면과 증폭 및 pLL7.0 - LifeAct - mCherry 구조를 생성하는 pLL7.0에 subcloned되었습니다.
2. pLL7.0 - LifeAct - mCherry 바이러스 생산
- 바이러스성 생산은 Lentiviral 표현 시스템 매뉴얼 (시스템 Bioscience 버전 2-051018)에 따라 실시되었다.
- 포장 세포주 293T/17 세포 (ATCC 고양이 # CRL - 11268) HNSCC 라인에 사용된 것과 같은 완전한 미디어 40 % 합류로 성장했다.
- 전지는 각각 (Clontech 고양이 # 631312) CalPhos를 사용하여 pLL7.0 - LifeAct - mCherry, psPAX2 및 3시 2분 1초 비율 pVSV - G 벡터와 transfected되었습니다.
- 24 시간 후에, transfection의 초기 미디어가 새로운 미디어로 대체되었습니다.
- 미디어 다음 수집 보충함 매 12 시간 72 시간 4 ° C.에 저장된
3. 안정 LifeAct - mCherry의 표정으로 머리와 목은 세포 라인의 생산
- 수집된 미디어 4 10 분 2,000 RPM에서 건지 알고 있느냐 ° C.
- 바이러스를 포함한 명확히 미디어 중 하나 ML 직접 12 시간 OSC19 또는 UMSCC1 세포에 추가되었습니다. 전지는 다음 씻어서되었고, 바이러스의 추가 한 ML은 다른 12 시간 동안 추가되었습니다.
- 세포는 강한 식민지를 선택하는 두 주 동안 200mg/ml puromycin를 포함하는 매체와 치료를했다.
- 살아남은 클론은 형광 현미경으로 LifeAct - mCherry 표현에 대한 시각 상영되었다. 개인 긍정적인 식민지는 무균 3mm 복제 디스크 (피셔 고양이 # 0790710A)를 사용 typsinized되었습니다.
- 긍정적인 세포는 다시 냉동 또는 orthotopic 사출에 사용까지 200mg/ml puromycin를 포함하는 미디어를 유지했다.
4. Orthotopic 종양 이종 이식의 형성
- 모든 동물의 절차는 웨스트 버지니아 대학 동물 케어 및 사용위원회의 승인을 프로토콜 (09-0821)에 따라 실시되었다.
- LifeAct - mCherry 표현 종양 세포는 trypsinized centrifuged 및 2.5 X 10 4 세포를 50 μL 전체 미디어 resuspended 하였다.
- 종양 세포는 27에 연결된 한 ML 주사기 ½ 바늘에로드되었습니다.
- 여성 athymic Fox1 뉴 / 뉴 생쥐 연령 8 주 (할란 연구소)는 마취제와 10mg/kg xylazine을 80mg/kg의 조합 anesthetized되었습니다. Anesthetized 생쥐는 가열 패드에 37-40 ° C 사이에서 유지되었다.
- 멸균 집게를 사용하여 혀끝을 부드럽게 쥐었다 조심스럽게 구강 밖으로 뽑았습니다.
- 세포 천천히 언어 동맥을 피하기 위해, 혀 중앙에 주먹코 미사를 만드는 각각의 혀가 한쪽으로 주입되었다.
- 마우스는 2.1mg/kg의 최음제 (요힘빈)와 함께 주입하고 그들이 마취에서 회복하는 동안 2~3시간에 대한 모니터링했던 손난로으로 반환되었습니다.
- 일단 부흥, 생쥐는 유전자 변형 부드러운 반죽 다이어트 (Bioserve 고양이 # S3472)이있는 무균 새장에 배치했다.
- 생쥐 2-3일 모든 무게와 종양 발병에 대한 시각 감시했다.
5. 전 생체내 이미징을위한 마우스 방언의 준비
- 다른 시간 지점 (일반적으로 2~4주 후 주사)에 종양을 품고 마우스는 이산화탄소 흡입에 의해 euthanized되었다.
- 방언은 추출 1X PBS로 씻어서 현지 취미 상점과 크기 8 바느질 바늘에서 monofilament의 바느질 스레드를 사용하여 기존의 파라핀 조직 포함 카세트의 한쪽 (StatLab 캣 # H104)에 붙어 있었다.
- 방언이 고정화되었다되면 전체 카세트 어셈블리는 30mm 조직 문화 요리에 위치하고 1X PBS에 열중했다.
- 가공 방언은 즉시 두 광자 여기 현미경에 사용되었습니다.
6. 두 광자 현미경과 혀 종양의 영상
- 텅 카세트는 직립 현미경 (; 서터 악기 움직일 수있는 현미경 (MOM))의 목적에 따라 위치 개폐식 캔틸레버 암 (상공 회의소 셔틀, 시스키유 악기)에 맞춤 설계된 소지자의 보안 1X PBS를 포함 60mm 접시에 빠져들되었다.
- 40X/0.8NA 물 수영 객관 렌즈는 가시 텀에 이상 직접 배치했다또는 병변. 사파이어 레이저 (미라, 일관된) 60 MW와 755 nm의 파장의 입력에서 강도 mCherry 신호를 최적화하기 : 방언은 티로 두 광자 현미경으로 몇 군데 있었다.
- 시리얼 1mm 레이저 스캔 이미지 15 및 100 μm의 (종양 부피에 따라) 사이의 전체 조직이 깊이 대 1 μm의 증분 깊이에서 수집된 있었다. 이미지 ScanImage, 카렐 스보보다 실험실 (Janelia 팜, HHMI)에 의해 개발된 MATLAB 플랫폼을 기반으로 오픈 소스 프로그램을 사용하여 점령했다. ScanImage는 X / Y 갈바 스캔 미러를 제어하는 래스터 스캔 패턴의 2 채널 출력을 생성하고, 동시에 (PCI - 6610S 데이터 수집 보드를 통해 photomultiplier 튜브 (PMTs)에서 동시에 최대 4 채널의 신호 입력을 캡처 , 내쇼날 인스 트루먼 트). PMT 신호는 모니터 화면에 표시를위한 NI - DAQ 보드에 이송하기 전에 저소음 현재 preamplifiers (SR570, 스탠포드 연구 시스템)에 의해 증폭됩니다. ScanImage은 목표의 Z 축 제어를하여 Z - 스택 이미지를 수집하고 단일 또는 사이클 모드에서 시간 경과 이미지를 수집합니다. 이미지는 16 비트 깊이로 단일 TIFF 파일에 저장되었습니다.
7. Amira 소프트웨어를 사용하여 이미지 분석
- 종양 부량에 대한 Amira 이미징 : Aimra 소프트웨어에서 Z - 스택 이미지의 집합을 포함하는 TIFF 파일을 엽니다.
- 파일 이름을 강조 표시, 선택하고 입체 렌더링을 생성하는 Voltex 기능을 적용할 수 있습니다. 이하 침략 세포의 여러 작은, dissociated 침해 그룹 (IG)와 큰 차 종양 이미지 (그림 6A 참조) 렌더링된 이미지에 일반적으로 분명합니다.
- 기본 종양의 질량을 선택하려면 다음 다음 "레이블 필드를" "레이블", "오픈 데이터"를 선택하십시오.
- 기본 Thresholding 모든 Z - 스택 이미지를 종양 것은의 선택과 세 차원에서만 기본 종양의 질량 포함을 보장하기 위해 Z - 비행기의 이미지를 스크롤합니다. 이것은 일반적으로 현장에서 가장 큰 크기의 이미지와 몇 군데가 Z - 비행기를 통해 통과와 같이 자주 세그먼트가 나타납니다.
- 배경 형광을 수정하고 폐기 종양 신호의없이 이미지에서 그것을 제거하는 마술 지팡이 / 임계값 기능을 사용하십시오. "내부 파일"레이블을 강조 표시하고 ⊕ 버튼을 클릭합니다. "모든 조각"확인란을 선택합니다. 이것은 모든 Z - 스택 증가에 thresholded 기본 종양 주변 색 테두리를 생산하고 있습니다.
- IGS를 선택하려면, "새"기능을 선택합니다. 단일 IG을 선택하고 그것이 Z - 비행기 스크롤하여 기본 종양과 관련되지 않도록.
- "모든 조각"을 선택하고 ⊕ 버튼을 클릭합니다. 파일 (IG 1 예)을 이름 바꾸기
- 7.4에서 thresholding 절차를 반복하여 결정 IG에 대해 7.5의 하이라이트 단계. 기본 종양의 질량을 나타내는 데 사용되는 색상과 다를 외곽선 색상을 선택합니다.
- 모든 IGS가 표시됨 수 있도록하는 Z - 비행기를 통해 스캐닝, 이미지를 통해 각 추가 IG에 대해 필요한 반복합니다. 이미지를 미래의 식별에있는 각 식별 IG 에이즈에 대해 서로 다른 색상을 사용합니다.
- 기본 종양 모든 IGS이 선택되면, 풀다운 메뉴에서 "분할"을 선택 후, '물질 통계 "를 선택하십시오. 이것은 볼륨의 측정뿐만 아니라 X, Y 및 X 종양 코어는 중앙 종양 지점에서 IGS의 거리를 계산하기 위해 기본 종양에 대한 좌표를 제공합니다.
- 볼륨 계산을 통해 기본 종양의 중심 코어에서 각 IG에 대한 거리를 결정합니다. 다음 '세그먼트', '자재 통계 "를 선택하십시오. 이 단계는 픽셀로 모든 측정을 계산합니다. 현미경 목표의 교정과 배율에 추가 증가 (; 줌 기능 IE)를 기반으로 micrometers에 픽셀을 변환합니다. 현미경 이러한 실험에 사용되는 설정에, 40X 목표는 1 픽셀 = 0.298 μm의의 교정을 제공, 아니 확대와 함께 사용되었다. 3 차원에 기본 종양 (X1, Y1, Z1) 및 각 IG (X2, Y2, 첫 번째 IG에 대한 Z2 예)에 대한 매개 변수를 제공 Excel 스프레드 시트로 가져오기 데이터입니다.
- 기본 종양의 중심에서 각 IG에 대한 미크론의 침략 거리는 공식 √ ((X2 - X1) 2 +를 (Y2 - Y1) 2 + (Z2 - Z1) 2)를 사용하여 계산됩니다.
- 종양 침입 색인 (T I) 수식 T I = N T X V T X D T, N T = 이미지에 IGS의 총 개수, V T = 모든 IGS의 총 볼륨, D T를 사용하여 계산됩니다 = 총 거리는 기본 종양의 중심에서 모든 침략적 그룹 여행.
8. 니콘 NIS - 요소 소프트웨어와 입체 렌더링
- 큰 지형 세부 사항과 함께 입체 렌더링은 니콘 NIS - 요소 소프트웨어로 전체 종양 이미지의 원본 16 비트 흑백 TIFF 파일을 가져와서 생성할 수 있습니다패키지 (니콘, 멜빌, NY). 다음 "ND"를 "파일"을 선택한 다음 "파일 시퀀스에서 ND 파일 만들기". TIFF Z - 시리즈 이미지 스택을 선택하고 해당 단계의 크기를 지정합니다.
- XY 평면에서 ND 문서를 보정합니다. 수동 보정을 사용하여 한 픽셀의 크기를 지정합니다.
- "볼륨보기"를 선택합니다. 높은 품질 Z - 비행기에 추가 조각을 계산하려면 "HQ"기능을 사용하십시오. "3D 렌더기 설정"에서 "초고 세부 사항"과 "전체 해상도"의 품질 "고급 렌더기"를 사용합니다. 종양 표면을 강조하기 위해 '알파 블렌딩 "을 선택합니다.
- 프레 젠 테이션에 대한 3 차원 이미지를 최적화합니다. 종양 및 관련 IGS하며 필요에 따라 작물에 확대. XYZ의 비행기에서 이미지를 회전하고 LUTs를 조정합니다.
- 프레 젠 테이션에 대한 이미지를 캡처합니다. "편집 - 만들기보기 스냅샷 (8 비트 RGB)"를 선택하십시오. 이름과 그에 따라 파일을 저장합니다.
9. 대표 결과
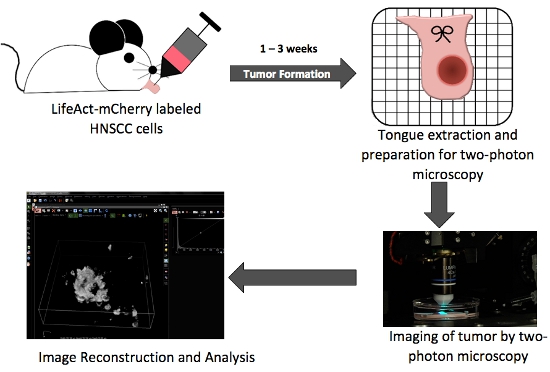
그림 1. orthotopic 혀 종양 생산과 현장이 광자 이미징의 주요 단계를 설명하는 전체 설계도.
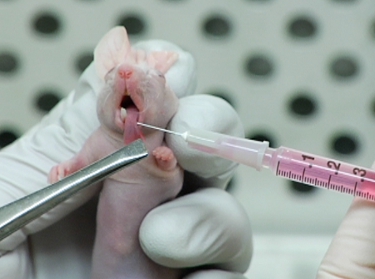
그림 2. 마우스 혀를에 OSC19 세포를 표현 LifeAct - mCherry의 사출.
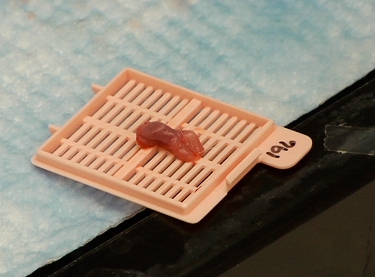
그림 3 Resected 종양 함유 마우스 혀가 두 광자 이미징을위한 준비.

그림 4. 이미징 준비 두 광자 현미경의 위치에 종양이 함유 혀가의 오리 엔테이션.
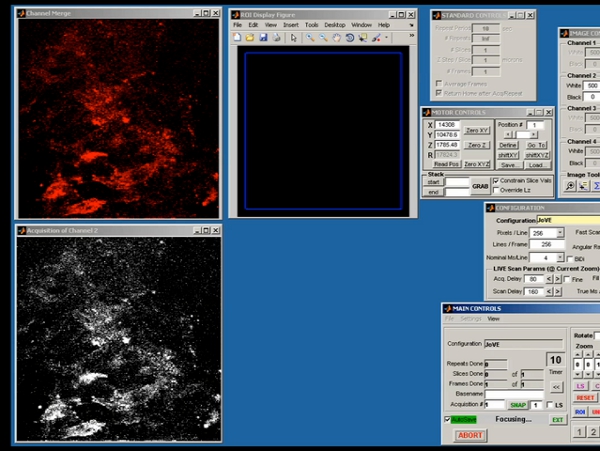
그림 5. ScanImage은 초기 두 광자 이미지의 원시 데이터 수집을 보여주 쏜 대표 화면.
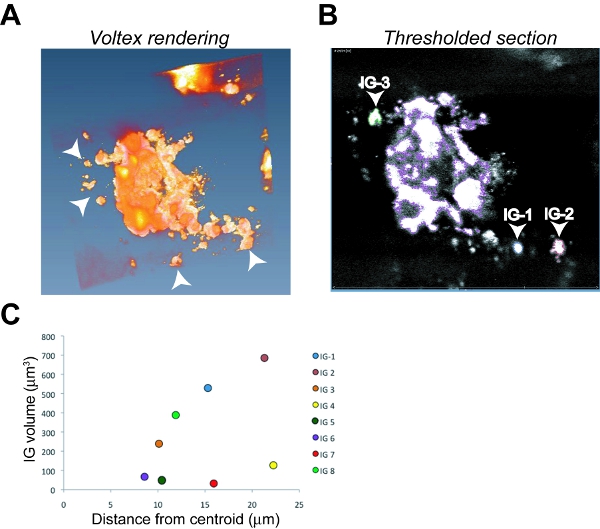
그림 6. orthotopic OSC19 종양의 이미지 분석 및 종양 침략의 부량. Amira Voltex 렌더링 (A)와 하나의 thresholded Z - 섹션 대표 스크린샷 이미지가 (B) 기본 기본 종양과 파란색으로 설명 자주색, 침략 그룹 1 (IG - 1)에 명시된, IG - 2는 빨간색 IG에 명시된 -3는 식별 절차의 예를 들어 녹색으로 설명했다. 화살촉이에 IGS을 나타냅니다 (A)와 (B). 볼륨 C. 플로츠 대 종양 침공 지수 (TI)를 계산하는 데 사용 여덟 개인 IGS에 대한 거리를 침공.
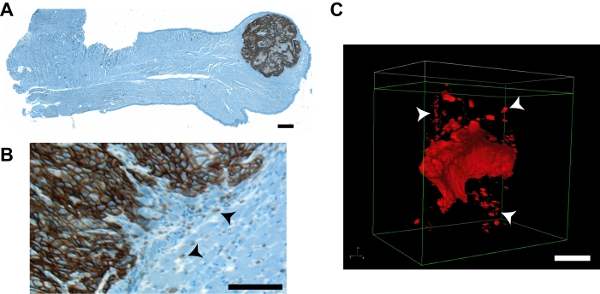
그림 7. 대표 종양의 이미지 및 기존 IHC 접근에서 이미지와 비교하여이 프로토콜에서 종양 그룹을 침공. UMSCC1 orthotopic 종양을 품고 전체 마우스 혀 A.의 파라핀 섹션. Immunohistochemical 얼룩은 HNSCC 특정 세포 마커 emmprin (Zymed, 고양이 # 34-5600)에 대한 기본 항체와 함께 종래의 절차를 사용하여 실시되었다 1:1000 희석에서와 OmniMap DAB 안티 - RB 탐지 키트 (벤타나 고양이 # 760을 사용하여 시각 -149)는 철분 hematoxylin의 얼룩으로 따라갔다. 전체 혀 영역을 포함한 이미지 Optronics MicroFire CCD 카메라와 올림푸스 ZX70 비스 현미경에 4X 배율에서 개별적으로 수집하고 StereoINvestigator 이미징 패키지 (MBF Bioscience)를 사용하여 복원되었습니다. 종양은 혀 끝에 분명하다. 침입 앞면과 개별 종양 세포 그룹 (화살촉)을 보여주는 확대 지역은 대표적인 OSC19 종양의 (B). C. 니콘 NIS - 요소 렌더링에 표시됩니다. 향상된 윤곽 세부 사항 및 IGS 명확하게 시각화가 (화살촉) 분명하다. 모든 이미지 바 = 100 μm의.
토론
Orthotopic 마우스 모델은 머리와 목 암 1,2의 여러 측면을 연구하는 데 유용 입증했습니다. 우리는 머리와 목의 종양 세포의 침략의 초기 이벤트를 연구하는 시스템으로 mCherry - 레이블 세포의 2 광자 현미경 이미징과 스콧 3 잘 설립 orthotopic 시스템을 결합했습니다. 이 절차에서는, 우리는 세포가 특히 부족 혀 크기로 인해 마우스 육주 이하에서 종양이 주사의 사이트에서 누설 수 있다고 지적했습니다. 우리는이 문제를 피하기 위해 기존의 마우스를 사용합니다. 이전 생쥐와 큰 혀 크기도 혀를에서 언어 동맥과 과도한 출혈의 파열을 피하기 위해 에이즈. 혀 크게 초기 주사의 사이트에 부풀 때 종양의 받아가 크게 향상됩니다. 주입 유체로 1-2시간 이내에이 붓기 가라 앉다가 흡수됩니다. 종양 성장 혀 표면에 작은 흰색 범프로 표시 주입 휴대폰 번호와 함께 분명 1~2주 게시물 사출 나타납니다. 우리는 또한 여기에 제시 우리의 연구에 사용된 40X 목적에서, 우리는 각각의 종양 세포를 구분하지 수 있지만 HNSCC 침략의 일반 모드를 요점을 되풀이하다 침입 셀 클러스터로 IGS을 식별하지 않습니다.
현재까지이 모델은 광범위 4-7 IHC 또는 발광 생물 방법을 사용하여 모니터링할 자궁 경부 림프절의 전이에 의해 측정 효율과 함께, 특정 분자의 역할뿐만 아니라 스콧 성장 침공에 여러 안티 종양 약물을 테스트하기 위해 사용되고 있습니다. 종양 침입 멀티 셀룰러 클러스터로 현장에 이미지 전체 종양에 두 광자 현미경의 응용 프로그램을 허용, 가까이 혀 표면 (그림 7)이 시스템 명단 형성. 절차는 또한 휴대폰 해상도 종양 침공을 시각화하는 이용하실 수 있습니다. 두 광자 현미경는 이전에 다음 ID로 orthotopic 8,9 및 이종 이식 8,10 모델에 머리와 목 암 치료 실험 연구를 이용했습니다. 그러나 이러한 보고서 및 프로토콜 사이의 두 가지 주요 차이점이 있습니다. 첫째,이 연구는 대상 / 가능한 순환에 충분한 액세스 권한이있는 유일한 종양 세포 검출을 제한, 머리와 목의 종양 세포를 확인하기 위해 세포 레이블을 사용합니다. 가능성이 recapitulates 초기 전이성 활동이 실험 매개 변수로 평가되지 않았음을 기본 사이트로 가까운 종양 세포의 두 번째 침공. 우리 프로토콜은 직접 마우스 방언 종양 진행 중 어느 시점 종양 세포 침공을 계량하는 기능을 제공합니다. 방법은 여기에서 설명한 해부 방언을 사용하는 절차를 설명하는 동안, 우리는 동시에 초기 침공, 지역 림프절의 참여와에 멀리 전이를 모니터링하는 bioluminescence와 함께 사용하기 위해 사는 생쥐의 이미지 종양의 침공이 방법을 채택하는 과정에서 현재 같은 동물. 생체내 이미징에 대한 프로토콜의 변경이 제대로 이미징 절차 동안 anesthetized 생쥐의 구강을 관개하기 위해뿐만 아니라 실용적인 시스템으로, 이미징하는 동안 마우스를 위치에 적절한 단계의 설계 및 유지 관리가 필요합니다. 일단 최적화된이 adaptations 잠재 프로 침해 분자 및 지역 침략과 오랜 시간 기간 동안 동물에 더 멀리 전이성 참여에 대한 테스트를 방지 침략적 화합물의 역할을 연구하는 기능을 제공합니다.
공개
감사의 말
NIH 교부금 P20 RR16440의 하위 연구 및 대학원 교육의 웨스트 버지니아 대학 사무실에서 S. 비드에 다리 부여 지원. 프로젝트 개발의 초기 단계 동안 L. 로페즈 - 스키너의 기술 지원은 기꺼이 인정받고 있습니다. P. 터너와 K. 시크 레스트 (웨스트 버지니아 대학학과, 저자는 또한 기술 지원 및 J. 마이어와 M. Younes (머리와 목은 외과학과, MD 앤더슨 암 센터, 휴스턴, TX)에서 OSC19 세포에 대한 감사 histological 처리 절차에 대한 병리 조직 은행), pLL7.0 lentiviral 벡터에 대한 LifeAct - mCherry 구조 J. 베어 (노스캐롤라이나 대학)에 대한 R. Wysolmerski (웨스트 버지니아 대학 신경 생물학과 해부학의학과). 웨스트 버지니아 대학 현미경 이미징 시설의 사용 (NIH 부여 P20 RR16440와 메리 밥 랜돌프 암 센터 지원) 및 비선형 광학 현미경 실험실 (NLOM, 공동 신경 과학을위한 웨스트 버지니아 대학 센터 간의 협력과 지원 물리 / 웨스트 버지니아 Nanoscience 이니셔티브의 웨스트 버지니아 대학학과)도 기꺼이 인정받고 있습니다. NLOM은 신경 과학을위한 센터에 NIH 부여 P30 RR031155에 의해 부분적으로 지원됩니다.
참고문헌
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유