Method Article
Labeling fluorescentes retrógrada Permite alvejado Extracelular Gravação Single-unidade dos neurônios identificados
Neste Artigo
Resumo
Transporte retrógrado de corante fluorescente rotula uma sub-população de neurónios baseado em projecção anatómica. Axônios rotulados pode ser alvo visualmente In vivo, Permitindo a gravação extracelular de axónios identificados. Esta técnica permite a gravação quando os neurónios não podem ser marcados através de manipulação genética ou são difíceis de isolar usando "cega" In vivo Abordagens.
Resumo
O objetivo geral deste método é o de registrar as respostas única unidade de uma população identificada de neurônios. Nos registros eletrofisiológicos in vivo dos neurônios individuais são fundamentais para a compreensão de como os circuitos neurais funcionam em condições naturais. Tradicionalmente, estes registos foram efectuados "cego", o que significa a identidade da célula registada é desconhecido no início da gravação. Identidade celular pode ser posteriormente determinada via intracelular 1, juxtacellular 2 ou solta-patch 3 iontoforese de corante, mas estas gravações não podem ser pré-alvejado a neurônios específicos em regiões com tipos de células funcionalmente heterogêneos. As proteínas fluorescentes podem ser expressas de uma forma específica do tipo de célula permitindo visualmente guiada electrofisiologia unicelular 4-6. No entanto, existem muitos sistemas modelo para o qual estas ferramentas genéticas não estão disponíveis. Mesmo em sistemas modelo geneticamente acessíveis, o desejado promoter pode ser desconhecido ou neurônios geneticamente homogêneos pode ter diferentes padrões de projeção. Do mesmo modo, os vectores virais têm sido utilizados para etiquetar subgrupos específicos de neurónios de projecção 7, mas a utilização deste método é limitada pela toxicidade e falta de especificidade trans-sináptica. Assim, são necessárias técnicas adicionais que oferecem pré-visualização específico para gravar a partir de neurônios individuais identificados in vivo. Pré-visualização do neurônio alvo é particularmente útil para condições de gravação difíceis, para que as gravações de uma única célula clássicos muitas vezes são proibitivamente difícil 8-11. A nova técnica descrita neste artigo usa transporte retrógrado de um corante fluorescente aplicada com o uso de agulhas de tungstênio para rotular rapidamente e seletivamente um subconjunto específico de células dentro de uma determinada região do cérebro com base em suas projeções axonais únicos, proporcionando assim uma indicação visual para obter registros eletrofisiológicos alvo de neurônios identificados em um circuito intacto withind vertebrado SNC.
O novo avanço mais significativo do nosso método é a utilização de rotulagem fluorescente para atingir tipos celulares específicos num sistema modelo acessíveis não geneticamente. Peixe fracamente elétrico é um sistema excelente modelo para o estudo de circuitos neurais no acordado, comportando 12 animais. Nós utilizamos esta técnica para estudar o processamento sensorial por "pequenas células" no núcleo exterolateral anterior (ELA) de peixes mormyrid fracamente elétrico. "Pequenas células" são supor para ser tempo de comparação neurônios importantes para a detecção de diferenças submillisecond nos tempos de chegada dos picos pré-sinápticos 13. No entanto, as características anatômicas, como mielina denso, engolindo as sinapses, e os corpos de pequenas células tornaram extremamente difícil para gravar a partir destas células através de métodos tradicionais 11, 14. Aqui demonstramos que o nosso novo método seletivamente rotula essas células em 28% das preparações, permitindo confiáveis, robustos e gravações caracteríszação das respostas à estimulação electrosensory.
Protocolo
1. Prepare Needles Dye-revestidos
- Eletroliticamente aguçar a 160 um de diâmetro 15 fio de tungstênio. Diâmetros finais ponta da agulha deve variar 5-50 um. O número de agulhas necessários depende do tamanho da região a ser rotulada. Preparamos cinco agulhas por 3-5 injeções no núcleo exterolateral posterior (ELP).
- Na noite anterior à experiência, colocar uma gota (<0,25 ul) de corante de 2 mM de dextrano conjugado com Alexa Fluor 10.000 MW para os distais 100 mm de cada uma das agulhas.
- Permitir que as agulhas secar ao ar à temperatura ambiente, deixando corante concentrada na ponta. Armazenar as agulhas a 4 ° C num recipiente escuro para proteger da luz.
2. Prepare animal para a cirurgia
- Induzir a anestesia geral, colocando o peixe em uma solução de 300 mg / L de MS-222 na água do tanque.
- Pesar o peixe e medir o comprimento do garfo (ponta do focinho até à mesa da nadadeira caudal) e profundidade corporal (máximo dorso-ventral distância no plano transversal). Estas medições deve cair dentro dos intervalos indicados na Tabela 1, de modo que o peixe se encaixa dentro de uma pequena câmara de registo suficiente para colocar sob uma objectiva de microscópio de imersão em água (Figura 1).
- Imobilizar e silenciar electricamente o peixe por injecção de 100 ul de 3 mg / ml flaxedil na musculatura dorsal do corpo.
- Encha a câmara de gravação (Figura 1A) com água do tanque. Colocar o peixe ventral-lateral para baixo sobre a plataforma no centro da câmara (Figura 1). Entregar uma solução arejada de 100 mg / L de MS-222 utilizando uma ponta de pipeta, colocado na boca do peixe (1-2 ml / min.) Estabilizar o peixe com hastes fixadas em cera colocados em ambos os lados do corpo (Figura 1C). Monitorar a saúde do peixe, verificando o fluxo de sangue contínuo nos vasos oculares e uma cor de corpo normal.
- Gire a plataforma ao longo de seu eixo longitudinal e abaixar a extremidade traseira do platforme de modo que um dos lados da superfície dorsal da cabeça do peixe é exposta acima da água, enquanto que o resto do corpo do peixe permanece submerso. Um pequeno pedaço de Kimwipe deve ser colocado em qualquer parte não submersa da pele para evitar a secagem.
3. Cirurgia (Figura 2)
O procedimento cirúrgico básico descrito aqui é bem estabelecida e usada de forma confiável para cegos em gravações vivo em Mormyrids 16. Para outras aplicações, expor as regiões desejadas para a rotulagem e gravação. A região que contém os terminais dos axônios das células de interesse deve ser acessível por uma agulha dye-revestido. A região que contém os segmentos mais proximais desses mesmos axónios deve ter espaço suficiente acima do tecido para acomodar a distância de trabalho da lente de imersão em água (2 mm em nosso caso).
- Aplicar uma solução de 0,4% de lidocaína à superfície exposta da cabeça através de um Q-tip.
- Usando uma lâmina de bisturi, cortar o perímetro de um pedaço rectangular da pele. Remover o rectângulo usando um par de fórceps. O tamanho do rectângulo será dimensionado com o tamanho do animal, mas deverão ser de aproximadamente 3 mm por 5 mm por 6,2 cm de peixe (Figura 2A). O bordo lateral do rectângulo, deverá alinhar com o centro do olho, a borda anterior do rectângulo deve ser apenas para posterior do olho, e o bordo medial do rectângulo deve ser apenas lateral da linha média do peixe.
- Expandir a região exposta ântero crânio para expor um adicional de 2,5 mm Área não-sobreposição quadrada (Figura 2B).
- Completamente limpar e secar a superfície exposta do crânio com a lâmina de bisturi para raspar qualquer excesso de tecido e Kimwipes e ar comprimido para secar a superfície (Figura 2C).
- Cole um poste de metal para a região crânio exposto ântero-medial usando Super Glue. Espere até que a cola estiver completamente seco (Figura 2D).
- Remover um rectângulo de crânio, aproximadamente 2 mm x 4 mm para 6,2 cm de peixe. Use uma broca de dentista com a ~ 0,5 milímetros de diâmetro bola moinho ponta de metal duro para diluir o perímetro do retângulo. Em seguida, utilizando um bisturi e pinça, cortar o perímetro do rectângulo e descascar para expor o cérebro subjacente. Perfuração ou corte com uma tesoura pequena adicional pode ser necessário para expor totalmente EL (Figura 2E). Se ocorrer uma hemorragia muscular, pode ser utilizada uma unidade de electrocautério.
- Cortar tanto a dura-máter (pigmentado) e a pia-máter (clara), utilizando tesouras de mola ou de uma agulha e remover as porções cortadas, com um par de pinças. As porções anterior e posterior do núcleo exterolateral (EL) estão agora disponíveis, ELA e ELP, respectivamente (Figura 3A).
4. Marcação retrógrada de axônios de Interesse
- Posicione um manipulador com uma agulha dye-revestido (feito na Etapa 1) acima da região de destino que contém axônios dos interest, no nosso caso ELP.
- Rapidamente inserir a agulha aproximadamente 25 um para o tecido. Aguarde 15-30 segundos, até que todo o corante tem de sair e, em seguida, retirar a agulha.
- Repita o procedimento com agulhas frescas adicionais, conforme necessário, colocando cada um em um local diferente, de modo que a tinta é distribuída por toda a região de destino. Foram utilizados 3-5 agulhas por preparação.
- Lavar o excesso de corante da cavidade com solução de Ringer de Hickman.
- Espere pelo menos 2 horas para a absorção e transporte de corante.
5. Visualização de axônios de Interesse
- Coloque a câmara de gravação, juntamente com o peixe, abaixo do objectivo de uma posição vertical, microscópio de epifluorescência fases fixa. À medida que o corpo do peixe oclui a penetração da luz, tanto fontes de luz fluorescente branca e deve vir de cima. Uma colocação cuidadosa de uma fonte de luz de fibra óptica acima da cavidade do crânio permite que as imagens de campo claro satisfatórios. Para visualização de epifluorescência, filtro de fluorescênciaespecificações devem corresponder a absorção / emissão do espectro do corante.
- Alterne a respiração de água do tanque fresco e manter a mesma taxa de fluxo. Coloque um fio terra na cavidade do cérebro exposto e conectar-se ao terreno do headstage gravação (ver 6.3).
- Coloque um par de eletrodos de registro junto à base da cauda e se conectar a um amplificador diferencial e um dispositivo de gravação (por exemplo, monitor de áudio, osciloscópio, ou computador) para monitorar o comando de descarga do órgão elétrico (EODC). Depois de o peixe se recupera da anestesia, o EODC pode ser usado como um indicador da condição do peixe.
- Prepare um esboço escala da região do cérebro visto em baixa ampliação. Incluir vasos sanguíneos importantes como marcos (pode variar de peixe para peixe) para identificar a localização exata de axônios marcados visíveis apenas sob alta ampliação (Figura 3D).
- Confirmar a colocação corante. Primeiro ver o tecido inteiro com brightfield iluminação para orientação ( Figura 3A). Então veja com iluminação fluorescente (Figura 3B). ELP terá marcação difusa (Figuras 3B e 3C). Minimizar a excitação de fluorescência para limitar os efeitos fotodinâmica e fototoxicidade do corante.
- Use os vasos como marcos para localizar ELA sob alta ampliação. Iluminar com luz fluorescente, enquanto busca de um axônio marcado perto da superfície. (Figura 4).
6. Registro de atividade extracelular
- Puxe eletrodos de registro de sucção utilizando 1 mm de diâmetro externo, 0,58 mm de diâmetro capilar de vidro de borosilicato com filamento. Tamanho da ponta ideal dependerá do diâmetro dos axónios alvo, que, no nosso caso, é 0,1-0,2 uM 17. Para a nossa aplicação, diâmetros de ponta do eletrodo foram de 1,5 ± 0,4 mM (intervalo: 1,0-2,4 mm), com a 5 mm de comprimento, haste estreita, a fim de aproximar os axônios rotulados sem mover o tecido circundante densamente.
- Preencha electrodos filtrada com solução de Ringer de Hickman. Resistência dica final é de 45,2 ± 38,0 mohms (intervalo: 16-155 mohms).
- Coloque o eletrodo em um porta-eletrodo com uma porta de pressão e conectá-lo a um amplificador headstage montado em um manipulador. Executar uma linha de pressão da porta de pressão para um final entroncamento em um manômetro e uma seringa para monitorar e controlar a pressão, respectivamente.
- Ligue o headstage a um amplificador e um dispositivo de aquisição de analógico para digital.
- Com 30 mbar pressão externa na linha do eletrodo, colocar um eletrodo ao lado de um axônio rotulados. Uma câmera de baixo nível de luz com interface com o software de imagem é usado para visualizar a colocação da pipeta. Comece perto da superfície do tecido e promover o eletrodo para o axônio. Ao se aproximar do axônio, a pressão externa deve causar um movimento leve, mas perceptível do axônio.
- Enquanto o eletrodo fica ao lado do axônio (Figura 4A, em cima) registrar o potenteial no eléctrodo enquanto que a apresentação de estímulos de ensaio (no nosso caso, foi utilizada a 100 mseg monofásicas impulsos transversais positivos e negativos a uma intensidade de 20 mV / cm, a Figura 1A). Os potenciais de ação não deve ser observado, apesar de um artefato elétrico confirma gravação / estimulação adequada (Figura 4A, inferior).
- Solte a pressão externa no eletrodo e repita estimulação / gravação. Os potenciais de ação não deve ainda ser observado (Figura 4B).
- Aplique uma leve (125 ± 25 mbar) de sucção para o eletrodo e estimulação / gravação de repetição. Os potenciais de acção deve ser agora observado em resposta à estimulação (Figura 4C). Também podem ocorrer actividade espontânea. Se os potenciais de ação não são observadas, solte a sucção, limpe o eletrodo com uma ligeira pressão, coloque o eletrodo um pouco, e tentativa de sucção novamente. Uma vez que os potenciais de ação são visíveis, feche a linha de pressão.
- Estimular e registrar comodesejado.
7. Rescisão e Eliminação
- Uma vez que todas as gravações desejadas estão completos, mude para a respiração com 100 mg / L MS-222 até o EODC parou. Nenhuma EODC deve ser detectado durante pelo menos 10 minutos.
- Dispor do pescado de acordo com as diretrizes institucionais e protocolos de cuidados de animais aprovados.
8. Os resultados representativos
Para a nossa aplicação em particular, estamos interessados em estudar estímulo codificação por neurônios sensoriais centrais. Gravações bem sucedidas de axônios marcados permitir a análise de respostas unitárias para estimulação sensorial 18. Figura 5A mostra os potenciais de ação representativas evocadas por estimulação electrosensory transversal utilizando eletrodos bipolares localizados no interior das paredes direita e esquerda da câmara de gravação. Pico vezes pode ser apresentada como uma quadrícula trama pico (Figura 5B). A 25 ms pré-estímulo vento gravaçãoow mostra o baixo nível de atividade espontânea. Este ELA especial "small cell" é de longa passar sintonizado duração do estímulo a uma intensidade de estímulo de 6 mV / cm, aumentando o número de espigas por repetição de duração aumenta estímulo (Figura 5C). A média do primeiro pico de latência é de 4,28 ± 0,16 ms, de acordo com a latência esperada para pequenas células em ELA 11.
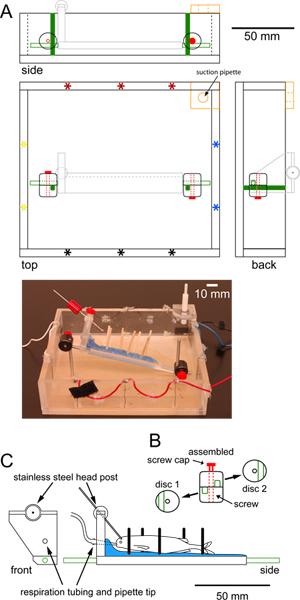
Figura 1. Especificações para uma câmara de gravação que pode caber debaixo da objetiva de um microscópio epiflourescent fase fixa. (A) câmara de gravação quadrados para escala feitos de plexiglass mostrando superior, laterais e traseira vistas. Conjuntos de pares de eletrodos estimulantes (asteriscos) na periferia permitir ou transversal (rubro-negro) ou estimulação longitudinal (azul-amarelo). Uma peça adicional de plexiglass no canto, com um buraco de borracha alinhada no centro (laranja),mantém uma pipeta de sucção que mantém um nível de água constante. Dois postes de aço inoxidável verticais aparafusado na parte inferior da câmara (sólido verde) se conectar a postes de aço inoxidável (contorno verde) ligados à plataforma que suporte o peixe (cinza claro, detalhado na C) através de grampos de discos ajustáveis. Uma fotografia da câmara é mostrada abaixo do desenho de escala. (B) vista individuais e montados dos grampos disco circular de plástico usado para proteger a plataforma para os postes verticais. Cada grampo disco tem um sulco (verde) para um post e um orifício central para o parafuso de aperto. Disco braçadeiras são rodados de modo que os sulcos são perpendiculares uns aos outros. Apertar os parafusos (vermelho) braçadeiras os postos no lugar para evitar mais movimento de rotação vertical e da plataforma. (C) vista da frente e de lado a escala da plataforma de plexiglass usado para segurar o peixe no lugar. A plataforma é revestida com uma camada de cera de parafina (azul), que mantém Dowe madeirals (barras pretas) no local para apoiar o peixe. Tubos para respirating o peixe passa através de um furo na 'cabeceira' da plataforma e termina numa ponta de pipeta colocado na boca do peixe. Um posto de cabeça de aço inoxidável (barra cinza) se conecta à plataforma por meio de uma rótula que permite uma rotação de 360 graus. Mensagens horizontais de aço inoxidável (verde) são parafusados em cada extremidade da plataforma. Clique aqui para ver a figura maior .
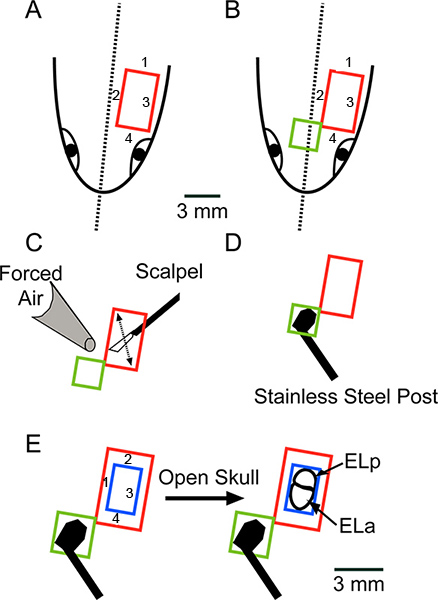
Figura 2. Visão esquemática da cirurgia olhando para a superfície dorsal da cabeça. (A) Faça quatro cortes, na ordem indicada, para remover um pedaço retangular de pele (vermelho). (B) Estender a abertura ântero para remover um pedaço retangular adicional da pele (verde). (C) Raspe qualquer gordura demais ou ligamentos pormover a lâmina de bisturi, como indicado pela seta e secar completamente a superfície com Kimwipes e ar forçado (D). Cole um borne de aço inoxidável ao crânio com supercola. Barra de escala em um aplica-se a AD. (E) Use uma broca de dentista para fazer quatro cortes, na ordem indicada, para remover um pedaço retangular de osso (azul), expondo os núcleos exterolateral anterior e posterior (ELA e ELP, respectivamente) . Clique aqui para ver a figura maior .
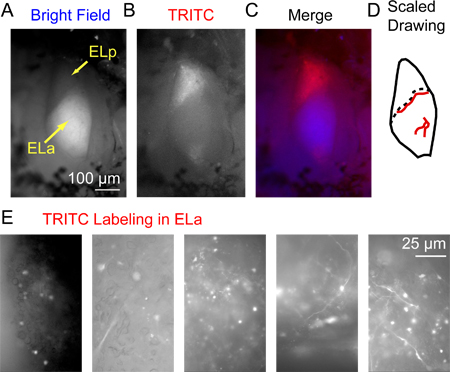
Figura 3. Marcação fluorescente no núcleo exterolateral posterior 3 horas após a injeção do dextrano conjugado com Alexa Fluor 568. (A) Os núcleos exterolateral anterior e posterior (ELA e ELP, respectivamente) visualizado com iluminação de campo claro de cima. Notaque a mielinização extensa dentro Ela lhe dá uma aparência relativamente brilhante que a distingue de ELP. (B) A mesma área visualizada usando epifluorescência visto através de um filtro TRITC. (C) A imagem mesclada com azul para A (campo claro) e vermelho para B (TRITC). (D) Exemplo de um desenho em escala de ELA e ELP, incluindo vasos sanguíneos principais (linhas vermelhas), que podem ser usados como pontos de referência para identificar a localização exata de axônios marcados visíveis apenas sob alta ampliação (a localização exata dos vasos sanguíneos varia de peixe para peixe). A linha pontilhada indica a fronteira entre ELA e ELP. (E) Exemplos de imagens obtidas utilizando um filtro TRITC de cinco preparações diferentes, ilustrando uma série de padrões de rotulagem de sucesso de pequenos axônios celulares e somas em ELA.
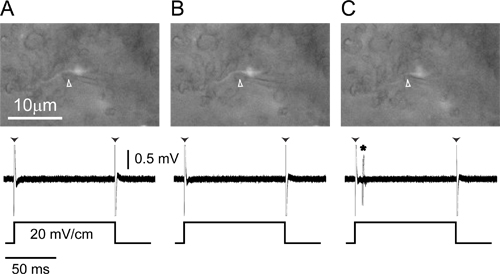
Figura 4. Gravação extracelular única unidadea partir de um axônio rotulados. (A) eletrodo de gravação (cabeça de seta), sob pressão positiva colocada ao lado de um axônio de pequenas células rotuladas de ELA (top) registra apenas artefato borda (cabeças de seta) em resposta a um 100 ms 20 mV / cm monofásicos, , transversal pulso quadrado contralateral positivo (inferior). (B) A libertação de pressão para fora do eletrodo (cabeça de seta) faz com que o axônio para mover ligeiramente para o eletrodo (em cima), mas ainda não há respostas para o estímulo (baixo). ( C) pressão ligeiramente negativa puxa o axônio para o eletrodo (em cima, cabeça de seta) e potenciais de ação em resposta ao início do estímulo são agora visíveis (parte inferior, asterisco). Porções de fundo de todos os três painéis são respostas sobrepostas a 20 repetições do estímulo.
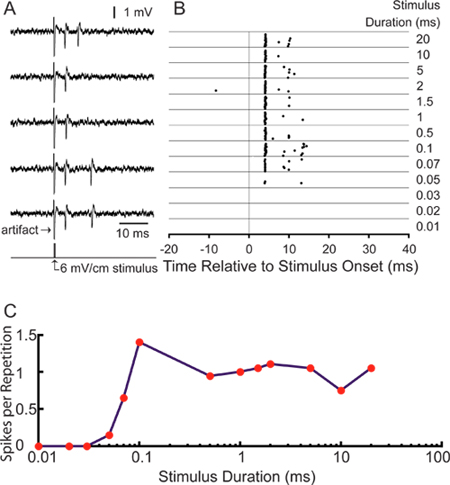
Figura 5. Os resultados representativos usando esta técnica. (A) 5 traços da amostramostrando os potenciais de ação evocados por um 0,1 ms 6 MV / cm monofásicos, transversal estímulo pulso quadrado contralateral positivo. (B) Raster enredo mostrando momentos de pico durante 20 repetições de uma janela de gravação de 75 ms para a mesma unidade estimuladas no tempo 0, com 6 mV / cm estímulos na faixa de durações listadas à direita. (C) curva de afinação Duração quantificar as respostas apresentadas na raster como espigas por repetição de estímulo.
| Massa (g) | Comprimento dos garfos (cm) | Profundidade do corpo (cm) | |
| Significar | 2,42 | 6.20 | 1.14 |
| Desvio Padrão | 0,64 | 0,52 | 0,18 |
| Alcance | 1,2-4,0 | 5,5-8,4 | 0,9-1,6 |
Tabela 1. Optimalpeso, comprimento e profundidade varia de corpo para os peixes. peso ideal, o comprimento do garfo (ponta do focinho até à mesa da nadadeira caudal) e corpo de profundidade (distância dorso-ventral máxima no plano transversal) varia permitindo que os peixes para caber na câmara de gravação ilustrado na Figura 1. Os peixes que são muito pequenas podem ser menos propensos a sobreviver à cirurgia e terá uma pequena ELP, tornando a colocação corante desafiador. Os peixes que são muito grandes vai ter um grande, cerebelo mais longo alcance que vai reduzir o acesso a ELA e ELP e pode impedir redução da energia, água, imersão objetivo alta perto o suficiente para se concentrar em ELA e ELP.
| Local de aplicação | Corante Tipo | Peixe tentou | Etiqueta em ELA | Etiqueta em ELP | Unidades tentou | Gravações |
| ELum | Alexa Fluor injecção | 32 | 26 (81,2%) | 19 (59,4%) | 50 | 4 (8,0%) |
| ELA | Alexa Fluor papel de filtro embebido | 1 | 0 | 0 | 0 | 0 |
| ELA | Di-me em DMSO | 8 | 6 (75,0%) | 0 | 0 | 0 |
| ELA | Di-O cristais | 5 | 3 (60,0%) | 2 (40,0%) | 9 | 0 |
| ELP | Alexa Fluor cristais sólidos | 2 | 0 | 2 (100%) | 0 | 0 |
| ELP | Alexa Fluor fios de tungstênio revestidos | 43 | 29 (67,4%) | 41 (95,3%) | 119 | 26 (21,8%) |
Tabela 2. As taxas de sucesso em cada método de injeção de corante. Taxas de sucesso para cada método de injeção de corante. Os métodos são divididos com base no local de injeção e tipo de corante. Para cada método, o número total de peixe e tentada a percentagem destas experiências, que resultou na marcação com êxito em ELA e ELP é mostrado. Note-se que a área de gravação alvo é o oposto do local de aplicação (caixas em negrito). Para o local da injeção, a absorção do corante foi considerada bem-sucedida com a rotulagem de ambos somas e axônios. Em contraste, no local da gravação, apenas preparados com axónios marcados foram contadas como experiências de marcação bem sucedidas. O número total de tentativas de unidades e a percentagem destas unidades, que resultou em gravações bem sucedidas são também mostrados.
| # Da injeção de sites | Volume médio por injeção (mL) | Gama de volumes por injeção (mL) | Volume de injeção total médio (mL) | Gama de volumes de injeção totais (mL) | |
| Microinjetor com Hamilton | 3 ou 4 | 0,144 | ,091-0,91 | 0,516 | 0,378-0,669 |
| Nanoinjector com vidro pipeta | 2-4 | 0.069 (fixo) | Volume fixo injetado 1-6 vezes | 0,621 | 0,414-0,966 |
| Microinjetor com vidro pipeta | 2-6 | 0.093 | 0,058-0,202 | 0.360 | ,252-,540 |
Tabela 3. Quantidades de corante aplicado para cada um dos três métodos utilizados para injectar Alexa Fluor em ELA Quantidades de corante aplicadas para cada um dos três métodos utilizados para injectar Alexa Fluor em ELA (primeiro método a partir da Tabela 2). Injecção de corante em ELA foi realizada tanto com um nanoinjector e um microinjector utilizando uma agulha de calibre 33 de Hamilton seringa ou uma pipeta capilar de vidro puxado. Nós variou o número de locais de injecção, o volume por injeção eo volume total de injeção de corante.
Discussão
Uma vez dominado, esta técnica permitirá um para atingir os neurônios identificados, incluindo axônios individuais, no gravações vivo em muitos sistemas modelo. Além disso, esta técnica permite registar com segurança de saída de pico de neurónios com características únicas que o tornam anatómicas tradicional em métodos de gravação vivo desafiador. Nós utilizamos esta técnica para gravar a partir de ELA "pequenas células" em mormyrid peixe fracamente elétrico. As tentativas anteriores para estudar as propriedades de ajuste de "pequenas células" não tiveram sucesso devido às condições desafiadoras de gravação 11, 14. Características anatômicas semelhantes criar barreiras para a obtenção de gravações em uma única unidade de diversos vertebrados neurônios electrosensory 8-10 e auditivos. Para superar estes desafios em nosso sistema, aproveitamos o fato de que "pequenas células" são as únicas células em ELA que se projetam para ELP. Assim, o transporte retrógrado de corante colocado no ELP limita rotulagem em ELA a "pequena"somas e axônios de células. marcação fluorescente dos axônios permitiu a colocação do eletrodo precisa ao lado de axônios marcados, fazendo gravações em uma única unidade de células identificadas possíveis apesar somas inacessíveis. Tentamos gravações somáticas, mas não tiveram sucesso, provavelmente devido às sinapses envolvendo em torno de 11 , 17. No entanto, a rotulagem somática era claramente visível, sugerindo que esta técnica pode ser usada para alvejar gravações somáticos em outros tipos celulares e outros circuitos. rotulagem fluorescente de neurónios através de transporte retrógrado in vivo, foi utilizado para orientar gravações alvo in vitro 19-21 . Uma técnica semelhante foi utilizada para alvo de gravações de neurónios motores in vivo em peixes-zebra medula espinal 22. nosso trabalho representa uma nova abordagem de expansão deste, em que ambos de rotulagem e gravação são feitas in vivo dentro do cérebro. nosso método demonstra que, in vivo rotulagem das áreas do sistema nervoso central com um retrógrado tpiloto pode ser expandido para o estudo de outros circuitos intactas com neurónios de projecção semelhante selectivos. Por exemplo, no tratamento de mamíferos auditivo, no colículo inferior (CI), que serve como um centro de retransmissão importante para as entradas de várias estruturas rhombencephalic 23. Injecção de corante para o IC seria etiquetar selectivamente as células de projecção a partir de cada um destes núcleos. O colículo superior (SC) tem uma função semelhante para a visão 24. Preparações da medula espinal são particularmente adequados para esta técnica, tal como a medula espinal é facilmente acessível, a injecção de corante pode ocorrer longe do local de gravação, e pode ser combinado com a gravação intracelular e enchimento de neurónios seleccionados para adquirir a informação anatómica mais detalhada 25. Finalmente, o tracto-tracing é uma técnica bem estabelecida utilizada em todo o sistema nervoso central para mapear complexo circuito 26. O método pode ser utilizado para adicionar a informação funcional para estes estudos, como tem sido feito windicadores de cálcio sensíveis om em cat córtex visual 27.
A cirurgia, o que está bem estabelecido, fiável e, regularmente usado para cego in vivo gravações 16, deve ser preenchida com hemorragia mínima e sem danificar a superfície do cérebro para permitir que o animal e o tecido para sobreviver. Com a prática, a aplicação da cirurgia e corante pode ser completado em 30-45 minutos. Nós rotulado com sucesso "pequenas células" axônios em 67% dos preparativos. A maioria das preparações têm apenas 1 ou 2 axônios marcados visíveis, mas alguns têm até 8. Dos 119 unidades marcadas tentaram, obtivemos gravações-unitárias de 26 unidades distribuídas ao longo de 12 preparações (Tabela 2). Assim, os dados foram coletados a partir de 41% de preparações com axônios marcados para uma taxa global de sucesso de 28%.
O aspecto crítico da aplicação corante é etiquetar profundidade. A falta de inserção do fio de tungsténio vai resultar em que o corante de ser lavado away. No entanto, se a penetração for muito profunda, axónios marcados não será visível para o direcionamento. Além disso, alguns danos mecânicos na célula deve ocorrer para que o corante deve ser adequadamente feita até 25, 28. No entanto, muito dano vai matar as células. Tentamos marcação com outros corantes e outros métodos (Tabela 2), incluindo a rotulagem anterógrada através de injeção de corante em ELA emparelhado com gravação de axônios marcados em ELP (Tabela 3). Nossa hipótese é que a rotulagem anterógrada não foi bem sucedida porque a rotulagem foi limitada a células com danos somática, tornando-se indiferente. Além disso, os terminais pré-sinápticas podem ter sido perturbada. Em contraste, marcação retrógrada minimiza tanto destas preocupações. A quantidade e localização de aplicação de corante pode ser alterado de acordo com o circuito particular a ser estudado. Rotulagem máxima ocorre com a maior concentração de corante, o que foi conseguido usando fios de tungsténio revestidas. No entanto, para a rotulagem de axônios comprojeções ep, corante pode sair de uma agulha de tungstênio como é avançado. Nestes casos, a injecção de pressão seria mais apropriada. Absorção e transporte Dye são rápidos, com axônios marcados em nossa preparação, sendo visível logo em 2 horas após a injeção e axônios marcados adicionais que aparecem tão tarde quanto 6 horas após a injeção. Assim, a marcação e gravação pode ser realizada num único dia, eliminando dificuldades técnicas associadas com a cirurgia de sobrevivência. Sincronismo irá variar para cada aplicação, dependendo da distância necessária para o transporte de corante.
Outro aspecto importante é a colocação do eletrodo. É importante para entrar no tecido próximo do sítio do axónio rotulado para evitar o entupimento da ponta. Para o tecido denso, tal como na ELA, uma longa haste fina no eléctrodo de registo minimiza o excesso de movimento do tecido circundante. Se uma gravação de sucesso não é alcançado na primeira tentativa, repita com eletrodos frescas até uma gravação é obtida ou a TISSue é interrompida para o ponto no qual o axónio já não é visível. No entanto, é também importante para colocar rapidamente o eléctrodo próximo ao axónio para minimizar a quantidade de exposição fluorescente, o que pode causar a fototoxicidade, branqueamento e pode afectar as propriedades fisiológicas da célula 29-31.
Uma vez que um segmento do axónio é aspirada com êxito no eléctrodo de registo, as gravações podem ser obtidos por várias horas. Se as unidades são constantemente perdidos em menos de 1 hora, considere fazer pontas de eléctrodos mais pequenos para impedir o axónio de deslizar para fora. Por outro lado, muito pequena de um ponta pode resultar em entupimento, baixo sinal-ruído, ou danos no axónio. Uma diminuição constante no pico de amplitude e o "retorno" de uma unidade de sucção é uma indicação adicional de que a ponta é demasiado grande. Muito sucção pode causar danos irreparáveis para o axônio. Uma solução é permitir que uma pequena fuga na linha de ar de modo a pressão lentamente retorna a zero. Rapidamente equalizar ªe pressão irá resultar em uma relação transitória-fora 'push' que pode expulsar o axônio.
Embora esta técnica representa uma grande vantagem para a obtenção de gravações específicas identificadas a partir de neurónios de projecção, que não será útil para distinguir interneurónios locais, como corante seria ocupada por todos os tipos de células no local da injecção. Teoricamente, a utilização de fluoróforos com múltiplos locais de injecção pode permitir que este método seja expandida. Por exemplo, a comparação de um único versus dupla marcação pode ser usado para distinguir interneurónios de neurónios de projecção dupla seguintes injecções em dois pontos no circuito 32. Da mesma forma, traçadores retrógrados pode ser combinada com outras técnicas de imagem avançadas, como a imagem de dois fótons, como foi feito recentemente em tentilhão alta centro Vocal (HVC) 32. Além disso, as regiões de gravação são limitados aqueles que perto da superfície quando se utiliza microscópios de epifluorescência, já que só foram capazes de resolver uma emu; estruturas m nos primeiros 30 mm de tecido. No entanto, esta profundidade poderia ser estendido através da utilização de outras técnicas de microscopia, tais como a microscopia de dois fotões 33 ou objectivo acoplado a microscopia de iluminação plana 34. No geral, esta técnica representa um avanço importante no estudo dos circuitos neuronais in vivo, porque pode ser utilizado para gravar a partir de neurónios individuais, em muitos circuitos diferentes em uma variedade de sistemas de modelos - incluindo aqueles que são relativamente inacessíveis.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Financiamento concedido pela Fundação Nacional de Ciência (IOS-1050701 para BAC), o National Institutes of Health (NS54174 a SM e F30DC0111907 a AML-W.), A Fundação Memorial Uehara e Sociedade Japonesa para a Promoção da Ciência (G2205 para TK ). Agradecemos Julian Meeks por seu apoio e orientação sobre o tema das gravações axonal extracelulares. Agradecemos Carl Hopkins para fornecer uma câmara de gravação protótipo.
Materiais
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
Referências
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099 (2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, &. #. 2. 0. 1. ;. M., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados