Method Article
역행 형광 라벨이 확인 된 신경 세포의 표적 세포 외 단일 단위 기록을 허용
요약
형광 염료의 역행 전송 해부학 적 투사에 따라 신경 세포의 하위 인구 레이블. 레이블 축삭은 시각적 대상이 될 수 있습니다 생체 내 확인, 축색 돌기에서 세포 녹음을 허용. 이 기술은 신경 세포가 유전자 조작을 통해 표시하거나 분리하기 어려운 할 수없는 경우 '블라인드'를 사용하여 녹화를 촉진 생체 내 방법.
초록
이 방법의 전반적인 목표는 뉴런의 확인 인구에서 하나의 단위 반응을 기록하는 것입니다. 개별 뉴런의 생체 전기 생리학 녹음에서 신경 회로는 자연 조건 하에서 작동 방법을 이해하기위한 중요합니다. 전통적으로,이 기록은 기록 된 셀의 ID가 녹음 시작시 알 수없는 의미 '블라인드'수행되었다. 세포 신원은 이후 세포 juxtacellular 1, 2, 느슨한 패치 염료의 3 이온 도입을 통해 확인할 수 있지만,이 기록은 기능적으로 서로 다른 세포 유형과 지역의 특정 신경 세포에 사전에 대상이 될 수 없습니다. 형광 단백질은 시각적으로 유도 한 세포 전기 생리학 4-6을 허용 셀 타입 특정 방식으로 표현 될 수 있습니다. 그러나 이러한 유전 적 도구를 사용할 수 없습니다하는 여러 모델 시스템이 있습니다. 심지어 유전자 접근 모델 시스템에서 원하는 프로moter를 알 수있을 수 있습니다 또는 유 전적으로 균일 한 신경 돌기 패턴을 다양한있을 수 있습니다. 마찬가지로, 바이러스 성 벡터를 투사 뉴런 7의 특정 하위 레이블로 사용되었지만,이 방법의 사용은 횡단 시냅스 특이 독성과 부족에 의해 제한됩니다. 따라서, 생체 내에서 확인 된 하나의 뉴런에서 기록하는 특정 사전 시각화를 제공하는 추가적인 기술이 필요합니다. 대상 신경 세포의 사전 시각화 고전 단일 셀 녹음은 종종 8-11 엄청나게 어려운하는 어려운 촬영 조건에 특히 유용합니다. 이 문서에 설명 된 새로운 기술은이를 대상으로 전기 생리학 녹음을 얻기 위해 시각적으로 제공하는 신속하고 선택적으로 그들의 독특한 축삭 돌기를 기반으로 특정 뇌 영역 내에서 세포의 특정 부분 집합에 레이블을 텅스텐 바늘을 사용하여 형광 염료의 역행 전송을 적용된 사용 그대로 회로 withi에서 확인 뉴런NA는 CNS 척추.
우리의 방법의 가장 중요한 새로운 발전이 아닌 유전자 접근 모델 시스템의 특정 세포 유형을 대상으로 형광 라벨의 사용이다. 약한 전기 물고기 동물 12 행동, 깨어있는 신경 회로를 공부를위한 훌륭한 모델 시스템입니다. 우리는 약한 전기 mormyrid 물고기의 전방 exterolateral 핵에서 "작은 세포"(ELA)의 감각 처리를 연구하는이 기술을 활용. "작은 세포는"연접 스파이크 (13)의 도착 시간의 밀리 초 이하의 차이를 검출하기위한 중요한 시간을 비교 뉴런으로 가설되어 있습니다. 그러나, 밀도 수초, 침몰 시냅스 작은 세포 기관으로 해부학 적 기능은 매우 어려운 전통적인 방법 11, 14를 사용하여 이러한 세포에서 기록을 만들었습니다. 여기에 우리가 신뢰할 수있는 강력한 레코딩 및 characte을 허용, 우리의 새로운 방법은 선택적 준비의 28 %에서 이러한 세포를 레이블 입증electrosensory 자극에 대한 응답 rization.
프로토콜
1. 염료 코팅 바늘을 준비합니다
- 전해 160 μm의 직경의 텅스텐 와이어 15을 선명하게. 최종 바늘 끝의 직경이 5-50 μm의에 이르기까지 다양합니다. 필요한 바늘의 수는 영역이 표시되는 크기에 따라 달라집니다. 우리는 후방 exterolateral 핵 (ELP)에 3-5 주사 5 바늘을 준비했다.
- 실험 전날 밤, 각 바늘의 말초 100 μm의 상 2 개 mm 덱스 트란 - 복합 알렉사 플 루어 10,000 MW 염료의 하락 (<0.25 μL)를 배치.
- 바늘 끝에 집중 염료를 떠나, 실온에서 건조 공기 수 있습니다. 4 ° C에서 빛으로부터 그들을 보호하기 위해 어두운 컨테이너에 바늘을 저장합니다.
2. 수술을위한 동물의 준비
- 탱크 물 300 ㎎ / L MS-222 용액에 물고기를 배치하여 전신 마취를 유도.
- 물고기와 측정 포크 길이 (꼬리 지느러미의 포크 주둥이 끝) 몸과 깊이를 (무게 dorso-ventra 최대가로 평면에서 L의 거리). 이 측정은 물고기가 물 침수 현미경 목표 (그림 1)에 따라 배치 할 정도로 작은 기록 챔버 내부에 맞도록 표 1의 범위 내에 있어야합니다.
- 고정화 및 전기 등의 신체 근육에 3 밀리그램 / ML flaxedil 100 μl를 주입하여 물고기를 침묵.
- 탱크 물과 녹음 챔버 (그림 1A)를 입력합니다. 챔버의 중앙 (그림 1)에서 플랫폼에 물고기 복부면을 아래로 놓습니다. 물고기의 입에 배치 피펫 팁 (1-2 ML / 분)를 사용하여 100 ㎎ / L MS-222의 탄산 솔루션을 제공합니다. 본문 (그림 1C)의 양쪽에 배치 왁스로 고정 막대와 물고기를 안정. 안구 혈관에 지속적으로 혈액 흐름과 정상적인 신체 색상을 확인하여 물고기의 건강을 모니터링합니다.
- 그것의 긴 축을 따라 플랫폼을 회전 platf의 뒤쪽 끝을 낮추물고기의 몸의 나머지는 물속에 잠긴 상태로 유지하면서 물고기의 머리의 등쪽 표면의 한쪽은 물 위에 노출되도록 ORM. Kimwipe의 작은 조각은 건조를 방지하기 위해 피부의 비 물속에 잠긴 부분에 배치해야합니다.
3. 수술 (그림 2)
여기에 설명 된 기본 수술은 잘 설립하고 안정적으로 mormyrids 16 생체 녹음에서 맹인을 위해 사용됩니다. 다른 응용 프로그램의 경우, 라벨 및 기록에 원하는 지역을 노출합니다. 관심 세포의 축삭 터미널을 포함하는 지역은 염료 코팅 바늘로 연결할 수 있어야합니다. 그 같은 축삭의 더 많은 근위 세그먼트를 포함하는 영역은 물 침지 렌즈 (우리의 경우 2 ㎜)의 작동 거리를 수용하기 위해 조직 이상 충분한 공간이 있어야합니다.
- Q - 팁을 사용하여 머리의 노출 된 표면 리도카인 0.4 % 용액을 적용합니다.
- 메스 블레이드를 사용하여, 피부의 사각형 조각의 경계를 잘라. 포셉 한 켤레를 사용하여 사각형을 제거합니다. 사각형의 크기는 물고기의 크기에 따라 확장되지만, 약 3mm 6.2 cm 물고기 (그림 2A)에 대한 x 5 mm 이상이어야한다. 사각형의 측면 가장자리는 눈의 중앙에 정렬한다, 사각형의 앞쪽 가장자리는 눈 바로 뒤쪽해야하며, 사각형의 내측 가장자리 물고기의 정중선의 바로 옆해야합니다.
- 추가로 2.5 mm 광장 비 중첩 영역 (그림 2B)를 노출 anteromedially 노출 된 두개골 영역을 확장합니다.
- 완전히 표면 (그림 2C)를 건조 초과 조직과 킴 와이프 및 강제 공기를 멀리 긁어 메스 블레이드를 사용하여 두개골의 노출 된 표면을 지우고 건조.
- 최고 접착제를 사용하여 내측 노출 된 두개골 부위에 접착제 금속 게시물을. 접착제 (그림 2D) 완전히 건조 될 때까지 기다리십시오.
- , 6.2 센티미터 물고기 약 2mm x 4 mm의 두개골의 사각형을 제거합니다. 사각형의 경계를 얇게 ~ 0.5 mm 직경의 볼 밀 초경 팁 치과 드릴을 사용합니다. 그런 다음, 메스와 집게를 사용하여 기본 뇌를 노출 멀리 사각형의 경계를 잘라 껍질. 추가 시추 또는 작은 가위로 절단 완전히 EL을 (그림 2E) 노출해야 할 수도 있습니다. 근육 출혈이 발생하는 경우, 소작 장치를 사용할 수 있습니다.
- 뇌경막 (안료)와 피아 교인 (지우기) 봄 가위를 사용하거나 바늘을 모두 버려야하고 포셉 한 쌍의 절단 부분을 제거합니다. exterolateral 핵 (EL)의 전방과 후방 부분은 이제 각각 ELA 및 ELP (그림 3A) 볼 수 있습니다.
4. 관심 축삭의 역행 레이블
- 가출의 축삭을 포함하는 대상 지역 위에 염색 코팅 바늘 (1 단계에서 만든)와 매니퓰레이터의 위치를우리의 경우 ELP에서 t.
- 신속하게 조직에 바늘을 약 25 μm의를 삽입합니다. 모든 염료가 벗겨 때까지 15-30 초 정도 기다린 후 바늘을 철회.
- 염료가 대상 지역에 걸쳐 분산되도록 다른 위치에 각각 배치, 필요에 따라 신선한 바늘로 반복합니다. 우리는 준비 당 3-5 바늘을 사용했습니다.
- 크먼의 벨소리 솔루션 구멍에서 초과 염료를 씻어.
- 염료 흡수 및 수송을 위해 최소한 2 시간을 기다립니다.
5. 관심 축삭의 시각화
- 수직, 고정 단계 epifluorescent 현미경의 목표 아래, 물고기와 함께 녹음 챔버를 놓습니다. 물고기의 몸이 빛의 침투를 폐색으로, 흰색과 형광 모두 광원 위에서 와야합니다. 두개골 구멍 위에 광섬유 광원의주의 깊은 배치는 만족 시야 이미지를 수 있습니다. epifluorescence에보기, 형광 필터사양은 염료의 흡수 / 방출 스펙트럼과 일치해야합니다.
- 신선한 탱크 물 호흡을 전환하고 동일한 유량을 유지한다. 노출 된 뇌 구멍에 접지선을 놓고 녹음 headstage의 지상 (6.3 참조)에 연결합니다.
- 꼬리의 기지 옆에 녹음 한 쌍의 전극을 배치하고 전자 오르간 방전 명령 (EODC)를 모니터링하는 차동 증폭기 및 녹화 장치 (예 : 오디오 모니터, 오실로스코프, 또는 컴퓨터)에 연결합니다. 물고기가 마취에서 회복 한 후, EODC는 물고기의 상태의 지표로 사용할 수 있습니다.
- 낮은 배율에서 볼 뇌 영역의 축소 스케치를 준비합니다. 단지 높은 배율 (그림 3D) 아래에 보이는 레이블 축삭의 정확한 위치를 식별하는 랜드 마크 (생선 생선에 따라 다를 수 있습니다)와 같은 주요 혈관을 포함합니다.
- 염료 배치를 확인합니다. 우선 (방향에 대한 시야 조명과 전체 조직을 볼 수 그림 3A). 다음 형광 조명 (그림 3B)를 볼 수 있습니다. ELP는 확산 라벨 (그림 3B 및 3C)해야합니다. 염료의 광역 및 광독성 효과를 제한하는 형광 여기를 최소화 할 수 있습니다.
- 고배율에서 ELA를 찾습니다 랜드 마크 혈관을 사용합니다. 표면 근처에 표시 축삭을 검색하는 동안 형광등 조명. (그림 4).
6. 세포 외 활동 기록
- 1mm OD, 필라멘트 0.58 mm ID 붕규산 모세관 유리를 사용하여 흡입 기록 전극을 당깁니다. 이상적인 팁 크기는 우리의 경우 17 0.1 ~ 0.2 μM 인 대상 축삭의 직경에 따라 달라집니다. 우리의 응용 프로그램의 경우, 전극 팁 직경은 1.5이었다 ± 0.4 μm의 (범위 : 1.0-2.4 μm의) 5 mm 길이, 폭이 좁은 정강이와 주변 밀집 조직을 이동하지 않고 레이블 축삭을 접근하는 순서입니다.
- ELEC 채우기와 trodes는 크먼의 벨소리 솔루션을 필터링. 마지막 팁 저항은 45.2 ± 38.0 MΩ (: 16-155 MΩ 범위)입니다.
- 압력 포트와 전극 홀더에 전극을 배치하고 조작에 장착 증폭기 headstage에 연결합니다. 압력 포트에서 압력계 및 각각 압력을 모니터링하고 제어하기위한 주사기에 T-접합 결말에 압력 라인을 실행합니다.
- 앰프 headstage 및 아날로그 - 디지털 수집 장치를 연결합니다.
- 전극 라인에서 30 mbar의 외부 압력, 레이블 축삭 옆에 전극을 배치합니다. 이미징 소프트웨어 인터페이스 낮은 조명 수준의 카메라 피펫 배치를 시각화하는 데 사용됩니다. 조직 표면 근처에 시작하고 축삭으로 전극을 진행. 당신은 축삭에 접근함에 따라, 외부 압력은 축삭의 약간 있지만, 눈에 띄는 움직임을 일으키는 원인이된다.
- 전극 축삭 (그림 4A, 최고) 강력한를 기록 옆에있는 동안전극에서 IAL 테스트 자극을 (우리의 경우, 우리는 20 MV / cm의 강도로 100 밀리 초 monophasic 긍정과 부정 가로 펄스를 사용하여, 그림 1A) 표시하는 동안. 전기 이슈 적절한 녹음 / 자극 (그림 4A, 아래) 확인하지만 활동 전위를 관찰 할 수 없습니다.
- 전극에 외부 압력을 풀어 자극 / 녹화를 반복합니다. 활동 전위는 여전히 (그림 4B) 관찰 할 수 없습니다.
- 전극과 반복 자극 / 녹음 약간 (125 ± 25 밀리바) 흡입을 적용합니다. 활동 전위는 이제 자극 (그림 4C)에 대한 응답으로 관찰해야한다. 자발적인 활동이 발생할 수 있습니다. 활동 전위가 관찰되지 않은 경우, 흡입을 풀어 약간의 압력으로 전극을 취소, 다시 약간 전극을 이동하고, 시도 흡입. 활동 전위가 표시되면, 압력 라인을 닫습니다.
- 로를 자극하고 기록원하는.
7. 종료 및 폐기
- 원하는 모든 녹음이 완료되면 EODC이 멈출 때까지, 100 ㎎ / L MS-222와 호흡으로 전환합니다. 더 EODC는 적어도 10 분 동안 감지되지 않아야합니다.
- 제도적 지침 및 승인 동물 관리 프로토콜에 따라 물고기의 폐기하십시오.
8. 대표 결과
우리의 특정 응용 프로그램을 위해, 우리는 중앙 감각 신경에 의해 코딩 자극을 공부에 관심이 있습니다. 레이블 축삭에서 성공적으로 녹음 감각 자극 18 단일 장치 응답의 분석을 할 수 있습니다. 그림 5A는 기록 챔버의 왼쪽과 오른쪽 벽의 내부에있는 바이폴라 전극을 사용하여 가로 electrosensory 자극에 의해 유발 대표적인 활동 전위를 보여줍니다. 스파이크 시간은 스파이크 래스터 플롯 (그림 5B)로 표시 할 수 있습니다. 25 밀리 사전 자극 기록 바람아야는 자발적인 활동의 낮은 수준을 보여줍니다. 이 특정 ELA "작은 세포는"긴 패스 자극 지속 시간이 증가한다 (그림 5C)로 반복 당 스파이크의 수를 증가, 6 MV / cm의 자극 강도로 자극 지속 시간을 조정합니다. 평균 번째 스파이크 대기 시간은 4.28 ± 0.16 밀리 초, ELA 11 작은 셀의 예상 대기 시간과 일치합니다.
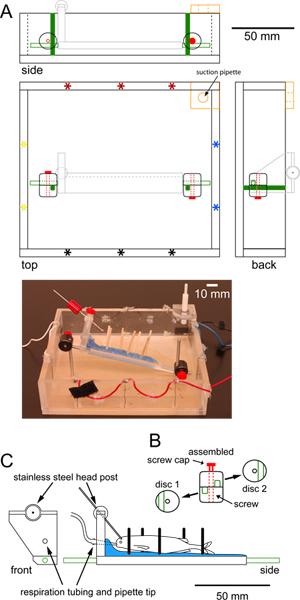
그림 1. 고정 단계 epiflourescent 현미경의 목적 아래에 들어갈 수있는 녹음 챔버의 사양. (A)으로 규모 평방 기록 챔버 상단, 측면 및 후면보기를 보여 플렉시 유리로 만든. 주변에 자극 전극 (별표)의 짝 세트는 가로 (빨강 - 검정) 또는 세로 (파랑 - 노랑) 자극 할 수 있습니다. 센터 (오렌지)의 고무 늘어선 구멍 모서리에있는 플렉시 글라스의 추가 조각,일정한 수위를 유지 흡입 피펫을 보유하고 있습니다. 챔버 (녹색)의 바닥에 나사 두 개의 수직 스테인레스 스틸 게시물은 조정 디스크 클램프를 통해 물고기 (C에 설명 된 라이트 그레이) 지원 플랫폼에 부착 된 스테인레스 스틸 게시물 (녹색 외곽선)에 연결합니다. 챔버의 사진은에 규모 그림 아래에 표시됩니다. (B) 원형 플라스틱 디스크 클램프의 개인 및 조립 뷰가 수직으로 게시물 플랫폼을 확보하는 데 사용됩니다. 각 디스크 클램프 조임 나사 포스트와 센터 구멍 홈을 (녹색)가 있습니다. 홈이 서로 직각이되도록 디스크 클램프 회전됩니다. 나사 (적색) 클램프에게 플랫폼의 더 수직과 회전 운동을 방지하기 위해 장소에 게시물을 체결. 장소에서 물고기를 보유하는 데 사용 플렉시 글라스 플랫폼 (C) 전면 및 측면에 규모 전망. 이 플랫폼은 나무 dowe를 보유하고 파라핀 왁스의 층 (파란색)로 코팅되어물고기를 지원하는 장소에서 LS (검은 막대). 물고기를 respirating을위한 튜브 물고기의 입에 배치 피펫 팁의 플랫폼과 끝의 '헤드 보드'에있는 구멍을 통해 전달합니다. 스테인레스 스틸 헤드 게시물 (회색 막대) 360도 회전을 허용하는 볼 조인트를 통해 플랫폼에 연결합니다. 스테인리스 수평 게시물 (녹색) 플랫폼의 양쪽 끝으로 망했다. 큰 그림을 보려면 여기를 클릭하십시오 .
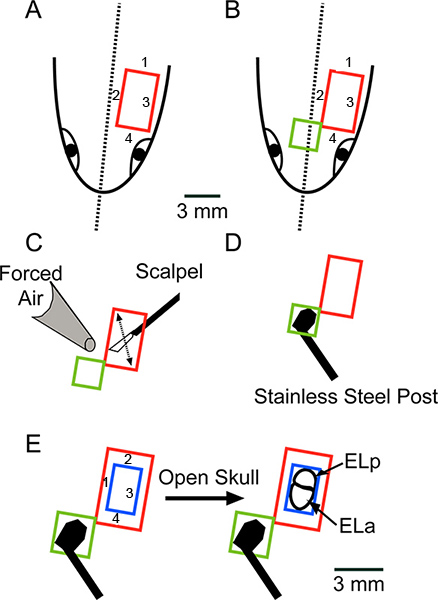
그림 2. 수술의 개략도는 머리의 등쪽 표면에서 아래를 내려다 보면서. (A) 피부의 사각형 조각 (빨강)을 제거하는 순서로 표시된 네 개의 상처를 확인합니다. (B) anteromedially 추가 사각형 조각을 제거하기 위해 개통을 확장 피부 (녹색). (C)에 남아있는 지방이나 인대를 다 쳤어요의화살표로 표시하고 킴 와이프 및 강제 공기와 완전히 표면을 건조로 메스 블레이드를 이동. (D) 접착제는 스테인레스 스틸 게시물은 최고 접착제를 사용하여 두개골에. 의 스케일 바는 AD에 적용됩니다. (E) (각각 ELA 및 ELP), 전방 및 후방 exterolateral 핵 노출, 뼈 (파란색)의 사각형 조각을 제거하는 순서에 표시된 네 개의 커트를 만들기 위해 치과 드릴을 사용하여 . 큰 그림을 보려면 여기를 클릭하십시오 .
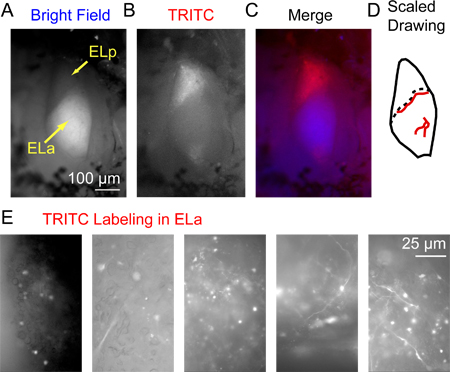
그림 3. 3시간 덱스 트란 - 복합 알렉사 플 루어 568. (A) 전방 및 후방 exterolateral 핵 (ELA 및 ELP, 각각)는 위의 시야 조명과 시각을 주입 한 후 후방 exterolateral 핵에 형광 라벨. 주의ELA에서 광범위한 수초 그것을 ELP 구별 비교적 밝은 모양을 제공합니다. (B) 같은 지역 TRITC 필터를 통해 볼 epifluorescence에를 사용하여 시각화. (C) 병합 된 이미지에 대 한 파란색 사용 (시야)와 B 빨간색 (TRITC). (D)는 높은 배율에 따라 표시 레이블 축삭의 정확한 위치 (혈관의 정확한 위치를 식별하는 랜드 마크로서 사용할 수있는 주요 혈관 (레드 라인) 등의 ELA 및 ELP의 축소 그림의 예 ) 생선 물고기 다릅니다. 점선 ELA와 ELP의 경계를 나타냅니다. (E) 샘플 이미지 ELA에있는 작은 세포 축삭과 somas 성공적으로 라벨 패턴의 범위를 설명하는 5 가지 준비에서 TRITC 필터를 사용하여 인수했다.
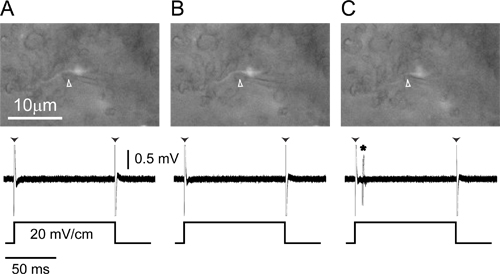
그림 4. 하나의 단위 세포 기록레이블 축삭에서. (A) 긍정적 인 압력을 기록 전극 (화살표 머리) ELA에서 표시된 작은 세포 축삭에 인접 배치하면 (위), monophasic 100 밀리 20 MV / cm 대한 응답으로 만 에지 이슈 (화살표 머리) 기록 반대측 양성, 가로 사각 펄스 (아래). (B) 전극에서 바깥쪽으로 압력 (화살표 머리)를 해제하면 전극 (TOP)으로 약간 이동하는 축삭의 원인이되지만 자극에 더 반응 (아래)는 아직 없습니다. ( C) 약간 부정적인 압력 전극 (위쪽 화살표 머리)와 자극 발병 님의 질문에 활동 전위로 축삭을 끌어 것은 지금 볼 수 있습니다 (아래, 별표). 세 패널의 하단 부분은 자극의 20 반복을 겹쳐 반응이다.
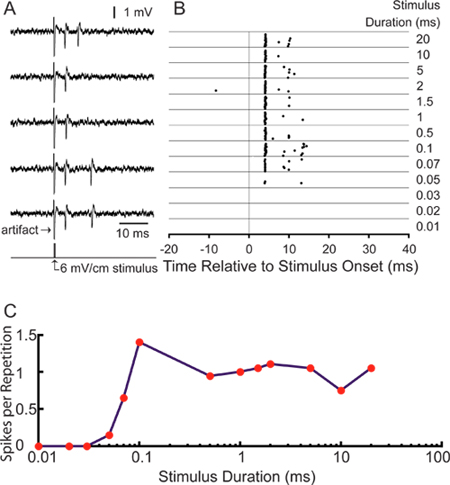
그림 5. 이 기술을 사용하여 대표 결과. (A) 5 샘플 흔적monophasic 0.1 밀리 초 6 MV / cm 의해 유발 활동 전위를 보여주는, 반대측 양성, 가로 광장 펄스 자극. (B) 동일한 유닛 75 밀리 기록 창 20 번 반복하는 동안 스파이크 시간을 보여주는 래스터 플롯은 6 시간이 0에 자극 오른쪽에 표시된 기간의 범위에서 MV / cm 자극. (C) 기간 조정 곡선이 자극 반복 당 스파이크로 래스터에 표시되는 응답을 정량화.
| 질량 (g) | 포크 길이 (cm) | 몸 깊이 (cm) | |
| 평균 | 2.42 | 6.20 | 1.14 |
| 표준 편차 | 0.64 | 0.52 | 0.18 |
| 범위 | 1.2-4.0 | 5.5-8.4 | 0.9-1.6 |
표 1. 최적의무게, 길이와 몸 깊이 범위 물고기. 최적의 무게, 포크 길이 (꼬리 지느러미의 포크 주둥이 팁) 몸과 깊이 (가로 평면에서 최대 dorso - 복부 거리) 물고기에 나와있는 기록 챔버에 맞게 할 수 있도록 범위 그림 1. 너무 작은 물고기 염료 배치 도전하고, 수술을 견딜와 작은 ELP이됩니다 가능성이있을 수 있습니다. 너무 큰 물고기 ELA 및 ELP에 대한 액세스를 절감하고 ELA 및 ELP에 초점을 충분히 가까이 높은 전력, 물 침지 목적의 저하 방지 할 수 있습니다 대형, 오버 광범위한 소뇌해야합니다.
| 응용 프로그램 사이트 | 염료 형 | 물고기 시도 | ELA의 라벨 | ELP의 라벨 | 단위는 시도 | 녹음 |
| EL | 알렉사 플 루어 주입 | 32 | 26 (81.2 %), | 19 (59.4 %), | 50 | 4 (8.0 %) |
| ELA | 알렉사 형석은 여과지를 적신 | 1 | 0 | 0 | 0 | 0 |
| ELA | DMSO의 디-I | 8 | 6 (75.0 %), | 0 | 0 | 0 |
| ELA | 디-O 결정 | 5 | 3 (60.0 %), | 2 (40.0 %) | 9 | 0 |
| 도와 줘요 | 고체 알렉사 형석 결정 | 2 | 0 | 2 (100 %) | 0 | 0 |
| 도와 줘요 | 알렉사 플 루어 코팅 된 텅스텐 철사 | 43 | 29 (67.4 %), | 41 (95.3 %), | 119 | 26 (21.8 %), |
표 2. 각 염료 주입 방법의 성공률. 각 염료 주입 방법 성공률. 방법은 주사 부위 및 염료 유형에 따라 구분됩니다. 각 방법에 대해, 물고기의 총 개수는 시도와 ELA 및 ELP에 성공적으로 레이블에 결과이 실험의 비율이 표시됩니다. 대상 레코딩 영역이 응용 프로그램 사이트 (굵은 상자)의 반대합니다. 주사 부위의 경우, 염료 흡수가 somas과 축삭 모두의 라벨에 성공한 것으로 간주되었다. 대조적으로, 녹음 현장에서 레이블이 축색 돌기 만 준비는 성공적인 라벨 실험으로 간주되었다. 시도 단위의 총 수와 성공적인 기록에서 결과 이러한 단위의 비율도 표시됩니다.
| # 주입시의TES | 주입 당 평균 양 (μL) | 주입 당 볼륨 범위 (μL) | 평균 총 주입량 (μL) | 총 주입량 범위 (μL) | |
| 해밀턴과 Microinjector | 3 또는 4 | 0.144 | 0.091-0.91 | 0.516 | 0.378-0.669 |
| 유리 피펫 Nanoinjector | 2-4 | 0.069 (고정) | 고정 볼륨은 1-6 회 주사 | 0.621 | 0.414-0.966 |
| 유리 피펫 Microinjector | 2-6 | 0.093 | 0.058-0.202 | 0.360 | 0.252-0.540 |
표 3. 염료의 양이 알을 주입하는 데 사용되는 세 가지 방법 각각에 대한 적용ELA (표 2에서 첫 번째 방법)에 알렉사 플 루어를 주입하는 데 사용되는 세 가지 방법 각각에 적용되는 염료의 ELA 수량에 엑사 형석. ELA에 염료를 주입하거나 33 게이지 해밀턴 주사기 바늘이나 뽑아 유리 모세관 피펫을 사용하여 nanoinjector과 microinjector 모두 수행되었다. 우리는 주사 부위, 주사 당 볼륨 및 염료 주입의 총 볼륨의 수를 다양.
토론
일단 마스터,이 기술 한 여러 모델 시스템에서 생체 기록에 대한 개별 축삭 등의 확인 뉴런, 대상 수있게됩니다. 또한,이 기술은 하나의 안정적 도전 생체 녹화 방법에서 전통적인 만드는 독특한 해부학 적 특성을 가진 뉴런의 스파이크 출력을 기록 할 수 있습니다. 우리는 mormyrid 약하게 전기 물고기 ELA "작은 세포"에서 기록하려면이 기술을 활용했다. "작은 세포"의 튜닝 특성을 연구하는 이전 시도는 어려운 촬영 조건 11, 14로 인해 실패했다. 비슷한 해부학 적 특징은 여러 가지 척추 동물의 청각 electrosensory 신경 8-10에서 단일 단위 기록을 얻기 장벽을 만들 수 있습니다. 우리의 시스템에서 이러한 문제를 극복하기 위해, 우리는 "작은 세포가"그 ELA에서 유일한 세포가 있다는 사실을 이용했다 ELP하는 프로젝트입니다. 따라서, ELP에 배치 염료의 역행 전송 "작은에 ELA의 표시를 제한셀 "somas와 축삭. 축삭의 형광 라벨에 액세스 할 somas에도 불구하고 가능한 확인 된 세포에서 단일 단위 녹음을하고, 레이블 축삭 옆에 정확한 전극의 배치를 허용했다. 우리는 주변 침몰 시냅스 11에 의해 아마, 체세포 녹음을 시도했지만 실패했다 17. 그러나 체세포 라벨은 분명히이 기술은 다른 세포 유형과 다른 회로의 체세포 녹음을 대상으로 사용될 수 있다고 제안 볼 수 있었다. 생체 내에서 역행 전송을 통해 신경 세포의 형광 라벨이 생체 19-21 표적으로 녹음을 안내하는 데 사용되었습니다 . 유사한 기술은 제브라 피쉬의 척수 22 모터 뉴런의 생체 녹음에서 대상을 위해 사용되었다. 우리의 작업 표시와 기록이 모두 뇌에서 생체 내에서 수행되는이 방법의 새로운 확장을 나타냅니다. 우리의 방법을 보여주는 생체 내 역행 T로 CNS 영역의 레이블레이서는 유사 선택적 투사 뉴런과 다른 그대로 회로의 연구에 확장 할 수 있습니다. 예를 들어, 포유류의 청각 처리, 하부 둔덕 (IC)는 여러 rhombencephalic 구조 23 입력의 중요한 중계 센터의 역할을합니다. IC에 염료를 주입 선택적으로 이러한 핵에서 각각 투사 세포를 레이블합니다. 우수한 둔덕 (SC)는 비전 24 유사한 기능을 제공합니다. 척수 준비는 특히 척수 쉽게 액세스로, 염료 주입까지 녹화 현장에서 발생할 수 있습니다,이 기술에 적합, 그것은 더 자세한 해부학 적 정보에게 25를 획득하도록 선택 뉴런의 세포 내 기록 및 작성과 결합 할 수 있습니다. 마지막으로, 요로-추적 복잡한 회로에게 26 매핑하는 중추 신경계 전반에 걸쳐 사용 잘 설립 된 기술입니다. 우리의 방법은 w를 수행 한 이러한 연구에 대한 기능 정보를 추가하기 위하여 이용 될 수있다고양이 시각 피질 27 i 번째 칼슘에 민감한 지표.
잘 설립 된 수술은, 안정적이고 정기적으로 생체 녹음 16 장님에 사용되는 최소한의 출혈과 동물과 생존을 위해 조직을 허용하는 두뇌의 표면에 손상없이 완료해야합니다. 연습으로, 수술 및 염료 응용 프로그램 30~45분에 완료 할 수 있습니다. 우리는 성공적으로 준비 67 %의 "작은 셀"축삭 표시. 대부분의 준비는 1 개 또는 2 개 표시 레이블 축삭을 가지고 있지만, 일부는 많은 8로되어 있습니다. 시도 119 표시 단위, 우리는 12 준비 (표 2)에 분산 된 26 대에서 단일 단위 기록을 얻었다. 따라서, 데이터는 28 %의 성공률에 대한 레이블 축삭과 준비의 41 %에서 수집되었다.
염료 응용 프로그램의 중요한 측면은 깊이 라벨입니다. 텅스텐 와이어의 얕은 삽입 세척 아우되는 염료가 발생합니다AY. 침투가 너무 깊은 경우, 레이블 축삭 타겟팅 표시되지 않습니다. 또한, 세포에 약간의 기계적 손상 적절하게 25, 28까지 수행 할 염료 발생해야합니다. 그러나 너무 많은 손상은 세포를 죽일 것입니다. 우리는 ELP에 표시된 축삭 (표 3) 기록과 짝 ELA에 염료를 주입을 통해 선행 성 라벨 등 다른 염료 및 다른 방법 (표 2)로 라벨을 시도했다. 우리는 라벨이 그들에게 응답하고, 신체적 손상과 세포에 국한 되었기 때문에 선행 성 라벨이 성공적으로 완료되지 않은 가설. 또한, 사전 시냅스 터미널이 방해되었을 수 있습니다. 대조적으로, 역행 표지는 이러한 문제를 모두 최소화합니다. 금액과 염료 응용 프로그램의 위치를 연구하는 특정 회로에 따라 변경 될 수 있습니다. 최대 라벨은 우리가 코팅 된 텅스텐 와이어를 사용하여 달성 큰 염료 농도가 발생합니다. 그러나 드와 축삭 레이블을그것은 진보로 경과 예측, 염료 텅스텐 바늘을 올 수 있습니다. 이러한 경우, 압력 주입 더 적합 할 것이다. 염료 흡수 및 수송 2 시간 주입 후 6 시간 후 주사로 늦게 나타나는 레이블이있는 추가 축삭 빠르면으로 표시되는 우리의 준비에 표시된 축삭과 급속한 있습니다. 따라서, 표시 및 기록은 생존 수술과 관련된 기술적 인 문제를 제거, 하루에 수행 할 수 있습니다. 타이밍 염료 전송에 필요한 거리에 따라 각 응용 프로그램에 따라 다를 것입니다.
또 다른 중요한 측면은 전극 배치됩니다. 이 팁의 막힘 방지하기 위해 레이블 축삭의 사이트에 조직 가까이를 입력하는 것이 중요합니다. 같은 ELA에서와 같이 밀도가 조직의 경우, 기록 전극에 긴 얇은 정강이 주변 조직의 과도한 움직임을 최소화합니다. 성공적으로 녹음 기록을 얻을 때까지 신선한 전극 첫 번째 시도, 반복에 달성하거나, 담배 마는되지 않는 경우UE는 축삭이 더 이상 표시되는 시점에 중단됩니다. 그러나 신속하게 표백 광독성을 일으킬 수 형광 노출의 양을 최소화하고 세포 29-31의 생리적 특성에 영향을 미칠 수있는 축삭 옆에 전극을 배치하는 것이 중요하다.
축삭의 세그먼트가 성공적으로 기록 전극에 흡입되면 녹음은 몇 시간 동안 얻을 수 있습니다. 단위는 일관되게 1 시간 미만에 분실되는 경우에, 밖으로 미끄러지는 축삭을 방지하기 위해 작은 전극의 끝 부분을 만드는 것이 좋습니다. 반면에, 팁이 너무 작은 축삭에 막힘 낮은 신호 대 잡음이나 손상을 초래할 수 있습니다. 스파이크 진폭과 추가 흡인 장치의 '리턴'의 꾸준한 감소는 끝이 너무 크다는 표시입니다. 너무 많은 흡입 축삭에 치명적인 손상을 줄 수 있습니다. 하나의 솔루션은 압력이 천천히 제로 반환되도록 공기 라인의 작은 누출을 허용하는 것입니다. 빠르게 일 동점 골전자 압력은 축삭을 추방 될 수있는 일시적인 상대적으로 안쪽에서 바깥쪽으로 '푸시'가 발생합니다.
이 기술은 확인 투사 뉴런에서 대상 레코딩을 얻기위한 중요한 이점을 나타냅니다 있지만 염료를 주입 사이트에있는 모든 세포 유형에 의해 촬영 될 것이라고, 그것은 지역의 interneurons을 구별하는 데 유용하지 않습니다. 이론적으로, 별도의 주사 부위 여러 형광 물질의 사용이 메서드가 확장 할 수 있습니다. 예를 들어, 단일 대 이중 라벨의 비교 회로에 32 개의 지점에서 이중 주사를 따라 투영 뉴런에서의 interneurons을 구별하는 데 사용할 수 있습니다. 마찬가지로, 역행 추적자는 얼룩말 핀치 높은 보컬 센터 (HVC) 32 최근에 수행 된 같은 두 광자 이미징과 같은 다른 고급 이미징 기법과 결합 할 수 있습니다. epifluorescence에 현미경을 사용하는 경우 또한, 녹화 영역은 우리가 단지 & 1를 해결 할 수 있었다로서, 표면 근처로 제한됩니다무, 조직의 처음 30 μm의에서 M 구조. 그러나이 깊이는 이러한 두 광자 현미경 33 또는 목적 결합 평면 조명 현미경 34와 같은 다른 현미경 기술의 사용을 통해 확장 할 수 있습니다. 상대적으로 접근 할 수없는 것을 포함하여 - 그것은 모델 시스템의 다양한 여러 회로에서 하나의 뉴런에서 기록하는 데 사용할 수 있기 때문에 전반적으로,이 기술은 생체 내에서 신경 회로의 연구에 중요한 진보를 나타냅니다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
TK에 G2205 (과학 진흥을 위해 국립 과학 재단 (BAC에 IOS-1050701), 건강의 국립 연구소 (SM에 NS54174과 AML-W에 F30DC0111907.), 우에하라 기념 재단과 일본 사회에 의해 제공하는 자금 조달 ). 우리는 세포 축삭 녹화의 주제에 대한 자신의 지원과지도를 위해 율리우스 믹스 감사합니다. 우리는 프로토 기록 챔버를 제공하기 위해 칼 홉킨스 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
참고문헌
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099 (2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, &. #. 2. 0. 1. ;. M., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유