Method Article
Ретроградная Флуоресцентная маркировка Позволяет Целевые Внеклеточные единичные Запись с Выявленные Нейроны
В этой статье
Резюме
Ретроградного транспорта флуоресцентным красителем маркирует субпопуляции нейронов на основе анатомической проекции. Маркированный аксонов может быть визуально целевые В естественных условиях, Что позволяет внеклеточной записи от установленных аксонов. Эта техника облегчает запись, когда нейроны не могут быть помечены с помощью генной манипуляции или трудно выделить использованием «слепой» В естественных условиях Подходов.
Аннотация
The overall goal of this method is to record single-unit responses from an identified population of neurons. In vivo electrophysiological recordings from individual neurons are critical for understanding how neural circuits function under natural conditions. Traditionally, these recordings have been performed 'blind', meaning the identity of the recorded cell is unknown at the start of the recording. Cellular identity can be subsequently determined via intracellular1, juxtacellular2 or loose-patch3 iontophoresis of dye, but these recordings cannot be pre-targeted to specific neurons in regions with functionally heterogeneous cell types. Fluorescent proteins can be expressed in a cell-type specific manner permitting visually-guided single-cell electrophysiology4-6. However, there are many model systems for which these genetic tools are not available. Even in genetically accessible model systems, the desired promoter may be unknown or genetically homogenous neurons may have varying projection patterns. Similarly, viral vectors have been used to label specific subgroups of projection neurons7, but use of this method is limited by toxicity and lack of trans-synaptic specificity. Thus, additional techniques that offer specific pre-visualization to record from identified single neurons in vivo are needed. Pre-visualization of the target neuron is particularly useful for challenging recording conditions, for which classical single-cell recordings are often prohibitively difficult8-11. The novel technique described in this paper uses retrograde transport of a fluorescent dye applied using tungsten needles to rapidly and selectively label a specific subset of cells within a particular brain region based on their unique axonal projections, thereby providing a visual cue to obtain targeted electrophysiological recordings from identified neurons in an intact circuit within a vertebrate CNS.
The most significant novel advancement of our method is the use of fluorescent labeling to target specific cell types in a non-genetically accessible model system. Weakly electric fish are an excellent model system for studying neural circuits in awake, behaving animals12. We utilized this technique to study sensory processing by "small cells" in the anterior exterolateral nucleus (ELa) of weakly electric mormyrid fish. "Small cells" are hypothesized to be time comparator neurons important for detecting submillisecond differences in the arrival times of presynaptic spikes13. However, anatomical features such as dense myelin, engulfing synapses, and small cell bodies have made it extremely difficult to record from these cells using traditional methods11, 14. Here we demonstrate that our novel method selectively labels these cells in 28% of preparations, allowing for reliable, robust recordings and characterization of responses to electrosensory stimulation.
протокол
1. Подготовка краски покрытием иглы
- Электролитически точить 160 мкм в диаметре вольфрамовой проволоки 15. Final диаметром кончика иглы должна составлять от 5-50 мкм. Количество игл необходимости в зависимости от размеров области клеймо. Мы подготовили 5 игл для 3-5 инъекций в заднюю exterolateral ядра (ELP).
- В ночь перед экспериментом, поместите каплю (<0,25 мкл) 2 мМ декстран-конъюгированные Alexa Fluor красителя 10000 МВт на дистальной 100 мкм каждой иглы.
- Разрешить иглы высохнуть на воздухе при комнатной температуре, в результате чего концентрированного красителя на конце. Хранить иглы при 4 ° С в темном контейнере, чтобы защитить их от света.
2. Подготовка животных для хирургии
- Общей анестезии путем размещения рыбы в раствор 300 мг / л MS-222 в резервуар.
- Взвесьте длина рыбы и мера вилкой (кончика морды до вилки хвостового плавника) и тела глубиной (максимальная спинно-Вентрал расстояние в поперечной плоскости). Эти измерения должны находиться в пределах диапазонов, указанных в таблице 1, так что рыба помещается внутрь регистрирующей камере, достаточно мал, чтобы разместить под водой погружением объектива микроскопа (Рис. 1).
- Зафиксировать и электрически отключить рыбы путем инъекции 100 мкл 3 мг / мл flaxedil в дорсальную мускулатуру тела.
- Заполните записи камеры (рис. 1А) с баком для воды. Поместите рыбу вентральной стороной вниз на платформу в центре камеры (рис. 1). Доставить газированные раствора 100 мг / л MS-222 с помощью пипетки наконечник помещается в рот рыбы (1-2 мл / мин). Стабилизировать рыбу палками зафиксирован в воск размещены на обеих сторонах тела (рис. 1в). Следить за здоровьем рыб, проверяя для непрерывного потока крови в глазных сосудов и нормального цвета тела.
- Поворот платформы вдоль его длинной оси и опускать заднюю часть платфORM так, чтобы одна сторона спинной поверхности головы рыбы подвергается над водой, а остальные тела рыбы остается погруженным. Небольшой кусочек Kimwipe должен быть сделан на любой не погруженной части кожи, чтобы предотвратить высыхание.
3. Хирургия (рис. 2)
Основные хирургические процедуры, описанной здесь хорошо известна и надежно использованы для слепых в естественных условиях в записях mormyrids 16. Для других приложений, подвергать нужный регионов для маркировки и записи. Область, содержащую аксонов в клетках интерес должен быть доступен на покрытых красителем иглы. Область, содержащую более проксимальных сегментах те же аксоны должны иметь достаточное пространство над тканью, чтобы приспособить рабочее расстояние воды погружения линз (2 мм в нашем случае).
- Применяют 0,4% раствор лидокаина с открытой поверхности головки с помощью ватной палочки.
- Используя лезвие скальпеля, вырезать по периметру прямоугольного куска кожи. Снимите прямоугольника с помощью пинцета. Размер прямоугольника будет масштабироваться с размером рыбы, но должно быть около 3 мм х 5 мм для рыбы 6,2 см (рис. 2А). Боковые края прямоугольника должны совпадать с центра глаза, передний край прямоугольника должна быть только позади глаз, и медиального края прямоугольника должна быть только боковая срединной рыбы.
- Развернуть подвергается Череп anteromedially подвергать дополнительным 2,5 мм квадратных непересекающиеся области (рис. 2В).
- Полностью очистить и высушить открытой поверхности черепа помощью скальпеля, чтобы очистить лишнюю ткань и Kimwipes и принудительной циркуляцией воздуха, чтобы высушить поверхность (рис. 2С).
- Клей металлический столб, на переднем подвергается черепа регионе с помощью суперклея. Подождите, пока клей полностью не высохнет (Рис. 2d).
- Удалите прямоугольник черепа, примерно 2 мм х 4 мм для 6,2 см рыбы. Используйте бормашины с ~ 0,5 мм в диаметре шаровой мельнице наконечник из карбида редеть периметру прямоугольника. Затем с помощью скальпеля и пинцета, вырезать по периметру прямоугольника и очистить его, чтобы выставить основной мозг. Дополнительные сверления или резки с небольшой ножницы могут быть необходимы для полного доступа EL (рис. 2Е). Если мышцы кровотечении электрокоагуляции может быть использована установка.
- Срежьте и твердой мозговой оболочки (цвет) и мягкой мозговой оболочки (прозрачная) с помощью пружинных ножниц или иглы и удалить вырезанные части с парой щипцов. Передняя и задняя части exterolateral ядра (EL) теперь видны, английскому языку и ELP, соответственно (рис. 3А).
4. Ретроградной маркировки аксонов интересов
- Расположите манипулятор с покрытыми красителем иглой (сделали в шаге 1) выше целевого область, содержащая аксоны Интерест, в нашем случае ELP.
- Быстро ввести иглу примерно 25 мкм в ткани. Подождите 15-30 секунд, пока все красители не оторвался, а затем втянуть иглу.
- Повторите с дополнительной свежей иглы по мере необходимости, размещая каждый из них в другую папку, чтобы краситель распределяется по всему целевом регионе. Мы использовали 3-5 игл на подготовку.
- Промыть избыток красителя из полости с раствором Рингера Хикман автора.
- Подождите по крайней мере 2 часа для поглощения красителя и транспорта.
5. Визуализация аксонов интересов
- Поместите записи камеры, наряду с рыбой, под цели вертикально фиксированной этап epifluorescent микроскопа. Как тело рыбы закрывает проникновения света, как белый, так и люминесцентные источники света должны прийти сверху. Тщательного размещения волоконно-оптических источников света над полости черепа позволяет удовлетворительные изображения светлого. Для эпифлуоресцентной осмотр, флуоресцентный фильтрспецификации должны совпадать с поглощением / спектра излучения красителя.
- Переключатель дыхания в пресной воде резервуара и поддерживать такой же скорости потока. Наведите грозотроса в открытой полости мозга и подключиться к земле Headstage записи (см. 6.3).
- Поместите пару электродов записи рядом с основания хвоста и подключения к дифференциальному усилителю и записывающего устройства (например, монитора аудио, осциллограф или компьютер) для мониторинга электрического разряда команду органа (EODC). После того, как рыба восстанавливается после анестезии, EODC может быть использована в качестве индикатора состояния рыбы.
- Подготовка масштабного эскиза области мозга, просматриваемые при малом увеличении. Включите крупных кровеносных сосудов в качестве ориентиров (может варьироваться от рыбы к рыбе), чтобы определить точное местонахождение меченых аксонов видно только при большом увеличении (рис. 3D).
- Подтвердите красителя размещения. Вид от первого всей ткани светлого освещение для ориентации ( рис. 3А). Затем просмотрите с люминесцентным освещением (рис. 3В). ELP будете иметь диффузные маркировки (рис. 3В и 3С). Минимизировать возбуждения флуоресценции ограничить фотодинамической и фототоксические эффекты красителя.
- Используйте судах в качестве ориентиров, чтобы найти ELa при большом увеличении. Осветить флуоресцентный свет при поиске меченого аксона вблизи поверхности. (Рис. 4).
6. Запись активности внеклеточных
- Вытяните всасывающий регистрирующих электродов с использованием 1 мм Диаметр, мм 0,58 ID боросиликатного стекла с капиллярной нити. Идеальный размер наконечника будет зависеть от диаметра целевой аксонов, который в нашем случае составляет 0,1-0,2 мкм 17. Для нашего приложения диаметра электрода были 1,5 ± 0,4 мкм (диапазон: 1,0-2,4 мкм) с 5 мм длиной, узкий хвостовик, чтобы приблизиться меченых аксонов без перемещения окружающих тканей плотно упакованы.
- Заполните электронэлектроды с фильтрованной Рингера Хикман автора. Последнее сопротивление наконечника 45,2 ± 38,0 МОм (диапазон: от 16 до 155 МОм).
- Поместите электрод в держатель электрода с давлением порта и подключить его к усилителю Headstage установлены на манипуляторе. Выполнить высокого давления от давления порта Т-образном перекрестке, оканчивающиеся на манометр и шприц для мониторинга и контроля давления, соответственно.
- Соединение Headstage на усилитель и аналого-цифровой синхронизации устройства.
- С 30 мбар внешнее давление в электродной линии, поместите электрод рядом с меченым аксона. Низкий уровень освещенности камера сопряжена с ПО для обработки изображений используется для визуализации пипетки размещения. Начать вблизи поверхности ткани и продвижение электрода к аксона. По мере приближения к аксона, внешнее давление должно вызывать небольшое, но заметное движение аксона.
- В то время как электрод находится рядом с аксона (рис. 4, вверху) записать мощнымIAL на электроде во время представления тестовых воздействий (в нашем случае, мы использовали 100 мс монофазную положительных и отрицательных поперечных импульсов при интенсивности 20 мВ / см; рис. 1А). Потенциалы действия не должна наблюдаться, хотя электрический артефакт подтверждает надлежащее записи / стимуляции (рис. 4, внизу).
- Отпустите внешнее давление в электроде и повторить стимуляцию / записи. Потенциалы действия должны быть по-прежнему не наблюдалось (рис. 4В).
- Нанесите небольшое (125 ± 25 мбар) на входе, к электроду и повторить стимуляцию / записи. Потенциалы действия должны теперь наблюдается в ответ на стимуляцию (рис. 4в). Спонтанная активность могут также произойти. Если потенциалы действия не наблюдается, разблокирование всасывающего, очистите электрод с небольшим давлением, переместите электрод незначительно, а попытка всасывания снова. Как только потенциалы действия видны, закрыть напорную линию.
- Стимулирование и записать в качествелучшего.
7. Прекращение и утилизация
- После того как все необходимые записи полны, переключиться на дыхание с 100 мг / л MS-222 пока EODC не остановится. Нет EODC не должно быть обнаружено по крайней мере 10 минут.
- Утилизировать рыбы в соответствии с ведомственным руководящим принципам и утвержденных протоколов по уходу за животными.
8. Представитель Результаты
Для нашего конкретного применения, мы заинтересованы в изучении стимулом кодирования центральных сенсорных нейронов. Успешное записи из меченых аксонов позволяет производить анализ единичного ответов на сенсорной стимуляции 18. 5А показаны репрезентативные потенциалов действия вызванные поперечной electrosensory стимуляции с использованием биполярных электродов, расположенных на внутренней стороне левой и правой стен записи камеры. Спайк раз может быть представлена в виде графика растровые шип (рис. 5В). 25 мс предварительной записи стимулом ветравл показывает низкий уровень спонтанной активности. Данный Ела "небольшая клетка" длинный-проход настроены на длительности стимула в стимул интенсивностью 6 мВ / см, увеличивая число колосьев на повторения, так как длительности стимула увеличивается (рис. 5в). Среднее первый всплеск задержка 4,28 ± 0,16 мс, в соответствии с ожидаемой задержкой для небольших клетках по английскому языку 11.
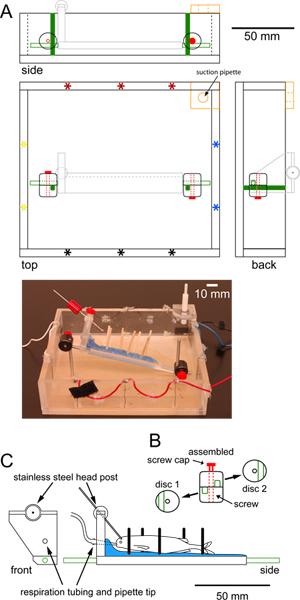
Рисунок 1. Спецификации для записи камеры, которые могут поместиться под цель фиксированной этапе epiflourescent микроскопом. (A) в масштабе квадратных камеры записи, сделанной с плексигласа показывает сверху, сбоку и сзади. Парный набор стимулирующих электродов (звездочки) на периферии позволяют либо поперечным (красно-черный) или продольных (сине-желтый) стимуляции. Дополнительные кусок оргстекла в углу, с резиновым покрытием отверстием в центре (оранжевый),держит всасывающую пипетки, что поддерживает постоянный уровень воды. Две вертикальные нержавеющей стали сообщений ввинчивается в нижней части камеры (зеленым) подключаются к нержавеющей стали сообщений (зеленый контур), прикрепленной к платформе поддерживать рыб (светло-серый, подробно описаны в C) через регулируемые зажимы диска. Фотографии камеры показан ниже в масштабе чертежа. (Б) индивидуальные и собран вид круговой Пластиковые зажимы дисков, используемых для крепления платформы на вертикальных стойках. Каждый диск зажим имеет паз (зеленый) на должность и центральное отверстие для затяжки винта. Диск зажимы повернуты так канавки расположены перпендикулярно друг к другу. Затяжка винтов (красный) зажимы сообщения на место, чтобы предотвратить дальнейшее вертикальное и вращательное движение платформы. (C) Фронтальные и боковые в масштабе вид на плексиглас платформы используются для хранения рыбы на месте. Платформа покрыта слоем парафина (синий), который содержит деревянных DoweLS (черные полосы) для поддержки рыбы. Шланги для вентиляции легких рыба проходит через отверстие в "изголовье" на платформе и заканчивается в пипетки помещают в рот рыбы. Нержавеющая сталь пост головы (серая полоса) подключается к платформе через шаровой шарнир позволяет вращение 360 градусов. Нержавеющая сталь горизонтальных сообщений (зеленый) ввинчивается в любом конце платформы. Нажмите здесь, чтобы увеличить рисунок .
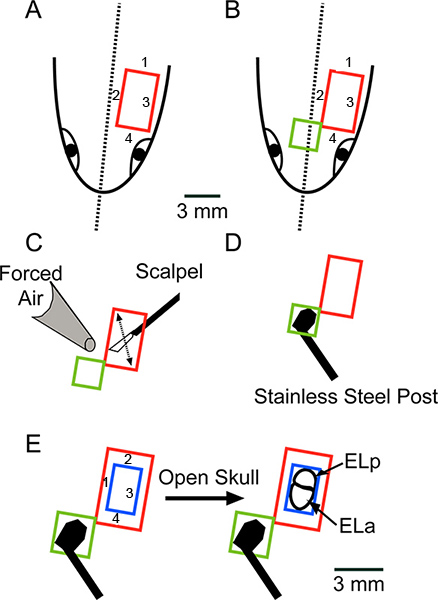
Рисунок 2. Схематический обзор хирургии глядя на спинной поверхности головы. (А) Сделайте четыре порезы, в указанном порядке, снять прямоугольный кусок кожи (красный). (B) продлить часы anteromedially чтобы удалить дополнительную прямоугольный кусок кожи (зеленый). (C) Соскребите оставшиеся жир или связокперемещении лезвие скальпеля, как указано стрелкой, и высушить поверхность полностью с Kimwipes и нагнетаемого воздуха. (D) Клей нержавеющей стальной столб с черепом использованием супер клей. Шкала бар в относится к AD. (Е) использование бормашины сделать четыре порезы, в указанном порядке, снять прямоугольный кусок кости (синий), выставляя передние и задние exterolateral ядер (ELA и ELP, соответственно) . Нажмите здесь, чтобы увеличить рисунок .
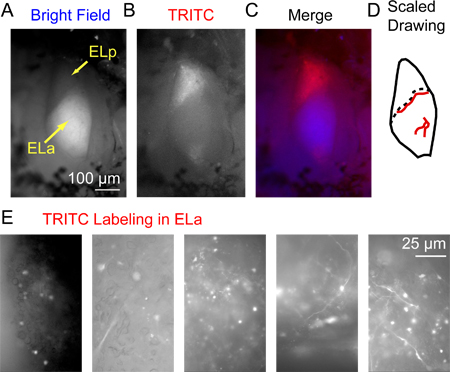
Рисунок 3. Флуоресцентное мечение в заднем exterolateral ядра 3 часа после инъекции декстран-конъюгированные Alexa Fluor 568. (А) передней и задней exterolateral ядер (ELA и ELP, соответственно) визуализировали с ярким освещением поля сверху. Вниманиечто обширная миелинизации в ELa дает ему относительно яркой внешности, что отличает его от ELP. (B) же районе визуализированы использованием эпифлуоресцентной рассматривается через TRITC фильтр. (C) объединенного изображения с помощью синего (светлое) и красный для B (TRITC). (D) Пример масштабного чертежа из ELP английскому языку и в том числе крупных кровеносных сосудов (красные линии), который можно использовать в качестве ориентиров для определения точного местоположения меченых аксонов видно только при большом увеличении (точное расположение кровеносных сосудов варьируется от рыбы к рыбе). Пунктирная линия указывает границу между английскому языку и ELP. (E) Примеры изображений, приобретенный с помощью фильтра TRITC из 5 различных препаратов иллюстрирующих ряд успешных моделей маркировки небольших клеток и аксонов Somas по английскому языку.
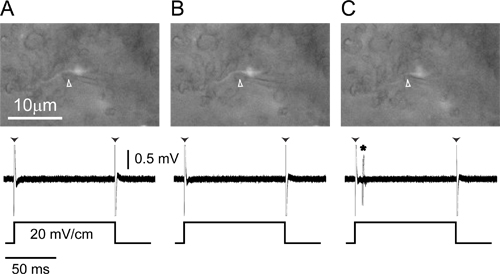
Рисунок 4. Единичные внеклеточной записиот меченого аксона. (A) записи электрод (стрелки) при положительном давлении располагаются рядом с меченым небольшой аксон клетки в ELa (вверху) записывает только край артефакт (стрелки) в ответ на 100 мс 20 мВ / см монофазные, контралатеральные-положительных, поперечный импульс квадратные (внизу). (B) Освобождение внешнее давление от электрода (стрелки) вызывает аксона немного двигаться к электроду (верхняя), но до сих пор нет ответа на стимул (внизу). ( С) небольшое отрицательное давление тянет аксона в электрод (сверху, стрелки) и потенциалов действия в ответ начала стимула теперь видны (на дне, звездочка). Нижняя часть всех трех панелей наложением ответов на 20 повторений стимула.
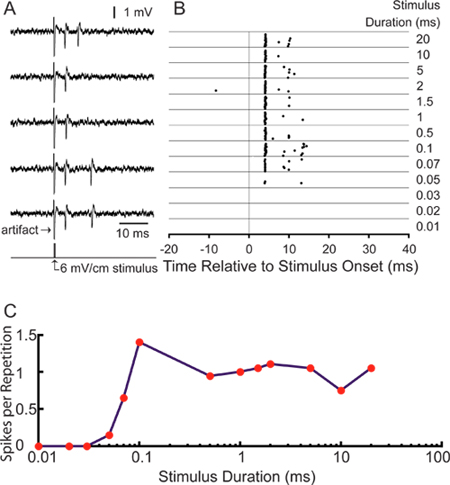
Рисунок 5. Типичные результаты помощью этой техники. (A) 5 следов образецпоказывающие действие потенциалов, вызванных 0,1 мс 6 мВ / см монофазные, контралатеральной-положительных, поперечная квадратных стимул импульса. (B) растровой график, показывающий шип раз в течение 20 повторений окна 75 мс для записи той же единицы стимулировали в момент времени 0 с 6 мВ / см стимулов в диапазоне длительностей перечисленные справа. (с) время, настройка кривой количественной ответов изображена в растровом, как пики на стимул повторения.
| Масса (г) | Длина вил (см) | Тело Глубина (см) | |
| Означать | 2,42 | 6,20 | 1,14 |
| Стандартное отклонение | 0,64 | 0,52 | 0,18 |
| Диапазон | 1.2-4.0 | 5.5-8.4 | 0,9-1,6 |
Таблица 1. Оптимальныйвеса, длины тела и диапазонов глубины для рыб. оптимальный вес, длина вил (кончика морды до вилки хвостового плавника) и тела глубиной (максимальная спинно-вентральной расстояния в поперечной плоскости) Диапазоны позволяет рыбе, чтобы поместиться в записи камеры показано на Рисунок 1. Рыбы, которые слишком малы, может быть меньше шансов выжить хирургии и будет иметь небольшой ELP, что делает краситель размещения сложным. Рыбы, которые являются слишком большими, будет иметь большой, выходящее за всякие пределы мозжечка, которые позволят сократить доступ к английскому языку и ELP и может предотвратить снижение высокой мощности, водные погружения цели достаточно близко, чтобы сосредоточиться на ELa и ELP.
| Применение сайта | Тип красителя | Рыба попыталась | Этикетка по английскому языку | Этикетка в ELP | Единицы пытались | Записи |
| EL | Alexa Fluor инъекций | 32 | 26 (81,2%) | 19 (59,4%) | 50 | 4 (8.0%) |
| ELa | Alexa Fluor пропитанной фильтровальной бумаги | 1 | 0 | 0 | 0 | 0 |
| ELa | Ди-я в ДМСО | 8 | 6 (75,0%) | 0 | 0 | 0 |
| ELa | Ди-О кристаллы | 5 | 3 (60.0%) | 2 (40,0%) | 9 | 0 |
| ELP | Твердые кристаллы Alexa Fluor | 2 | 0 | 2 (100%) | 0 | 0 |
| ELP | Alexa Fluor покрытием вольфрамовой проволоки | 43 | 29 (67,4%) | 41 (95,3%) | 119 | 26 (21,8%) |
Таблица 2. Успех ставки для каждого красителя методом инъекции. Показатели эффективности каждого красителя методом инъекции. Методы делятся основана на месте инъекции и тип красителя. Для каждого метода, общее количество рыбы пытались и процент этих экспериментов, что привело к успешному маркировки в ELa и ELP показано. Отметим, что целевой области записи противоположно узла приложения (полужирный коробки). Для инъекции, поглощение красителя было считать успешным с обозначением обоих Somas и аксонов. В противоположность этому, на записи сайта, только препараты с мечеными аксоны считались успешными экспериментами маркировки. Общее число попыток единиц и процент этих блоков, в результате успешной записи также показаны.
| # Впрыска сиTES | Средний объем одной инъекции (мкл) | Диапазон объемов на инъекцию (мкл) | Средний суммарный объем инъекций (мкл) | Диапазон от общего объема инъекции (мкл) | |
| Микроинъектор с Хэмилтоном | 3 или 4 | 0,144 | 0,091 - 0,91 | 0,516 | 0,378 - 0,669 |
| Nanoinjector со стеклянной пипетки | 2 - 4 | 0,069 (фиксированный) | Фиксированном объеме вводится 1-6 раза | 0,621 | 0,414 - 0,966 |
| Микроинъектор со стеклянной пипетки | 2 - 6 | 0,093 | 0,058 - 0,202 | 0,360 | 0,252 - 0,540 |
Таблица 3. Количества краситель применяется для каждого из трех методов, используемых для введения Alэкза Fluor в количествах ELa красителя применяется для каждого из трех методов, используемых для введения Alexa Fluor в ELa (первый способ из таблицы 2). Краска инъекции в Эла проводились как nanoinjector и микроинъектор используя либо 33 калибровочных Гамильтон шприц иглой или вытащил стеклянный капилляр пипетки. Мы варьировали количество инъекций, объем на инъекцию, а общий объем красителя инъекции.
Обсуждение
Как только освоили, данная методика позволит одному целевому определили нейронов, в том числе отдельных аксонов, в естественных условиях записей во многих системах модели. Кроме того, этот метод позволяет надежно записывать всплеск выхода из нейронов с уникальными анатомическими характеристиками, которые делают традиционные методы в естественных условиях записи сложной задачей. Мы использовали эту технику для записи с Ела "мелкие клетки" в mormyrid слабо электрических рыб. Предыдущие попытки изучения настройка свойств "мелкие клетки" были неудачными из-за сложных условий съемки 11, 14. Похожие анатомические особенности создания препятствий для получения единичного записей из разных позвоночных слуховая и electrosensory 8-10 нейронов. Для решения этих проблем в нашей системе, мы воспользовались тем, что «маленьких камерах" являются единственными клетками по английскому языку, что проект по ELP. Таким образом, ретроградного транспорта краситель помещают в ELP ограничивает маркировки по английскому языку для "малыхячейка "Somas и аксонов. флуоресцентное мечение аксонов позволило точное размещение электродов рядом с меченых аксонов, что делает единичные записи с выделили клетки, возможно, несмотря на недоступный Somas. Мы попытались соматических записи, но не увенчались успехом, вероятно, в связи с окружающими поглощение синапсы 11 17. Однако соматических маркировки была хорошо видна предположить, что этот метод может быть использован для целевой соматических записи в других типах клеток и другие схемы. флуоресцентные маркировки нейронов посредством ретроградного транспорта в естественных условиях была использована для направления целевой записи в пробирке 19-21 . Аналогичный метод был использован для целевых в естественных условиях записи из двигательных нейронов в спинном мозге данио 22. Наша работа представляет собой новый расширение этого подхода, в котором обе маркировки и запись выполняется в естественных условиях в головном мозге. Наш метод показывает, что в естественных условиях маркировка областей ЦНС с ретроградным тГонщик может быть расширена до изучения других нетронутыми цепи с аналогичным селективных нейронов проекции. Например, у млекопитающих слуховой обработки, нижние холмики (IC) служит важным центром реле для входа из нескольких rhombencephalic структур 23. Краска инъекции в IC будет избирательно маркировать проекции клетки от каждого из этих ядер. Верхний бугорок (SC) выполняет ту же функцию для зрения 24. Препаратах спинного мозга, особенно хорошо подходят для этой техники, а спинного мозга можно легко получить, краситель инъекций могут возникать далеко от записи сайта, и он может быть объединен с внутриклеточной регистрации и заполнение выбора нейронов получить более подробную анатомической информации 25. Наконец, тракт трассировки является солидной метод, используемый в центральной нервной системе для отображения сложных схем 26. Наш метод может быть использован, чтобы добавить информацию функциональных этих исследований как это было сделано безго кальций-чувствительных индикаторов в зрительной коре кошки 27.
Хирургия, которая хорошо известна, надежной и регулярно используется для слепых в естественных условиях 16 записей, должна быть завершена с минимальными кровотечения и без ущерба для поверхности мозга, чтобы позволить животным и ткани, чтобы выжить. С практикой хирургии и краситель приложение может быть завершена в течение 30-45 минут. Мы успешно с надписью "маленькой камере" аксоны в 67% препаратов. Большинство препаратов имеют только 1 или 2 видимых меченых аксонов, но у некоторых есть целых 8. Из 119 единиц помечены попытки были получены единичные записи из 26 единиц распределены по 12 препаратов (табл. 2). Таким образом, данные были собраны от 41% препаратов с мечеными аксонов на общий показатель успеха 28%.
Важнейшим аспектом красителя приложение маркировки глубины. Неглубокие вставки вольфрамовой проволоки приведет краситель быть промытый авАу. Однако, если проникновение слишком глубоко, обозначенные аксоны не будут видны для ориентации. Кроме того, некоторые механические повреждения клетки должны произойти для красителя быть адекватным образом приняты 25, 28. Однако, слишком много повреждений убьет клетки. Мы попытались маркировки с другими красителями и другими методами (таблица 2), в том числе антероградной маркировки через краситель инъекции в ELa паре с записью из меченых аксонов в ELP (табл. 3). Мы предполагаем, что антероградной маркировка не была успешной, потому что маркировка была ограничена клетки с повреждением соматических, что делает их не отвечает. Кроме того, в пресинаптических терминалах может быть нарушена. В отличие от ретроградной маркировки минимизирует обе эти проблемы. Количество и расположение краситель приложение может быть изменен в соответствии с конкретной схемой изучается. Максимальный маркировки происходит с наибольшей концентрацией красителя, который мы достигается с помощью покрытием вольфрамовой проволоки. Тем не менее, для маркировки аксоны с де-EP прогнозов, краситель может оторваться вольфрамовую иглу, как это продвинутый. В этих случаях давление впрыска будет более подходящим. Поглощение красителя и транспорт являются быстрые, с мечеными аксонов в нашей подготовке быть видны уже через 2 часа после инъекции и дополнительных меченых аксонов появляться уже в 6 часов после инъекции. Таким образом, маркировка и регистрация может быть осуществлена в течение одного дня, устранение технических трудностей, связанных с выживанием хирургии. Сроки будет варьироваться для каждого приложения в зависимости от расстояния необходимы для красителя транспорта.
Другим важным аспектом является размещение электродов. Важно, чтобы проникать в ткань близко к месту меченого аксона, чтобы предотвратить засорение кончика. Для плотных тканей, таких как по английскому языку, длинные, тонкие голени на записи электрода минимизирует избыточное движение окружающие ткани. При успешной регистрации не достигается с первой попытки, повторите со свежим электроды, пока запись не будет получена или папироUE нарушается в точке, в которой аксона больше не видна. Тем не менее, это также важно быстро поместить электрод рядом с аксона, чтобы минимизировать количество флуоресцентных экспозицию, которое может вызвать фототоксичности, отбеливания и может повлиять на физиологические свойства клетки 29-31.
После того, как сегмент аксона успешно всасывается в записи электрода, записи могут быть получены в течение нескольких часов. Если блоки последовательно потерял менее чем за 1 час, рассмотреть вопрос о внесении меньшего электрода советов для предотвращения аксона от выскальзывания. С другой стороны, слишком малое наконечник может привести к засорению, низкое отношение сигнал-шум или повреждение аксона. Устойчивое снижение всплеска амплитуды и «возвращении» блок с дополнительным всасывающим признак того, что кончик слишком велик. Слишком много всасывания может нанести непоправимый ущерб аксона. Одно из решений, чтобы позволить небольшой утечки в линии подачи воздуха, так что давление постепенно возвращается к нулю. Быстро выравнивания йэлектронной давления приведет к относительной переходных-наружу "толчок", который может изгнать аксона.
Хотя этот метод представляет собой основное преимущество для получения целевых записей из нейронов определены проекция, это не будет полезно для различения местных интернейронов, как краситель будет рассмотрен на всех типах клеток в месте инъекции. Теоретически, использование нескольких флуорофоров с отдельными участками инъекций могут позволить этому методу быть расширена. Например, сравнение одного сравнению с двойной маркировки может использоваться для различения интернейронов из нейронов после двойной инъекции в двух точках в цепи 32. Аналогично, ретроградная трейсеры могут быть объединены с другими передовыми методов визуализации, таких как двухфотонного изображения, как это было сделано недавно в Zebra Finch высокое вокальное центра (ВВК) 32. Кроме того, записи регионах ограничиваются теми вблизи поверхности при использовании эпифлуоресцентной микроскопы, как мы были только в состоянии решить 1 &му; м структур в течение первых 30 мкм ткани. Однако эта глубина может быть расширена за счет использования других методов микроскопии, такие как двухфотонной микроскопии 33 или цель связью плоских микроскопии подсветки 34. В целом, эта методика представляет собой важный прогресс в изучении нейронных цепей в естественных условиях, поскольку он может быть использован для записи из отдельных нейронов во многих различных схем в различных модельных системах - включая те, которые являются относительно недоступным.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Финансовые средства, предоставленные Национальным научным фондом (IOS-1050701 для BAC), Национального института здоровья (NS54174 С.М. и F30DC0111907 ПОД-W.), Уэхара Мемориальный фонд и Японское общество продвижения науки (G2205 до ТК ). Мы благодарим Julian Микс за его поддержку и руководство на тему внеклеточной аксональное записей. Мы благодарим Карл Хопкинса для обеспечения прототип камеры записи.
Материалы
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
Ссылки
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099(2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, ÉM., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены