Method Article
Visualizando interações DNA-proteína em células bacterianas ao vivo usando fotoativado única molécula de Rastreamento
Neste Artigo
Resumo
Microscopia localização fotoativado (PALM), combinada com uma única molécula de rastreamento permite a observação direta e quantificação das interações DNA-proteína em células de Escherichia coli ao vivo.
Resumo
Interações DNA-proteína estão no centro de muitos processos celulares fundamentais. Por exemplo, a replicação do DNA, transcrição, reparação e organização cromossomo são regidos por proteínas de ligação de DNA que reconhecem estruturas ou seqüências específicas de DNA. Experiências in vitro têm ajudado a gerar modelos detalhados para a função de muitos tipos de proteínas de ligação de DNA, ainda , os mecanismos exatos desses processos e sua organização no ambiente complexo da célula viva permanecem muito menos compreendida. Recentemente, introduziu um método para quantificar as atividades de reparo do DNA em células de Escherichia coli ao vivo usando fotoativado Localização Microscopy (PALM), combinada com rastreamento de moléculas individuais. A nossa abordagem geral identifica os eventos de ligação de ADN individuais pela alteração na mobilidade de uma única proteína sobre a associação com o cromossoma. A fração de moléculas ligadas fornece uma medida quantitativa direta para o ato de proteínaivity e abundância de substratos ou sítios de ligação ao nível de uma única célula. Aqui, nós descrevemos o conceito do método e demonstrar a preparação da amostra, a aquisição de dados, e os procedimentos de análise de dados.
Introdução
Este protocolo descreve a medição direta de interações DNA-proteína em células de Escherichia coli vivo. A técnica utiliza a alteração no coeficiente de difusão de uma proteína única marcado por fluorescência, uma vez que se liga o cromossoma (Figura 1). Para demonstrar o método que usa DNA polimerase I (Pol1), uma proteína de ligação de ADN prototípico que preenche as lacunas de ADN em replicação costa de retardamento e de reparação de excisão vias 1.
O advento da microscopia de fluorescência de super-resolução permite a visualização de estruturas moleculares em células com resolução nanométrica. Fotoativado Localização Microscopy (PALM) emprega proteínas fluorescentes que podem ser ativados a partir de um estado escuro inicial para um estado fluorescente (Figura 2). Apenas um subconjunto de todas as moléculas marcadas é activada em qualquer momento para determinar as posições de uma forma sequencial, de forma independente de tele concentração total de moléculas marcadas na amostra 2. A precisão de localização por molécula depende principalmente do tamanho da Função Propagação Ponto fluorescente (PSF), o número de fotões recolhidos, e o sinal de fundo 3. Muitas aplicações deste método se concentrar na melhor visualização das estruturas celulares. A constatação de que PALM pode ser combinado com uma única molécula de rastreamento 4 abriu novas possibilidades para seguir directamente o movimento de números arbitrários de proteínas marcadas em células vivas. Aumento da sensibilidade e resolução temporal de microscópios de fluorescência agora permitem o rastreamento de proteínas fluorescentes único difusão no citoplasma bacteriano 5.
Aqui, nós empregamos PAmCherry, uma proteína fluorescente engenharia que irreversivelmente converte de um estado não fluorescente inicial para um estado fluorescente após irradiação com 405 nm de luz 6. Fluoróforos PAmCherry activados podem ser imagemd por excitação em 561 nm e acompanhados por vários quadros até fotodegradação. Nós demonstrar a capacidade do método para identificar eventos de ligação de ADN transiente de proteínas individuais usando uma fusão de Pol1 e PAmCherry. O tratamento de células com metanossulfonato de metilo (MMS) provoca danos a metilação do DNA, que é transformado em substratos de ADN gapped por enzimas de reparação de excisão-base. Nosso método mostra clara de ligação das moléculas Pol1 individuais em resposta ao dano MMS 7.
Protocolo
1. Cultura de Células
Use tubos de cultura estéreis e pontas de pipeta. A E. coli estirpe AB1157 polA-PAmCherry transporta uma fusão PAmCherry C-terminal de Pol1. A fusão foi inserido na localização cromossómica nativa por substituição do gene do tipo selvagem usando recombinação lambda-vermelho, como descrito em Datsenko et al. 8 funcionalidade da proteína de fusão foi confirmada tal como avaliado pelas taxas de crescimento celular e a sensibilidade para o ADN danificar agente metil metanos (MMS). Mais informação sobre a construção da estirpe de células podem ser encontrados em Uphoff et al. 7, Datsenko et al. 8, e Reyes-Lamothe et al. 9 As culturas de células são cultivadas em meio mínimo M9 para reduzir autofluorescência e evitar partículas de fundo sobre a lâmina de microscópio. Em alternativa, um meio definido rica em nutrientes pode ser usado 10.
- Streak a E. AB115 coli7 polA-PAmCherry de um estoque de glicerol congelado de uma placa de agarose Luria Broth (LB) com antibióticos selectivos (aqui, 25 ug / ml de canamicina) e incubar a 37 ° C durante a noite.
- Inocular uma cultura de 5 ml de LB a partir de uma única colónia de células e crescer a 37 ° C com agitação a 220 rpm durante 3 horas.
- Dilui-se a cultura de 1:10.000 em 5 ml de meio mínimo (meio M9, aminoácidos MEM + prolina, vitaminas MEM, 0,2% de glicerol) e incubar a 37 ° C com agitação a 220 rpm durante a noite.
- Na manhã seguinte, medir a densidade óptica (DO) utilizando um espectrofotómetro e dilui-se a cultura em 5 ml de meio mínimo de fresco a OD de 0,025. Crescer durante 2 horas a 37 ° C com agitação a 220 rpm a fase exponencial precoce (OD 0.1).
- Concentra-se um ml de células num tubo de microcentrífuga de 1,5 ml por centrifugação a 2300 xg durante 5 min. Remover o sobrenadante e ressuspender o sedimento celular em 20 ul de meio residual e vortex.
2. Lâmina de Microscópio Preparatíon
- Prepara-se uma solução de agarose de baixa fluorescência 1,5% em dH2O Usar um forno para fundir a agarose até a solução estar límpida. Misturar 500 mL da solução de agarose fundida com 500 mL de meio mínimo de 2x por suavemente pipetando para cima e para baixo algumas vezes.
- Espalhar a solução de agarose de forma uniforme sobre o centro de uma lamela de microscópio, (n de 1,5 de espessura). Isso tem de ser feito rapidamente antes da agarose esfria, evitando bolhas.
- Alise a almofada com uma segunda lamela (Sem 1,5 espessura). Para remover o fundo partículas fluorescentes, lamelas foram previamente calcinado num forno a 500 ° C durante 1 hora. Lamelas queimados pode ser armazenada durante semanas à temperatura ambiente, coberto de folha de alumínio.
- Para os experimentos de danos ao DNA, preparar uma almofada de agarose contendo MMS 100 mM. Seguir o procedimento em passos 2,1-2,3, mas adicionar 8,3 MMS ul a 500 ul de meio M9, antes da mistura com 500 ul de 1,5% de agarose fundida, para uma concentração final de 100 mM de MMS. (Atenção! MMS é tóxico e mutagênico e devem ser manuseados com luvas, máscara, óculos e jaleco).
- Retire o slide superior do bloco e adicionar 1 ml de suspensão de células concentradas sobre o bloco. Imobilizar as células, cobrindo o teclado com uma lamela não utilizado queimada (Sem 1,5 de espessura, combinando a especificação objetiva do microscópio) e pressionando muito suavemente no slide. As células devem ser trabalhada dentro de 45 min de imobilização antes da seca almofada de agarose. Para evitar o ressecamento durante as experiências mais longas, almofadas de agarose podem ser vedados com juntas de silicone.
- Para as experiências de ADN de danos, incubar células imobilizadas sobre a almofada de agarose contendo MMS 100 mM durante 20 min num recipiente humidificada à temperatura ambiente antes de imagem.
3. Preparando Microscopia de Aquisição de Dados
PALM se baseia na detecção e localização precisa de proteínas fluorescentes individuais. A sensibilidade e alinhamento óptimoo microscópio é crítico para a qualidade dos dados. Microscópios de fluorescência única molécula normalmente empregam reflexão interna total (TIR) de iluminação para melhorar a relação sinal-ruído de apenas fluorophores emocionantes dentro de uma seção fina acima da superfície da lamela. Aqui, a imagem latente dentro E. coli requer altamente iluminação inclinada 11, o que pode ser conseguido através de um microscópio TIRF por diminuir ligeiramente no ângulo da luz de excitação. Imagiologia PAmCherry requer ainda um laser fotoactivação 405 nm e um laser de excitação 561 nm. A emissão de fluorescência é gravado em um elétron multiplicando CCD (EMCCD) câmera com uma ampliação resultando em um comprimento de pixel de 114,5 nm / pixel. Para precisão a localização ideal, o tamanho do pixel deve cerca de acordo com a largura desvio padrão do PSF para garantir a amostragem suficiente sem espalhar o sinal em muitos pixels. Figura 3 mostra um diagrama esquemático de uma configuração mínima PALM. Vídeo 1dá uma impressão de que o processo de construção do microscópio sob medida; ver Uphoff et al 7 para uma descrição detalhada do instrumento..
- Realizando o alinhamento microscópio de rotina. Meça a 405 nm e 561 nm de onda contínua intensidades de laser na frente da objetiva. Ajustar a intensidade 561 nm a 3,5 mW (~ 400 W / cm 2) e 405 nm, a intensidade de 10 μW (~ 1 W / cm 2). Use uma roda de filtros continuamente variável densidade neutra que permite o ajuste gradual de intensidade 405 nm 0-10 μW. Desligue a iluminação a laser até o início do experimento.
- Colocar a amostra na platina do microscópio e trazer as células para o foco no modo de transmissão de microscopia de luz (Figura 4A). O ganho da câmera EMCCD tem que ser desligado para evitar danos à câmara por superexposição.
- Definir um FOV cortada para reduzir o tamanho dos dados e aumentar a velocidade de câmera de leitura.
- Cubra a amostra da luz ambiente e switch sobre o ganho da câmera EMCCD.
- Defina a taxa de quadros para 15,26 ms / frame (incluindo 0,26 ms câmera tempo de leitura). Consulte "tempo de exposição e excitação intensidades" na seção Discussão.
- Exiba os dados da câmera para verificar o sinal de fundo escuro (Figura 4B).
- Ligue o laser 561 nm e verificar o sinal de fundo de excitação (Figura 4C).
- Ligue o laser de 405 nm para a fotoactivação das proteínas de fusão Pol1-PAmCherry e aumentar a intensidade de fluorescência até PSFs aparecer.
- Ajuste o ângulo do feixe de excitação para iluminar apenas uma seção fina da amostra perto da superfície da lamela.
- Para este fim, o feixe de laser é focado no plano focal posterior de uma objectiva 100X NA 1.4 (Figura 3). Traduzindo a lente de focagem perpendicular ao feixe move o foco afastado do centro do objectivo fazendo com que o feixe de sair do objectivo sob um ângulo.
- Aim para maximizar a intensidade da fluorescência e minimizar o sinal de fundo. Note-se que estrita excitação TIR é o ideal para fluoróforos imagem dentro de 100 nm da superfície da lamela, no entanto, as proteínas de ligação a DNA de imagem associada ao E. coli nucleoid requer iluminação mais profunda até 0,8 mM.
4. Aquisição de Dados
Aqui, descrevemos o protocolo geral para a aquisição de um filme de PALM. O mesmo procedimento aplica-se para a imagem proteínas de fusão Pol1-PAmCherry em intacta E. coli células e sob tratamento contínuo danos ao DNA com MMS. A aplicação do método de proteínas de fusão de diferentes peso ou cópia número molecular por célula vai exigir configurações diferentes de aquisição (ver secção Discussão).
- Encontrar um novo campo de visão (FOV) de células no modo de microscopia de luz transmitida e focar a imagem. Tirar um instantâneo da câmera para gravar a contornos de células (Figura 4A).
- Cubra a amostra da luz ambiente e ligue o ganho da câmera EMCCD.
- Ligue o laser 561 nm e branquear a autofluorescência celular e pontos de fundo sobre a lamela por alguns segundos antes de iniciar a aquisição de dados. Para as células cultivadas e fotografada em meio M9 e utilizando lamelas queimado geralmente há muito pouco a fluorescência de fundo, no entanto, prebleaching poderia ser útil para imagens de células em um meio de cultura rico como LB. Note-se que a iluminação intensa é tóxico para as células, de modo prebleaching deve ser mantido a um mínimo.
- Comece a aquisição de um filme de PALM sob contínua de excitação 561 nm em 15,26 ms / frame.
- Ligar o laser de 405 nm e, gradualmente, aumentar a intensidade ao longo do filme, atingindo até 1 W / cm 2. Evite altas intensidades 405 nm que causam autofluorescência celular. Preste atenção para a densidade de moléculas fluorescentes - é importante para manter as taxas de ativação baixo de tal forma que PSFs são claramenteisolado em cada quadro (Figuras 4D-F).
- Grave 10.000 quadros / filme (dependendo do número de moléculas a ser trabalhada por célula), uma tira de filme tipicamente 2-3 min e requer 0,5-1 GB de espaço em disco, dependendo do tamanho do campo de visão.
- Repita o procedimento para aquisição múltipla FOV. Note que cada FOV só pode ser trabalhada uma vez porque fluorophores PAmCherry obter fotoativados e branqueada de forma irreversível.
5. Análise de Dados
Uma estrutura automatizada e robusta análise de dados é essencial para o desempenho ea eficiência do método. Nós usamos software personalizado escrito em MATLAB.
- Realize a análise de localização usando algoritmos descritos em 12 Crocker et al., Holden et al. 13, HoldenI et al. 14, e Wieser et al. 15 PSFs são primeiro identificados em uma imagem filtrada passa-banda usando um kernel gaussiano com 7 pixelss de diâmetro (Figura 5A). Candidatos posições correspondem a PSFs com intensidades de pico do pixel acima de 4,5 vezes o desvio padrão do sinal de fundo (Figura 5B). O pixel localmente mais brilhante por candidato PSF serve como estimativa inicial para a montagem de uma função de Gauss elíptica (Figura 5C). Os parâmetros de ajuste livres são: posições x, y-posição, de largura x, y de largura, o ângulo de rotação, a amplitude, e deslocamento de fundo. A máscara Gaussian elíptica representa molécula durante o tempo de exposição, que borra e deforma o PSF.
- Traçar as resultantes (x, y) localizações de todos os quadros do filme PALM para a imagem de microscopia de luz transmitida da mesma FOV. Localizações de Pol1-PAmCherry deve aparecer dentro da área central do E. células de E. coli (Figura 6A). Se muitas localizações aparecer fora das células, o limiar de localização estava muito baixa ou a amostra continha fundo partículas fluorescentes.
- Para a análise de rastreamento automatizado, a implementação do algoritmo MATLAB descrito no Crocker et al. 12 pode ser utilizado (ver "Análise de difusão" na seção Discussão). Posições que aparecem nos quadros subseqüentes dentro de uma janela de rastreamento definido pelo usuário são ligados para formar uma trajetória. No caso em que várias localizações de ocorrer na mesma janela, as faixas são atribuídos exclusivamente, minimizando a soma dos comprimentos do passo. Para uma discussão detalhada das várias considerações ao cálculo dos coeficientes de difusão de dados de rastreamento de partícula única, ver 15 Wieser et al.
- O algoritmo usa um parâmetro de memória para explicar piscar transitória ou localizações perdidas durante uma trilha. Aqui, vamos definir o parâmetro de memória para uma estrutura; valores mais altos podem ser usados para rastrear fluoróforos com estados escuros de longa duração.
- Escolha de uma janela de acompanhamento apropriado com base nos seguintes passos de calibração. Para Pol1, usamos 0,57 mM (5 pixels).
- Execute o algoritmo de rastreamento para uma série de parâmetros de controle da janela. Calcular o número de faixas medidos por célula como uma função de janela de rastreamento para identificar a janela de rastreamento menor possível que não dividido pistas (Figura 6B).
- Traçar as faixas resultantes da imagem de microscopia de luz transmitida da mesma FOV sobre a visualização da distribuição espacial do movimento molécula nas células. Faixas Pol1 deve exibir difusão confinado dentro das células individuais (Figuras 6C-D).
- Se uma fracção de faixas parece cruzar entre células isto sugere que as moléculas separadas foram erroneamente ligados porque a janela de acompanhamento foi escolhido demasiado grande e / ou a taxa de fotoactivação era demasiado elevada (Figura 6E).
- Traçar a distribuição cumulativa de comprimento do passo entre localizações consecutivas (Figura 6F). A curva sobe e satura bem para suficientemente grandes janelas de rastreamentomas mostra uma aresta de corte se a janela foi escolhido demasiado pequeno.
- Analisar as características de difusão de Pol1, calcule o deslocamento quadrado-médio (MSD) entre localizações consecutivas para cada faixa com um total de N passos):
DPM = 1 / (N-1) Σ i = 1 N-1 (X i +1 - x i) 2 + (y i +1 - y i) 2.
Inclua apenas as faixas com pelo menos 4 etapas (N ≥ 5 localizações) para reduzir a incerteza estatística nos valores de MSD. - Traçar uma curva de valores de MSD em um intervalo de tempos de atraso, calculando os deslocamentos ao longo de vários quadros (Figura 6G). A forma da curva de DMS podem ajudar a classificar o movimento molecular observado (Figura 6H).
- Calcule o coeficiente de difusão aparente D * por faixa do MSD:
D * = MSD / (4 Dt) - σ loc 2 / Dt.
O segundo term corrige o erro de localização estimado (aqui, σ loc = 40 nm e Dt = 15,26 ms, ver 15 Wieser et al.). - Trace um histograma dos valores medidos D * de todas as faixas da FOV (Figura 7a).
- Identificar as moléculas Pol1 individuais que aparecem ligados ao cromossomo baseado no D * valor medido por faixa. Separe as populações de limite (distribuição acentuada centrado em D * ~ 0 mM 2 / seg) e moléculas difundem livremente (distribuição ampla centrado em D * ~ 0,9 mM 2 / s), definindo um limite D * <0,15 mM 2 / seg ( as barras vermelhas nas Figuras 7A e 7D).
- Efectuar a localização, rastreamento e análise de difusão para Pol1 em células intactas (Figuras 7A-C) e em células em tratamento DNA-dano com MMS (Figuras 7D-E). A fração de faixas encadernados fornece uma medida quantitativa direta do DNA atividade de reparo de Pol1 in vivo.
Resultados
O conceito de fotoactivado tracking para estudar as interacções proteína-ADN in vivo, uma única molécula é ilustrada na Figura 1. As proteínas de fusão PAmCherry são detectados em vivo E. células de E. coli, de forma sequencial por photoactivating moléculas individuais estocasticamente com 405 nm de luz em uma freqüência de menos de uma molécula por célula de cada vez. Moléculas ativadas são gravadas em contínuo 561 nm de excitação. Movimento Molecular na célula pode ser rastreado através da ligação localizações próximas de uma série de quadros até fotodegradação irreversível. Porque a difusão de proteínas de ligação a DNA é retardado sobre a ligação do cromossomo, o coeficiente de difusão aparente D * obtido por faixa reporta diretamente nas interações proteína-ADN individuais.
A Figura 2 demonstra fotoativação de proteínas de fusão Pol1-PAmCherry Live E. células de E. coli. A influência da intensidade de 405 nm, on a densidade de moléculas fluorescentes pode ser visto na Figura 4. Note-se que a densidade não é exclusivamente determinada pela intensidade de 405 nm, mas, adicionalmente, por o número de moléculas que estão disponíveis para activação, o conjunto de moléculas restantes está esgotada, ao longo de um filme PALM.
Análise de localização é realizada para cada quadro de um filme de palma, como ilustrado na Figura 5. Nós medimos a precisão de localização usando moléculas de imóveis em células fixas ou moléculas ligadas em células vivas. Nossos configurações de aquisição deu uma precisão de localização de σ loc = 40 nm, de acordo com a previsão teórica 3.
As localizações Pol1 resultantes ocupam a zona central da célula (Figura 6A), amplamente recapitulando a organização espacial da E. coli Nucleoid 7. A maioria das faixas Pol1 em células intactas exibir diffusão, como mostrado na Figura 6C. Uma célula típica contém várias centenas de faixas Pol1 (Figura 6D), de acordo com o número de cópias de aproximadamente 400 moléculas Pol1 por E. . coli célula 1 Figuras 6B e 6E-F fornecer orientações sobre a escolha de um parâmetro janela de rastreamento adequado - se a janela de monitoramento é muito grande, moléculas diferentes são mais propensos a tornar-se erroneamente ligado a uma pista, se a janela de monitoramento é muito pequeno, faixas com passos maiores serão divididas. A curva de MSD para Pol1 aumenta linearmente para curtos tempos de atraso e satura em tempos de atraso mais devido ao confinamento celular (Figura 6G). Diferentes tipos de movimento molecular pode ser identificado por análise de MSD. Dirigido movimento dá uma curva parabólica; movimento browniano é caracterizada por uma linha reta, a curva de difusão confinado atinge um platô, um deslocamento da curva de MSD para partículas imóveis representa o localization incerteza (Figura 6H). Informações adicionais sobre o de partícula única de monitoramento e solução de problemas dicas podem ser encontradas em Arnauld et al. 16
Nós já aplicou o método para medir a atividade de reparo do DNA de Pol1 em resposta a exógena danos alquilação DNA 7. O D * histograma de Pol1 faixas em células intactas mostra uma população predominante de difusão de moléculas (Figuras 7A-C). Uma pequena fração de 2,7% moléculas Pol1 encadernados é provável envolvida na replicação da cadeia atrasada e reparação de danos no DNA endógeno. Sob contínua 100 de dano MMS mM, a população de faixas com D * ~ 0 ^ M 2 / seg aumenta para 13,8% (Figura 7D). Estas faixas representam moléculas Pol1 pessoas individuais que executam síntese de reparação do ADN para preencher as lacunas de nucleotídeo único como parte da via de reparo base-excisão. Os cargos de faixas encadernados mostrar as localizações de indivíduoDanos no DNA e sítios de reparação (Figura 7E-F).
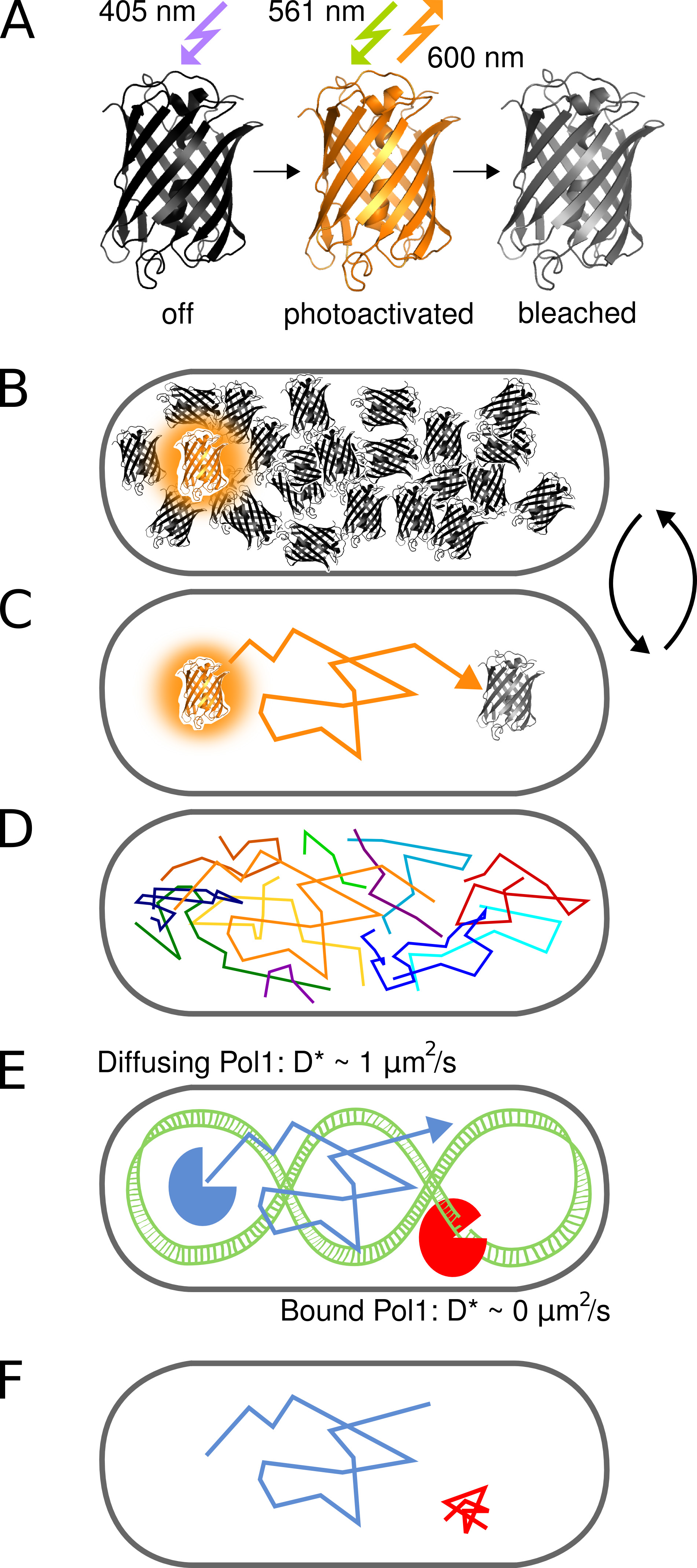
Figura 1. Representação gráfica do método. (A) O PAmCherry proteína fluorescente pode ser fotoativado de um estado inicial não fluorescente após irradiação com luz 405 nm. O estado brilhante está animado em 561 nm e emite fluorescência em torno de 600 nm até que os alvejantes fluoróforo de forma irreversível. (B) O controle da taxa de fotoativação permite imagens apenas um único estocasticamente ativado proteína de fusão PAmCherry por célula a qualquer momento enquanto o arbitrariamente grande conjunto de moléculas que ainda não foram ativados ou já foram clareados restos em um estado escuro. (C) A posição da molécula fluorescente é determinada a partir do centro do PSF isolado e tracked para vários quadros até fotodegradação. (D) Faixas de muitas moléculas são gravados de forma seqüencial. (EF) A interacção de uma proteína de ligação a DNA com uma sequência alvo cromossómico ou estrutura pára o movimento difusivo aleatória. Moléculas de associados e não associados são distinguidos pelo coeficiente de difusão aparente D * extraído de single tracks. A fração resultante de moléculas ligadas dá uma medida quantitativa para a atividade de uma proteína de ligação de DNA in vivo. Clique aqui para ver imagem ampliada.
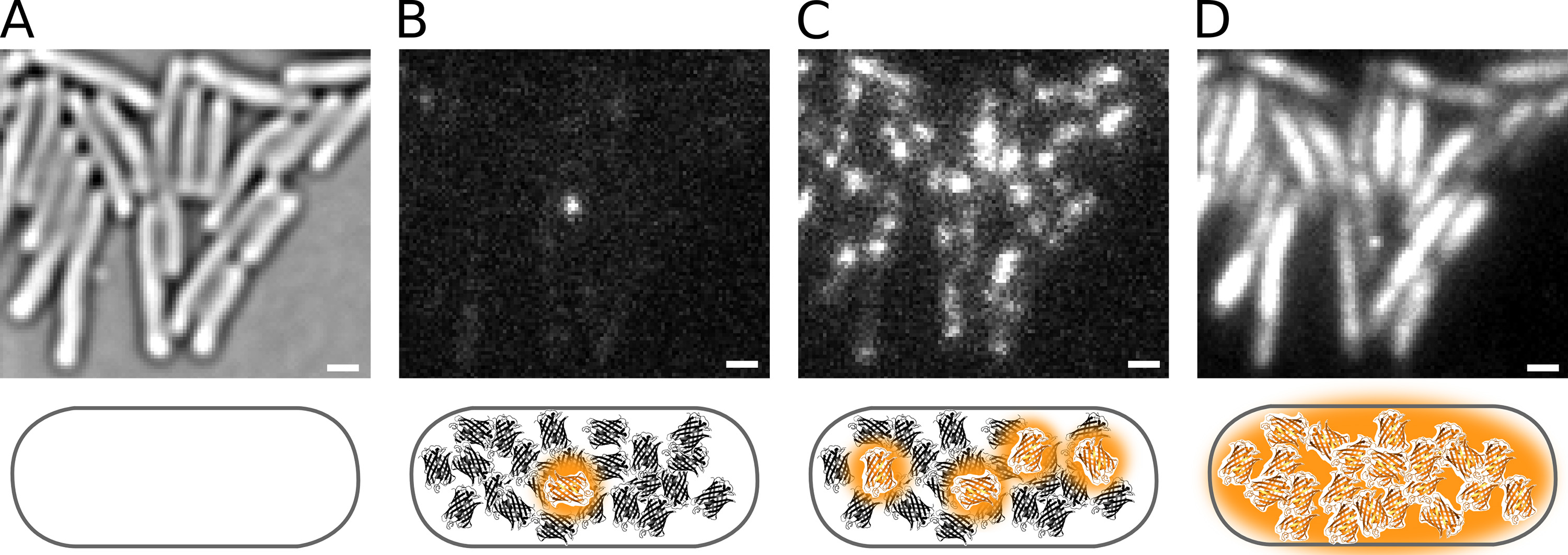
Figura 2. Fotoativação de Pol1-PAmCherry Live E. células de E. coli. Barras de escala: 1 m. Esquema são mostrados por baixo de cada painel. ( A) imagem de microscopia de luz de células imobilizadas em uma almofada de agarose Transmissíveis. (B) Phototactivating um único fluoróforo PAmCherry em uma célula. (C) A taxa de fotoactivação maior aumenta o número de moléculas fluorescentes. (D) integrado PAmCherry fluorescência de um filme de PALM. Clique aqui para ver imagem ampliada.
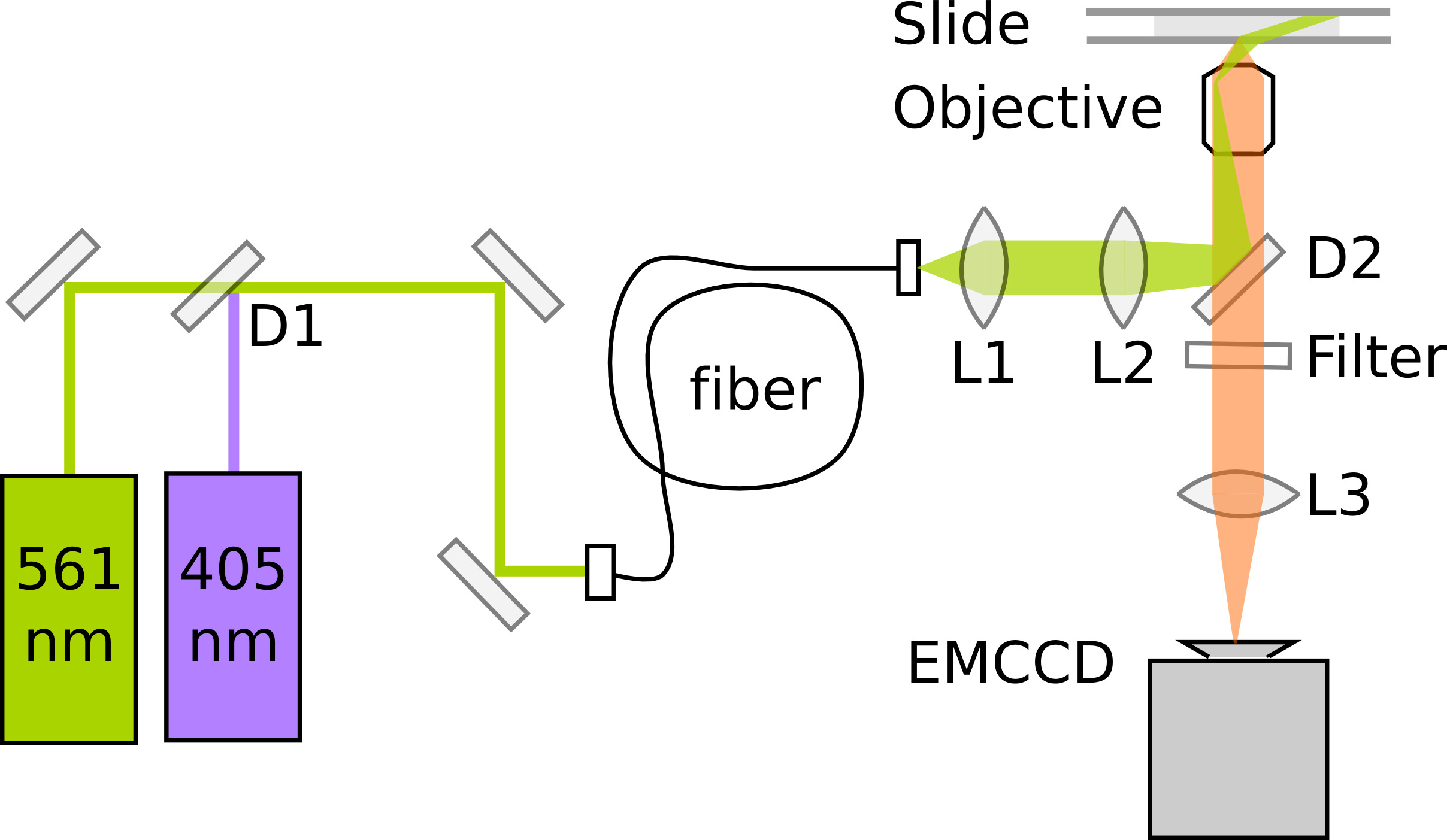
Figura 3. Esquema de uma configuração mínima para PALM proteínas photoactivating e fusão PAmCherry imagem D1:. Dichroic espelho (por exemplo, 550-pass longo nm). D2: dicróica espelho (por exemplo, 570-pass longo nm). L1: lente de colimação. L2: lente TIR. L3: Lente Tube.1177/51177fig3highres.jpg "target =" _blank "> Clique aqui para ver imagem ampliada.

Figura 4. Imagens representativas de um filme PALM com 15,26 ms / frame Barras de escala:. 1 mícron. (A) Transmitida imagem luz de células imobilizadas em uma almofada de agarose. (B) Imagem escura de fundo medida na câmara EMCCD com os lasers desligado. (C) Excitação imagem de fundo sob contínua de excitação 561 nm antes de fotoativação. (DF) Aumento da intensidade 405 nm leva a taxas mais elevadas de fotoativação PAmCherry, fotografada sob contínua 561 nm de excitação. As eas dentro de caixas são mostrados abaixo ampliada. (D) 405 Baixa intensidade nm (<1 μW) ativos muito poucas moléculas fluorescentes por FOV. (E) 405 Médioresultados intensidade nm (~ 2 μW) fotoativação em uma boa densidade de PSF para localização e análise de rastreamento. (F) Maior intensidade nm 405 (~ 10 μW) ativa mais de uma molécula fluorescente em algumas células, o que obscurece a localização e análise de rastreamento. Clique aqui para ver imagem ampliada.

Figura 5. Ilustração da análise de localização. Barras de escala: 1 mícron (A) filtragem passa-banda remove o ruído de pixel espúria e nivela gradientes de intensidade em todo o FOV.. (B) PSFs candidatos são identificados na imagem filtrada com base em um limite definido pelo usuário que é escolhido para minimizar falsas detecções positivos e falsos negativos. O threshold corresponde ao mínimo de intensidade de pixel candidato dividido pelo desvio padrão do fundo (relação sinal-ruído, SNR). (C) O pixel localmente mais brilhante que passa o limiar serve como estimativa de localização inicial (cruz de laranja) para um ajuste de Gauss elíptica bidimensional. Barras de escala: 0,5 mM. A localização super-resolução resultante (cruz azul) tem uma precisão média de σ loc = 40 nm. Clique aqui para ver imagem ampliada.
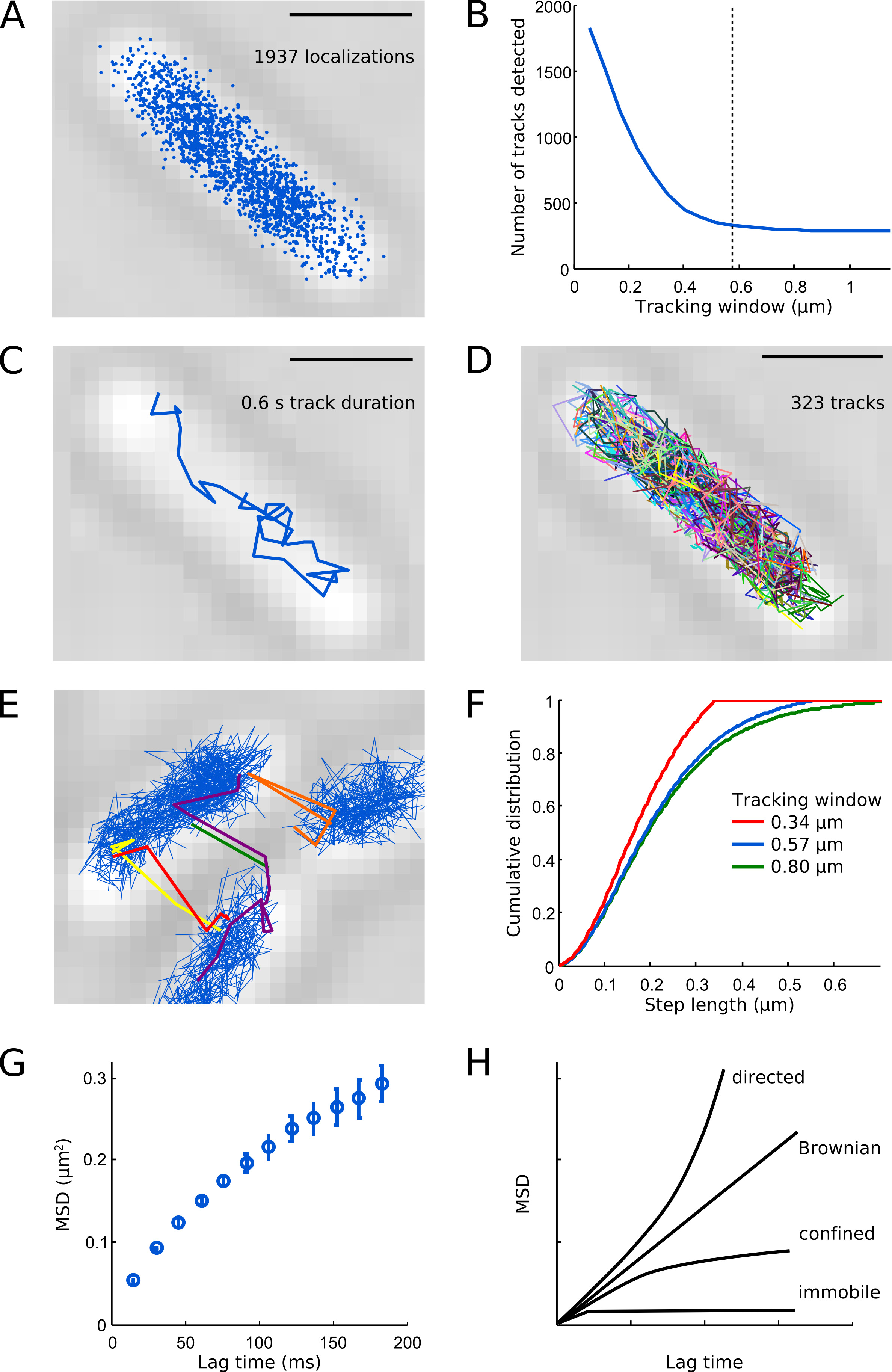
.. Figura 6 Ilustração da análise de rastreamento Barras de escala: 1 m. (A) Todas as localizações detectadas de Pol1-PAmCherry em uma célula exemplo. (B) Número de faixas detectared na célula de exemplo, como uma função de janela de rastreamento. Pequenas janelas de rastreamento dividir trajetórias molécula, o que leva a artifactual elevado número de faixas. A linha pontilhada indica a nossa escolha para o parâmetro janela de rastreamento (0,57 mM, 5 pixels) - o que dá um bom compromisso entre a detecção da distribuição completa de passos e mantendo as trajetórias de diferentes moléculas intactas. (C) o controle Exemplo de uma única molécula Pol1-PAmCherry. (D) Todas as faixas de medição mostrados em cores aleatórias. (E) artefactos Acompanhando se a janela de monitoração é escolhido demasiado grande (aqui 0,8 mM, 7 pixels) ou a densidade de PSF por quadro é demasiado elevada. (F) as distribuições cumulativas dos comprimentos do passo para as janelas de monitoramento: 0,34 mM (3 pixels, linha vermelha), 0,57 mM (5 pixels, linha azul) e 0,80 mM (7 pixels, linha verde). Note que a janela de monitoramento 0,34 mM corta etapas mais longas do que 0,34 mM que claramentetrunca a distribuição completa de passos. A janela de rastreamento 0,57 mM detecta quase a mesma distribuição de passos tal como a janela de rastreamento de 0,80 mM. Curva (G) MSD mostra difusão confinada de Pol1. Curvas (H) Esquema MSD para o movimento dirigido, o movimento Browniano, difusão confinado, e as partículas de imóvel. Clique aqui para ver imagem ampliada.
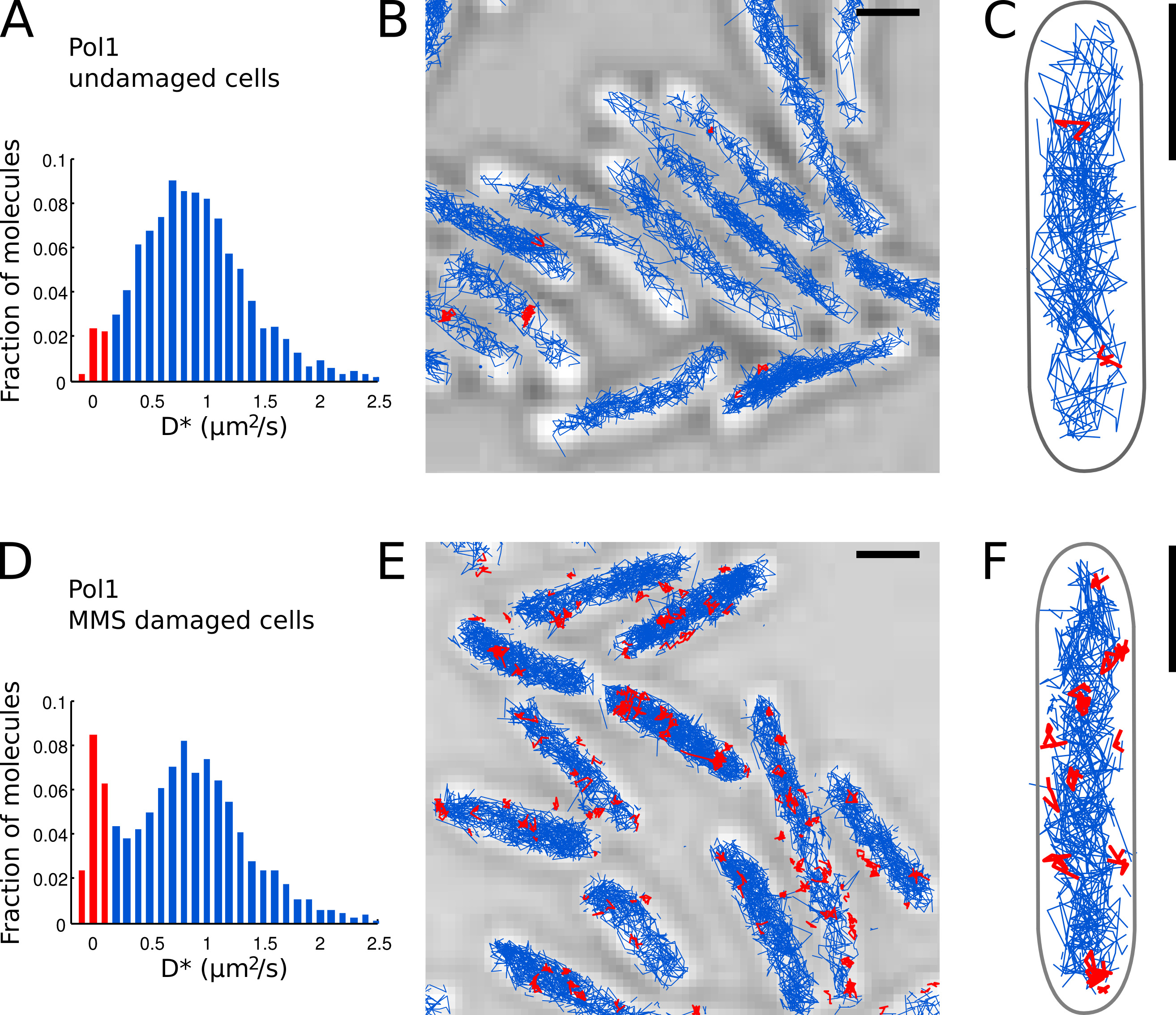
Figura 7. A medida direta da atividade de reparo de DNA de Pol1 Live E. coli. células Barras de escala: 1 m. (A) Histograma da aparente coeficiente de difusão D * para todas as faixas de 4 ou mais etapas de um FOV de células intactas (N = 4.162 faixas). A população de moléculas classificadas como b ound é destacado em vermelho. (BC) Faixas de Pol1-PAmCherry são mostrados uma imagem de microscopia de luz transmitida por diante. Faixas classificados como obrigado de acordo com seu coeficiente de difusão são mostrados em vermelho. (D) D * histograma para faixas Pol1 medidos em células imobilizadas em uma almofada de agarose com MMS 100 mM e incubados por 20 min antes de imagem (N = 2.128 faixas). A população de moléculas ligadas envolvidas no reparo do DNA é mostrada em vermelho. (EF) Pol1-PAmCherry imagem Trilhas microscopia de luz transmitida mostrando as faixas de eventos isolados Pol1 de reparo de DNA em vermelho. Clique aqui para ver imagem ampliada.

Filme 1. A construção de uma instalação PALM sob medida."Target =" _blank JoVE_Uphoff_Movie1.avi "> Clique aqui para ver o vídeo.
Discussão
Discutimos várias considerações-chave para o sucesso do experimento.
Selecção e expressão da proteína de fusão fluorescentes: Há uma grande paleta de proteínas fluorescentes fotoactiváveis e foto induzida 17. A escolha específica depende das características de microscópio, em particular os lasers e os filtros disponíveis. A combinação de 405 nm e 561 nm é ideal para proteínas fluorescentes fotoactiváveis comuns. Escolhemos PAmCherry 6 porque é monomérica e não mostrou nenhuma agregação de células. Além disso, permite a fotoactivação irreversível da contagem do número de fluoróforos activados para medir os números de cópias de proteína por célula. Em vez de expressar a proteína de fusão a partir de um plasmídeo, prefere-se a inserção cromossómica do gene que codifica para a proteína de fusão no local de tipo selvagem. Isto assegura a substituição completa da proteína de interesse com a fluorescente version e manter o nível de expressão do tipo selvagem.
Taxa Fotoativação: É importante ajustar a taxa de fotoactivação tais que, em média, menos de uma molécula por célula está no estado de fluorescência em qualquer moldura do filme. Isto depende da intensidade a 405 nm e o número de moléculas de esquerda para ser activado. Em densidades muito baixas de imagem, no entanto, nem todas as moléculas irá ser trabalhada, antes do final do filme ou filmes muito longos têm que ser adquiridos. O número de imagens gravadas por filme depende do número de cópias de proteínas de fusão por célula e a média de tempo de vida fotodegradação PAmCherry nas condições de excitação utilizados. O número de cópias de Pol1 é ~ 400 moléculas / célula de 1 e o valor médio da distribuição de fotodegradação vida exponencial foi ~ 4 quadros. Ao aumentar a intensidade de 405 nm, de forma gradual, a ativação é distribuído uniformemente ao longo dos 10.000 quadros do filme. Portanto, cada célula é occupIED por moléculas fluorescentes para um total de ~ 1.600 quadros, garantindo pouca sobreposição de PSFs e rastreamento de complicações em um filme de 10.000 quadros.
Tempo de exposição e excitação intensidades: Acima de tudo, os tempos de exposição precisa ser suficientemente curto para observar PSFs nítidas com pouco movimento borrar. No entanto, a taxa de quadros deve ser escolhido para produzir o movimento molecular observável entre quadros sucessivos para além da incerteza de localização, caso contrário fótons cruciais são desperdiçados por oversampling da pista. Devem ser colhidas amostras do movimento de moléculas não ligadas a intervalos suficientemente longo de tempo a ser claramente distinguível do movimento aparente de moléculas ligadas, devido à incerteza de localização. Quando o tempo de exposição é definido, a intensidade do PSF deve ser ajustado. A precisão de localização de um PSF aumenta com o número de fotões detectados durante a duração de um quadro. Intensidades de excitação mais altos aumentam os bu taxa de emissão de fótont também a taxa de fotodegradação e sinal de fundo. Use a intensidade de excitação menor que dá a precisão de localização desejada. Para Pol1-PAmCherry optamos 15,26 ms / frame e 3,5 mW 561 nm de excitação (400 W / cm 2). É importante para confirmar a viabilidade das células para as condições particulares de imagem através da monitorização do crescimento e morfologia celular, antes e depois da aquisição de dados (ver Informação suplementar em Uphoff et al. 7).
Pol1 exibe um tempo de ligação de ~ 2 seg a um substrato de DNA com folga in vivo 7; que esperar, portanto, a maioria das moléculas de ser no seu estado ligado ou não ligado durante toda a duração de uma faixa. Moléculas ligadas aparecem essencialmente imóvel porque os locais do cromossoma tem um coeficiente de difusão de várias ordens de grandeza menor (~ 10 mM -5 2 / seg, Elmore et al. 18) que Pol1 difusão no citoplasma (~ 1 mM 2 / s).
Análise Difusão: O coeficiente de difusão aparente D * é calculado a partir da MSD de faixas individuais, em média um mínimo de 4 etapas (5 quadros) para reduzir o erro estatístico. Note-se que ~ 75% de moléculas de lixívia dentro de menos de 5 quadros para as condições de imagem descritos. Tais pistas curtas não oferecem certeza estatística suficiente para distinguir moléculas associados e não associados. No entanto, as frações relativas de moléculas de associados e não associados que relatam sobre a atividade da proteína são independentes do número total de faixas analisadas.
É útil em conta o erro de localização PSF (σ loc) no cálculo da D * devido à incerteza agrega um passo aleatório aparente para cada localização de uma molécula de 15.
Para melhorar a classificação de moléculas ligadas e difusão, recomendamos cálculo D * both desde os deslocamentos de passo único e os deslocamentos ao longo do tempo de duas armações. Em seguida, é possível definir dois D * limiares separados: D * (15 ms) <0,15 mM 2 / seg e D * (30 ms) <0,075 mM 2 / seg.
Note que D * é um coeficiente de difusão aparente que é afetado por confinamento celular das faixas e movimento tremido devido a difusão durante o tempo de exposição. Para extrair os coeficientes de difusão imparciais precisos, ele tem se mostrado útil para comparar o movimento observado para dados simulados com base em um modelo de movimento Browniano 5,7 estocástica. Dados simulados também pode ser utilizado para testar os procedimentos de análise de dados.
Potenciais aplicações deste método: Foram descritas uma abordagem geral para a visualização e quantificação de interacções DNA-proteína in vivo por a alteração na mobilidade da proteína quando da ligação com o cromossoma. As actividades da ADN-ouProteínas de ligação a ARN envolvidas na reparação, a replicação, a transcrição e manutenção do cromossoma pode assim ser seguido em tempo real, ao nível de uma única célula, com uma resolução espacial inferior ao limite de difracção óptica. Fotoativado rastreamento única molécula estende métodos de monitoramento convencionais que são restritos a algumas moléculas marcadas por célula. Um método alternativo, que mede a difusão molecular in vivo é Recuperação de fluorescência Após Fotodegradação (FRAP). Enquanto FRAP é muito útil para medir características de difusão globais em células grandes, ele é limitado em sua capacidade de resolver várias espécies moleculares com diferentes mobilidades em um ambiente espacialmente heterogêneo, especialmente para as pequenas células bacterianas.
Nós aplicamos fotoativados molécula única de monitoramento para medir as atividades de ligação a DNA e localizações subcelulares de uma gama de diferentes proteínas em E. coli incluindo Pol1, ligase de ADN, proteína Fis, ADNpolimerase III 7, bem como a manutenção estrutural de proteínas Cromossomas MukB, E, F e 19. Prevemos que o método também pode ser adaptada para outros tipos de células.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Reconhecemos Justin Pinkney e Johannes Hohlbein para obter ajuda com a construção do microscópio sob medida e Seamus Holden para o software de localização. Rodrigo Reyes-Lamothe é agradeceu por fornecer a E. coli. A pesquisa foi financiada pela Comissão Europeia Sétimo Programa-Quadro Grant FP7/2007-2013 SAÚDE-F4-2008-201418, Reino Unido Biotecnologia e Ciências Biológicas Research Council Grant BB/H01795X/1, eo Conselho Europeu de Investigação Grant 261.227 para ANK. DJS foi financiado pelo Wellcome um Programa de Confiança Grant WT083469. SU foi apoiado por uma bolsa de doutorado MathWorks.
Materiais
| Name | Company | Catalog Number | Comments |
| E. coli strain carrying a chromosomal insertion for a PAmCherry DNA-binding fusion protein | created by Lambda-Red recombination | ||
| MEM amino acids | Invitrogen | 11130-051 | minimal medium supplement |
| MEM vitamins | Invitrogen | 11120-052 | minimal medium supplement |
| Agarose | BioRad | 161-3100 | certified molecular biology grade |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1 hr |
| Methyl methanesulfonate (MMS) | Sigma-Aldrich | 129925 | CAUTION: toxic |
| PALM setup | home-built | described in Uphoff et al.7 | |
| MATLAB | MathWorks | for data analysis and visualization | |
| Localization software | custom-written, available online | http://www.physics.ox.ac.uk/Users/kapanidis/Group/Main.Software.html | MATLAB and C++ software package that can be adapted for localization analysis. Cite Holden et al.13 if used in publication. |
| Tracking software | available online | http://physics.georgetown.edu/matlab/ | MATLAB implementation by Blair and Dufresne. Cite Crocker & Grier12 if used in publication. |
Referências
- Friedberg, E. C. . DNA Repair and Mutagenesis. , (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer spatial resolution. Science. 313 (5793), 1642-1645 (2006).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat. Methods. 7 (5), 377-381 (2010).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc. Natl. Acad. Sci. U.S.A. 108 (31), (2011).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat. Methods. 6 (2), 153-159 (2009).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc. Natl. Acad. Sci. U.S.A. 110 (20), 8063-8068 (2013).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97 (12), 6640-6645 (2000).
- Reyes-Lamothe, R., Possoz, C., Danilova, O., Sherratt, D. J. Independent positioning and action of Escherichia coli replisomes in live cells. Cell. 133 (1), 90-102 (2008).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J. Bacteriol. 119 (3), 736-747 (1974).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5 (2), 159-161 (2008).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid. Interface. Sci. 179 (1), 298-310 (1996).
- Holden, S. J., et al. Defining the limits of single molecule FRET resolution in TIRF microscopy. Biophys. J. 99 (9), 3102-3111 (2010).
- Holden, S. J., Uphoff, S., Kapanidis, A. N. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat. Methods. 8 (4), 279-280 (2011).
- Wieser, S., Schütz, G. J. Tracking single molecules in the live cell plasma membrane-Do's and Don't's. Methods. 46 (2), 131-140 (2008).
- Arnauld, S., Nicolas, B., Hervé, R., Didier, M. Multiple-target tracing (MTT) algorithm probes molecular dynamics at cell surface. Protoc. Exch. , (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. (11), 555-565 (2009).
- Elmore, S., Müller, M., Vischer, N., Odijk, T., Woldringh, C. L. Single-particle tracking of oriC-GFP fluorescent spots during chromosome segregation in Escherichia coli. J. Struct. Biol. 151 (3), 275-287 (2005).
- Badrinarayanan, A., Reyes-Lamothe, R., Uphoff, S., Leake, M. C., Sherratt, D. J. In vivo architecture and action of bacterial Structural Maintenance of Chromosome proteins. Science. 338 (6106), 528-531 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados