Method Article
Fosfopéptido Análise de Rodent epidídimo Espermatozóides
Neste Artigo
Resumo
Proteomic analysis of any cell type is highly dependent on both purity and pre-fractionation of the starting material in order to de-complexify the sample prior to liquid chromatography mass spectrometry (MS). By using back-flushing techniques, pure spermatozoa can be obtained from rodents. Following digestion, phosphopeptides can be enriched using TiO2.
Resumo
Os espermatozóides são bastante único entre os tipos de células. Embora produzido no testículo, tanto a transcrição do gene nuclear e tradução são desligadas uma vez que a célula rodada pré-cursor começa a se alongar e se diferenciar em que é morfologicamente reconhecida como um espermatozóide. No entanto, o espermatozóide é muito imaturo, não tendo capacidade para motilidade ou reconhecimento de ovo. Ambos os eventos ocorrem uma vez que o trânsito espermatozóides um órgão secundário conhecido como o epidídimo. Durante a passagem ~ 12 dias que demora para uma célula de esperma de passar através do epidídimo, modificações pós-traducionais das proteínas existentes desempenham um papel crucial na maturação da célula. Uma faceta importante de tal proteína é a fosforilação. A fim de caracterizar eventos de fosforilação que ocorrem durante a maturação do esperma, é necessário estabelecer as duas populações de células de esperma puros e pré-fracionamento de fosfopeptídeos. Usando técnicas de descarga de volta, um método para o isolamento do puro espermatozóides of alta qualidade e rendimento dos epidídimos distais ou caudal é delineada. Os passos para a solubilização, a digestão, e pré-fraccionamento de fosfopéptidos de esperma por meio de cromatografia de afinidade de TiO 2 são explicadas. Uma vez isolado, fosfopéptidos pode ser injectado na MS para identificar os dois eventos de fosforilação de proteína sobre os resíduos de aminoácidos específicos e quantificar os níveis de fosforilação que ocorre durante os processos de maturação do esperma.
Introdução
Tendo emergido dos testículos, os espermatozóides são muito diferenciados ainda notavelmente, estas células são imaturas 1,2. Como tal, eles não têm a funcionalidade completa, incluindo a capacidade de nadar e se ligam a um ovócito 3. Embora seja necessário continuar a maturação do espermatozóide, isso não pode ocorrer por vias canônicas, uma vez que, nesta fase do seu processo de diferenciação celular, eles são incapazes de transcrição do gene e proteína mais biossíntese 4. Competência Biológica é conferido a espermatozóides como eles deixam o testículo e digite uma parte do sistema reprodutor masculino, conhecido como o epidídimo 5. O epidídimo é um tubo em espiral apertado, altamente diferenciado, que liga as condutas de eferentes (de testículos) para os canais deferentes e está presente em todos os mamíferos do sexo masculino 6. Espermatozóides adquirir progressivamente o seu potencial fertilizante durante a descida do epidídimo, contando com o ambiente luminal em constante mudança que é created pelas células epiteliais do epidídimo locais 7. As diversas atividades secretoras e re-absorção presentes no ato epididymal meio para modificar o próprio esperma, alterando a sua proteína, carboidratos e lipídeos composição 6. A importância do epidídimo, particularmente a região inicial 'caput' dessa estrutura tenha sido exemplificada utilizando técnicas de ligação 8 cirúrgicos. Espermatozóides retida dentro do testículo por ligadura de ducto eferente são completamente desprovido de qualquer capacidade de fertilizar o óvulo 9-11.
Além do ambiente epididimal, vias de transdução de sinal dentro do trabalho de espermatozóides ao pós-traducionalmente modificar o complemento existente de células de esperma. Por exemplo, os espermatozóides a partir do início regiões do epidídimo exibir diferentes padrões de fosforilação de proteínas em comparação com estas últimas regiões 5,12. Isto não é surpreendente uma vez que existem grandes diferenças na capability do esperma destas regiões. Por exemplo, os espermatozóides do início, caput epidídimo são immotilite. Em contraste, as células do esperma da região da cauda para a frente serão submetidos a motilidade progressiva, uma vez colocados em meio isotónico. Como as células de esperma do epidídimo são incapazes de biossíntese de proteínas-novo, todas as vias intrínseca que regulam a função do esperma deve ser através de modificações pós-traducionais (PTM). Por isso, é lógico que proteômica e, nomeadamente, a investigação de PTMs como fosforilação deve ser um grande impulso para que possamos conhecer a maturação do espermatozóide.
Um método alternativo para a obtenção dos espermatozóides epididymidies usar retro-backflushing 13-16. Embora esta técnica é, certamente, mais demorada e tem um maior grau de habilidade por parte do operador, os espermatozóides obtidos demonstram de forma consistente pureza superior a 99,99%. Além disso, ao contrário de todas as outras técnicas, ca espermatozóidesn ser isolada num estado de repouso, tornando-se possível estudar a motilidade do esperma como é iniciada. Como preparação da amostra é o aspecto mais importante para a análise proteômica, isolamento de espermatozóides tornou-se um dos aspectos mais importantes de estudos de esperma-proteômica. Este protocolo proporciona uma explicação de como os espermatozóides são isolados a partir de cauda do epidídimo. Após isto, o processo de enriquecimento de TiO 2 fosfopéptido é descrito, com referência específica sobre como extrair péptidos a partir das células de esperma altamente diferenciadas. A abordagem MS pode ser usado para distinguir mudança fosfopeptídeos se fosse para comparar os espermatozóides do epidídimo caudal em um estado (immotile ou não capacitados) para outro (móveis, capacitados, acrossoma reagido, etc.) tornando-a uma abordagem poderosa para estudar esperma função.
Protocolo
1. Preparação de Meios de Cultura e Pratos
- Adicione 200 ml de Biggers Whitten e Whitten (PD) 17 Solução de trabalho pela adição de 5,54 g de NaCl, 0,356 g de KCl, 0,25 g de CaCl2, 0,162 g de H 2 KO 4 P, e 0,294 g de MgSO4 e 1 L de água Milli-Q . Esta é a solução estoque e pode ser mantida a 4 ° C durante até um mês.
- A partir da solução estoque, adicionar 420 mg de NaHCO3 -, 200 mg de glucose, 6 mg de piruvato de sódio, 600 mg de albumina de soro bovino, 0,74 ml lactato de sódio, e 4,0 ml de tampão HEPES a 193 ml do estoque de BWW. Esta é a solução de trabalho e é sempre frescos no dia e equilibrou-se a 37 ° C antes de usar.
- Para fazer com que a cânula, ter de polietileno (PE), tubagem com um diâmetro interno de 0,4 mm e um diâmetro externo de 1,1 mm e mantenha em fogo baixo (tipicamente metanol chama) de tal modo que o tubo começa a derreter. Tire imediatamente a tubulação outward para esticar e fazer o diâmetro exterior mais estreito.
- Cut para produzir um estreitamento de uma extremidade que permite a fácil punção dos vasos deferentes.
- Cortar a outra extremidade da cânula até cerca de 15 cm. Inserir uma agulha G 30 no fim brusco, e anexar uma seringa de 3 ml para ele (totalmente retraída).
- Adicione um bocal de sucção por um corte 20 cm de comprimento de tubagem de PE (4,2 mm de diâmetro interno, 6,4 mm de diâmetro exterior). Insira um porta-voz em uma das extremidades.
- Insira o suporte tubo de vidro a micro-capilar e da própria micro-capilar de vidro (tipicamente 3 ul para um rato, 40 ul para um rato).
2. Remoção de epidídimos de Mouse
- Eutanásia ratos de acordo com os procedimentos aprovados IACUC específicas para cada instituição.
- Leve o animal e fazer uma pequena incisão no escroto para expor o epidídimo. Puxe o testículo e epidídimo para fora da cavidade usando um par de # 5 pinças de relojoeiro.
- Cortam os canais deferentes de tal modo que, pelo menos, 1-2 cm de permanecer ligados à cauda do epidídimo. Além disso, cortar os ductos eferentes proximais e tecidos de ligação do epidídimo ao testículo e remover a faixa reprodutiva masculina inteira.
- Coloque a faixa reprodutor masculino inteira sob um microscópio de dissecação com uma gama de ampliação na ordem de 5-40X.
3. canulação do epidídimo
- Fita para baixo da cânula para o microscópio, de tal modo que 1-2 cm da extremidade (em forma de cone) estreitada é livre e visível através da lente.
- Pegue um par de # 5 pinças de relojoeiro e apertar suavemente cada lado do canal deferente e puxe o canal deferente para a cânula, de tal modo que a cânula vai para os canais deferentes.
- Pegue um pedaço de não-absorvível trançado preto de seda tratado (tamanho 5-0) e dê um nó em torno dos vasos deferentes canulados. Verifique se o nó é puxado com força para segurar a cânula no interior dos vasos deferentes, quando a pressão do ar from a seringa é aplicado.
4. Retrograde ou Backflushing do caudal do epidídimo Espermatozóides
- Usando relojoeiros # 5 fórceps, pegue a extremidade distal dos epidídimos Cauda e remover a túnica albugínea, a fim de expor um único túbulo epidídimo.
- Usando a pinça, puxe para fora do túbulo para expor e, em seguida, provocar uma separação, de modo a criar uma abertura para o esperma para ser liberado.
- Suavemente empurrar os 3 ml (rato) ou 20 ml (rato) de seringa, de modo a expelir o ar a partir da seringa para dentro do vaso deferente. À pressão adequada, espermatozóides vai começar a sair lentamente do túbulo quebrada na extremidade distal da cauda do epidídimo. Neste momento, para aplicar sucção do bocal para desenhar os espermatozóides no capilar de vidro. Nota: Tipicamente, um rato, 2-3 ul de espermatozóides pode ser obtida, dependendo da idade do animal. A vontade de rato, no rendimento médio de 30-40 mL.
5. LavarLise e espermatozóides em Preparação para Proteomics
- Expulsar os espermatozóides do capilar de vidro, em 1 ml de solução de solução de BWW (37 ° C), soprando suavemente para dentro do bocal ou anexar uma seringa e expelir o ar de modo a empurrar os espermatozóides de volta para fora do capilar.
- Uma vez que os espermatozóides são difundidos, lavar 3x (300 x g, 5 min) com 1 ml BWW para remover proteínas contaminantes. Após a lavagem final, remover o sobrenadante. Nota: Neste ponto, as células de esperma podem ser congeladas para uso posterior.
- Solubiliza-se proteínas utilizando 4% CHAPS, 2 M tioureia, e Tris 50 mM, pH 7,4, durante 1 hora com agitação em vórtex intermitente.
- Após a lise das células, de centrifugação (10.000 xg, 20 min), ter sobrenadante e transferir para um tubo novo. Nota: Neste ponto, a quantificação de proteína pode ser realizada.
6. Disulfide bond Redução e alquilação
- Adicionar DTT 10 mM como uma concentração final de proteínas de lisados, vortex e incubar à TA durante 30 min.
- Adicionar 50 mM idodoacetamide como uma concentração final de lisado, vortex e incubar à temperatura ambiente durante 30 min no escuro.
7. Precipitação
- Metanol clorofórmio precipitar a amostra por adição de 1 volume de lisado (400 ul como um exemplo), adicionar um volume (400 ul) de metanol e 0,5 volumes (200 mL) de clorofórmio.
- Vortex da amostra e rotação (10.000 xg, 2 min).
- Note-se que duas fases aparece depois da centrifugação. Descarte todos mas 2 mm da camada superior (tomando cuidado para não perturbar a interface).
- Adicionar 1 volume (400 ul) de metanol, tubo invertido 1-2X suavemente para misturar e novamente girar (10.000 xg, 15 min). Elimine o sobrenadante para o lixo e ar pellet seco para 3-4 min.
8. A digestão com tripsina
- Reconstituir tripsina em 25 mM de bicarbonato de amónio contendo ureia 1 M a uma proporção de 50: 1 (W / W; proteína: tripsina) e incubadas overnight a 37 ° C, de preferência a 700 rpm num termomisturador.
- Rotação (10.000 xg, 15 min) para sedimentar o material não digerido. Transferir o sobrenadante para um novo tubo.
9. fosfopéptido Enriquecimento
- Realizar purificação e do enriquecimento de fosfopéptidos da digestão tríptica como previamente descrito 18. Diluir péptidos trípticos 10 vezes em tampão de DHB [tampão DHB consiste de: 350 mg / ml de ácido 2,5 dihydrobenzesulfonic (DHB), 80% (v / v), ACN (acetonitrilo), 2% (v / v) de TFA (trifluoroacético ácido)], e aplicam-se a secar o TiO 2 esferas (200 ug).
- Deixar num rotor a temperatura ambiente durante 1 h.
- Lavar a amostra com tampão DHB, girar e remover o sobrenadante. Em seguida, lava-se a amostra três vezes com tampão de lavagem [80% de ACN (v / v), TFA a 2% (v / v)] para remover o DHB.
- Após a centrifugação final, eluir directamente os fosfopéptidos utilizando tampão de eluição por adição de 25 ul de um hidróxido de amónio a 2,5%, pH 10,5 ≥ solução. Sprender e remover o sobrenadante. Imediatamente ~ neutralizar com ácido fórmico a 0,3 ul.
Resultados
A qualidade dos resultados de qualquer análise proteômica é fortemente dependente do material de partida. Com MS modernos, leves contaminações em preparações de amostra são facilmente apanhados. Portanto, é essencial, no caso de células de esperma proteómica, para escolher um método que dá espermatozóides altamente puro. Como ilustrado na Figura 1, backflushing retrógrada é usado para recuperar células de esperma de cauda do epidídimo. Trata-se de canulação dos vasos deferentes com tubagem PE que permite aplicar lentamente a pressão de ar da seringa em anexo. Figura 1A demonstra cauda do epidídimo, juntamente com os canais deferentes. Figura 1B é um fim acima do tiro de como o canal deferente é ligada em que o é inserida uma cânula. Ao fazer, por isso, os espermatozóides são liberados no final extirpado de um túbulo dos epidídimos caudais. Como mostrado na Figura 2A, os espermatozóides são extraídos a partir das regiões apicais do CAUDum epidídimo e são sugados para dentro de um capilar de vidro em um estado de repouso (Figura 2B). Isto tem várias vantagens sobre os métodos tradicionais "nadar-up", não o menos importante dos quais é a capacidade de realizar uma análise phoshoproteomic dos espermatozóides antes e depois da activação da motilidade. Os espermatozóides podem então ser expelido para a mídia de sua escolha. Figura 2C (lado esquerdo) demonstra como o esperma procurar imediatamente após expulsão em media BWW. Muitas das células são aglutinados. No entanto, após 10 min da competência das células é demonstrada porque nadar para homogeneidade na solução (Figura 2C, células à direita). Uma vez que a técnica backflushing tem muito pouco impacto sobre as células do esperma, obtém-se perto de 100% e a motilidade das células dispersam-se rapidamente para o meio externo sem provocação. Em um experimento backflushing típico, esperma recuperado da Swiss-rato contémentre 1-5 x 10 6 células. Isto é altamente dependente da idade do animal, e pode variar entre diferentes estirpes de ratinhos. Em um rato da Noruega, que tipicamente se obter 200 x 10 6 espermatozóides, ± 20%. A Figura 2D representa o grau de pureza obtido a partir de espermatozóides cauda do epidídimo de rato.
Além da própria amostra, uma das principais questões relacionadas com a preparação da amostra é o rendimento da digestão de tripsina. Precipitação de proteínas desempenha um papel importante, não apenas na remoção de detergentes e sais indesejados, ambos os quais são incompatíveis com MS, mas também em desnaturação de proteínas. Nós descobrimos que o precipitação metanolclorofórmio funcionar melhor. Não apenas esse procedimento foi relatado para precipitar proteínas abundantes baixas melhor do que outros, incluindo TCA precipitação 19, mas tem vantagens adicionais. Após precipitação com TCA, é muitas vezes necessário reajustar o pH após a suspensão da pelota ACT, que pode permanecer bastanteácida. Embora o sedimento precipitado de TCA pode ser lavado em soluções orgânicas elevadas para remover o ácido, o que aumenta o manuseamento da amostra e irreproducibility de resultados. A falha em neutralizar o ácido vai resultar em baixos rendimentos de péptidos trípticos. Precipitação de metanol-clorofórmio é não só rápido, mas não se acidificar a amostra. A Figura 3 ilustra o sedimento de proteína tipicamente visto a partir de 100 mg de amostra a interfase entre inferior e superior.
O isolamento dos fosfopéptidos pode ocorrer em um número de maneiras; no entanto reprodutibilidade depende de como a amostra ter sido tratada até e incluindo esta etapa. Um dos métodos em desenvolvimento, mais comuns é TiO 2, originalmente desenvolvido pelo grupo de Martin Larsen 18,20,21. Embora tenha sido descrito como um processo para usar em microcolunas, podemos obter dados reprodutíveis usando cromatografia em lotes. O sucesso do processo é fortemente dependente do tampão de eluição, que deve estar louco e com a composição correta; caso contrário, não são eluídas fosfopéptidos em tudo.
A reprodutibilidade dos dados do protocolo e representativos de TiO2 a partir da cauda do epidídimo fosfopéptidos esperma enriquecido em um não-móveis (Figura 4 em cima) e móveis (Figura 4 inferior) estado de m / z 650-670 pode ser visto. Nós demonstramos que esta é uma técnica extremamente reprodutível mesmo quando se usa repetições biológica 17. As estrias azul aparecem ao longo do tempo são péptidos que eluem a partir de um nano-coluna C18 como a concentração de acetonitrilo aumenta. Claramente, a população em móveis (n = 3 ilustrados, n = 8 funcionam tipicamente), há um peptídeo de grupo, com uma massa monoisotópica torno da faixa de 651,5 Da que está completamente ausente no intervalo não-móveis. Espectrometria de massa em tandem é então utilizado para identificar este péptido.
546 / 51546fig1highres.jpg "/>
Figura 1:. Canulação da cauda do epidídimo (A) Imagem da cauda do epidídimo. A própria cânula é gravada para baixo para expor aproximadamente 1-2 cm da extremidade pré-puxado. Este é inserido nos vasos deferentes usando finas # 5watchmakers fórceps. (B) A cânula é mantida no lugar por amarrar seda fina em torno de um segmento que contém ambos os canais deferentes e da cânula. A partir do ratinho, aproximadamente 2-3 ul de células do epidídimo e caudais de fluido são recolhidos a uma concentração de 1 x 10 6 / mL. A partir do rato (mostrado), cerca de 30-40 uL de fluido são obtidos em concentrações semelhantes.
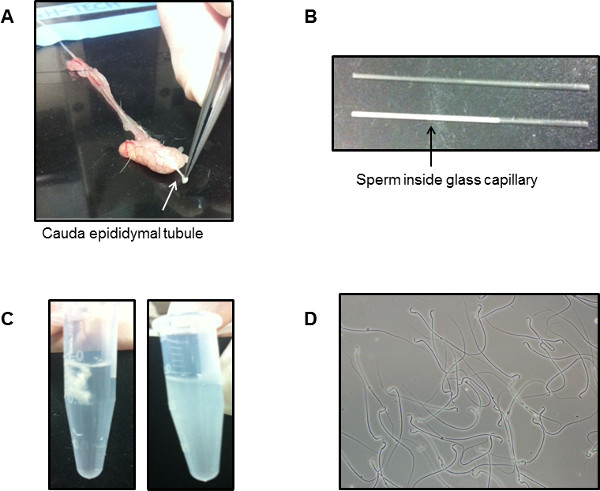
Figura 2: capilar de vidro usado para coletar espermatozóides do epidídimo competente. (A) Um túbulo do ápice da cauda e pididymis é isolado e quebrado. A posição aproximada do qual isto ocorre é mostrado. (B) A parte superior da imagem mostra um tubo capilar de vidro vazia e a parte inferior apresenta uma a partir de um rato previamente backflushed. Não há contaminação sanguínea e contaminação de células epiteliais mínima. (C) Como os espermatozóides são ainda diluído no líquido do epidídimo, eles não começaram a ativar. Quando os espermatozóides são inicialmente expulsos em uma solução BWW, eles vêm como uma "string" compacto (lado esquerdo). A competência da célula é facilmente estabelecida, uma vez que depois de 10 min mais dos espermatozóides nadam em solução, sem qualquer perturbação externa (lado direito). (D) Uma imagem de uma alíquota de células do epidídimo caudais imediatamente depois de terem sido deixados para nadar fora demonstra a pureza das células.
g3highres.jpg "/>
Figura 3:. Precipitação de metanol-clorofórmio Uma vez que os espermatozóides foram solubilizados, a fracção solúvel é precipitado de metanol-clorofórmio para assegurar a desnaturação das proteínas e a remoção de substâncias contaminantes. O sedimento de proteína aparece na interface entre as fases de metanol / água e clorofórmio. A camada superior é removido com cuidado, de modo a não perturbar este pellet. É comum para deixar cerca de 2-3 mm da fase superior, de modo nenhum se perde proteína.
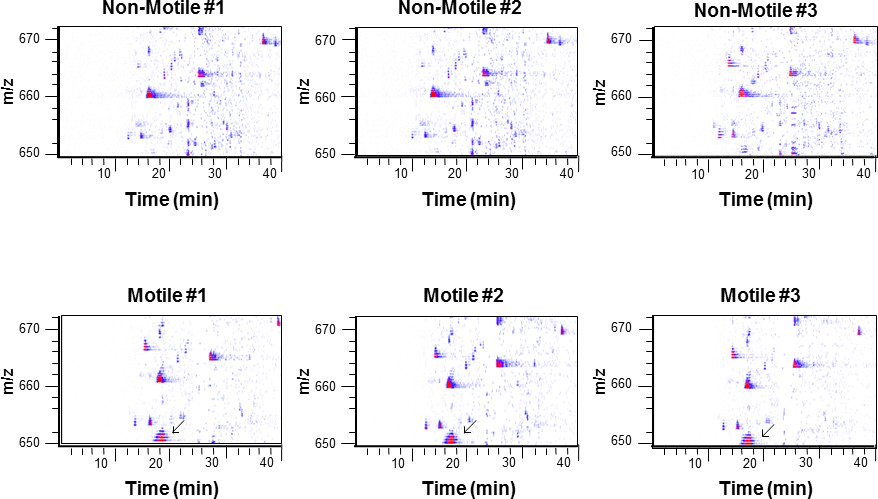
Figura 4:. Típica TiO2 perfil fosfopéptido enriquecido Utilizando o protocolo descrito, caudal espermatozóides epididimal foram isolados em qualquer immotile (topo, N = 3) ou estados com motilidade (inferior, N = 3). Um cluster de peptídeo com uma massa mono-isotópica do ~ 651,5 Dum é mostrado para estar presente nas populações com motilidade mas completamente ausente em os immotile (seta). Comparações desta natureza são referidos como "livre de marcador (baseado em MS)". A massa do péptido e o tempo de retenção são então utilizadas para direccionar o composto para espectrometria de massa em tandem e identificar a proteína a partir dos quais o péptido foi derivado.
Discussão
Os passos críticos para uma análise proteómica bem sucedida e reprodutível de espermatozóides são: 1) pureza do material de partida; 2) a remoção de sais não desejados e detergentes; 3) desnaturação de proteínas toda a sua extensão de modo a permitir que a tripsina para digerir um elevado rendimento de proteínas e 4) minimizando o manuseamento da amostra para reduzir a perda de péptido.
A fim de backflush cauda do epidídimo com sucesso, é essencial para localizar a área da qual os espermatozóides vai sair. No caso de ambos os ratos e ratinhos, isto é, no vértice da superfície côncava, no meio da região caudal do epidídimo (ver Figura 2A). Se alguém vem mais para o canal deferente, backflushing é mais fácil e a taxa de sucesso é geralmente mais elevada. No entanto, isso vem com a perda do número de espermatozóides. Em alternativa, se se tenta mover-se mais próximo do corpo, então a quantidade de pressão necessária para empurrar o espermatozóides de volta através do epididymdutos de AL é muitas vezes tão alto, que os danos para o epidídimo inevitavelmente ocorre.
Backflushing do epidídimo é tradicionalmente realizado utilizando água saturada com óleo mineral e uma solução salina equilibrada na própria seringa, assim como um meio para remover os espermatozóides 22-25. Ambos os procedimentos são potencialmente problemática da LC-MS. Em primeiro lugar, mineral é susceptível de bloquear os nano-nano-C18 colunas que são basicamente utilizadas em todo o mundo para a análise proteômica e os cuidados devem ser tomados para que nenhum é transportado no procedimento. Se isto ocorre, é impossível continuar e a amostra é essencialmente perdido. Isto pode ser ultrapassado através da utilização de BWW ou outras soluções salinas equilibradas na seringa, no entanto, embora este seja bem sucedido, é reconhecido logo que muitos dos espermatozóides móveis se tornar tão logo a solução BWW entrou em contacto e misturado com o caudal do epidídimo células. Para contornar esse problema, simplesmente backflush dos espermatozóides com o ar. Não é só a quadade de espermatozóides comparável à dos métodos à base de líquidos, mas a quantidade é idêntica.
Phosphoproteomics é talvez uma das únicas maneiras de estabelecer vias de sinalização que estão ocorrendo em espermatozóides pós-ejaculação. Uma das principais vias que estamos a investigar é o processo de capacitação. Espermatozóides deve sofrer "capacitação" antes que seja capaz de se ligar a um ovo. Na prática, isto é conseguido, basicamente, por incubação de espermatozóides durante um período de tempo (40 min ratinho; de rato de 1,5 h; 3-24 h humana) numa solução de albumina de soro com BWW. Anteriormente, nós e outros têm demonstrado um papel para várias quinases envolvidas na capacitação. De interesse, a exclusão da PKA μ II produzir camundongos cujos espermatozóides nadam de forma espontânea in vitro, mas não podem ser submetidos a hiperativação 26. O último é uma marca registrada de capacitação, em que os espermatozóides alterar o seu padrão de natação a partir de uma velocidade elevada, de baixa amplitude, com um baixovelocidade, amplitude alta frequência de batimento. Nós mostramos quinases a jusante envolvidos neste processo incluem pp60-CRV (SRC) 13,27 c-yes 28 e c-ABL 14. Curiosamente, a inibição de SRC pára-dependente capacitação fosforilação da tirosina 13. No entanto, isso pode ser superado com o ácido ocadaico, sugerindo que SRC não está directamente envolvido no aparecimento geral de fosforilação da tirosina 29, mas podem regular uma fosfatase 29. O problema com o uso BWW como um meio para forçar espermatozóides fora do epidídimo é que uma vez ativado, espermatozóides mouse apenas levar cerca de 40 min para capacitar. Dado que o isolamento de espermatozóides pode levar de 5 min / rato e frequentemente vários ratos são usados em uma experiência, em seguida, os espermatozóides será em diferentes fases de maturidade no início da experiência. Para ultrapassar esta situação, a pressão de ar pode ser usado para empurrar o espermatozóides do epidídimo caudal em uma cânula de vidro. Não só são todos inact espermaive e essencialmente como eles seriam encontrados no meio caudal, isso faz com que seja possível comparar phosphoproteomics não-móveis e imóveis.
Manuseamento da amostra para phosphoproteomics devem ser mantidos a um mínimo quando se comparam os espermatozóides em dois estados funcionais diferentes. A utilização de metanol clorofórmio sobre os outros métodos tradicionais de precipitação da proteína 1) reduz a necessidade de passos de lavagem adicionais, 2) remove quase todos os vestígios de sais e gorduras e 3) tem uma capacidade comprovada para precipitar as proteínas de baixa abundância ao longo TCA 19. Precipitação de proteína antes da digestão com tripsina é recomendado uma vez que isto não só ajuda a desnaturar proteínas (o qual auxilia a digestão de tripsina), mas remove muitos dos metabolitos MS-incompatíveis presentes na célula.
A comparação de fosfopéptidos de esperma pode ser feito de um número de maneiras. No nível básico, uma simples comparação do fosfopéptido identificada em uma amostra, para que, em outroamostra no processo conhecido como "contagem espectral" pode ser feito. No entanto crítica tem sido a esta abordagem, basicamente, porque os estudos de proteômica primeiros estavam usando baixas repetições (para uma discussão mais completa ver Lundren et al. 30). Uma abordagem mais sofisticada é olhar para a intensidade da massa pai peptídeo e comparar com as outras amostras (comparação livre-label). No exemplo mostrado na Figura 4, um péptido ausente do de não-móveis (Figura 4 em cima), mas presente no móveis (Figura 4 inferior) espermatozóides de m / z 650-670 pode ser visto. Este processo, designado por etiqueta baseada em MS quantificação livre é uma estratégia livre de marcador.
Uma estratégia alternativa utilizada para reduzir a quantidade de funcionamentos necessárias para quantificação proteómica é o uso de isótopos. À medida que a massa de um isótopo é diferente, no espectrómetro de massa pode ser utilizado para comparar as intensidades da eluting péptidos. No entanto, diferentemente da maioria dos outros tipos de células, algumas marcação isotópica não pode ser aplicada aos espermatozóides. Por exemplo, a adição de isótopos estáveis (um isótopo pesado é adicionado a uma amostra, ao passo que uma versão mais leve é adicionado ao outro) podem ser utilizados em cultura de tecidos. Quando os isótopos são incorporadas na proteína, uma análise proteómica pode ser realizado através da combinação das duas amostras (multiplexação). No entanto, no caso de espermatozóides, isto não pode ser feito, simplesmente em virtude do facto de que 1) marcação isotópica requer várias passagens (até 8) em cultura de tecidos e 2) as células de esperma tem nenhuma transcrição do gene nuclear e tradução e, portanto, eles não podem incorporar os isótopos em todas as suas proteínas de qualquer maneira. Uma maneira de contornar isso é pedir camundongos radiofármacos, no entanto, estes são notoriamente caros. Uma abordagem alternativa é a utilização de uma etiqueta química. Isto foi feito quando os ratos não-capacitada foram comparados com ratinhos capacitadas. Neste caso, um e um D 0 D 3 -label foi usada para distinguir entre uma amostra e um outro no espectrómetro de massa 31. Outras abordagens podem incluir o uso de iTRAQ (tag isobárica para a quantificação relativa e absoluta), em que as lisinas são rotulados quimicamente com diferentes isótopos de massa; iCAT (isótopo codificada marca de afinidade), pelo que cisteínas são marcados com diferentes isótopos de massa e rotulagem de água pesada e leve.
Em cada caso, no entanto, uma coisa que precisa de ser mantido em mente. O MS apenas relata o que está presente em uma amostra, e isso é um reflexo de tudo o que aconteceu para que a amostra até esse ponto. Minimizando o manuseamento da amostra enquanto maximiza o rendimento em cada passo é necessário para uma análise proteómica bem sucedida.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors would like to acknowledge the NHMRC for career development award and grant support APP1066336 which supported this work.
Materiais
| Name | Company | Catalog Number | Comments |
| 2,5-Dihydroxy-1,4-benzoquinone | Aldrich | 195464 | |
| 2-D Quantitation Kit | VWR (GE Healthcare) | 80-6483-56 | |
| Albumin from bovine serum | Sigma | A7030 | |
| Ammonia solution 25% | Merck | 1.05432 | |
| Ammonium bicarbonate | Sigma | A6141 | |
| Calcium chloride | Sigma | C5080 | |
| CHAPS 3-[3-(cholamidopropyl)dimethylammonio]-1-propanesulfonate | Research Organics | 1300C | |
| Chloroform | BDH | 10077.6B | |
| Disodium hydrogen phosphate | Merck | 1.06580 | |
| Dithiothreitol (DTT) | Sigma | D9779 | |
| Formic acid | Sigma | O6440 | |
| Glucose | Sigma | G6152 | |
| Glutamine-L | Sigma | G7513 | |
| Hepes (free acid) | Sigma | H3375 | |
| Iodoacetic acid free acid | Sigma | I4386 | |
| Lactic acid | Sigma | L1750 | |
| Magnesium chloride | Res. Org. | 0090M | |
| Methanol | Merck | 10158.6B | |
| Percoll (sterile) | VWR (GE Healthcare) | GEHE17-0891-01 | |
| Phosphatase Inhibitor Cocktail Halt | ThermoFisher Scientific (Pierce) | PIE78420 | |
| Potassium chloride | Sigma | P9333 | |
| Potassium hydrogen carbonate | Medical Store | CH 600 | |
| Sodium bicarbonate | Sigma | S3817 | |
| Sodium chloride | Sigma | S7653 | |
| Sodium dihydrogen phosphate | Merck | 1.06346 | |
| Sodium hydrogen carbonate | BDH | 10247.4V | |
| Sodium pyruvate | Sigma | S8636 | |
| Tris, ultra pure grade | Amresco (Astral) | AM0497 | |
| Trypsin Gold, mass spec grade | Promega | V5280 | |
| Urea | Sigma | U5128 | |
| Zinc chloride | Sigma | Z0173 | |
| 0.4 mm Polyethylene tubing | Goodfellow | ET317100 | |
| 30 G needle | Terumo | NN2038R | |
| 3 ml Syringe | Terumo | SS035 | |
| 4.2 mm Polyethylene tubing | Goodfellow | ET317640 | |
| Braided silk (5-0) | Dynek | CSS0100 | |
| Trichloroacetic acid | Sigma | 299537 | |
| TiO2 beads (from disassembled column) | Titansphere | 6HT68003 | |
| Eppendorf Tube | Eppendorf | 22431081 | |
| C7B30 | Sigma | C0856 |
Referências
- Blandau, R., Rumery, R. E. The relationship of swimming movements of epididymal spermatozoa to their fertilizing capacity. Fertil. Steril. 15, 571-579 (1964).
- Tournade, A. Différence de motilité des spermatozoïdes prélevés dans les divers segments de l’épididyme. C. R. Soc. Biol. 74, 738-739 (1913).
- Wyker, R., Howards, S. S. Micropuncture studies of the motility of rete testis and epididymal spermatozoa. Fertil. Steril. 28, 108-112 (1977).
- Eddy, E. M. Male germ cell gene expression. Recent progress in hormone research. 57, 103-128 (2002).
- Lin, M., Lee, Y. H., Xu, W., Baker, M. A., Aitken, R. J. . Ontogeny of Tyrosine Phosphorylation-Signaling Pathways During Spermatogenesis and Epididymal Maturation in the Mouse. 75 (4), 588-597 (2006).
- Jones, R. Plasma membrane structure and remodelling during sperm maturation in the epididymis. J. Reprod. Fertil. Suppl. 53, 73-84 (1998).
- Robaire, B., Hinton, B. T., Orgebin-Crist, M. C., Neill, J. D. . The Epididymis. 3, 1072-1120 (2006).
- Lacham, O., Trounson, A. Fertilizing capacity of epididymal and testicular spermatozoa microinjected under the zona pellucida of the mouse oocyte. Mol. Reprod. Dev. 29, 85-93 (1991).
- Bedford, J. M. Effects of duct ligation on the fertilizing ability of spermatozoa from different regions of the rabbit epididymis. J. Exp. Zool. 166, 271-281 (1967).
- Orgebin-Crist, M. C. Studies on the function of the epididymis. Biol, Reprod. 1, 155-175 (1969).
- Orgebin-Crist, M. C. Maturation of spermatozoa in the rabbit epididymis: effect of castration and testosterone replacement. J. Exp. Zool. 185, 301-310 (1973).
- Lin, M., Hess, R., Aitken, R. J. Induction of sperm maturation in vitro in epididymal cell cultures of the tammar wallaby (Macropus eugenii): disruption of motility initiation and sperm morphogenesis by inhibition of actin polymerization. Reproduction. 124, 107-117 (2002).
- Baker, M. A., Hetherington, L., Aitken, R. J. Identification of SRC as a key PKA-stimulated tyrosine kinase involved in the capacitation-associated hyperactivation of murine spermatozoa. J. Cell. Sci. 119, 3182-3192 (2006).
- Baker, M. A., Hetherington, L., Curry, B., Aitken, R. J. Phosphorylation and consequent stimulation of the tyrosine kinase c-Abl by PKA in mouse spermatozoa; its implications during capacitation. Dev. Biol. 333, 57-66 (2009).
- Baker, M. A., et al. Use of Titanium Dioxide To Find Phosphopeptide and Total Protein Changes During Epididymal Sperm Maturation. J. Proteome. Res. 10 (3), 1004-1017 (2010).
- Baker, M. A., Weinberg, A., Hetherington, L., Velkov, T., Aitken, J. Post-Ejaculatory Changes in the Metabolic Status of Rat Spermatozoa as Measured by GC-MS. Metabolomics. 11, 1-14 (2012).
- Biggers, J. D., Whitten, W. K., Whittingham, D. G. . The culture of mouse embryos in vitro. , (1971).
- Larsen, M. R., Thingholm, T. E., Jensen, O. N., Roepstorff, P., Jorgensen, T. J. Highly selective enrichment of phosphorylated peptides from peptide mixtures using titanium dioxide microcolumns. Mol. Cell. Proteomics. 4, 873-886 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal. Biochem. 138, 141-143 (1984).
- Thingholm, T. E., Jorgensen, T. J., Jensen, O. N., Larsen, M. R. Highly selective enrichment of phosphorylated peptides using titanium dioxide. Nat. Protoc. 1, 1929-1935 (2006).
- Thingholm, T. E., Larsen, M. R. The use of titanium dioxide micro-columns to selectively isolate phosphopeptides from proteolytic digests. Methods. Mol. Biol. 527, 57-66 (2009).
- Ecroyd, H., Asquith, K. L., Jones, R. C., Aitken, R. J. The development of signal transduction pathways during epididymal maturation is calcium dependent. Dev. Biol. 268, 53-63 (2004).
- Ecroyd, H., Jones, R. C., Aitken, R. J. Tyrosine Phosphorylation of HSP-90 During Mammalian Sperm Capacitation. Biol. Reprod. 69 (6), 1801-1807 (2003).
- Jones, R., Mann, T., Sherins, R. Peroxidative breakdown of phospholipids in human spermatozoa, spermicidal properties of fatty acid peroxides, and protective action of seminal plasma. Fertil. Steril. 31, 531-537 (1979).
- Wade, M. A., Jones, R. C., Murdoch, R. N., Aitken, R. J. Motility activation and second messenger signalling in spermatozoa from rat cauda epididymidis. Reproduction. 125, 175-183 (2003).
- Nolan, M. A., et al. Sperm-specific protein kinase A catalytic subunit C{alpha}2 orchestrates cAMP signaling for male fertility. Proc. Natl. Acad. Sci. U.S.A. 101, 13483-13488 (2004).
- Mitchell, L. A., Nixon, B., Baker, M. A., Aitken, R. J. Investigation of the role of SRC in capacitation-associated tyrosine phosphorylation of human spermatozoa. Mol. Hum. Reprod. 14, 235-243 (2008).
- Leclerc, P., Goupil, S. Regulation of the human sperm tyrosine kinase c-yes. Activation by cyclic adenosine 3',5'-monophosphate and inhibition by Ca(2). Biol. Reprod. 67, 301-307 (2002).
- Krapf, D., et al. Inhibition of Ser/Thr phosphatases induces capacitation-associated signaling in the presence of Src kinase inhibitors. J. Biol. Chem. 285, 7977-7985 (2010).
- Lundgren, D. H., Hwang, S. I., Wu, L., Han, D. K. Role of spectral counting in quantitative proteomics. Expert. Rev. Proteomics. 7, 39-53 (2010).
- Platt, M. D., Salicioni, A. M., Hunt, D. F., Visconti, P. E. Use of differential isotopic labeling and mass spectrometry to analyze capacitation-associated changes in the phosphorylation status of mouse sperm proteins. J. Proteome. Res. 8, 1431-1440 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados