É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Gradiente planar do sistema de difusão para investigar Quimiotaxia numa Matriz de Colagénio 3D
Neste Artigo
Resumo
Cell migration is an important part of human development and life. In order to understand the mechanisms that can alter cell migration, we present a planar gradient diffusion system to investigate chemotaxis in a 3D collagen matrix, which allows one to overcome modern diffusion chamber limitations of existing assays.
Resumo
The importance of cell migration can be seen through the development of human life. When cells migrate, they generate forces and transfer these forces to their surrounding area, leading to cell movement and migration. In order to understand the mechanisms that can alter and/or affect cell migration, one can study these forces. In theory, understanding the fundamental mechanisms and forces underlying cell migration holds the promise of effective approaches for treating diseases and promoting cellular transplantation. Unfortunately, modern chemotaxis chambers that have been developed are usually restricted to two dimensions (2D) and have complex diffusion gradients that make the experiment difficult to interpret. To this end, we have developed, and describe in this paper, a direct-viewing chamber for chemotaxis studies, which allows one to overcome modern chemotaxis chamber obstacles able to measure cell forces and specific concentration within the chamber in a 3D environment to study cell 3D migration. More compelling, this approach allows one to successfully model diffusion through 3D collagen matrices and calculate the coefficient of diffusion of a chemoattractant through multiple different concentrations of collagen, while keeping the system simple and user friendly for traction force microscopy (TFM) and digital volume correlation (DVC) analysis.
Introdução
A deslocação preferida de células para um gradiente de concentração, conhecido como quimiotaxia, desempenha um papel importante em processos fisiológicos e patológicos no organismo. Tais exemplos são a pele e mucosa 1 a cicatrização de feridas, a morfogénese 2, 3 inflamação, e 4,5 o crescimento do tumor. Também tem sido mostrado que as células cancerosas podem migrar através de duas estratégias individuais e colectivos-migração celular 6. Além disso, os mecanismos de difusão de instabilidade pode induzir a separação de células individuais ou agrupados a partir de um corpo / objeto tumoral e, em seguida, podem emigrar para uma fonte de nutrientes e, portanto, invadir áreas mais largas e 7 tecidos.
Além disso, foi demonstrado que diversos mecanismos de migração podem ser activa em 2D e em 3D, devido a diferentes funções de moléculas de adesão 8. Portanto, um movimento para fisiologicamente relevante em ensaios in vitro para investigar a motilidade celular em um measureable de modo simples e é de importância na compreensão de fenômenos movimento de 9 células. Infelizmente, a dificuldade em analisar a migração de células, um ensaio de quimiotaxia quantificável abrangente geralmente requer um método trabalhoso longo, fundada na medição da motilidade celular e fenômenos de transporte modelos imparciais.
Abordagens experimentais passadas para investigar quimiotaxia de células incluem a câmara de Boyden 10 eo ensaio sob agarose 11. No entanto, dentro destes primeiros ensaios, as experiências de migração de células não acompanhar o movimento em relação ao tempo. Mais, o mais importante, os gradientes de concentração utilizados para as experiências não foram bem definidas ou completamente compreendido, enquanto apenas para sustentar a sinalização para não mais do que algumas horas. Além disso, as tentativas de câmara de quimiotaxia precoce restrito a migração de células para duas dimensões e não permitem controlar a cinética da migração 12. Olhando para a câmara de Boyden, um ensaio endpointnão permitiria ao pesquisador observar visualmente a migração e não poderia diferenciar diretamente quimiotaxia (movimento direcional) de quimiocinese (movimento aleatório). Além disso, várias variáveis diferenças no tamanho de poro e espessura de membranas feitas a câmara muito difícil de reproduzir de forma fácil e oculta a reacção migrante de células para quimiocinas 13,14.
Com o novo entendimento de microfluídica, novas câmaras e micro-dispositivos têm sido investigados como um instrumento para investigar a locomoção de células sob condições de fluxo intersticiais ou quimiotaxia 15,16. De acordo com estes novos dispositivos, novas métricas de células foram introduzidos e investigados, como o efeito da tensão de cisalhamento em uma célula 17,18. Infelizmente, câmaras de quimiotaxia microfluídicos passadas e atuais limitam estudos de migração celular para substratos um 2D revés importante, pois muitos processos biológicos, incluindo a invasão de células de tumores e metástases, e immigração celular Mune, envolvem a migração 3D.
Câmaras-onde a observação direta de uma solução chemoattractant está em contacto com um gel 3D contendo células também têm sido também relatados 19,20. Estas câmaras têm dois compartimentos, um contendo um quimioatractor e uma contendo células, são unidas ao lado uma da outra na horizontal 21 ou como anéis concêntricos 22. Estes sistemas são apontados na direção certa, mas não manter um sistema de quimiotaxia por um período prolongado de tempo.
Além disso, os investigadores examinaram também difusividade através de membranas de colagénio em células de diálise, bem como a difusão de moléculas marcadoras através de amostras de colagénio submetido a pressão hidrostática 23-25. Algumas experiências de difusão em géis de colagénio dependem de alterações físicas e químicas do gel usando campos magnéticos e incorporação química 26. Um método popular para a modelagem diffusivity em collatecidos endógenos baseia-se na imagem de fluorescência de ponto fotodegradação contínua. Este método revelou anisotropia nos coeficientes de difusão de macromoléculas em tecidos de colagénio orientadas. No entanto, a fotodegradação foi usado na cartilagem articular e não matrizes de colagénio. Embora semelhantes, os experimentos de modelagem necessárias devem ser realizadas através da compreensão especificamente o coeficiente de difusão de géis de colágeno. Mais importante ainda, os sistemas não utilizam um método para medir a força de geração de células.
Infelizmente, a maioria dos sistemas parecem estar faltando um ou dois elementos-chave para um sistema ideal: o que permite rastreamento de celular, uma compreensão gradiente de difusão com um fator quimiotático através da matriz, um conjunto relativamente simples com uma facilidade de reprodutibilidade, a minimização de célula-célula interações, e a capacidade de medir unidades dimensionais para quantificação (isto é, velocidade, força, concentração específica). Moghe et ai. 27 proposto um sistema que cumpriu a maioria destas exigências em que as células foram inicialmente dispersos por todo o gel em vez de concentradas na superfície do filtro, mas foi difícil de medir as forças que a célula gera.
Para este fim, apresentamos um sistema de gradiente de difusão planar para investigar quimiotaxia em uma matriz de colágeno 3D, que permite superar as limitações modernas câmara de difusão de ensaios existentes, que é baseado na microscopia de lapso de tempo, juntamente com técnicas de análise de imagem para medir celular forças em um ambiente 3D. Este protocolo proporciona uma maneira simples, contudo inovadora de criar uma câmara de difusão 3D simples que pode ser utilizado para investigar a quimiotaxia 3D em células diferentes.
Protocolo
Mold Design 1. 3D e Peças
- Mofo
- Antes de trabalhar, obter um kit de elastômero de silicone, uma câmara de imagens de células vivas, uma lamela de vidro 22 mm, e um cubo de metal de alumínio usinado com dimensões 10,07 milímetros x 3,95 milímetros x 5,99 milímetros. Preparar a câmara de imagem de células vivas para moldagem, colocando a lamela inferior no suporte de montagem e o resto da câmara, conforme indicado pelo fornecedor.
- Em seguida, usando uma pinça, coloque o cubo de alumínio usinado de metal no meio da caixa de uma câmara ao vivo imagens de células e em cima da lamela, e, em seguida, reserve.
- Misturar as soluções de elastómero de silicone de acordo com o protocolo do fabricante para fazer 5 ml de elastómero.
- Usando uma espátula de laboratório descartável, despeje solução de elastômero de silicone em configuração ao vivo câmara de imagens de células e garantir para não mover colocado usinado cubo de metal de alumínio. Coloque o sistema na bancada do laboratório, em um local seguro O / N para a cura.
- Na manhã seguinte, desconstruira câmara de imagens de células vivas, como recomendado pelo fabricante e retirar o molde usando uma pinça. Utilizando uma pinça, extraia cuidadosamente o cubo de metal de alumínio usinado a partir do molde. Vá até a pia e lavar o molde com água deionizada. Coloque o molde em uma toalha de papel para secar.
- Depois de seco, usando uma faca passatempo, cortar fendas através do molde, espaçadas 2,34 milímetros para além de cada extremidade longitudinal, no interior do molde de silicone. Verifique se as estadias do molde em um lugar seguro e seco até que você esteja pronto para construir o sistema para uma experiência.
- Hidrofílicos e hidrofóbicos As lamelas de vidro Preparação
- Para permitir que a matriz de colagénio para aderir a uma superfície, criar lamelas hidrófilos:
- Usando uma pipeta descartável, medir 150 mL de 3-aminopropil-trimetoxissilano e despeje solução num tubo de 50 ml. Adicionar 30 ml de etanol a 100% para o tubo de 50 ml com uma pipeta descartável segundo e fechar a tampa. Vortex a solução durante 2 min, assegurando uma mistura completa. Pnossa solução em uma placa de Petri de vidro e reserve.
- Despeje 15 ml de álcool etílico 100% em uma segunda placa de Petri e reserve (certifique-se de rotular pratos).
- Usando uma nova pipeta descartável, medir 30 ml de água desionizada e uma solução para um tubo de 50 ml, deitar. Em seguida, usando uma pipeta descartável nova medida a 1875 ul de glutaraldeído e despeje solução para o mesmo tubo de 50 ml e fechar a tampa. Vortex a solução durante 2 min, assegurando uma mistura completa. Despeje a mistura na terceira placa de Petri, e reserve.
- Utilizando uma pinça, retire uma lamela de vidro 22 milímetros rodada e lave ambos os lados com 100% de mistura de etanol com uma pipeta descartável.
- Coloque lamela de vidro lavadas em 3-aminopropil-trimetoxi-silano com 30 ml de etanol a 100% e solução prato permitir a sentar-se na solução durante 5 minutos.
- Com uma pinça, retire lamela de vidro e lavar novamente com uma solução de etanol a 100% com pipeta descartável.
- Largar lamela de vidro lavado em 1875ul de glutaraldeído e 30 ml de uma mistura de água desionizada e retiradas durante 30 min.
- Após 30 min, remover lamela de vidro com uma pinça e enxaguar com água desionizada e coloque-O tecido seco / N para secar à temperatura ambiente.
- Dipping lamela Repita e movendo-se para o maior número de lamelas, conforme necessário com as mesmas soluções geradas.
- Faça lamelas hidrofóbicas pelo protocolo determinado.
- Adicionar 500 ul de tridecafluoro-1,1,2,2-tetrahydrooctyl, 100 ul de ácido acético e 19,4 ml de hexano em um tubo de 50 mL e agitar com vortex durante 2 min. Despeje solução em vidro Petri prato e reserve.
- Utilizando uma pinça limpo, tire uma lamela de vidro e cair na solução mista preparado por 2 min. Após 2 min passaram, tirar lamela de vidro com uma pinça e enxágüe com água deionizada usando uma pipeta e lugar lamela descartáveis para O tecido seco / N para secar em temperatura ambiente. Lamela loja em pratos de Petri de plástico até ser utilizado.
- Repita dipp lamelaing e movendo-se para o maior número de lamelas, conforme necessário com as mesmas soluções geradas.
- Para permitir que a matriz de colagénio para aderir a uma superfície, criar lamelas hidrófilos:
Assembléia 2. Mold
- Antes de usar moldes, usando uma pipeta descartável lave o molde com álcool etílico a 90% ao longo de um recipiente para resíduos químicos. Em seguida, colocar o molde numa placa de Petri cheia de água desionizada e permitir a sentar O / N.
- Tome molde da solução usando uma pinça e coloque em uma toalha para o ar seco antes de iniciar a montagem de molde.
- Enquanto o molde é o ar de secagem, corte as lamelas hidrofílicos quadrados em dois retângulos um pouco maiores do que 3,95 milímetros x 5,99 milímetros usando uma ferramenta de traçagem de diamante de alta precisão. Deslize cada lamela corte retângulo nas ranhuras cortadas no molde de silicone.
- Vire o molde de cabeça para baixo e aplique graxa de vácuo ao longo da parte inferior do molde de silicone com uma pipeta descartável. Em seguida, vire o molde de volta com o lado direito para cima e pressione a parte inferior do molde para as circulares tampas de vidro hidrofílicoslábio para criar uma vedação.
- Com luvas descartáveis, pegar o molde montado e coloque em um prato descartável Petri e, em seguida, em um bio-hood. Ligue lâmpada UV Bio-capa para 1 hora para esterilizar o molde antes de ocorrer a experimentação.
3. O colagénio mistura e Matrix 3D
- Antes de preparar a mistura de colagénio, mancha e preparar as células para a imagiologia de acordo com protocolos padrão 28.
- Utilizando técnicas laboratoriais padrão e protocolos 29,30, num bio-capa, e meios da mistura de células em quimioatractor um tubo de 15 ml com a concentração desejada quimioatractor. Pipeta 5 ml de solução a concentração dos media-chemoattractant célula específica em um tubo de 15 ml e mover a solução em um banho de água aquecida.
- Usando uma pipeta, 5 ml de extracto de células de apenas meios de comunicação para um segundo tubo de 15 ml e colocar num banho de água aquecida para aquecer a solução para as experiências de microscopia.
- Em um bio-hood, pipeta 30 ul de 10x tampão fosfatoed solução (PBS) para dentro do tubo de micro centrífuga. Adicionar 6 ul de 1 N hidróxido de sódio (NaOH) em mesma micro tubo de centrifugação e de vórtice durante 15 seg.
- Obter solução de cauda de rato colágeno I da geladeira e passar para a bio-capa utilizando técnicas laboratoriais padrão e protocolos 29. Verifique se o colágeno ainda está frio. Pipetar 168,3 ul de colagénio no mesmo tubo de micro centrífuga.
- Em seguida, adicionar 18 ul de amarelo-verde microesferas modificadas com carboxilato fluorescentes, utilizando uma pipeta para o mesmo tubo de micro centrífuga. Vortex do tubo de microcentrífuga com todas as soluções durante 30 seg.
- Adicionar 77,7 uL de mistura de células meio celular pretendida (cerca de 2 X 10 6 células / ml de concentração) para dentro do tubo de micro centrífuga e misture utilizando a ponta da pipeta durante 20 seg. Conforme necessário, alterar a densidade da matriz seguindo-se a mistura de colagénio costume adaptado para a adição de contas fluorescentes e mesa de viabilidade celular (Tabela 1).
- Pipetar 300 & #181; l de mistura de células-colagénio para o centro do poço (bem como 2) do conjunto de molde preparado. Coloque o molde sobre um prato de Petri descartáveis e movê-lo para uma incubadora padrão durante 20 minutos a 37 ° C com 5% de CO 2.
- Retirar sistema da incubadora e coloque de volta para bio-hood. Utilizando uma pinça, retire ambas as lamelas hidrofóbicos por aperto na parte superior de cada lamela e puxando para cima e longe do molde.
- Mover todo o sistema para a microscopia e imagem desejada para garantir os lados do molde de colagénio são ainda recta para permitir um gradiente de difusão planar.
- Com o sistema ainda sob o microscópio, utilizando uma pipeta de canal único 100 ul, adicionar 100 uL de meio celular para o poço # 1. Em seguida, usando uma pipeta de canal único 100 ul adicionar 100 ul de meios de células com a concentração desejada em quimioatractivo bem # 3.
- Imediatamente após a adição de soluções em ambos os poços, início de imagem.
4. Criação de Imagens e DifusãoModelagem
- Se se quer encontrar o coeficiente de difusão para a densidade específica de colagénio para calcular a concentração específica, seguir o protocolo abaixo:
- Siga o protocolo dado acima intitulado "Mistura de colágeno e Matrix 3D", em vez de gerar meios de células com a concentração chemoattractant desejar, faça rhodamine 5 M em um tubo de 15 ml usando cálculos e protocolos 30 padrão.
- Imagem as matrizes de colágeno 3D com um sistema confocal montado em um microscópio invertido usando um laser de argônio (488 nm) para capturar a fluorescência. Imagem a cada 2 ou 3 segundos para até 7 hr.
- Para Modelagem Difusão: Usando o modelo matemático apresentado abaixo, escrever um código de software computacional para processamento e análise com estas etapas gerais.
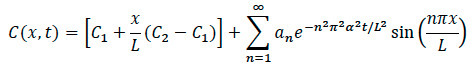
- Importar imagens para software computacional para redimensionamento e normalizando pelo inten máximosidade. Converta imagens para um mapa de cor cinza da imagem para selecionar a borda. Escolha de um eixo ao longo do centro da imagem, para a direita do centro e para a esquerda do centro.
- Usando o código de software computacional, traçar a intensidade normalizada, juntamente com o verdadeiro intensidade e a diferença entre os dois.
- A seguir, introduza os parâmetros necessários para a montagem (concentração, tempo e duração).
- Traça-se a concentração normalizada em função do tempo e o perfil de concentração ao longo do eixo-x com um ajuste polinomial para os dados.
- Calcular o coeficiente de difusão utilizando o código de software computacional.
5. As medições experimentais
- Referindo de novo a equação de difusão, reescrever a equação para encontrar a concentração específica em qualquer local dentro do sistema como mostrado abaixo.
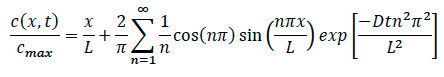
Onde:
L = Comprimento do thmatriz de colágeno e
x = localização sob investigação
D = coeficiente de difusão
T = tempo decorrido - Durante as experiências de quimiotaxia, garantir para registrar o tempo específico que a quimiocina momento foi adicionado ao sistema. Uma vez que o movimento de migração celular é encontrado, garantir a gravar confocal gravação de lapso de tempo, e observe o tempo específico e localização da borda onde imaging ocorreu.
- Durante a análise de dados, conecte o observado o tempo decorrido, a localização e o coeficiente de difusão para a célula específica na equação para encontrar a concentração normalizada específica em qualquer ponto dentro do colagénio, tanto para difusão e experiências com células.
6. Acompanhamento de migração celular Utilizando TFM
- Para controlar a migração de células usando técnicas de TFM / DVC seguir o protocolo abaixo:
- Após a adição da concentração desejada em quimioatractor bem # 3, iniciar o Imaging as matrizes de colagénio em 3D com um sistema confocal montado num micr invertidooscope para encontrar uma célula para investigar.
- Uma vez que uma célula se encontra em movimento, colocar a célula no meio do campo de vista e utilizar um motor piezoeléctrico (para a imagem no eixo z), cada imagem 1 ou 2 minutos.
- Para calcular a geração de força e deformação celular, gerar um código computacional para encontrar os deslocamentos dos grânulos de fluorescência seguindo os protocolos TFM / DVC 31.
Resultados
A capacidade do presente ensaio para avaliar com precisão a migração da célula depende de uma boa configuração do sistema. Portanto, é crucial para certificar-se de projetar o molde sistema de difusão de forma precisa e tomar muito cuidado na colocação de lamelas de ambos hidrofóbicos e hidrofílicos, como ilustrado na figura 1. Se o sistema for projetado corretamente e durante a etapa de modelagem difusão garantindo para encontrar um muito boa linha de partida linear, uma é capaz de alcan?...
Discussão
Os passos mais críticos para as experiências bem-sucedidas de difusão com ou sem células são: configurar corretamente o conjunto de molde; desenvolver a destreza manual necessário para evitar danos durante a extracção de lamelas hidrofóbicos; garantindo a encontrar uma linha muito boa de partida linear para calcular correctamente o coeficiente de difusão; corrigir cálculos experimentais de colagénio e quimioatractiva; usar corretamente do sistema de imagens de células vivas para garantir matriz não secar; ...
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors would like to acknowledge Drs. Jonathan Reichner and Angle Byrd for cell experiment insight. The National Science Foundation Graduate Research Fellowship Program (GRFP) supported this work.
Materiais
| Name | Company | Catalog Number | Comments |
| Silicone elastomer kit | Dow Corning Corp | 182 SIL ELAST KIT .5KG | a two-part misture with a 10:1 mix |
| Live cell imaging chamber | Live Cell Instrument | CM-B18-1 | CMB for 18 mm round coverslips |
| 22 mm Glass Coverslip | Fisher Scientific | NC0180281 | Neuvitro Corp. cover slip 22 mm 1.5 |
| Machined aluminum metal cube | |||
| Hobby utility knife | X-Acto | X3201 | |
| 3-(aminopropyl) trimethoxysilane | Sigma-Aldrich | 281778-5ML | |
| Glutaraldehyde | Polysciences, Inc | 00216A-10 | Glutaraldehyde, EM Grade, 8% |
| 50 ml tube | Fisher Scientific | 14-432-22 | Standard floor model and tabletop centrifuges |
| Glass Petri dish | Fisher Scientific | 08-747A | Reusable Petri Dishes: Complete (60 x 15 mm) |
| Forceps | Fisher Scientific | 22-327-379 | Fine Point Forceps |
| Cover glasses | Fisher Scientific | 12-518-105A | Rectangle; 30 x 22 mm; Thickness No. 1 |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl | Gelest | SIT8174.0 | |
| Acetic acid | Sigma-Aldrich | 320099 | Acetic acid ACS reagent, ≥99.7% |
| Hexane | Sigma-Aldrich | 296090 | anhydrous, 95% |
| Ethyl alcohol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| High-precision diamond scribing tool | Lunzer | PV-081-3 | Straight extended tip scribe, .020" (.50 mm) diameter by .200" (5.0 mm) tip length |
| Vacuum grease | Dow Corning | 14-635-5C | High-Vacuum Grease |
| 15 ml tube | Fisher Scientific | 14-959-49D | 15 ml conical centrifuge tubes with hydrophobic, biologically inert surface |
| 10x phosphate buffered solution | Fisher Scientific | BP399-500 | 1.37 M Sodium Chloride, 0.027 M Potassium Chloride, and 0.119 M Phosphate Buffer |
| 1 N sodium hydroxide | Sigma-Aldrich | 38215 | Sodium hydroxide concentrate |
| Collagen I, rat tail | BD Biosciences | 354236 | Rat tail |
| Micro centrifuge tube | Fisher Scientific | 02-681-332 | Volume: 2.0 ml; O.D. x L: 13 x 40 mm; sterile; single-wrapped |
| [header] | |||
| Carboxylate-modified microspheres | Invitrogen | F-8813 | Carboxylate-modified microspheres, 0.5 µm, yellow-green fluorescent (505/515), 2% solids |
| Rhodamine | Sigma-Aldrich | 83689 | Rhodamine B for fluorescence |
Referências
- Adzick, N. S. The Molecular and Cellular Biology of Wound Repair. Ann Surg. 225 (2), 236 (1997).
- Reddi, A. H. Bone morphogenetic proteins: an unconventional approach to isolation of first mammalian morphogens. Cytokine Growth F. R. 8 (1), 11-20 (1997).
- Coussens, , Werb, Z, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Vital-Lopez, F. G., Armaou, A., Hutnik, M., Maranas, C. D. Modeling the effect of chemotaxis on glioblastoma tumor progression. AIChE J. 57 (3), 778-792 (2011).
- Hughes-Alford, S. K., Lauffenburger, D. A. Quantitative analysis of gradient sensing: towards building predictive models of chemotaxis in cancer. Curr. Opin. Cell Biol. 24 (2), 284-291 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol Cell Bio. 10 (7), 445-457 (2009).
- Cristini, V. Morphologic Instability and Cancer Invasion. Clin. Cancer Res. 11 (19), 6772-6779 (2005).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453 (7191), 51-55 (2008).
- Parent, C. A., Devreotes, P. N. A cell's sense of direction. Science. 284 (5415), 765-770 (1999).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-466 (1962).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. J. Immunol. 115 (6), 1650-1656 (1975).
- Rosoff, W. J., McAllister, R., Esrick, M. A., Goodhill, G. J., Urbach, J. S. Generating controlled molecular gradients in 3D gels. Biotechnol. Bioeng. 91 (6), 754-759 (2005).
- Wells, A., Kassis, J., Solava, J., Turner, T., Lauffenburger, D. A. Growth factor-induced cell motility in tumor invasion. Acta Oncol. 41 (2), 124-130 (2002).
- Wilkinson, P. C. Assays of leukocyte locomotion and chemotaxis. J. Immunol. Methods. 216 (1-2), 139-153 (1998).
- Bonvin, C., Overney, J., Shieh, A. C., Dixon, J. B., Swartz, M. A. A multichamber fluidic device for 3D cultures under interstitial flow with live imaging: development, characterization, and applications. Biotechnol. Bioeng. 105 (5), 982-991 (2010).
- Noo, L. J., et al. Neutrophil chemotaxis in linear and complex gradients of interleukin-8 formed in a microfabricated device. Nat. Biotechnol. 20 (8), 826-830 (2002).
- Shao, J., et al. Integrated microfluidic chip for endothelial cells culture and analysis exposed to a pulsatile and oscillatory shear stress. Lab Chip. 9 (21), 3118-3125 (2009).
- Haessler, U., Kalinin, Y., Swartz, M. A., Wu, M. An agarose-based microfluidic platform with a gradient buffer for 3D chemotaxis studies. Biomed. Microdevices. 11 (4), 827-835 (2009).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat. Rev. Cancer. 3 (5), 362-374 (2003).
- Sixt, M., Lammermann, T. In vitro analysis of chemotactic leukocyte migration in 3D environments. Methods Mol. Biol. 769, 149-165 (2011).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. J. Cell Biol. 75 (2 Pt 1), 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. J. Cell. Sci. 99 (Pt 4), 769-775 (1991).
- Gilbert, D. L. Macromolecular diffusion through collagen membranes. Int. J. Pharm. 47 (1-3), 79-88 (1988).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys. J. 83 (3), 1650-1660 (2002).
- Weadock, K., Silver, F. H., Wolff, D. Diffusivity of 125I-calmodulin through collagen membranes: effect of source concentration and membrane swelling ratio. Biomaterials. 7 (4), 263-267 (1986).
- Erikson, A., Andersen, H. N., Naess, S. N., Sikorski, P., Davies, C. d. L. Physical and chemical modifications of collagen gels: impact on diffusion. Biopolymers. 89 (2), 135-143 (2008).
- Moghe, P. V., Nelson, R. D., Tranquillo, R. T. Cytokine-stimulated chemotaxis of human neutrophils in a 3-D conjoined fibrin gel assay. J. Immunol. Methods. 180 (2), 193-211 (1995).
- Sundd, P., et al. Live cell imaging of paxillin in rolling neutrophils by dual-color quantitative dynamic footprinting. Microcirculation. 18 (5), 361-372 (2011).
- Sanders, E. R. Aseptic Laboratory Techniques: Volume Transfers with Serological Pipettes and Micropipettors. J. Vis. Exp. (63), 2754 (2012).
- Stephenson, F. H. . Calculations for Molecular Biology and Biotechnology: A Guide to Mathematics in the Laboratory 2e. , (2010).
- Bar-Kochba, E., Toyjanova, J., Andrews, E., Kim, K., Franck, C. A Fast Iterative Digital Volume Correlation Algorithm for Large Deformations. Exp. Mech. In press, (2014).
- Shenoy, V., Rosenblatt, J. Diffusion of Macromolecules in Collagen and Hyaluronic Acid, Rigid-Rod-Flexible Polymer Composite Matrixes. Macromolecules. 28 (26), 8751-8758 (1995).
- Leddy, H., Guilak, F. Site-Specific Molecular Diffusion in Articular Cartilage Measured using Fluorescence Recovery after Photobleaching. Ann. Biomed. Eng. 31 (7), 753-760 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados