Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Planar градиентной диффузионной системы по расследованию хемотаксис в 3D коллагеновой матрице
В этой статье
Резюме
Cell migration is an important part of human development and life. In order to understand the mechanisms that can alter cell migration, we present a planar gradient diffusion system to investigate chemotaxis in a 3D collagen matrix, which allows one to overcome modern diffusion chamber limitations of existing assays.
Аннотация
The importance of cell migration can be seen through the development of human life. When cells migrate, they generate forces and transfer these forces to their surrounding area, leading to cell movement and migration. In order to understand the mechanisms that can alter and/or affect cell migration, one can study these forces. In theory, understanding the fundamental mechanisms and forces underlying cell migration holds the promise of effective approaches for treating diseases and promoting cellular transplantation. Unfortunately, modern chemotaxis chambers that have been developed are usually restricted to two dimensions (2D) and have complex diffusion gradients that make the experiment difficult to interpret. To this end, we have developed, and describe in this paper, a direct-viewing chamber for chemotaxis studies, which allows one to overcome modern chemotaxis chamber obstacles able to measure cell forces and specific concentration within the chamber in a 3D environment to study cell 3D migration. More compelling, this approach allows one to successfully model diffusion through 3D collagen matrices and calculate the coefficient of diffusion of a chemoattractant through multiple different concentrations of collagen, while keeping the system simple and user friendly for traction force microscopy (TFM) and digital volume correlation (DVC) analysis.
Введение
Предпочтительным движение клеток к градиенту концентрации, известный как хемотаксис, играет важную роль в патологических и физиологических процессов в организме. Такие примеры кожи и слизистой заживление ран 1, 2 морфогенез, воспаление 3 и 4,5 рост опухоли. Кроме того, было показано, что раковые клетки могут мигрировать через индивидуальных и коллективных стратегий клеточной миграции 6. Кроме того, диффузионные механизмы неустойчивости может вызвать разделение одного или кластерных клеток из опухолевого тела / объекта, а затем может иммигрировать в сторону источника питательных веществ и, таким образом, вторгнуться в более широкие области и тканей 7.
Кроме того, было показано, что различные механизмы миграции может быть активным в 2D и в 3D, из-за различных роли молекул адгезии 8. Таким образом, переход к физиологически соответствующих анализов в пробирке, чтобы исследовать подвижность клеток в measureablе и простой способ имеет значение для понимания движения клеток явления 9. К сожалению, сложность в анализе миграции клеток, комплексное количественно хемотаксиса, как правило, требует длительного трудоемкий способ, основанный на измерении беспристрастные подвижности клеток и транспортные явления моделей.
Прошедшие экспериментальные подходы к расследованию клеток хемотаксис включают камеру Бойдена 10 и нижней агарозы анализа 11. Тем не менее, в этих ранних анализов, миграции клеток эксперименты не следить за движением по отношению к времени. Более того, важно, градиенты концентрации, используемые для экспериментов не определены или полностью понял, а только поддержание сигнализации не более, чем несколько часов. Кроме того, в начале хемотаксис попытки камерные ограничено миграцию клеток к двум измерениям и не позволяют контролировать кинетику миграции 12. Глядя на камеру Бойдена, конечная точка анализане позволит исследователю наблюдать миграцию визуально и не может непосредственно различать хемотаксис (направленное движение) от хемокинез (случайной движения). Кроме того, несколько переменных-различия в размере пор и толщины мембраны производства камеру очень трудно легко воспроизводить и скрыл мигрантов реакцию клеток на хемокинов 13,14.
С нового понимания микрофлюидики, новые камеры и микро-устройства были исследованы в качестве инструмента для исследования клеток передвижения под внедренных условий потока или хемотаксис 15,16. В этих новых устройств, новые показатели клеток были введены и исследованы, как влияние напряжения сдвига на клетки 17,18. К сожалению, прошлые и нынешние микрофлюидных хемотаксис камеры ограничены исследования миграции клеток к 2D-субстратов важного неудачу, поскольку многие биологические процессы, в том числе вторжение опухолевых клеток и метастазов, и имиспольнил миграция клеток, привлекать 3D миграции.
Прямого наблюдения камеры-когда раствор хемоаттрактантной находится в контакте с 3D-гель, содержащий клетки были также также сообщил 19,20. Эти камеры имеют два отсека, один, содержащий хемоаттрактанта и один, содержащий клетки, соединены рядом друг с другом по горизонтали 21 или 22 концентрических колец. Эти системы в правильном направлении, но не держать систему хемотаксис в течение длительного периода времени.
Кроме того, исследователи также исследовали диффузии через мембраны коллагена в диализных клеток, а также диффузии молекул-меток через образцов коллагена подвергают гидростатическому давлению 23-25. Некоторые диффузии эксперименты в коллагеновых гелях полагаться на физических и химических модификаций геля с использованием магнитных полей и химических включение 26. Популярный метод для моделирования диффузии в Коллагенный ткани зависит от флуоресценции визуализации непрерывного точки фотовыцветания. Этот метод показал анизотропию коэффициентов диффузии макромолекул в ориентированных коллагеновых тканей. Тем не менее, фотообесцвечивание был использован в суставном хряще, а не коллагеновые матрицы. В то время как аналогичный, необходимые эксперименты моделирования должна осуществляться через специально понимания коэффициент диффузии коллагеновых гелей. Что еще более важно, эти системы не используют метод измерения поколение клеток силы.
К сожалению, большинство систем, кажется, не хватает одного или двух ключевых элементов для идеальной системы: позволяет отслеживания клетки, диффузионного градиента взаимопонимании с хемотаксических фактора через матрицу, относительно простого набора с легкостью воспроизводимости, минимизации межклеточных взаимодействий, а возможность измерения размерных единиц для количественной (т.е. скорость, сила, определенной концентрации). Moghe др. 27 предложил систему, которая выполнила большинство из этих требований, в которой клетки сначала диспергировали в течение всего гель, а не сконцентрированы на поверхности фильтра, но было трудно измерить силы, что клетка генерирует.
Для этой цели, мы представляем систему плоской градиент диффузии для расследования хемотаксис в коллагеновой матрице 3D, которая позволяет преодолеть ограничения современных диффузионной камеры существующих анализов, который основан на покадровой микроскопии в сочетании с методами анализа изображений для измерения клетки силы в 3D-среде. Этот протокол обеспечивает простой, но инновационный способ создания простого 3D диффузионной камеры, которые могут быть использованы для исследования 3D хемотаксис в различных клетках.
протокол
1. 3D дизайн формы и запчастей
- Форма
- Перед началом работы, получить силиконовой эластомерной комплект, живой камеры изображений клеток, 22 мм стекло покровное, и обработанного алюминия металла куб с размерами 10,07 мм х 3,95 мм х 5,99 мм. Подготовьте живую камеру изображения клеток для литья путем размещения покровное в нижней держателя и монтаж остальные камеры по указанию поставщика.
- Далее, с помощью щипцов, поместите обработанную алюминиевой металлической куб в середине живого изображения клеток в камере корпуса и на верхней части покровного стекла, а затем отложите в сторону.
- Смешайте силиконовые эластомеры решения в соответствии с протоколом производителя, чтобы 5 мл эластомера.
- Использование одноразового шпателя лаборатории, залить силиконового эластомера решение в настройки живого изображения камеры клеток и обеспечить, чтобы не двигаться размещены обработанной алюминиевой металлической куб. Установите систему на лабораторном столе, в безопасном месте O / N для отверждения.
- Следующим утром, разобратьживая камера изображений клеток, как это рекомендовано производителем и вытащить форму с помощью пинцета. Использование щипцов, чтобы аккуратно извлечь обработанную алюминиевой металлической куб из пресс-формы. Перейти к раковине и смойте форму с деионизированной водой. Поместите форму на бумажное полотенце, чтобы высохнуть.
- После высыхания, используя хобби нож, вырезать прорези через форму, разнесены 2,34 мм друг от продольного конца, внутри силиконовые формы. Убедитесь, что плесень остается в сухом и безопасном месте, пока вы не готовы построить систему для эксперимента.
- Гидрофильные и гидрофобные покровные стекла Приготовление
- Чтобы разрешить коллагеновой матрицы, чтобы прилипать к поверхности, создают гидрофильные покровные:
- Пипеткой, отмерить 150 мкл 3-аминопропил-триметоксисилана и залить раствор в 50 мл трубки. Добавить 30 мл 100% этанола в 50 мл пробирку со вторым одноразовым пипетки и закрыть крышку. Vortex решение в течение 2 мин, обеспечивая полное перемешивание. Рнаше решение в стеклянную чашку Петри и отложите в сторону.
- Налейте 15 мл 100% этилового спирта на второй чашке Петри и отложите в сторону (убедитесь, что на этикетке блюда).
- Используя новую Пипеткой отмерьте 30 мл деионизированной воды и вылить раствор в 50 мл трубки. Далее, используя новый одноразовый пипетки меру из 1875 мкл глутаральдегида и залить раствор в той же трубке 50 мл и закройте крышку. Vortex решение в течение 2 мин, обеспечивая полное перемешивание. Вылейте смесь в третьем чашке Петри, и отложите в сторону.
- Использование щипцов, возьмите одну 22 мм круглые покровного стекла и промойте обе стороны с 100% этанол, используя одноразовый пипетки.
- Поместите промытый покровным стеклом в 3-аминопропил-триметоксисилан 30 мл 100% раствора этанола, блюдо и позволяют сидеть в растворе в течение 5 мин.
- С пинцетом, вынуть стекла покровное и снова промыть с 100% раствором этанола с одноразовой пипетки.
- Оставьте промыть стекло покровное в 1875мкл глутарового альдегида и 30 мл деионизированной воды и смеси отложить на 30 мин.
- Через 30 мин, удалить стекло покровное щипцами и промыть дистиллированной водой и поместите на сухой ткани O / N, чтобы высохнуть при комнатной температуре.
- Повторите покровное погружения и перемещения на столько покровные при необходимости с теми же генерируемых решений.
- Сделать гидрофобные покровные к данному протоколу.
- Добавить 500 мкл tridecafluoro-1,1,2,2-tetrahydrooctyl 100 мкл уксусной кислоты и 19,4 мл гексана в 50 мл пробирку и вихря в течение 2 мин. Налейте раствор в стеклянную чашку Петри и отложите в сторону.
- Использование чистых щипцов, возьмите одну покровного стекла и опустите в подготовленную смешанного раствора в течение 2 мин. Через 2 мин прошло, вынуть стекла покровное щипцами и промыть деионизированной водой, используя одноразовый пипетки и место покровное на сухой ткани O / N, чтобы высохнуть при комнатной температуре. Магазин покровное в пластиковых чашках Петри, пока не используется.
- Повторите покровное ОРДПи падающие на столько покровные при необходимости с теми же генерируемых решений.
- Чтобы разрешить коллагеновой матрицы, чтобы прилипать к поверхности, создают гидрофильные покровные:
2. Плесень Ассамблея
- Перед использованием пресс-форм, Пипеткой промыть форму с 90% этиловым спиртом в течение химической контейнер для отходов. Далее, поместите форму в чашку Петри с деионизированной водой и дайте сесть O / N.
- Возьмите форму из раствора с помощью щипцов и место на полотенце чтобы высохнуть на воздухе, прежде чем начать сборку пресс-формы.
- В то время как плесень воздушной сушки, сократить квадратных гидрофильные покровные в двух прямоугольников чуть больше, чем 3,95 мм х 5,99 мм с использованием высокоточной алмазной-вающих инструмент. Слайд каждого разреза прямоугольник покровное в прорези, вырезанных в силиконовые формы.
- Флип форму вверх дном и применять вакуумной смазки вдоль нижней части силиконовые формы Пипеткой. Далее, переверните форму обратно правой стороной вверх и нажмите на дно формы на круговых гидрофильных стеклянных крышекгубы, чтобы создать уплотнение.
- С одноразовых перчаток, забрать собранную форму и поместить в одноразовый чашку Петри и затем в био-капюшон. Включите УФ Био-капюшоном лампы в течение 1 часа, чтобы стерилизовать почву до появления экспериментов.
3. Коллаген смесь и 3D Matrix
- Перед приготовлением смеси коллагена, пятно и подготовить клеток для формирования изображения в соответствии со стандартными протоколами 28.
- Используя стандартные лабораторные методы и протоколы 29,30, в био-капюшон, смешать клеточную среду и хемоаттрактант в 15 мл трубки к нужной концентрации хемоаттрактанта. Внесите 5 мл конкретной медиа-хемоаттрактант решения концентрации клеток в 15 мл пробирку и переместить раствор в ванну с подогревом воды.
- С помощью пипетки, экстракт 5 мл всего клеточных сред во второй трубке 15 мл и поместите его в баню, нагретую воды, чтобы нагреть решение для микроскопии экспериментов.
- В био-капюшон, пипетка 30 мкл фосфатного буфера 10xред раствор (PBS), в микро центрифужную пробирку. Добавить 6 мкл 1 н гидроксида натрия (NaOH) в той же микро центрифужную пробирку и вихря в течение 15 сек.
- Получить коллагена I крысиный хвост решение из холодильника и перейти к био-капюшон с использованием стандартных лабораторных методик и протоколов 29. Убедитесь, коллаген-прежнему холодно. Внесите 168,3 мкл коллагена в то же микро трубки центрифуги.
- Затем добавьте 18 мкл желто-зеленых флуоресцентных карбоксилатных модифицированный микросфер с помощью пипетки к тому же микро трубки центрифуги. Вихревой микро центрифужную пробирку со всеми растворов в течение 30 сек.
- Добавить 77,7 мкл смеси нужного сотового СМИ клеток (примерно 2 х 10 6 клеток / мл концентрации) в микро трубки центрифуги и смешать с помощью пипетки на 20 сек. При необходимости изменить матрицы плотности, следуя пользовательских коллагена смесь, предназначенную для добавления флуоресцентные шарики и жизнеспособности клеток таблице (Таблица 1).
- Внесите 300 & #181; л смеси коллагена клеток в центре хорошо (а # 2) подготовленного сборки пресс-формы. Поместите форму на одноразовую чашку Петри и переместить его в стандартном инкубаторе в течение 20 мин при 37 ° С с 5% СО 2.
- Снять систему из инкубатора и место обратно в био-капюшон. Использование щипцов, снимите обе крышки гидрофобные промахи, зажимая на верхней части каждой покровное и потянув вверх и в сторону от плесени.
- Перемещение всей системы до нужного микроскопии и изображения, чтобы обеспечить коллагена плесени стороны все еще прямо, чтобы обеспечить плоской диффузии градиента.
- С помощью системы все еще под микроскопом, с использованием 100 мкл одноканальный пипетки, добавьте 100 мкл клеточной среды в скважине № 1. Далее, используя 100 мкл одноканальной пипетки добавить 100 мкл клеточной среде с требуемой концентрации хемоаттрактанта в хорошо # 3.
- Сразу после добавления решений в обеих скважинах, начать визуализацию.
4. изображений и диффузияМоделирование
- Если кто-то хочет найти коэффициент диффузии удельной плотности коллагена, чтобы рассчитать конкретную концентрацию, выполните следующие протокол:
- Следуйте данный протокол выше названное «Коллаген смесь и 3D Матрица", вместо генерации клеток носитель с нужной концентрации хемоаттрактанта, сделать 5 мкм родамин в 15 мл пробирку с использованием стандартных протоколов и расчеты 30.
- Изображение 3D-коллагеновые матрицы с конфокальной системы установлены на инвертированный микроскоп с использованием аргонового лазера (488 нм), чтобы захватить флуоресценции. Изображение каждые 2 или 3 сек до 7 ч.
- Для диффузии моделирования: Использование математической модели, показанной ниже, написать программный код вычислительной для обработки и анализа с этих общих шагов.
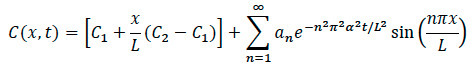
- Импорт изображений в вычислительной программного обеспечения для изменения масштаба и нормализации по максимальному Intenплотность. Преобразование изображения в серой цветовой карте изображения, чтобы выбрать края. Выбор ось по центру изображения, справа от центра и слева от центра.
- Использование вычислительной программного кода, участок нормированной интенсивности, наряду с истинной интенсивности и разность между ними.
- Затем введите параметры, необходимые для монтажа (концентрации, времени и длины).
- Участок нормированной концентрации от времени и профиля концентрации через оси х с полиномиальной подгонки к данным.
- Рассчитать коэффициент диффузии, используя вычислительную программного кода.
5. Экспериментальные измерения
- Возвращаясь к уравнению диффузии, перепишем уравнение, чтобы найти конкретный концентрации в любом месте в системе, как показано на ниже.
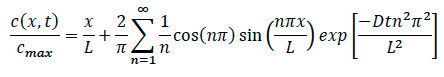
Где:
L = Длина гое коллагеновой матрицы
х = место под следствием
D = коэффициент диффузии
т = прошедшее время - Во экспериментах хемотаксиса, обеспечить, чтобы записать определенное время, что в тот момент, хемокинов был добавлен в систему. После того, как движение миграция клеток находится, обеспечить, чтобы записать конфокальной покадровой записи, и обратите внимание на определенное время и место от края, где произошла изображений.
- Во время анализа данных, подключите отметил, прошедшее время, место и коэффициент диффузии для конкретной ячейки в уравнение, чтобы найти конкретную концентрацию нормированный в любой точке в пределах коллагена и для диффузии и клеточных экспериментов.
6. Отслеживание миграции клеток Использование TFM
- Чтобы отслеживать миграцию клеток, используя методы ПМФ / DVC следовать протоколу ниже:
- После добавления требуемой концентрации хемокина в хорошо # 3, начать визуализации 3D матрицы коллагена с конфокальной системы, установленной на перевернутой MICRoscope найти сотовый расследование.
- После того, как движется ячейка найдена, разместить клетку в середине поля зрения и использовать пьезоэлектрический двигатель (к изображению в оси), образ каждый 1 или 2 мин.
- Для расчета поколения и деформации клеток силы, генерировать код вычислительную найти смещения флуоресценции бисером следующих протоколов ПМФ / DVC 31.
Результаты
Способность этого теста, чтобы точно оценить миграцию клетки опирается на хорошей настройки системы. Поэтому, очень важно для убедитесь, что дизайн системы диффузии формы точно и проявлять большую осторожность в размещении и гидрофобные и гидрофильные покровные, как показано на р...
Обсуждение
Наиболее важные шаги для успешных экспериментов диффузии с или без клеток: правильно настройке сборки пресс-формы; развитие необходимой ловкость, чтобы предотвратить повреждение во время извлечения гидрофобных покровные; обеспечения, чтобы найти очень хорошую линейную стартовую лин...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The authors would like to acknowledge Drs. Jonathan Reichner and Angle Byrd for cell experiment insight. The National Science Foundation Graduate Research Fellowship Program (GRFP) supported this work.
Материалы
| Name | Company | Catalog Number | Comments |
| Silicone elastomer kit | Dow Corning Corp | 182 SIL ELAST KIT .5KG | a two-part misture with a 10:1 mix |
| Live cell imaging chamber | Live Cell Instrument | CM-B18-1 | CMB for 18 mm round coverslips |
| 22 mm Glass Coverslip | Fisher Scientific | NC0180281 | Neuvitro Corp. cover slip 22 mm 1.5 |
| Machined aluminum metal cube | |||
| Hobby utility knife | X-Acto | X3201 | |
| 3-(aminopropyl) trimethoxysilane | Sigma-Aldrich | 281778-5ML | |
| Glutaraldehyde | Polysciences, Inc | 00216A-10 | Glutaraldehyde, EM Grade, 8% |
| 50 ml tube | Fisher Scientific | 14-432-22 | Standard floor model and tabletop centrifuges |
| Glass Petri dish | Fisher Scientific | 08-747A | Reusable Petri Dishes: Complete (60 x 15 mm) |
| Forceps | Fisher Scientific | 22-327-379 | Fine Point Forceps |
| Cover glasses | Fisher Scientific | 12-518-105A | Rectangle; 30 x 22 mm; Thickness No. 1 |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl | Gelest | SIT8174.0 | |
| Acetic acid | Sigma-Aldrich | 320099 | Acetic acid ACS reagent, ≥99.7% |
| Hexane | Sigma-Aldrich | 296090 | anhydrous, 95% |
| Ethyl alcohol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| High-precision diamond scribing tool | Lunzer | PV-081-3 | Straight extended tip scribe, .020" (.50 mm) diameter by .200" (5.0 mm) tip length |
| Vacuum grease | Dow Corning | 14-635-5C | High-Vacuum Grease |
| 15 ml tube | Fisher Scientific | 14-959-49D | 15 ml conical centrifuge tubes with hydrophobic, biologically inert surface |
| 10x phosphate buffered solution | Fisher Scientific | BP399-500 | 1.37 M Sodium Chloride, 0.027 M Potassium Chloride, and 0.119 M Phosphate Buffer |
| 1 N sodium hydroxide | Sigma-Aldrich | 38215 | Sodium hydroxide concentrate |
| Collagen I, rat tail | BD Biosciences | 354236 | Rat tail |
| Micro centrifuge tube | Fisher Scientific | 02-681-332 | Volume: 2.0 ml; O.D. x L: 13 x 40 mm; sterile; single-wrapped |
| [header] | |||
| Carboxylate-modified microspheres | Invitrogen | F-8813 | Carboxylate-modified microspheres, 0.5 µm, yellow-green fluorescent (505/515), 2% solids |
| Rhodamine | Sigma-Aldrich | 83689 | Rhodamine B for fluorescence |
Ссылки
- Adzick, N. S. The Molecular and Cellular Biology of Wound Repair. Ann Surg. 225 (2), 236 (1997).
- Reddi, A. H. Bone morphogenetic proteins: an unconventional approach to isolation of first mammalian morphogens. Cytokine Growth F. R. 8 (1), 11-20 (1997).
- Coussens, , Werb, Z, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Vital-Lopez, F. G., Armaou, A., Hutnik, M., Maranas, C. D. Modeling the effect of chemotaxis on glioblastoma tumor progression. AIChE J. 57 (3), 778-792 (2011).
- Hughes-Alford, S. K., Lauffenburger, D. A. Quantitative analysis of gradient sensing: towards building predictive models of chemotaxis in cancer. Curr. Opin. Cell Biol. 24 (2), 284-291 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol Cell Bio. 10 (7), 445-457 (2009).
- Cristini, V. Morphologic Instability and Cancer Invasion. Clin. Cancer Res. 11 (19), 6772-6779 (2005).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453 (7191), 51-55 (2008).
- Parent, C. A., Devreotes, P. N. A cell's sense of direction. Science. 284 (5415), 765-770 (1999).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-466 (1962).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. J. Immunol. 115 (6), 1650-1656 (1975).
- Rosoff, W. J., McAllister, R., Esrick, M. A., Goodhill, G. J., Urbach, J. S. Generating controlled molecular gradients in 3D gels. Biotechnol. Bioeng. 91 (6), 754-759 (2005).
- Wells, A., Kassis, J., Solava, J., Turner, T., Lauffenburger, D. A. Growth factor-induced cell motility in tumor invasion. Acta Oncol. 41 (2), 124-130 (2002).
- Wilkinson, P. C. Assays of leukocyte locomotion and chemotaxis. J. Immunol. Methods. 216 (1-2), 139-153 (1998).
- Bonvin, C., Overney, J., Shieh, A. C., Dixon, J. B., Swartz, M. A. A multichamber fluidic device for 3D cultures under interstitial flow with live imaging: development, characterization, and applications. Biotechnol. Bioeng. 105 (5), 982-991 (2010).
- Noo, L. J., et al. Neutrophil chemotaxis in linear and complex gradients of interleukin-8 formed in a microfabricated device. Nat. Biotechnol. 20 (8), 826-830 (2002).
- Shao, J., et al. Integrated microfluidic chip for endothelial cells culture and analysis exposed to a pulsatile and oscillatory shear stress. Lab Chip. 9 (21), 3118-3125 (2009).
- Haessler, U., Kalinin, Y., Swartz, M. A., Wu, M. An agarose-based microfluidic platform with a gradient buffer for 3D chemotaxis studies. Biomed. Microdevices. 11 (4), 827-835 (2009).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat. Rev. Cancer. 3 (5), 362-374 (2003).
- Sixt, M., Lammermann, T. In vitro analysis of chemotactic leukocyte migration in 3D environments. Methods Mol. Biol. 769, 149-165 (2011).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. J. Cell Biol. 75 (2 Pt 1), 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. J. Cell. Sci. 99 (Pt 4), 769-775 (1991).
- Gilbert, D. L. Macromolecular diffusion through collagen membranes. Int. J. Pharm. 47 (1-3), 79-88 (1988).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys. J. 83 (3), 1650-1660 (2002).
- Weadock, K., Silver, F. H., Wolff, D. Diffusivity of 125I-calmodulin through collagen membranes: effect of source concentration and membrane swelling ratio. Biomaterials. 7 (4), 263-267 (1986).
- Erikson, A., Andersen, H. N., Naess, S. N., Sikorski, P., Davies, C. d. L. Physical and chemical modifications of collagen gels: impact on diffusion. Biopolymers. 89 (2), 135-143 (2008).
- Moghe, P. V., Nelson, R. D., Tranquillo, R. T. Cytokine-stimulated chemotaxis of human neutrophils in a 3-D conjoined fibrin gel assay. J. Immunol. Methods. 180 (2), 193-211 (1995).
- Sundd, P., et al. Live cell imaging of paxillin in rolling neutrophils by dual-color quantitative dynamic footprinting. Microcirculation. 18 (5), 361-372 (2011).
- Sanders, E. R. Aseptic Laboratory Techniques: Volume Transfers with Serological Pipettes and Micropipettors. J. Vis. Exp. (63), 2754 (2012).
- Stephenson, F. H. . Calculations for Molecular Biology and Biotechnology: A Guide to Mathematics in the Laboratory 2e. , (2010).
- Bar-Kochba, E., Toyjanova, J., Andrews, E., Kim, K., Franck, C. A Fast Iterative Digital Volume Correlation Algorithm for Large Deformations. Exp. Mech. In press, (2014).
- Shenoy, V., Rosenblatt, J. Diffusion of Macromolecules in Collagen and Hyaluronic Acid, Rigid-Rod-Flexible Polymer Composite Matrixes. Macromolecules. 28 (26), 8751-8758 (1995).
- Leddy, H., Guilak, F. Site-Specific Molecular Diffusion in Articular Cartilage Measured using Fluorescence Recovery after Photobleaching. Ann. Biomed. Eng. 31 (7), 753-760 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены