É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Drug Delivery intraluminal para o Rato Fístula Arteriovenosa endotélio
Neste Artigo
Resumo
After puncturing the aorta through the inferior vena cava (IVC) to create an aorto-caval fistula in the mouse, solution containing a drug is infused into the IVC via the same needle, followed by incubation. This method enables more robust drug delivery to the venous endothelium compared to the external route.
Resumo
A entrega de agentes terapêuticos para melhorar a fístula arteriovenosa (FAV) de maturação pode ser administrado quer por via intraluminal ou externos. O modelo murino FAV simples foi combinada com a administração intraluminal de solução de fármaco para o endotélio venoso ao mesmo tempo que a criação de fístula. são discutidos aspectos técnicos deste modelo. Sob anestesia geral, uma incisão é feita abdominal e a veia cava inferior e aorta (IVC) estão expostos. A aorta infra-renal e IVC são dissecados para fixação. Após o pinçamento proximal e distal, o local da punção é exposta e uma agulha G 25 é usado para perfurar ambas as paredes da aorta e para o IVC. Imediatamente após a punção, um gene repórter que expressa vector viral foi infundido na VCI através da mesma agulha, seguido por 15 min de incubação. O método de administração intraluminal activado de entrega de genes virais mais robusto ao endotélio venoso em comparação com a administração por via externa. este novel método de entrega vai facilitar estudos que explorar o papel do endotélio em FAV maturação e permitem uma entrega de drogas intraluminal no momento da operação cirúrgica.
Introdução
A fístula aortovenous murino (FAV) modelo de punção entre a aorta ea veia cava inferior (VCI) é agora uma técnica estabelecida. 1 Nesse modelo, ambas as paredes da aorta infra-renal são perfuradas com uma agulha G 25, sair para o adjacente infra-renal, veia cava; o orifício de entrada da aorta anterior é reparado com compressão simples, e não necessita de reparação de sutura. Serial exame de acompanhamento por ultra-som Doppler de alta resolução e análise histológica mostra a AVF ter uma fase de maturação e, em seguida, uma fase falhando, recapitulando a fisiopatologia conhecido da AVF humana. 2
Para explorar mecanismos que modulam FAV maturação, são necessários métodos melhorados para a administração de agentes terapêuticos para o amadurecimento endotélio FAV. A entrega de agentes terapêuticos para navios podem ser tanto via entrega endovascular para o lúmen, ou através de entrega externa à adventícia. Um exemplo de entrega externa é o commumente usado aplicação adventícia de gel Pluronic. Este copolímero é termo-reversível e transformado de líquido para gel sólido quando aquecida à temperatura corporal. Entrega da droga sustentada estudos anteriores mostraram é conseguido quando a droga misturada em gel 'Pluronic' é aplicada por via tópica in vivo. 3,4 aplicação adventícia de vectores virais ou ARNsi com gel 'Pluronic' tem sido relatada como sendo eficaz como um sistema de entrega perivascular. 5,6 Nós têm também relataram que o tratamento de veias safenas humanas explantados com estimulação adventícia por peptídeos resultou na fosforilação de proteínas receptoras endoteliais. 7
Por outro lado, os investigadores têm usado também entrega intraluminal de ambos os vectores virais e não virais em canino e coelho 8-10 11,12 modelos de enxertos de veia. Nesses relatórios, a transferência de genes foi realizada ex vivo após veia colheita. Eslami et ai. Relataram gene virai endovascular entregary a carótida veias in situ sem criar um bypass. 13 Gloverman et al. entrega intraluminal e adventícia relatado de DNA nu em ratos femoral fístulas veia epigástrica artéria-superficial. 14 O grupo Mayo relataram entrega da droga adventícia em fístulas rato artéria carótida-jugular. 15,16 No entanto, estes modelos previamente relatados necessária uma anastomose suturada para criar FAV. Neste relatório, a entrega de drogas intraluminal com a criação AVF simultânea em ratos é descrito, utilizando um modelo de sutura-less da criação FAV. Usando este modelo de murino modificado FAV um método simples para a entrega de drogas intraluminal para o membro da fístula venosa pode ser realizada.
Protocolo
Aprovação pela Comissão Cuidado e Uso Institucional animal apropriado é obtido.
1. A anestesia e procedimentos pré-operatórios
- Anestesiar ratos machos C57BL / 6 de gelo, com idades entre 8 semanas, com isoflurano vaporizado 3% e 0,8 L / min de oxigénio administrado em uma câmara de indução acrílico.
- Confirmar anestesia adequada pela falta de reação a pitada dedo do pé. Posicione o supino rato na mesa de operação e coloque uma máscara de silicone para entregar vaporizado 2-3% de isoflurano por inalação contínua.
- Remover pêlos ventral do pescoço até inferior do abdome utilizando um creme depilatório químico.
- Realizar o exame de ultra-som Doppler antes da cirurgia AVF para gravar características basais dos arterial e fluxo venoso e diâmetro do vaso para as áreas de interesse. 1,2
- Anexar uma seringa de 1 ml a uma agulha G 25 e carregar a seringa com o fármaco desejado. Dobrar a agulha a um ângulo de 60 graus aproximadamente 4 mm a partir da necessidadele ponta. Segure a 25 G agulha com um suporte de agulha curva.
2. Procedimentos Operativos
- Prepare o local da incisão com um anti-séptico tópico e aplicar um campo cirúrgico. Use luvas e instrumentos esterilizados para manter uma técnica asséptica durante toda a cirurgia.
- Fazer uma incisão na linha média abdominal com um bisturi que se estende desde o nível da borda inferior do fígado para um pouco acima do púbis.
- Insira um afastador e eviscerar todas as entranhas da cavidade abdominal para o lado direito. Enrole as entranhas em gaze embebida em soro fisiológico. Dissecar a membrana que liga o retro-peritônio e inferior do cólon para obter visão completa da aorta e CIV.
- Dissecar a aorta infra-renal e IVC dos tecidos adjacentes, preparando-se para proximal e fixação distal.
- Coloque um único clipe de microcirurgia através tanto da aorta proximal e proximal VCI no nível imediatamente abaixo da veia renal esquerda. Coloque um segundo clipe microcirurgia através tanto o daorta istal e da VCI distal.
- Agarrar o tecido conjuntivo em torno da aorta e medialmente rodar de modo a que a superfície dorsal da aorta é exposta ligeiramente para o punção arterial, tal como descrito anteriormente. 1
- expor rapidamente o local da punção. O local da punção será no aspecto caudal dos vasos, cerca de três quartos da distância da veia renal esquerda para a bifurcação da aorta. Mantendo a aorta numa posição rodada com a mão esquerda, dissecar a margem lateral esquerda da aorta de modo que há uma ampla exposição para permitir a perfuração com a mão direita. Tenha cuidado para não dissecar entre a aorta ea veia cava inferior.
- Manter a aorta numa posição rodada e punção na aorta através de para a VCI usando uma agulha G 25 com uma solução contendo a droga ligada seringa de 1 ml. (Figura 1A)
- Infundir a solução do fármaco (100 - 200 mL) utilizando a mão esquerda. A agulha pode ser visto através da dilatada e finaParede da VCI quando a solução de fármaco transparente desloca o sangue venoso para fora da VCI (Figura 1B, C). Permanecem ainda e manter a agulha na posição, durante 15 min.
- Remova o clipe microcirurgia distal de-braçadeira somente a aorta distal e da VCI distal.
- Remova a agulha e, em seguida, cobrir o local da punção da aorta, puxando o tecido retro-peritoneal adjacente.
- Remova o clipe microcirurgia proximal de-prender a aorta proximal e proximal IVC. Upon de-fixação, o sangue arterial é observado que flui para o IVC, em vez de fluxo sanguíneo venoso escuro. Mantenha cobrindo o buraco da punção por 1 min.
- Após a confirmação da hemostasia por observação durante 30 segundos sem compressão, retorno dos intestinos em sua posição natural e fechar o abdómen com uma sutura contínua de acordo com o seu protocolo de animais aprovado.
Procedimentos 3. pós-operatórias
- Após o fechamento do abdômen, interromper o anesthesia. Aplicar cuidados pós-operatórios, incluindo analgesia e cuidados de feridas, de acordo com as instruções recomendadas pelo Comitê de Cuidado e Uso Institucional Animal. Para analgesia usamos buprenorfina a 0,1 mg / kg intrasmuscularly cada 12 h durante 24 horas seguindo os procedimentos cirúrgicos.
- No primeiro dia após a operação, a realização do Doppler ultra-som para confirmar a permeabilidade da FAV. Além disso, medir a outra embarcação e características de fluxo em série e comparar para mudanças de valores basais pré-operatórios 1,2.
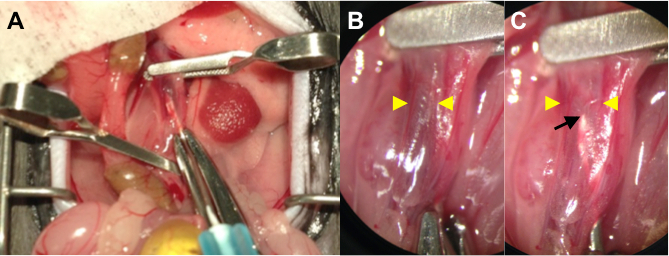
Figura 1. (A) Mostrando intraluminal entrega durante a cirurgia AVF operativo Foto. Prender o proximal e distai da aorta, bem como a VCI por aplicação de pinças de microcirurgia. Punção na aorta através de para a VCI usando uma agulha de 25 G com uma solução de fármaco que contém a seringa ligados. (B) Um Higseu retrato de energia (uma ampliação de 4X) do puncionado IVC antes da infusão. A ponta da agulha é obscurecida por sangue venoso de cor escura. Setas amarelas indicam o diâmetro de parede a parede da VCI. (C) um poder superior de imagem (uma ampliação de 4X) do puncionado IVC após a infusão. A ponta da agulha (seta preta) pode ser vista através da parede da VCI suavemente distendido e finas (pontas de seta amarelo) como a solução de um fármaco transparente desloca o sangue venoso.
Resultados
Numa série de 33 ratinhos, a sobrevivência, no primeiro dia pós-operatório foi de 97,0%; FAV permeabilidade, tal como determinado por ultra-sons, foi de 84,9%.
Gene eficiência de transdução desta via de administração endovascular com o percurso externa tradicional foi comparada. Para a administração intraluminal (ILD), imediatamente após a punção, a 200 ul de adenovírus-GFP (GFP-Ad) vetor solução (1 × 10
Discussão
Esta modificação do modelo murino incorpora FAV de administração de fármaco intraluminal ao endotélio venoso no momento da criação FAV. Uma FAV foi criado através de punção na aorta infra-renal com uma agulha G 25, e estendendo-se o furo através da parede aórtica em frente para a VCI, seguido de injecção de solução de fármaco através da mesma agulha. A solução é mantida intra-cava, isto é., No membro de FAV venosa, até que de-aperto. O que distingue este modelo a partir de outros modelos...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported in part by the United States Department of Veterans Affairs Biomedical Laboratory Research and Development Program Merit Review Award I01-BX002336, the National Institute of Health grant R56-HL095498, as well as with the resources and the use of facilities at the VA Connecticut Healthcare System, West Haven, CT.
Materiais
| Name | Company | Catalog Number | Comments |
| Pluronic F-127 | Sigma-Aldrich | P2443-250G | Used as 30% solution in d-water |
| GFP antibody | NOVUS BIOLOGICALS INC | NB100-1770 | |
| Ad-CMV-GFP | VECTOR BIOLABS | 1060 | |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | 2F7122 | |
| BD PrecisionGlide Needle 25 G x 5/8 | BD | 305122 | |
| BD 1 ml Syringe Tuberculin Slip Tip | BD | 309659 | |
| Scalpel | Surgical Design Inc | 22079707 | |
| 6-0 ETHILON P-1 11 mm 3/8c Reverse Cutting | ETHICON INC | 697G | |
| Vevo 770 ultrasound machine | Visualsonics | 20 - 60 Mhz scan head; RMV-704 | |
| Vascular clamp | Roboz Surgical Instrument Co. | RS-5424 | |
| Clamp applying forceps | Roboz Surgical Instrument Co. | RS-5410 |
Referências
- Yamamoto, K., Li, X., Shu, C., Miyata, T., Dardik, A. Technical Aspects of the Mouse Aortocaval Fistula. J. Vis. Exp. (77), e50449 (2013).
- Yamamoto, K., et al. The mouse aortocaval fistula recapitulates human arteriovenous fistula maturation. Am. J. Physiol.: Heart Circ. Physiol. 305 (12), H1718-H1725 (2013).
- Escobar-Chávez, J. J., Lòpez-Cervantes, M., Naïk, A., Kalia, Y. N., Quintanar-Guerrero, D., Ganem-Quintanar, A. Applications of thermo-reversible pluronic F-127 gels in pharmaceutical formulations. J. Pharm. Pharm. Sci. 9 (3), 339-358 (2006).
- Almeida, H., Amaral, M. H., Lobão, P., Lobo, J. M. S. Pluronic® F-127 and Pluronic Lecithin Organogel (PLO): main features and their applications in topical and transdermal administration of drugs. J. Pharm. Pharm. Sci. 15 (4), 592-605 (2012).
- Karper, J. C., et al. Toll-like receptor 4 is involved in human and mouse vein graft remodeling, and local gene silencing reduces vein graft disease in hypercholesterolemic APOE*3Leiden mice. Arterioscler., Thromb., Vasc. Biol. 31 (5), 1033-1040 (2011).
- Redmond, E. M., Hamm, K., Cullen, J. P., Hatch, E., Cahill, P. A., Morrow, D. Inhibition of patched-1 prevents injury-induced neointimal hyperplasia. Arterioscler., Thromb., Vasc. Biol. 33 (8), 1960-1964 (2013).
- Wong, D. J., et al. Ephrin type-B receptor 4 activation reduces neointimal hyperplasia in human saphenous vein in vitro. J. Vasc. Surg. , (2014).
- Matsumoto, T., et al. Hemagglutinating virus of Japan-liposome-mediated gene transfer of endothelial cell nitric oxide synthase inhibits intimal hyperplasia of canine vein grafts under conditions of poor runoff. J. Vasc. Surg. 27 (1), 135-144 (1998).
- Petrofski, J. A., et al. Gene delivery to aortocoronary saphenous vein grafts in a large animal model of intimal hyperplasia. J. Thorac. Cardiovasc. Surg. 127 (1), 27-33 (2004).
- Hata, J. A., et al. Modulation of phosphatidylinositol 3-kinase signaling reduces intimal hyperplasia in aortocoronary saphenous vein grafts. J. Thorac. Cardiovasc. Surg. 129 (6), 1405-1413 (2005).
- Ohta, S., et al. Intraluminal gene transfer of endothelial cell-nitric oxide synthase suppresses intimal hyperplasia of vein grafts in cholesterol-fed rabbit: a limited biological effect as a result of the loss of medial smooth muscle cells. Surg. 131 (6), 644-653 (2002).
- Baldwin, Z. K., et al. Modulation of vascular remodeling induced by a brief intraluminal exposure to the recombinant R7020 strain of Herpes simplex-1. J. Vasc. Surg. 41 (1), 115-121 (2005).
- Eslami, M. H., et al. Gene delivery to in situ veins: differential effects of adenovirus and adeno-associated viral vectors. J. Vasc. Surg. 31 (6), 1149-1159 (2000).
- Globerman, A. S., et al. Efficient transgene expression from naked DNA delivered into an arterio-venous fistula model for kidney dialysis. J. Gene Med. 13 (11), 611-621 (2011).
- Yang, B., et al. Adventitial transduction of lentivirus-shRNA-VEGF-A in arteriovenous fistula reduces venous stenosis formation. Kidney Int. 85 (2), 289-306 (2014).
- Brahmbhatt, A., et al. The role of Iex-1 in the pathogenesis of venous neointimal hyperplasia associated with hemodialysis arteriovenous fistula. PLoS ONE. 9 (7), e102542 (2014).
- Karram, T., et al. Induction of cardiac hypertrophy by a controlled reproducible sutureless aortocaval shunt in the mouse. J. Investig. Surg. 18 (6), 325-334 (2005).
- Perry, G. J., et al. Genetic variation in angiotensin-converting enzyme does not prevent development of cardiac hypertrophy or upregulation of angiotensin II in response to aortocaval fistula. Circ. 103 (7), 1012-1016 (2001).
- Guzman, R. J., Krystkowiak, A., Zarins, C. K. Early and sustained medial cell activation after aortocaval fistula creation in mice. J. Surg. Res. 108 (1), 112-121 (2002).
- Alexander, J. H., et al. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. JAMA. 294 (19), 2446-2454 (2005).
- Khaleel, M. S., et al. High-pressure distention of the saphenous vein during preparation results in increased markers of inflammation: a potential mechanism for graft failure. Ann. thorac. surg. 93 (2), 552-558 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados