Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Внутрипросветный доставки лекарств к мыши артериовенозной фистулы эндотелия
В этой статье
Резюме
After puncturing the aorta through the inferior vena cava (IVC) to create an aorto-caval fistula in the mouse, solution containing a drug is infused into the IVC via the same needle, followed by incubation. This method enables more robust drug delivery to the venous endothelium compared to the external route.
Аннотация
Доставки терапевтических агентов для повышения артериовенозной фистулы (АВФ) Созревание можно вводить либо с помощью внутрипросветных или внешних маршрутов. Простой мышиной модели АВФ сочеталась с внутриполостного введения лекарственного раствора, в венозный эндотелий в то же самое время, что и создание свища. Технические аспекты этой модели обсуждаются. Под общим наркозом, брюшная надрез и аорта и нижняя полая вена (НПВ) подвергаются. Инфра-почечную аорта и IVC расчленены для зажима. После того, как проксимальный и дистальный зажим, место пункции подвергается и 25 G игла используется для прокола обе стенки аорты и в НПВ. Сразу же после того, как прокол, репортер ген-экспрессирующих вирусного вектора вливают в НПВ через ту же иглу, а затем 15 мин инкубации. Метод внутрипросветное администрирования позволили получить более надежную доставку генов вируса к венозным эндотелий по сравнению с введением по внешнему маршруту. Это новьел способ доставки будет содействовать проведению исследований, которые исследуют роль эндотелия в АВФ созревания и позволяют внутрипросветного доставки лекарств во время хирургической операции.
Введение
Мышиный aortovenous свищ (AVF) прокол модель между аортой и нижней полой вены (НПВ) в настоящее время является отработанной технологией. 1 В этой модели, обе стенки инфра-почечные аорты проколотые с 25 G иглой, выход в прилегающая инфра-почечной полая вена; передняя аортального входное отверстие ремонтируется с простым сжатием, и не требует ремонта шовного. Последовательный последующий осмотр с высокой разрешающей способностью допплерографии и гистологический анализ показывает AVF иметь фазу созревания , а затем неудовлетворительную фазу, обобщал известную патофизиологии человека АВФ. 2
Для того, чтобы изучить механизмы, которые модулируют AVF созреванию, необходимы усовершенствованные способы доставки терапевтических агентов к созревающем АВФ эндотелий. Доставки терапевтических агентов для сосудов может быть либо путем эндоваскулярного доставки в полость, или с помощью внешнего доставки в адвентиции. Одним из примеров внешней доставки является комобычно используется адвентициальных применение Pluronic геля. Этот сополимер термообратимый и превращается из жидкого состояния в твердый гель при нагревании до температуры тела. Предшествующие исследования показали , длительной доставки лекарственного средства достигается , когда препарат смешивают в плуроника гель наносят местно в естественных условиях. 3,4 адвентициальных применение вирусных векторов или миРНК с Pluronic гель сообщалось , чтобы быть эффективным в качестве околососудистой системы доставки. 5,6 We также сообщили , что лечение эксплантированной подкожных вен человека с адвентиции стимуляции пептидами приводит к фосфорилированию эндотелиальных рецепторных белков. 7
С другой стороны, исследователи также использовали в просвете доставку обоих вирусных и невирусных векторов в собачьих 8-10 и кроличьи 11,12 моделей венозных шунтов. В этих докладах, перенос генов был проведен после того, как экс виво вены урожая. Ислами и др. Сообщили эндоваскулярная вирусный ген доставкиу каротидной вены на месте без создания обхода. 13 Gloverman и др. сообщает внутрипросветное и адвентиции доставки голой ДНК в бедренной артерии крысы-поверхностной эпигастральной вены свищей. 14 Группа Mayo сообщили адвентициальных доставки лекарств в сонную артерию мыши-яремной вены свищей. 15,16 Однако эти ранее сообщенные модели требовали ушивают анастомоз для создания АВФ. В этом докладе, внутрипросветное доставки лекарственных средств с одновременным созданием АВФ у мышей описано, с использованием шовного-менее модель создания АВФ. С помощью этого модифицированного мышиной модели AVF может быть выполнена простой способ для внутриполостной доставки лекарственных средств к венозной конечности свища.
протокол
Об утверждении соответствующих институциональных животных по уходу и использованию Комитетом получается.
1. Обезболивание и Дооперационные процедуры
- Обезболить мужчина C57BL / 6 льда, в возрасте 8 недель, с испарившейся 3% изофлуран и 0,8 л / мин кислорода вводят в акриловой индукции камеры.
- Подтверждение адекватной анестезии из-за отсутствия реакции до ног крайнем случае. Поместите лежачем мыши на операционном столе и поместите силиконовую маску для доставки испаряются 2 - 3% изофлуран при непрерывном вдыхании.
- Удалить вентральной волосы от шеи до нижней части живота с использованием химической депиляции крем.
- Выполните доплеровский УЗИ до АВФ хирургии для записи базовых характеристик артериального и венозного кровотока и диаметра сосуда в областях , представляющих интерес. 1,2
- Приложить 1 мл шприц с иглой 25 G и загрузите шприц с желаемого лекарственного средства. Изгиб иглы под углом 60 градусов приблизительно 4 мм от необходимостиле наконечник. Возьмите 25 г иглу с изогнутым держателем иглы.
2. Оперативные процедуры
- Подготовьте место надреза с местным антисептиком и применять хирургические драпировка. Используйте стерильные перчатки и инструменты для поддержания асептики на протяжении операции.
- Делают разрез по средней линии живота скальпелем простирается от уровня нижнего края печени до чуть выше лобка.
- Вставьте втягивающим и потрошить все кишки из брюшной полости по направлению к правой стороне. Оберните кишечник в марлю, смоченным физиологическим раствором. Рассеките мембрану, соединяющую ретро-брюшины и нижней части толстой кишки, чтобы получить полное представление аорты и нижней полой вены.
- Рассеките инфра-почечные аорту и IVC от окружающих тканей, готовясь к проксимального и дистального зажима.
- Поместите одного клипа микрохирургии через оба проксимальной аорты и проксимальных IVC на уровне чуть ниже левой почечной вены. Поместите второй клип микрохирургии через как Distal аорта и дистальный НПВ.
- Возьмитесь соединительной ткани , окружающей аорту и вращать медиально так, чтобы дорсальной аорты приоткрыта для артериальной пункции, как было описано ранее. 1
- Быстро обнажить место прокола. Сайт прокол будет каудальной сосудов, примерно три четверти расстояния от левой почечной вены до бифуркации аорты. Сохраняя аорту в повернутом положении левой рукой, рассекают левую боковой край аорты, так что есть достаточно экспозиции, чтобы прокол правой рукой. Будьте осторожны, чтобы не рассечь между аортой и нижней полой вены.
- Поддерживать аорту в повернутом положении и проткнуть аорту через в НПВ с использованием 25 G иглы с прикрепленным 1 мл шприц, содержащий раствор лекарственного средства. (Рисунок 1А)
- Настаивать лекарственного раствора (100 - 200 мкл), используя левую руку. Игла можно увидеть через дилатационная и тонкийIVC стенки , когда прозрачный раствор лекарственного средства вытесняет венозной крови из нижней полой вены (рис 1B, C). Остаются еще и поддерживать иглу в заданном положении в течение 15 мин.
- Удалите дистального микрохирургии зажим для снятия зажима только дистального аорту и дистального IVC.
- Удалите иглу, а затем покрывают место прокола аорты путем подтягивания смежную ретро-перитонеального ткани.
- Удалите проксимальный микрохирургии зажим для снятия зажима проксимального аорту и проксимальных IVC. После де-зажима, артериальная кровь течет наблюдаемый в НПВ вместо темной венозного кровотока. Держите покрытие проколу отверстие в течение 1 мин.
- После подтверждения гемостаза наблюдением в течение 30 сек без сжатия, возвращают кишечники в их естественное положение и закройте живот с запущенным швом в соответствии с утвержденным протоколом вашего животного.
3. Послеоперационные процедуры
- После закрытия брюшной полости, прекратить ANESThesia. Применить послеоперационный уход, включая обезболивание и уход за раной в соответствии с инструкциями, рекомендованными по уходу и использованию комитета Institutional животных путем. Для анальгезии мы используем бупренорфин в дозе 0,1 мг / кг каждые 12 intrasmuscularly ч в течение 24 ч, следуя хирургическим процедурам.
- В первый день после операции, выполнять доплеровский УЗИ, чтобы подтвердить проходимость АВФ. Кроме того, измерения другой сосуд и последовательно характеристики потока , и сравнить изменения из дооперационными исходных значений. 1,2
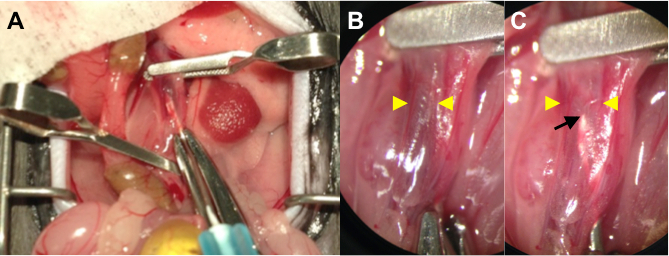
Рисунок 1. (A) Оперативная фотография Отображение внутрипросветное во время доставки АВФ хирургии. Зажмите проксимальной и дистальной аорты, а также IVC путем применения микрохирургические клипов. Прокол аорту через в НПВ с помощью 25 G иглу с подсоединенным шприц , содержащий раствор лекарственного средства. (В) HigЕе сила изображения (4X увеличение) проколотой IVC перед инфузией. Кончик иглы затемняется темного цвета венозной крови. Желтые наконечники стрел обозначают диаметр от стены к стене НПВ. (C) Высшая Сила изображения (4X увеличение) проколотой IVC после инфузии. Кончик иглы (черная стрелка) можно увидеть через слегка раздутым и тонкой IVC стенки (желтые стрелки) в качестве прозрачного раствора лекарственного средства вытесняет венозной крови.
Результаты
В серии из 33 мышей, выживание на первый послеоперационный день был 97,0%; АВФ проходимость, как определено с помощью ультразвука, был 84,9%.
сравнивали Gene эффективность трансдукции этого эндоваскулярного маршрута доставки с традиционным в...
Обсуждение
Эта модификация мышиной модели АВФ включает внутрипросветного доставки лекарственного средства к венозным эндотелий в момент создания АВФ. АВФ была создана путем прокалывания инфра-почечный аорту с 25 G иглой и расширение пункции через противоположную стенку аорты в НПВ, а затем с пом?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported in part by the United States Department of Veterans Affairs Biomedical Laboratory Research and Development Program Merit Review Award I01-BX002336, the National Institute of Health grant R56-HL095498, as well as with the resources and the use of facilities at the VA Connecticut Healthcare System, West Haven, CT.
Материалы
| Name | Company | Catalog Number | Comments |
| Pluronic F-127 | Sigma-Aldrich | P2443-250G | Used as 30% solution in d-water |
| GFP antibody | NOVUS BIOLOGICALS INC | NB100-1770 | |
| Ad-CMV-GFP | VECTOR BIOLABS | 1060 | |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | 2F7122 | |
| BD PrecisionGlide Needle 25 G x 5/8 | BD | 305122 | |
| BD 1 ml Syringe Tuberculin Slip Tip | BD | 309659 | |
| Scalpel | Surgical Design Inc | 22079707 | |
| 6-0 ETHILON P-1 11 mm 3/8c Reverse Cutting | ETHICON INC | 697G | |
| Vevo 770 ultrasound machine | Visualsonics | 20 - 60 Mhz scan head; RMV-704 | |
| Vascular clamp | Roboz Surgical Instrument Co. | RS-5424 | |
| Clamp applying forceps | Roboz Surgical Instrument Co. | RS-5410 |
Ссылки
- Yamamoto, K., Li, X., Shu, C., Miyata, T., Dardik, A. Technical Aspects of the Mouse Aortocaval Fistula. J. Vis. Exp. (77), e50449 (2013).
- Yamamoto, K., et al. The mouse aortocaval fistula recapitulates human arteriovenous fistula maturation. Am. J. Physiol.: Heart Circ. Physiol. 305 (12), H1718-H1725 (2013).
- Escobar-Chávez, J. J., Lòpez-Cervantes, M., Naïk, A., Kalia, Y. N., Quintanar-Guerrero, D., Ganem-Quintanar, A. Applications of thermo-reversible pluronic F-127 gels in pharmaceutical formulations. J. Pharm. Pharm. Sci. 9 (3), 339-358 (2006).
- Almeida, H., Amaral, M. H., Lobão, P., Lobo, J. M. S. Pluronic® F-127 and Pluronic Lecithin Organogel (PLO): main features and their applications in topical and transdermal administration of drugs. J. Pharm. Pharm. Sci. 15 (4), 592-605 (2012).
- Karper, J. C., et al. Toll-like receptor 4 is involved in human and mouse vein graft remodeling, and local gene silencing reduces vein graft disease in hypercholesterolemic APOE*3Leiden mice. Arterioscler., Thromb., Vasc. Biol. 31 (5), 1033-1040 (2011).
- Redmond, E. M., Hamm, K., Cullen, J. P., Hatch, E., Cahill, P. A., Morrow, D. Inhibition of patched-1 prevents injury-induced neointimal hyperplasia. Arterioscler., Thromb., Vasc. Biol. 33 (8), 1960-1964 (2013).
- Wong, D. J., et al. Ephrin type-B receptor 4 activation reduces neointimal hyperplasia in human saphenous vein in vitro. J. Vasc. Surg. , (2014).
- Matsumoto, T., et al. Hemagglutinating virus of Japan-liposome-mediated gene transfer of endothelial cell nitric oxide synthase inhibits intimal hyperplasia of canine vein grafts under conditions of poor runoff. J. Vasc. Surg. 27 (1), 135-144 (1998).
- Petrofski, J. A., et al. Gene delivery to aortocoronary saphenous vein grafts in a large animal model of intimal hyperplasia. J. Thorac. Cardiovasc. Surg. 127 (1), 27-33 (2004).
- Hata, J. A., et al. Modulation of phosphatidylinositol 3-kinase signaling reduces intimal hyperplasia in aortocoronary saphenous vein grafts. J. Thorac. Cardiovasc. Surg. 129 (6), 1405-1413 (2005).
- Ohta, S., et al. Intraluminal gene transfer of endothelial cell-nitric oxide synthase suppresses intimal hyperplasia of vein grafts in cholesterol-fed rabbit: a limited biological effect as a result of the loss of medial smooth muscle cells. Surg. 131 (6), 644-653 (2002).
- Baldwin, Z. K., et al. Modulation of vascular remodeling induced by a brief intraluminal exposure to the recombinant R7020 strain of Herpes simplex-1. J. Vasc. Surg. 41 (1), 115-121 (2005).
- Eslami, M. H., et al. Gene delivery to in situ veins: differential effects of adenovirus and adeno-associated viral vectors. J. Vasc. Surg. 31 (6), 1149-1159 (2000).
- Globerman, A. S., et al. Efficient transgene expression from naked DNA delivered into an arterio-venous fistula model for kidney dialysis. J. Gene Med. 13 (11), 611-621 (2011).
- Yang, B., et al. Adventitial transduction of lentivirus-shRNA-VEGF-A in arteriovenous fistula reduces venous stenosis formation. Kidney Int. 85 (2), 289-306 (2014).
- Brahmbhatt, A., et al. The role of Iex-1 in the pathogenesis of venous neointimal hyperplasia associated with hemodialysis arteriovenous fistula. PLoS ONE. 9 (7), e102542 (2014).
- Karram, T., et al. Induction of cardiac hypertrophy by a controlled reproducible sutureless aortocaval shunt in the mouse. J. Investig. Surg. 18 (6), 325-334 (2005).
- Perry, G. J., et al. Genetic variation in angiotensin-converting enzyme does not prevent development of cardiac hypertrophy or upregulation of angiotensin II in response to aortocaval fistula. Circ. 103 (7), 1012-1016 (2001).
- Guzman, R. J., Krystkowiak, A., Zarins, C. K. Early and sustained medial cell activation after aortocaval fistula creation in mice. J. Surg. Res. 108 (1), 112-121 (2002).
- Alexander, J. H., et al. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. JAMA. 294 (19), 2446-2454 (2005).
- Khaleel, M. S., et al. High-pressure distention of the saphenous vein during preparation results in increased markers of inflammation: a potential mechanism for graft failure. Ann. thorac. surg. 93 (2), 552-558 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены