Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Intraluminale Drug Delivery auf die Maus arteriovenöse Fistel Endothel
In diesem Artikel
Zusammenfassung
After puncturing the aorta through the inferior vena cava (IVC) to create an aorto-caval fistula in the mouse, solution containing a drug is infused into the IVC via the same needle, followed by incubation. This method enables more robust drug delivery to the venous endothelium compared to the external route.
Zusammenfassung
Abgabe therapeutischer Mittel arteriovenöse Fistel (AVF) zur Verbesserung der Reifung entweder via intraluminalen oder externe Wege verabreicht werden kann. Die einfache murine AVF Modell wurde mit intraluminale Verabreichung von Arzneimittellösung in die venöse Endothel zugleich als Fistel Schaffung kombiniert. Technische Aspekte dieses Modells diskutiert. Unter Vollnarkose wird ein Bauchschnitt gemacht und die Aorta und untere Hohlvene (IVC) ausgesetzt sind. Die Infrarot-Nieren-Aorta und IVC sind zum Klemmen seziert. Nach proximal und distal Klemmung wird der Einstichstelle freigelegt und eine 25 G-Nadel verwendet wird, beide Wände der Aorta und in die IVC zu durchstechen. Unmittelbar nach dem Einstich, ein Reporter-Gen-exprimierenden viralen Vektor wurde in der IVC über die gleiche Nadel infundiert, um 15 min inkubiert. Die intraluminale Verabreichungsmethode ermöglicht robustere virales Gen Lieferung an den venösen Endothel im Vergleich zur Verabreichung durch die externe Route. Diese novel Verfahren zur Lieferung wird Studien erleichtern, die die Rolle des Endothels in AVF Reifung erforschen und zum Zeitpunkt der chirurgischen Operation intraluminal Arzneimittelabgabe ermöglichen.
Einleitung
Die murine aortovenous Fistel (AVF) Einstich Modell zwischen der Aorta und der unteren Hohlvene (IVC) ist jetzt eine etablierte Technik. 1 In diesem Modell beide Wände der infra-renale Aorta sind mit einer 25 G Nadel durchstochen, in das austretende angrenzenden Infranieren Hohlvene; die vordere Aorten-Eingangsloch ist mit einfachen Kompression repariert, und erfordert keine Naht Reparatur. Serien Follow-up - Prüfung von hochauflösenden Doppler - Ultraschall und histologische Analyse zeigt die AVF eine Reifephase haben und dann eine versagende Phase, die bekannte Pathophysiologie menschlicher AVF rekapituliert. 2
Mechanismen erforschen, die AVF Reifung modulieren, verbesserte Verfahren zur Abgabe von therapeutischen Mitteln an die Reifungs AVF Endothels benötigt. Lieferung von therapeutischen Wirkstoffen auf Schiffe können entweder über endovaskuläre Lieferung an das Lumen oder über externe Lieferung an die Adventitia sein. Ein Beispiel für eine externe Lieferung ist der comhäufigsten verwendeten adventitiellen Anwendung von Pluronic-Gel. Dieses Copolymer wird thermo-reversibel und vom flüssigen in den festen Gel umgewandelt wenn sie auf Körpertemperatur erwärmt. Frühere Studien haben gezeigt , aufrechterhalten Arzneimittelabgabe erreicht wird , wenn die Droge in Pluronic - Gel gemischt topisch in vivo angewendet wird. 3,4 adventitiellen Anwendung von viralen Vektoren oder siRNA mit Pluronic - Gel wurde als perivaskuläre Abgabesystem wirksam zu sein berichtet. 5,6 Wir haben auch berichtet , dass die Behandlung von explantierten humanen Vena saphena mit adventitiellen Stimulation durch Peptide , die in der Phosphorylierung der endothelialen Rezeptorproteine führte. 7
Auf der anderen Seite haben Forscher auch intraluminale Lieferung von beiden viralen und nicht - viralen Vektoren in canine 8-10 und Kaninchen 11,12 Modelle von Venentransplantaten verwendet. In diesen Berichten wurde Gentransfer durchgeführt ex vivo nach der Ernte Vene. Eslami et al. Berichtet endovaskuläre viralen Gens lieferny Venen in situ zu Karotis ohne einen Bypass zu schaffen. 13 Gloverman et al. berichtete intraluminale und adventitiellen Lieferung von nackter DNA in Ratte Femoralarterie-V. epigastrica superficialis Fisteln. 14 Die Mayo - Gruppe berichtet adventitiellen Arzneimittelabgabe in Arterie-Halsvene Fisteln Maus Carotis. 15,16 Allerdings sind diese bereits berichtet Modelle eine genähte Anastomose , die zum Erstellen die AVF. In diesem Bericht wird intraluminale Medikamentenabgabe bei gleichzeitiger AVF Schöpfung bei Mäusen beschrieben, eine Naht lose Modell der AVF Schöpfung verwenden. Durch die Verwendung dieses modifizierte murine AVF Modell eine einfache Methode zur intraluminale Medikamentenabgabe an den venösen Schenkel der Fistel durchgeführt werden.
Protokoll
Die Genehmigung durch die entsprechende Institutional Animal Care und Use Committee erhalten.
1. Anästhesie und präoperative Verfahren
- Anesthetize männlichen C57Bl / 6 Eis im Alter von 8 Wochen mit verdampfte 3% Isofluran und 0,8 l / min Sauerstoff in eine Acrylinduktionskammer verabreicht.
- Bestätigen ausreichende Anästhesie durch den Mangel an Reaktion auf Zehe Prise. 3% Isofluran durch kontinuierliche Inhalation - Bewegen Sie die Maus in Rückenlage auf dem Operationstisch und positionieren, um eine Silikonmaske zu liefern 2 verdampft.
- Entfernen ventralen Haare vom Hals zum Unterbauch eine chemische Enthaarungscreme verwenden.
- Führen Sie Doppler - Ultraschall - Untersuchung vor der AVF Chirurgie Baseline - Charakteristika der arteriellen und venösen Rückstrom und Gefäßdurchmesser in den Bereichen von Interesse zu erfassen. 1,2
- Bringen Sie eine 1-ml-Spritze mit einer 25 G-Nadel und laden Sie die Spritze mit dem gewünschten Medikament. Biegung der Nadel zu einem Winkel von 60 Grad ungefähr 4 mm von der Notwendigkeitle Spitze. Fassen Sie die 25 G-Nadel mit einem gebogenen Nadelhalter.
2. Operative Verfahren
- Bereiten Sie die Inzisionsstelle mit einem Antiseptikum und ein Operationstuch anwenden. Verwenden Sie sterile Handschuhe und Instrumente zur aseptischen Bedingungen in der gesamten Operation erhalten.
- Machen Sie eine Mittellinie Bauchschnitt mit einem Skalpell aus dem Niveau der unteren Leberrand erstreckt, knapp über dem Schambein.
- Legen Sie eine Aufroller und ausweiden alle Eingeweide aus der Bauchhöhle zur rechten Seite. Wickeln Sie die Eingeweide in Gaze, getränkt mit Kochsalzlösung. Präparieren Sie die Membran, die die retro-Peritoneum verbindet und unteren Kolon vollen Blick auf die Aorta und IVC zu erhalten.
- Präparieren Sie die infra-renalen Aorta und IVC aus den umliegenden Geweben, die Vorbereitung für proximale und distale Klemm.
- Legen Sie eine einzelne Mikroclip über beide proximalen Aorta und dem proximalen IVC auf der Ebene direkt unterhalb der linken Nierenvene. Legen Sie eine zweite Mikroclip über beide distal Aorta und das distale IVC.
- Fassen des Bindegewebes die Aorta umgibt und medial zu drehen , so dass die Rückenfläche der Aorta leicht für den arteriellen Einstich ausgesetzt ist, wie zuvor beschrieben. 1
- Schnell die Einstichstelle aus. Die Punktionsstelle wird von der linken Nierenvene zur Aortenbifurkation am kaudalen Aspekt der Gefäße, etwa drei Viertel des Abstandes sein. Halten Sie die Aorta in einer gedrehten Position mit der linken Hand, sezieren die linke seitliche Rand der Aorta, so dass es genügend Belichtung ist Einstich mit der rechten Hand zu ermöglichen. Achten Sie darauf, nicht zwischen der Aorta und der IVC zu sezieren.
- Pflegen Sie die Aorta in einer gedrehten Position und durchstechen die Aorta durch in die IVC unter Verwendung einer 25 G-Nadel mit einem daran befestigten 1 ml Spritze mit Wirkstofflösung. (1A)
- Infuse die Wirkstofflösung (100-200 ul) mit der linken Hand. Die Nadel kann durch die erweiterte und dünn zu sehenIVC Wand , wenn die transparente Arzneimittellösung aus dem IVC (1B, C) das venöse Blut verdrängt. Bleiben Sie ruhig und die Nadel in Position für 15 Minuten aufrechtzuerhalten.
- Entfernen Sie die distale Mikrochirurgie Clip zu de-Klemme nur die distale Aorta und das distale IVC.
- Entfernen Sie die Nadel und dann bedecken Sie die Einstichstelle der Aorta durch benachbarte retroperitonealen Gewebe nach oben ziehen.
- Entfernen Sie den proximalen Mikrochirurgie Clip zu de-klemmen die proximale Aorta und den proximalen IVC. Bei der De-Klemm wird arterielle Blut in den IVC beobachtet fließt, anstatt dunkel venösen Blutfluss. Halten Sie das Einstichloch für 1 min abdecken.
- Nach der Bestätigung der Hämostase durch Beobachtung für 30 Sekunden ohne Kompression, kehren die Därme in ihre natürliche Position und schließen Sie den Bauch mit einem fortlaufenden Naht nach Ihren zugelassenen Tier Protokoll.
3. Post-operative Verfahren
- Nach dem Schließen des Bauches, beenden anesthesia. Bewerben postoperative Pflege einschließlich Analgesie und Wundversorgung in Übereinstimmung mit den Anweisungen von der Institutional Animal Care und Use Committee empfohlen. Analgesieprüfung verwenden wir Buprenorphin bei 0,1 mg / kg intrasmuscularly alle 12 h für 24 Stunden, die chirurgische Verfahren folgende.
- Am ersten Tag nach der Operation durchführen Doppler-Ultraschall-Durchgängigkeit des AVF zu bestätigen. Darüber hinaus messen die anderen Behälter und Fließeigenschaften seriell und für Änderungen von der präoperativen Ausgangswerten zu vergleichen. 1,2
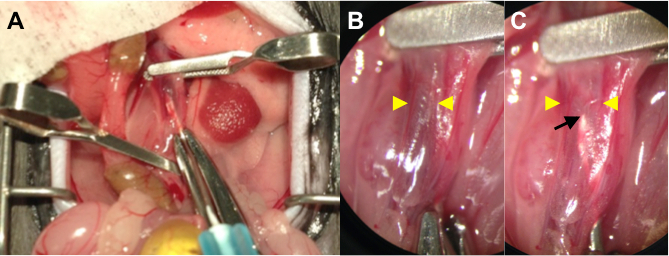
Zeige intraluminale Lieferung bei AVF Chirurgie Abbildung 1. (A) Operative Foto. Klemmen Sie den proximalen und distalen Aorta sowie die IVC von Mikrochirurgie Clips anwenden. Die Punktion der Aorta durch in die IVC unter Verwendung einer 25 G - Nadel mit angebrachtem Spritze mit Wirkstofflösung. (B) Ein Higihre Leistung Bild (4-fache Vergrößerung) des punktierten IVC vor der Infusion. Die Nadelspitze wird durch dunkel gefärbte venösem Blut verdeckt. Gelbe Pfeile bezeichnen die Wand-zu-Wand - Durchmesser des IVC. (C) eine höhere Leistung Bild (4 - fache Vergrößerung) des punktierten IVC nach der Infusion. Die Nadelspitze (schwarzer Pfeil) durch die sanft aufgetrieben und dünne IVC Wand (gelbe Pfeile) als die transparente Arzneimittellösung verdrängt das venöse Blut zu sehen.
Ergebnisse
In einer Serie von 33 Mäusen, Überleben am ersten postoperativen Tag betrug 97,0%; AVF Durchgängigkeit, wie durch Ultraschall bestimmt wurde, betrug 84,9%.
Gene Transduktionswirksamkeit dieser endovaskulären Lieferweg mit der traditionellen externen Route verglichen. Zur intraluminalen Liefer (ILD), unmittelbar nach der Punktion 200 ul Adenovirus-GFP (Ad-GFP) Vektor - Lösung (1 × 10 9 PFU / ml) wurde über die...
Diskussion
Diese Modifikation des murinen AVF Modell enthält intraluminal Arzneimittelabgabe an das venöse Endothel zum Zeitpunkt der AVF-Erstellung. Ein AVF wurde durch Punktierung der infra-renalen Aorta mit einer 25 G-Nadel und zur Verlängerung der Einstich durch die gegenüberliegende Aortenwand in die IVC, gefolgt von Injektion von Arzneimittellösung durch die gleiche Nadel geschaffen. Die Lösung wird beibehalten inner caval, dh., Im venösen Schenkel des AVF, bis de-Klemm. Was unterscheidet dieses Modell von an...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported in part by the United States Department of Veterans Affairs Biomedical Laboratory Research and Development Program Merit Review Award I01-BX002336, the National Institute of Health grant R56-HL095498, as well as with the resources and the use of facilities at the VA Connecticut Healthcare System, West Haven, CT.
Materialien
| Name | Company | Catalog Number | Comments |
| Pluronic F-127 | Sigma-Aldrich | P2443-250G | Used as 30% solution in d-water |
| GFP antibody | NOVUS BIOLOGICALS INC | NB100-1770 | |
| Ad-CMV-GFP | VECTOR BIOLABS | 1060 | |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | 2F7122 | |
| BD PrecisionGlide Needle 25 G x 5/8 | BD | 305122 | |
| BD 1 ml Syringe Tuberculin Slip Tip | BD | 309659 | |
| Scalpel | Surgical Design Inc | 22079707 | |
| 6-0 ETHILON P-1 11 mm 3/8c Reverse Cutting | ETHICON INC | 697G | |
| Vevo 770 ultrasound machine | Visualsonics | 20 - 60 Mhz scan head; RMV-704 | |
| Vascular clamp | Roboz Surgical Instrument Co. | RS-5424 | |
| Clamp applying forceps | Roboz Surgical Instrument Co. | RS-5410 |
Referenzen
- Yamamoto, K., Li, X., Shu, C., Miyata, T., Dardik, A. Technical Aspects of the Mouse Aortocaval Fistula. J. Vis. Exp. (77), e50449 (2013).
- Yamamoto, K., et al. The mouse aortocaval fistula recapitulates human arteriovenous fistula maturation. Am. J. Physiol.: Heart Circ. Physiol. 305 (12), H1718-H1725 (2013).
- Escobar-Chávez, J. J., Lòpez-Cervantes, M., Naïk, A., Kalia, Y. N., Quintanar-Guerrero, D., Ganem-Quintanar, A. Applications of thermo-reversible pluronic F-127 gels in pharmaceutical formulations. J. Pharm. Pharm. Sci. 9 (3), 339-358 (2006).
- Almeida, H., Amaral, M. H., Lobão, P., Lobo, J. M. S. Pluronic® F-127 and Pluronic Lecithin Organogel (PLO): main features and their applications in topical and transdermal administration of drugs. J. Pharm. Pharm. Sci. 15 (4), 592-605 (2012).
- Karper, J. C., et al. Toll-like receptor 4 is involved in human and mouse vein graft remodeling, and local gene silencing reduces vein graft disease in hypercholesterolemic APOE*3Leiden mice. Arterioscler., Thromb., Vasc. Biol. 31 (5), 1033-1040 (2011).
- Redmond, E. M., Hamm, K., Cullen, J. P., Hatch, E., Cahill, P. A., Morrow, D. Inhibition of patched-1 prevents injury-induced neointimal hyperplasia. Arterioscler., Thromb., Vasc. Biol. 33 (8), 1960-1964 (2013).
- Wong, D. J., et al. Ephrin type-B receptor 4 activation reduces neointimal hyperplasia in human saphenous vein in vitro. J. Vasc. Surg. , (2014).
- Matsumoto, T., et al. Hemagglutinating virus of Japan-liposome-mediated gene transfer of endothelial cell nitric oxide synthase inhibits intimal hyperplasia of canine vein grafts under conditions of poor runoff. J. Vasc. Surg. 27 (1), 135-144 (1998).
- Petrofski, J. A., et al. Gene delivery to aortocoronary saphenous vein grafts in a large animal model of intimal hyperplasia. J. Thorac. Cardiovasc. Surg. 127 (1), 27-33 (2004).
- Hata, J. A., et al. Modulation of phosphatidylinositol 3-kinase signaling reduces intimal hyperplasia in aortocoronary saphenous vein grafts. J. Thorac. Cardiovasc. Surg. 129 (6), 1405-1413 (2005).
- Ohta, S., et al. Intraluminal gene transfer of endothelial cell-nitric oxide synthase suppresses intimal hyperplasia of vein grafts in cholesterol-fed rabbit: a limited biological effect as a result of the loss of medial smooth muscle cells. Surg. 131 (6), 644-653 (2002).
- Baldwin, Z. K., et al. Modulation of vascular remodeling induced by a brief intraluminal exposure to the recombinant R7020 strain of Herpes simplex-1. J. Vasc. Surg. 41 (1), 115-121 (2005).
- Eslami, M. H., et al. Gene delivery to in situ veins: differential effects of adenovirus and adeno-associated viral vectors. J. Vasc. Surg. 31 (6), 1149-1159 (2000).
- Globerman, A. S., et al. Efficient transgene expression from naked DNA delivered into an arterio-venous fistula model for kidney dialysis. J. Gene Med. 13 (11), 611-621 (2011).
- Yang, B., et al. Adventitial transduction of lentivirus-shRNA-VEGF-A in arteriovenous fistula reduces venous stenosis formation. Kidney Int. 85 (2), 289-306 (2014).
- Brahmbhatt, A., et al. The role of Iex-1 in the pathogenesis of venous neointimal hyperplasia associated with hemodialysis arteriovenous fistula. PLoS ONE. 9 (7), e102542 (2014).
- Karram, T., et al. Induction of cardiac hypertrophy by a controlled reproducible sutureless aortocaval shunt in the mouse. J. Investig. Surg. 18 (6), 325-334 (2005).
- Perry, G. J., et al. Genetic variation in angiotensin-converting enzyme does not prevent development of cardiac hypertrophy or upregulation of angiotensin II in response to aortocaval fistula. Circ. 103 (7), 1012-1016 (2001).
- Guzman, R. J., Krystkowiak, A., Zarins, C. K. Early and sustained medial cell activation after aortocaval fistula creation in mice. J. Surg. Res. 108 (1), 112-121 (2002).
- Alexander, J. H., et al. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. JAMA. 294 (19), 2446-2454 (2005).
- Khaleel, M. S., et al. High-pressure distention of the saphenous vein during preparation results in increased markers of inflammation: a potential mechanism for graft failure. Ann. thorac. surg. 93 (2), 552-558 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten