Method Article
Estabelecimento de Zebrafish Larval como um modelo Animal para investigar Trypanosoma cruzi motilidade In Vivo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste protocolo, fluorescente etiquetadas T. cruzi foram injetados em larvas de peixe-zebra transparente, e motilidade do parasita foi observada na vivo usando microscopia de fluorescência folha de luz.
Resumo
Doença de Chagas é uma infecção parasitária causada pelo Trypanosoma cruzi, cuja motilidade não é apenas importante para a localização, mas também para a ligação de celular e invasão. Atuais modelos animais para o estudo do T. cruzi permitem observação limitada de parasitas em in vivo, que representa um desafio para o comportamento do parasita de compreensão durante as fases iniciais da infecção em seres humanos. Este protozoário tem um palco flagelar em vetor e hospedeiros mamíferos, mas não existem estudos descrevendo sua motilidade na vivo. O objetivo deste projeto foi estabelecer um modelo de zebrafish vertebrados vivos para avaliar a mobilidade do T. cruzi no sistema vascular. Zebrafish transparente larvas foram injetadas com fluorescente etiquetado trypomastigotes e observadas usando microscopia de fluorescência folha de luz (LSFM), um método não invasivo para visualizar os organismos vivos, com alta resolução óptica. Os parasitas podem ser visualizados por longos períodos de tempo devido a desta técnica relativamente baixo risco de photodamage comparado com confocal ou microscopia de epifluorescência. Parasitas de T. cruzi foram observadas viajando no sistema circulatório de zebrafish ao vivo em vasos de diferentes tamanhos e a gema. Eles também poderiam ser visto anexado na parede do saco vitelino e para a válvula atrioventricular, apesar das forças fortes associados com as contrações do coração. LSFM de T. cruzi-larvas inoculadas zebrafish é um valioso método que pode ser usado para visualizar a circular parasitas e avaliar seu tropismo, padrões de migração e mobilidade no ambiente dinâmico do sistema cardiovascular de um animal vivo.
Introdução
Doença de Chagas é causada pelo protozoário parasita T. cruzi. Cerca de 6 a 7 milhões de pessoas no mundo estão infectadas com T. cruzi. A doença é transmitida principalmente na América Latina, mas tem sido relatada em Estados Unidos, Canadá e muitos europeus, bem como alguns países do Pacífico Ocidental, principalmente devido à migração de indivíduos infectados1. Chagas é em grande parte vetorial e transmitida aos humanos pelo contato com as fezes de insetos hematophagic da subfamília Triatominae, conhecido como "kissing bugs". No entanto, T. cruzi também pode ser transmitida através de transfusões de sangue, transferência vertical de mãe para filho, ou ingestão de alimentos contaminados com parasitas2. A fase aguda da infecção é constitutivamente sintomática ou assintomática principalmente e dura de 6 a 8 semanas, após o qual envolvimento do sistema imunológico controla a carga do parasita, mas não elimina completamente a infecção3. A maioria dos indivíduos, em seguida, digite uma fase crônica assintomática; no entanto, quase 30% dos pacientes desenvolvem uma fase crônica sintomática, em que o sistema cardiac e menos frequentemente o digestivo e sistema nervoso estão comprometidos4. Esse cenário apresenta um desafio para o tratamento da doença e controle desde há não há vacinas disponíveis, e há apenas dois medicamentos eficazes para Chagas: benzonidazol e doença de Chagas. Ambos os tratamentos requerem Administração prolongada e podem ter efeitos colaterais graves2.
Aumentou a compreensão do comportamento de T. cruzi comportamento na vivo é a chave para determinar a migração parasitária, acessório celular e invasão dentro do host; a falta de modelos na vivo limita o desenvolvimento de novas abordagens terapêuticas. Estudos in vitro da infecção por T. cruzi demonstraram que a motilidade do trypomastigotes é importante para a ligação com as membranas de pilha de anfitrião e subsequente invasão celular5. Depleção de energia em trypomastigotes em co-cultura com uma linhagem de células sensíveis tem sido mostrada para reduzir a invasão celular6. Curiosamente, no tripanossomatídeos, movimento flagelar também tem sido caracterizado como um mecanismo de evasão contra anticorpos específicos parasita7.
Mobilidade flagelar tem sido extensivamente estudados em vitro no Trypanosoma brucei, um parasita estreitamente relacionado que causa a tripanossomíase africana8. Estudos in vitro da motilidade destes tripanosomas mostraram que a simulação das condições de sangue ou fluidos corporais, incluindo a viscosidade e a presença de obstáculos representativos das células do sangue, é importante para o movimento para a frente do parasita9 . Como de ainda não foi possível visualizar o movimento de parasitas no sangue na vivo.
Zebrafish as larvas são um poderoso modelo para o estudo de interações patógeno-hospedeiro em vivo. Eles são pequenos, baratos e relativamente fáceis de levantar quando comparado com outros modelos de vertebrados estabelecidos para doença de Chagas. Zebrafish tem inatos e adaptativos sistemas imunológicos semelhantes aos seres humanos, mas seu sistema imune adaptativo começa a desenvolver-se em 4 dias pós fertilização (dpf) e não é maduro para outro várias semanas10. Durante o desenvolvimento precoce, quando apenas os macrófagos estão presentes, há uma grande janela para estudar o comportamento de parasita sem interferência imunológica imediata10. No entanto, a maior vantagem de utilizar o zebrafish larvas de vertebrados modelo para estudar o comportamento do agente patogénico reside na sua transparência óptica, tornando-os receptivos para a seleção e a imagem11microscópica. Além disso, existem várias ferramentas para manipular a genética de peixes. Por exemplo, a tensão do Casper é uma linha mutante de zebrafish com nenhuma pigmentação, tornando o animal completamente transparente e útil para a visualização de órgãos individuais e para acompanhamento em tempo real de células injetadas12.
Uma limitação fundamental de observação longitudinal de parasitas rapidamente se movendo em zebrafish ao vivo usando confocal ou microscopia de epifluorescência situa-se na impossibilidade de imaging na aquisição de alta velocidades e profundidades de penetração grande com boa qualidade de imagem e baixa risco de photodamage. Folha de luz micsroscopy de fluorescência (LSFM) é uma técnica de imagem emergente que supera essas limitações para permitir estas observações. Usando um objetivo detectar fluorescência e um segundo objetivo da iluminação ortogonais que ilumina apenas o plano focal do objectivo da deteção, é possível obter seções óptico de alta resolução como um microscópio confocal, mas com significativamente reduzido Fotodano, mesmo no que diz respeito de microscopia de epifluorescência13. A técnica LSFM usada aqui é chamada único avião iluminação microscopia (SPIM), em que uma folha fina de luz ilumina um avião dentro das larvas de peixe-zebra.
O objetivo desta metodologia é estabelecer zebrafish larval como um modelo de infecção não viável para a compreensão da motilidade do T. cruzi e comportamento relacionado na vivo. Para fazer isso, nós injetado transparente zebrafish larvas com trypomastigotes fluorescente etiquetadas, a forma celular responsável pela infecção dos seres humanos e identificado o movimento de T. cruzi na circulação cardiovascular de zebrafish usando LSFM.
Protocolo
os seguintes protocolos foram aprovados pelo cuidado institucional do Animal e uso Comité de Los Andes University (CICUAL). Nível de biossegurança 2 (BSL-2) diretrizes devem ser seguidas rigorosamente para evitar a contaminação com o patógeno T. cruzi.
Nota: cuidados com animais e manutenção: Casper zebrafish, uma variedade geneticamente modificada de zebrafish (Danio rerio) é usado no presente protocolo devido a sua transparência óptica valioso em todas as fases do desenvolvimento. Peixes são manipuladas usando cuidados ideais condições para a espécie 14, num 14 h luz-10 h escuro ciclo, a 28 ± 1 ° C, em um pH (7,0-7,4) controladas multi tanque recirculação sistema de água. Os animais são alimentados duas vezes por dia com artémia viva (Artemia salina) e enriquecidos com criação de alimentos. Todos os protocolos foram aprovados pela CICUAL na Universidad de los Andes (C.FUA_14-017).
1. preparação de água ovo
- Prepare sal de aquário de 0,6 g/L em reverso osmose (RO) ou deionizada (DI) e adicionar a solução de azul de metileno 0,01 mg/L.
Nota: A medida de condutividade deve ser nível em 7,2-7,9 de 400-500 µS/cm e pH. Para baixar o pH, ventilar a água de ovo por algumas horas.
2. Preparação da solução de estoque tricaina
- preparar 0,4% tricaina solução dissolvendo 400mg metanosulfonato (MS-222) em 97,9 mL de água destilada (ddH 2 O). Depois que o pó se dissolva completamente, ajustar o pH a 7,0 usando 2,1 mL 1M Tris (pH 9,0) e refrigerar a solução.
3. Preparação de 1.0% Agarose de baixo ponto de fusão
- dissolver o pó de agarose do ponto de derretimento baixo no ovo água a uma concentração final de 1.0%. Aqueça a mistura no microondas ou em uma chapa quente com agitação contínua até a solução de agarose aparece homogênea.
- Armazenar as alíquotas a 4 ° C, para não mais de uma semana.
4. Acasalamento de ensaio e colheita de embriões
- três dias antes de injeções configurar acasalamentos usando pares saudáveis do sexo masculinos e femininos de peixes em tanques de reprodução. Enriquecimento com bolinhas de vidro e plantas artificiais aumenta a desova. Acasalamentos devem ser configurados durante a tarde e saiu durante a noite.
- Na manhã seguinte, recolher os ovos gerados drenar o tanque através de um filtro e lavando os ovos com a água do ovo. Remova todos os ovos invertendo o coador e derramando água ovo através do filtro em uma placa de Petri. Para manter os embriões saudáveis, sua água limpa, removendo quaisquer detritos e embriões mortos com uma pipeta de transferência plástica.
- Transferir os embriões para uma incubadora a uma temperatura estável de 28,5 ° C, para permitir o desenvolvimento dos embriões de acordo com normas preparo 15 o zebrafish. Examinar os embriões duas vezes por dia e descartar os ovos inviáveis para manter a embreagem saudável.
5. Embrião Dechorionation
Nota: este procedimento é necessário se os embriões não eclodiram no momento da injeção. Neste procedimento, " larvas " são animais fora seu córion de 48 h pós fertilização (hpf) em diante.
- No dia do experimento, coloque o prato de Petri contendo os embriões saudáveis sob um dissecação estereoscópio.
- Agarra extremidades opostas do cório com duas pinças afiadas (Dumont #5), e rasgo e tração abrem cuidadosamente o córion. Cerca de 5-6 larvas são injetadas em um tempo e tipicamente 3-4 são imaged.
- Retire as chorions da água utilizando uma pipeta de transferência.
6. Preparação de Material de injeção
- preparar 1.0 mm agulhas usando um dispositivo de extrator de micropipeta e capilares de vidro de parede fina com as seguintes configurações: 2 pesos leves 1 peso pesado, tração superior 2 mm + 5 mm inferior puxar, 75,9 ° C (etapa 1) + (78,2 ° C Passo 2). Armazenar as agulhas em um prato de Petri em uma tira de argila de modelagem. A agulha ideal deve ter uma ponta estreita, como T. cruzi mede aproximadamente 20 x 1-3 µm e passará através da agulha facilmente. O comprimento da ponta pode variar: uma dica mais é útil para atingir estruturas mais profundas, mas uma ponta mais curta será mais rígida facilitando a injeção para o usuário.
Nota: O tamanho da ponta de agulha varia de acordo com a temperatura utilizada: uma temperatura alta para etapa 2 resulta em uma ponta mais longa e mais fina. - Preparar uma solução de agarose 1,5% em ddH 2 O e despeje em um prato de Petri de 10 cm. Cobrir uma profundidade de aproximadamente 1,0 cm.
- Coloque um molde pré-fabricado microinjeção sobre o agarose e deixe-o solidificar.
- Levantar o molde pré-fabricado microinjeção fora e adicione água ovo para armazenamento a 4 ° C. Isso impede que a agarose dessecar.
- Adicione água ovo à solução estoque tricaina para uma concentração final de 150 mg/L. loja a 4 ° C.
7. Cultura de células para o crescimento do parasita
- parasitas são mantidas em uma linhagem de células de tumor humano (CRL-1718) usando o método descrito por Vargas-Zambrano et al 16
- iniciar a cultura de células humanas em frascos de cultura um T25 (área de superfície = 25 cm 2) com uma densidade de 2 x 10 5 ou 4 x 10 5 células em 4 mL de meio RPMI-1640 com 10% de soro fetal bezerro (FCS), complementada com 2 mM L-glutamina, 4,5 g/L glicose, 10 mM HEPES, piruvato de 1 mM e 1% penicilina-estreptomicina (conhecido como " completar a mídia "). Incubar a 37 ° C, num ambiente 5% CO 2, as culturas o astrocitoma.
- Uma vez uma monocamada confluente, separar as células usando 2 mL de 0,25% de tripsina-EDTA incubando-os por 3 min a 37 ° C. visualmente verificar células para destacamento e bloquear a solução de tripsina usando 3 mL de RPMI-1640 com FCS de 10% em um tubo de 15 mL.
- Centrifugar a suspensão de eritrócitos durante 5 min à 1.350 g. x
- Lavar o sedimento celular resultante em meio DMEM em um tubo de 15 mL e centrifugar durante 5 min à 1.350 x g em 22 ° C.
- Contar as células manualmente em uma câmara de Neubauer e verificar a viabilidade em um microscópio de luz na ampliação de 40 X.
- Gentilmente re-suspenso o celular de pelotas em 4 mL de mídia completa e usá-lo para criar novas culturas de células, usando células de 2 x 10 5 por frasco de cultura T25.
8. T. cruzi cultura e rotulagem
- parasitas são uma cepa originalmente obtidos de um humano infectado e caracterizada como T. cruzi DA estirpe (MHOM/CO/01/DA), genótipo TcI unidade discreta de digitação (DTU) 16. Depois de 3 ou 4 dias de cultivo, coletar os parasitas se movendo do sobrenadante da cultura humana astrocitoma célula e centrifugar durante 5 min à 1.350 g. x descarte o meio a.
Nota: Parasitas no meio completo podem ser usadas para re-cultura em uma proporção de 1:1 com células de astrocitoma em frascos de cultura T25. - Delicadamente Ressuspender o pellet em 10 mL estéril 1x tampão de fosfato salino (PBS) com 0,1% FCS e centrifugar por 5 min em 1.350 g. x
- Desprezar o sobrenadante e ressuspender em 1 mL de PBS. Leve 10 µ l para contar os parasitas livres em uma câmara de Neubauer.
- Tirar o resto dos parasitas re-suspensos (990 µ l) e adicione 1 µ l de Carboxyfluorescein diacetato SuccinimiDyl éster (CFSE), concentração final 5,0 µM. Incubar durante 10 minutos à temperatura ambiente.
Nota: Estoque CFSE em 5 mM deve ser aliquotadas e mantida em -20 ° C. - De pelotas os parasitas (1.350 x g, 5 min). Reconstituir a pelota do parasita por agredir o tubo e lavar em 10 mL de 1x FCS PBS-0.1% seguido por uma rodada subsequente (1.350 x g, 5 min).
- Desprezar o sobrenadante e suavemente Ressuspender a pelota parasita etiquetados em 1X PBS com o volume adequado para obter uma concentração final de aproximadamente 10-20 parasitas/nL para injeção.
- Usar um volume pequeno (∼ 10 µ l, aproximadamente 1 x 10 4 -2 x 10 4 parasitas) de trypomastigotes para avaliar a viabilidade e a rotulagem. Um microscópio de fluorescência invertido pode ser usado para visualização directa dos parasitas. No modo de luz transmitido, verificar que os parasitas se mover. No modo de fluorescência, use o filtro de isotiocianato de fluoresceína (FITC) para avaliar a rotulagem parasita.
9. Injetando o Zebrafish larvas
- parasita carregando
- tomar 10 µ l de parasitas da ressuspensão (100 µ l) e carregá-los para as agulhas de vidro selado usando uma ponta de pipeta 10 µ l microloader.
- Inserir a agulha de vidro no suporte da agulha do micromanipulador, use um carrinho magnético e coloque ao lado o estereoscópio.
- Usando fórceps bem sob o estereoscópio, cortar a agulha, criando um brusco aberto acabar e medir o tamanho da gota para obter um volume de injeção de 1 nL (isso é equivalente a um diâmetro de grânulo de 0.12-0.13 mm quando medido em óleo mineral, 17). Uma ponta mais longa é preferencial para que a agulha pode atingir estruturas profundas dentro o peixe sem danificar o tecido. Neste protocolo, é usada uma agulha, mas uma agulha chanfrada pode ser usada também.
- De montagem
- anestesiar larvas de 48 hpf, com metanosulfonato de 150 mg/L. Verifique se eles não responder ao toque, mas certifique-se de que o coração está batendo.
- Colocar as larvas no molde em uma posição lateral agarose microinjeção.
- Coloque o suporte da agulha ao lado o estereoscópio e ajustar o micromanipulador, de modo que a ponta da agulha está no centro do campo de visão. Mova o prato de Petri preparadas em passos 6.2 a 6.4, para que a gema larval está perto da ponta da agulha. Verifique o estado da larva para garantir que o coração continua batendo.
- Definir os valores de microinjector da seguinte forma: injeção 9,6 libras pela polegada (psi) de pressão, mantenha a pressão: 20 psi; intervalo de 100 ms de gating; período valor de 1,9 (corresponde a 10,9 ms). O volume da injeção deve ser entre 1-3 nL, com aproximadamente 10-20 parasitas/nL.
10. Injeção do parasita
- injetar o peixe na porção superior-anterior da gema no duto de Cuvier. Esta etapa deve ser praticada para garantir a sobrevivência de animais após a injeção. Demora cerca de 10 min para injetar larvas de 5-6 com sucesso.
- Como um controle, injetar larvas de 1-2 com o mesmo volume de veículo (1X PBS).
- Transferir a larva para água ovo fresco imediatamente.
11. LSFM montagem de injetado larvas
- transferir a larva injectada com parasitas de um prato de Petri vazia e remova cuidadosamente a água circundante com uma pipeta de plástico e papel absorvente. Imediatamente Adicione 100 µ l de pré-aquecido 1,0% baixa de agarose do ponto de derretimento (consulte a etapa 3 para a preparação de agarose) para cobrir a larva. Garantir a agarose não é mais de 40 ° C.
- Inserir um fio em linha reta dentro de um capilar de vidro 1,0 mm e usá-lo como um êmbolo para aspirar a larva na posição vertical. Certifique-se de deixar uma pequena quantidade de agarose acima a larva. Espere até que a agarose solidifica antes de expor a larva (isto exigirá alguns minutos). Se necessário, empurrar para fora o excesso agarose abaixo a larva e cortá-la fora
- Colocar o capilar no suporte de amostra do microscópio e empurre a extremidade que contém a larva até ele trava livre do capilar. A câmara de amostra deve ser preenchida com solução metanosulfonato (150 mg/L) e a temperatura de 28 ° C.
- Posicionar a larva na frente da pupila do objectivo da deteção usando um sistema XYZ-micromanipulador. Para rotações sobre o eixo vertical, use um estágio de rotação. Posicionamento da larva deve ser feito no modo de luz transmitido claramente identificar estruturas larvas.
12. LSFM Imaging de injetado parasitas
modo- mudança de fluorescência e ajustar a intensidade de iluminação, bem como o tempo de exposição para diminuir Fotodano e otimizar a resolução de tempo. Para estas experiências particulares, usamos 2.8-3.0 mW de potência para a amostra e expostos a cada frame para 200 ms usando uma câmera com 6,45 µm de pixels e eficiência quântica de ~ 70% em comprimentos de onda da deteção. Essas configurações devem resultar em imagens adequadamente expostas em cerca de 5 frames/s. Certifique-se de usar um objectivo com a mais alta possível abertura numérica.
- Começar uma aquisição vídeo da região de interesse (ROI). No nosso caso, parasitas são observadas anexado para válvulas e livremente se movendo ao redor da área do coração. É recomendável levar um vídeo de um avião ao longo do tempo, ou usar o sistema micromanipulador ou piezo-galvo para concentrar diferentes planos enquanto o parasita move.
Nota: Este procedimento é útil para tempos curtos de aquisição de até 2 h. Para aquisição de longo prazo, as larvas devem ser montadas utilizando métodos alternativos 20.
13. Processamento e análise de dados adquiridos de imagem
Nota: processamento de imagem foi executado em um computador pessoal com um processador de 2,90 GHz, 8,00 GB de memória e uma placa de vídeo com 1.00 GB de memória.
- Aberto a adquirida conjunto de dados o software processamento de imagem de escolha. A céu aberto software FiJi é recomendado para LSFM de processamento de dados e análise 21.
- Do software de análise de imagem, ajustar níveis de brilho e contraste para melhorar as imagens.
Nota: Não há parâmetros fixos são usados neste caso, mas selecionando o " Auto " opção pode ser útil para obter uma melhoria inicial. - Selecione o ROI.
Nota: Para o acompanhamento individuais parasitas, FiJi tem ambos os plugins de controle manual e automático disponíveis.
14. Recuperação de larvas Imaged
- remover a larva de cuidadosamente a agarose usando pinça fina e uma ferramenta de laço de cabelo. Transferir o peixe volta para água ovo fresco e verificar se há recuperação após 15 min. voltar a larva a incubadora 28 ± 0,5 ° C.
- , Alternativamente, proceder à eutanásia as larvas de imagens com uma overdose de tricaina. Em seguida, introduzir as larvas em uma solução de hipoclorito de sódio (6.15% NaClO) por 5 min matar o parasita. Descartar de acordo com a instituição ' protocolos padrão de s.
Resultados
Condições ideais para a injeção:
Grupos de zebrafish larvas foram injetados em 24, 48, 72, 96 e 120 hpf, em diferentes sítios anatômicos e sua sobrevivência foi examinado todos os dias durante 5 dias. Depois de 5 dias pós injeção, embriões injetado em 24 hpf tinha 6.25% sobrevivência (2/32), Considerando que 95% (38/40) das larvas injetadas em 48 hpf sobreviveu. Como um controle, as larvas foram injetadas com 1X PBS como um veículo. Não houve diferença na sobrevivência entre larvas de veículo-injetado e parasita-injetado, indicando sem efeitos parasitas dependentes na taxa de sobrevivência dos peixes (p = 0,08). As larvas injetadas entre 72-120 hpf tinham taxas de sobrevivência comparáveis a 48 larvas hpf-injetado no volume constante de injeção. Para todos os procedimentos aqui apresentados, 48 larvas hpf foram utilizadas devido a sua facilidade de manipulação e tendo desenvolvido órgãos e pele facilmente penetrável sem dano evidente após a injeção.
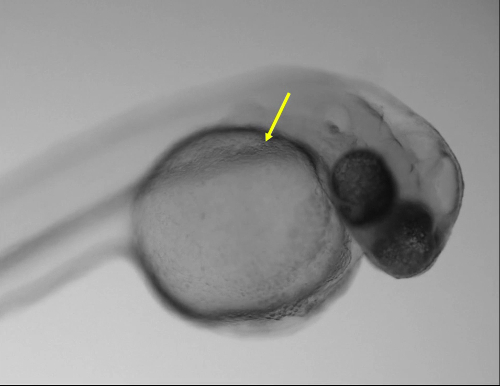
As larvas injetadas em 48 hpf foram injetados no espaço pericárdico, cauda muscular, ventrículo rombencéfalo, vesícula ótica, notocorda e duto de Cuvier no saco vitelino. Não houve diferença na sobrevivência de larvas injetado em diferentes sítios anatômicos. No entanto, a região mais rápida e fácil para injetar foi que o duto de Cuvier localizado na parte anterior do saco vitelino (Figura 1, 1 filme). Injeções nesse local permitiu a introdução de volumes maiores com menor risco de lesão de estruturas vitais. Além disso, entre 24-72 hpf, esta região é um local ideal para acessar diretamente o desenvolvimento da vasculatura e coração11.
Visualização do parasita usando LSFM:
Dentro de 8-10 min após a injeção de T. cruzi no duto de Cuvier, parasitas foram identificadas em larvas de zebrafish usando LSFM devido a seu sinal fluorescente CFSE e a transparência óptica das larvas. Após a inoculação, parasitas foram observadas que também aderiu às paredes ao redor do sistema circulatório ou viajando na direção do fluxo de sangue (Figura 2, Figura 3). Quando um parasita permanece ligado a uma estrutura cardíaca, tais como a válvula atrioventricular, oscila com as contrações do coração, indicando que os mecanismos moleculares para a aderência dos parasitas podem ser eficazes no nosso modelo de vertebrados (Movie 2, Movie 3 Filme suplementar 1). T. cruzi também aderiu às paredes do saco vitelino larval ( Figura 2, filme 2), uma estrutura que será posteriormente reabsorvida e tornar-se parte do intestino zebrafish22. Isto poderia ser semelhante ao que acontece durante a fase crônica da doença em seres humanos infectados, onde os parasitas são encontradas em cardiomyocytes e o digestivo sistema nervoso23,24. Quando não conectado, os parasitas drifted com o fluxo de sangue na mesma direção como as hemácias ( Figura 3, filme 4). Parasitas poderiam ser observadas em vasos de tamanhos diferentes dos peixes, mas foram mais abundantes no espaço pericárdico e na região adjacente gema que contém o fluxo de sangue ( Figura 2, Figura 3, suplementar filme 2).
Em 10 min post injeção, foi mais difícil de detectar formas única do parasita devido a sua distribuição ao longo da vasculatura e uma incapacidade para rapidamente tela anatômicas locais diferentes dos peixes devido a um campo de visão limitado a LSFM (em ampliação de 40 X ). Após 24h pós injeção (hpi), o sinal CFSE começa a se acumular na região perto do intestino em desenvolvimento (Figura complementar 1).

Figura 1: Injecção ideal. Imagem do (A) de larva 48 hpf mostrando o local da injeção ideal no ducto de Cuvier (seta amarela) usando um estereoscópio regular. (B) Magnified Ver os da caixa em um mostrando o duto de Cuvier (seta amarela). Barra de escala = 200 µm (A), (B) de 50 µm. Clique aqui para ver uma versão maior desta figura.
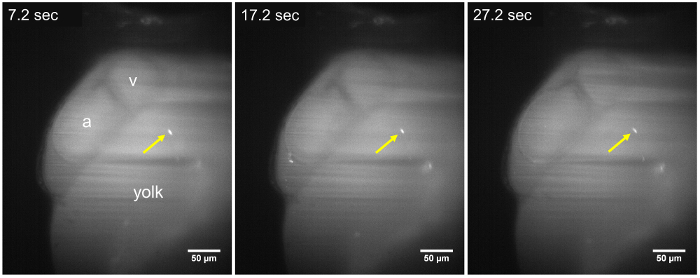
Figura 2: Fotos LSFM de um parasita estático em uma larva hpf 48. O parasita T. cruzi (seta amarela) permanece aderido às paredes do saco vitelino, durante a sequência de lapso de tempo (7,2 s, 17,2 s e 27,2 s), cerca de ~ 15 min após a injeção do parasita. Nenhuma mudança na posição do parasita é observada durante um período de aquisição de pelo menos 30 s. a, Atrium; v, ventrículo. Barra de escala = 50 µm. clique aqui para ver uma versão maior desta figura.
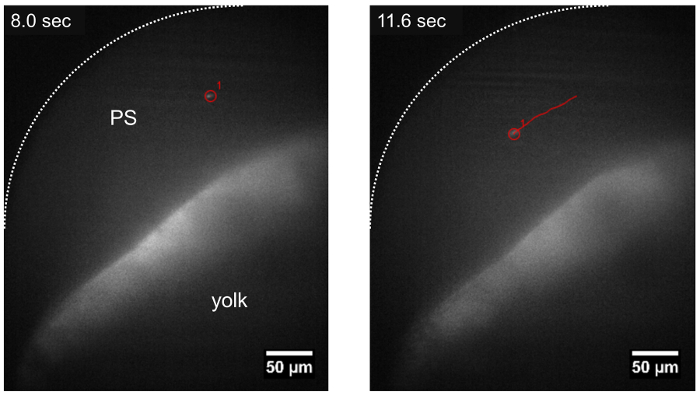
Figura 3: a trajetória de um parasita viajando no espaço pericárdico usando LSFM. O parasita T. cruzi pode ser rastreado enquanto à deriva no espaço pericárdico (PS), seguindo a direção do fluxo de sangue (faixa mostrada em vermelho) cerca de ~ 15 min após a injeção do parasita. Barra de escala = 50 µm. clique aqui para ver uma versão maior desta figura.
Filme 1: vale de circulação de sangue da gema em uma larva 48 hpf. Filme de uma larva 48 hpf, mostrando o vale de circulação do sangue ou ducto de Cuvier usando um estereoscópio regular. Diferentes regiões concentram-se durante o vídeo para mostrar células vermelhas do sangue circulando ao longo do duto. Seta amarela mostra o local da injeção ideal. Filme foi gravado cerca de 10-15 min após a injeção do parasita. Clique aqui para baixar o vídeo.
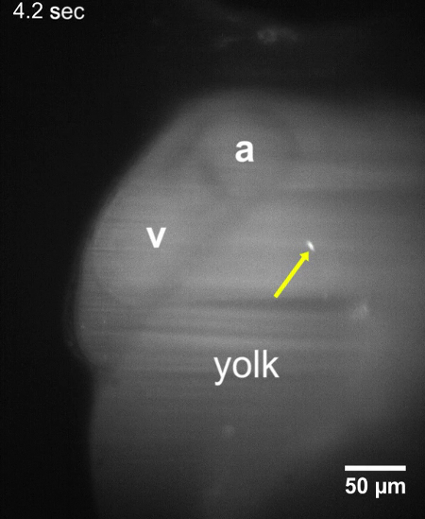
Filme 2: T. cruzi parasitas anexado às paredes do saco vitelino. Filme LSFM de uma exibição de hpf larva 48 que T. cruzi parasitas permanecem aderidas ao saco vitelino cerca de 10-15 min após a injeção do parasita. Nenhuma mudança na posição do parasita foi observada durante um período de aquisição de pelo menos 30 s. a, Atrium; v, ventrículo. Clique aqui para baixar o vídeo.

Filme 3: Parasitas de T. cruzi anexado às paredes do coração. Filme LSFM de uma larva 48 hpf mostrando aquele remai parasitas do T. cruzi n se adere à parede cardiovascular, apesar das contrações do coração forte cerca de 10-15 min após a injeção do parasita. Hemácias podem ser observadas como sombras negras arredondadas. Clique aqui para baixar o vídeo.

Movie 4: parasitas, movendo-se no espaço pericárdico. Filme LSFM o parasitas de T. cruzi de apresentando uma larva 48 hpf à deriva no espaço pericárdico. Dois parasitas podem ser rastreadas nos pontos de tempo diferente (ID 1, no círculo vermelho e 2 ID no círculo amarelo), a seguir uma trajetória semelhante. O filme foi gravado cerca de 10-15 min após a injeção do parasita. Clique aqui para baixar o vídeo.
Suplementar Figura 1: sinal fluorescente de acumulação de CFSE a gema de. Imagens de estereoscópio de uma larva de sua injetado em 48 hpf no ducto de Cuvier. Sinal fluorescente CFSE acumula-se progressivamente a gema, depois de dois dias pós injeção (48 hpi). Barra de escala = 500 µm. por favor clique aqui para baixar a figura.
Suplementar 1 filme: parasitas anexado às paredes e válvulas do sistema circulatório. Imagens de série de tempo estereoscópio de uma larva do tipo selvagem injetado em 48 hpf. Imagens são tomadas a intervalos 0,2 s capturando parasitas de T. cruzi , movendo-se em sincronia com as contrações do músculo cardíaco na válvula atrioventricular. Filme foi gravado cerca de 30 min após a injeção do parasita. Clique aqui para baixar o vídeo.
Suplementar Movie 2: parasitas em movimento e aderidas no espaço periventriculares e gema. Filme LSFM de uma larva 48 hpf apresentando T. cruzi parasitas à deriva ou aderido para o espaço pericárdico ou a gema. Observou-se uma visão de luz transmitida para os 5 primeiros s. Observou-se a vista de fluorescência de s 5.2-25,8. O filme foi gravado cerca de 10-15 min após a injeção do parasita. Clique aqui para baixar o vídeo.
Discussão
Este estudo destaca as vantagens do zebrafish como um modelo animal para estudar patógeno comportamento na vivo. Em particular, este estudo propõe um método para visualizar o patógeno de T. cruzi em seu ambiente natural: circulação hemático. O ambiente do microambiente circulatório em peixes é comparável dos mamíferos, e tripanossomatídeos têm evoluído mecanismos para viajar, evitando o sistema imunológico e anexar às células para a infecção em que ambiente25. Este protocolo oferece uma descrição de um procedimento ideal para a cultura do T. cruzi em uma linhagem de células humanas e subsequente isolamento das formas flagelar para rotulagem fluorescente. Em seguida, ele mostra as configurações apropriadas para a injeção bem sucedida dos parasitas no zebrafish transparente para depois montar e visualização usando LSFM. Finalmente, este protocolo oferece sugestões para a eficiente e eficaz na vivo de imagem da localização do parasita e movimento em circulação usando LSFM.
O flagelo dos tripanosomas emerge de sua região posterior, flui do corpo celular, e trava grátis na parte anterior do organismo26. T. cruzi se impulsiona acenando o flagelo à frente do corpo, que ondula o corpo inteiro do parasita. Movimento flagelar não só é indispensável para motilidade do parasita, como no caso do T. brucei27 (o agente causador da tripanossomíase africana), mas também é usado para infecção celular, como ficou demonstrado em T. cruzi5 ,28. Embora o zebrafish não são os hospedeiros naturais para T. cruzi, motilidade do parasita pode ser estudada em um sistema de circulação cardiovascular em desenvolvimento usando os protocolos descritos aqui. Além disso, existem espécies de tripanosomas que infectam ciprinídeos, a classe de zebrafish, tais como T. carassii e T. borreli25. Estas espécies de parasita poderiam ser usados para estudar em tempo real os movimentos e mecanismos de fixação destes tripanossomatídeos; tais estudos podem emprestar insight sobre o processo de infecção de células de mamíferos.
Neste estudo, injetado motile T. cruzi parasitas foram observados viajando através da circulação cardiovascular de peixe inoculados, movendo-se juntamente com eritrócitos opacos e aderindo às estruturas das paredes do sistema cardiovascular. Nós usamos um LSFM casa construída com um 10 X acromática longa distância de trabalho objetivo de ar (17,6 mm) para o braço de iluminação com uma abertura numérica de 0,25. Utilizou-se um 40 X objetivo de imersão água apocromático com uma abertura numérica de 0,8 e uma distância de trabalho de 3,5 mm para o braço de deteção. O objetivo da deteção estava imerso na câmara de amostra, enquanto o objetivo de iluminação foi fora da câmara. Um porto na câmara selada com uma lamela e cola óptica permitido para o feixe de iluminação a entrar na câmara, como retratado no Lorenzo et al 18 para iluminação, foi utilizado um laser DPSS 50 mW em 488 nm, cujo poder foi modulado por um filtro sintonizável óptico de acústico. Filtros compatíveis com proteína fluorescente verde (GFP) ou FITC será usado o caminho de deteção. Um microscópio de luz folha equipado com um suporte de amostra capilar (idealmente com rotação automática) e controle de temperatura da câmara de amostra deve ser adequado para esta aplicação. O microscópio deve ser alinhado e calibrado de acordo com as instruções do fabricante ou protocolos de laboratório do usuário padrão antes da aquisição, se necessário. Neste protocolo, controlamos o microscópio usando o SPIM software19.
É importante notar que, na circulação de zebrafish, acessório de parasitas de larvas é eficaz. Na veia cardinal, parasitas permaneceram associadas para até vários minutos; no coração, mantiveram-se válvulas e paredes, oscilando com as contrações do coração. Novos estudos continuam a fim de elucidar se o T. cruzi interage com as hemácias fluindo que deriva na direção do fluxo de sangue. Em vitro estudos anteriores mostraram que a presença de estruturas sólidas (ou seja, as células do sangue), ou aumento da viscosidade do líquido para imitar sangue em vitro, tem um efeito significativo sobre a motilidade e a velocidade do parasita 9.
Há muitas perguntas sobre o curso da infecção do T. cruzi em humanos após amastigotes escapar células fagocíticas, o tipo de célula infectada inicialmente29. Por exemplo, como é que eles chegam a seus órgãos-alvo? Quais são os mecanismos para o tropismo para os órgãos preferenciais, como cardíaco, digestivo e sistema nervoso central? Curiosamente, neste estudo os parasitas foram inicialmente fotografados no coração porque foi o local de maior densidade de parasitas. No entanto, o sinal CFSE posteriormente acumulada no intestino em desenvolvimento por injeção de pós 7 dias. Embora a anatomia dos peixes e mamíferos é diferente, os resultados deste estudo demonstram uma forma de tropismo, como observou-se que os parasitas exibiram tropismo em direção de órgãos-alvo preferencial conhecido apesar das diferenças dos. Uma significativa limitação deste estudo diz respeito a temperatura utilizada nos experimentos. Zebrafish larvas devem ser mantidas em torno de 28 °C durante todo o procedimento. Embora esta temperatura pode ser semelhante ao host de vetores (insetos da subfamília Triatominae), é completamente diferente dos mamíferos de sangue quente que compõem os hosts finais (em torno de 37 ° C). T. cruzi é conhecido por ter formas de vida flagelar em ambos os hosts; no entanto, é importante ter em mente que este fator pode ter um efeito no comportamento do animal vivo em.
Embora o sistema imune adaptativo de fish´s não é maduro até 4 semanas pós fertilização, o sistema imune inato é ativo no início de desenvolvimento10. Tão cedo quanto 48 ou 96 hpf, células fagocíticas foram observadas tendo engolido rotulado tripanosomas (dados não mostrados). Isso limita a janela de tempo para visualização do parasita. No entanto, se um estudo para se concentrar em avaliar a resposta imune fish´s, injeção em fases posteriores pode ser recomendada. Além disso, injeção de parasitas em linhas de peixe transgénicos com macrófagos rotuladas ou outras células do sistema imunológico podem ser útil no estudo de fixação do parasita e mecanismos de endocitose possível. É importante notar que, se os parasitas são rotulados com CFSE, rótulos de transgênicos célula não devem ser a GFP e um marcador no final do espectro amarelo ou vermelho é necessário.
Para avaliar a direção detalhada do movimento parasita, pode ser útil acompanhar sua trajetória em 3 dimensões (3D). Para visualização em 3D e reconstrução do processo, é necessário um sistema de alta velocidade. Com o equipamento utilizado no presente protocolo, só é possível visualizar os parasitas em um avião. Neste caso, priorizamos a manutenção da estabilidade do plano focal durante o movimento de parasita e sua trajetória de gravação em um avião.
A metodologia proposta aqui abre o caminho para investigar o comportamento do parasita na circulação cardiovascular. Em resumo, as etapas essenciais para parasitas fluorescentes ao vivo dentro do zebrafish larvas de imagem são:(i) uso de embriões adiantados hachurados (24-48 hpf) ou larvas ou animais entre 72-96 hpf com nenhuma pigmentação para que eles sejam transparentes e fácil injetar; (ii) as larvas a imagem logo que possível após a injeção para evitar afastamento do parasita por células fagocíticas; e (iii) focar o LSFM no site de interesse (por exemplo, região pericárdico) e manter o foco. Este novo procedimento permite a visualização de trypomastigotes em um ambiente comparável ao seu nicho de infecção natural, proporcionando pela primeira vez a possibilidade de estudar o T. cruzi em um organismo vivo.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pela Convocatoria Interfacultades de Vicerrectoría de Investigaciones de la Universidad de los Andese o programa da USAID investigação e inovação Fellowship. Agradecemos a Juan Rafael Buitrago e Yeferzon Ardila para assistência e manutenção de peixes.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Micropipette | Fisherbrand | 21-377-815 | |
| Agarose RA | Amresco | N605 | Regular |
| Agarose SFR | Amresco | J234 | Low Melting point |
| Aquarium salt | Instant ocean | SS15-10 | |
| Cell Count chamber | Boeco | Neubauer | |
| Cell culture flasks | Corning | 430639 | |
| Centrifuge | Sorvall | Legend RT | |
| CFSE | ThermoFisher | C34554 | |
| Detection objective | Nikon 40x 0.8NA | 40x CFI APO NIR | |
| DMEM medium | Sigma-Aldrich | D5648 | |
| Dumont #5 fine forceps | World precision Instruments | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Fetal calf serum (FCS) | Eurobio | CVFSVF00-01 | |
| Filter | Chroma | ET-525/50M | |
| Glass capillaries for embryo mounting | Vitrez Medical | 160215 | |
| Glass capillaries for pulling needles | World precision instruments | TW100-4 | |
| Glucose | Gibco | A2494001 | |
| HEPES | Gibco | 156300-80 | |
| Incubator | Thermo Corporation | Revco | |
| Larval microinjection mold | Adaptive Science Tools | I-34 | |
| Laser | Crystalaser | DL488-050 | |
| L-glutamine | Gibco | 250300-81 | |
| Methylene blue | Albor Químicos | 12223 | |
| Micromanipulator | Narishige | MN-153 | |
| Micromanipulator system | Sutter Instrument | MP-200 | For LSFM |
| Micropipette puller device | Narishige | PC-10 | |
| Microscope | Olympus | CX31 | |
| Microscope (inverted) | Olympus | CKX41 | |
| Multipurpose microscope | Nikon | AZ100M | |
| Neubauer counting chamber | Boeco Germany | ||
| Penicillin-streptomycin | Gibco | 15140-163 | |
| Petri dish 94x16 | Greiner bio-one | 633181 | |
| Plastic pasteur pipette | Fisherbrand | 11577722 | |
| Rotation stage | Newport | CONEX-PR50CC | |
| RPMI-1640 medium | Sigma-Aldrich | R4130 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Stereoscope | Nikon | C-LEDS | |
| Tricaine (MS-222) | Sigma-Aldrich | 886-86-2 | |
| TRIS | Amresco | M151 | |
| Trypsin-EDTA (0.25%) | Gibco | R-001-100 | |
| Tubes 15 ml | Corning | 05-527-90 |
Referências
- Bern, C. Chagas's Disease. New England Journal of Medicine. 373 (5), 456-466 (2015).
- Sosa Estani, S., Segura, E. L., Ruiz, A. M., Velazquez, E., Porcel, B. M., Yampotis, C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. The American Journal of Tropical Medicine and Hygiene. 59 (4), 526-529 (1998).
- Rosas, F., Roa, N., Cucunuba, Z. M., Cuellar, A., Gonzalez, J. M., Puerta, J. C. Chagasic Cardiomyopathy. Cardiomyopathies - From Basic Research to Clinical Management. , (2012).
- Finkelsztein, E. J., et al. Altering the motility of Trypanosoma cruzi with rabbit polyclonal anti-peptide antibodies reduces infection to susceptible mammalian cells. Experimental Parasitology. 150, 36-43 (2015).
- Martins, R. M., Covarrubias, C., Rojas, R. G., Silber, A. M., Yoshida, N. Use of L-Proline and ATP Production by Trypanosoma cruzi Metacyclic Forms as Requirements for Host Cell Invasion. Infection and Immunity. 77 (7), 3023-3032 (2009).
- Engstler, M., et al. Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. 131 (3), 505-515 (2007).
- Uppaluri, S., et al. Impact of Microscopic Motility on the Swimming Behavior of Parasites: Straighter Trypanosomes are More Directional. PLoS Computational Biology. 7 (6), e1002058 (2011).
- Heddergott, N., et al. Trypanosome Motion Represents an Adaptation to the Crowded Environment of the Vertebrate Bloodstream. PLoS Pathogens. 8 (11), e1003023 (2012).
- Gratacap, R. L., Wheeler, R. T. Utilization of zebrafish for intravital study of eukaryotic pathogen–host interactions. Developmental & Comparative Immunology. 46 (1), 108-115 (2014).
- Meijer, A. H., Spaink, H. P. Host-Pathogen Interactions Made Transparent with the Zebrafish Model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Huisken, J. Slicing embryos gently with laser light sheets. BioEssays. 34 (5), 406-411 (2012).
- Westerfield, M. . The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Vargas-Zambrano, J. C., Lasso, P., Cuellar, A., Puerta, C. J., González, J. M. A human astrocytoma cell line is highly susceptible to infection with Trypanosoma cruzi. Memórias do Instituto Oswaldo Cruz. 108 (2), 212-219 (2013).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. JoVE (Journal of Visualized Experiments). (25), e1115-e1115 (2009).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6, 22 (2011).
- Edelstein, A. D., Tsuchida, M. A., Amodaj, N., Pinkard, H., Vale, R. D., Stuurman, N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 1 (2), e10 (2014).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer Mounting for Long-term Light Sheet Microscopy of Zebrafish. Journal of Visualized Experiments. (84), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ng, A. N. Y., et al. Formation of the digestive system in zebrafish: III. Intestinal epithelium morphogenesis. Developmental Biology. 286 (1), 114-135 (2005).
- Higuchi, M. D. L., et al. Correlation between Trypanosoma cruzi parasitism and myocardial inflammatory infiltrate in human chronic chagasic myocarditis: Light microscopy and immunohistochemical findings. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 2 (2), 101-106 (1993).
- Vago, A. R., Silva, D. M., Adad, S. J., Correa-Oliveira, R., d'Avila Reis, D. Chronic Chagas disease: presence of parasite DNA in the oesophagus of patients without megaoesophagus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 97 (3), 308-309 (2003).
- Wiegertjes, G. F., Forlenza, M., Joerink, M., Scharsack, J. P. Parasite infections revisited. Developmental & Comparative Immunology. 29 (9), 749-758 (2005).
- De Souza, W. Basic cell biology of Trypanosoma cruzi. Current Pharmaceutical Design. 8 (4), 269-285 (2002).
- Langousis, G., Hill, K. L. Motility and more: the flagellum of Trypanosoma brucei. Nature Reviews. Microbiology. 12 (7), 505-518 (2014).
- Johnson, C. A., et al. Cellular response to Trypanosoma cruzi infection induces secretion of defensin α-1, which damages the flagellum, neutralizes trypanosome motility, and inhibits infection. Infection and Immunity. 81 (11), 4139-4148 (2013).
- Magalhães, L. M. D., Viana, A., Chiari, E., Galvão, L. M. C., Gollob, K. J., Dutra, W. O. Differential Activation of Human Monocytes and Lymphocytes by Distinct Strains of Trypanosoma cruzi. PLoS neglected tropical diseases. 9 (7), e0003816 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados