Method Article
조사 Trypanosoma cruzi 운동 비보 를 동물 모델로 서 애벌레 Zebrafish의 설립
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜에 붙일 레이블된 T. cruzi 투명 zebrafish 애벌레로 주입 했다 그리고 기생충 운동 성에서 관찰 되었다 vivo에서 빛 시트 형광 현미경 검사 법을 사용 하 여.
초록
샤 가스 병은 기생 감염 기인 Trypanosoma cruzi, 그 운동 뿐만 아니라 뿐만 아니라 세포 바인딩 및 침략에 대 한 지역화를 위해 중요 하다. T. cruzi 의 연구에 대 한 현재 동물 모델 기생충 vivo에서 인간에서 감염의 초기 단계 동안 이해 기생충 행동에 대 한 도전을 대표의 한정 된 관측을 허용 한다. 이 protozoan flagellar 단계 벡터에 포유류 호스트, 하지만 아무 연구의 운동 성에서 vivo에서설명 하는. 이 프로젝트의 목적은 혈관 시스템에서 T. cruzi 운동 성을 평가 하는 라이브 척추 zebrafish 모델을 구축 했다. 투명 zebrafish 애벌레 붙일 주사 했다 trypomastigotes를 표시 하 고 가벼운 시트 형광 현미경 검사 법 (LSFM), 높은 광학 해상도 살아있는 생물을 시각화 하는 비 침범 성 방법을 사용 하 여 관찰. 기생충이이 기술은 photodamage confocal에 비해 상대적으로 낮은 위험 때문에 시간의 연장된 기간에 대 한 구상 될 수 또는 epifluorescence 현미경 검사 법. T. cruzi 기생충 다른 크기의 혈관에 노 른 자 라이브 zebrafish의 순환 시스템에서 관찰 되었다. 그들은 또한 보일 수 있었다 노른자위 낭 벽에 그리고 심장 수축과 관련 된 강력한 힘에도 불구 하 고 것 밸브에 연결 된. T. cruzi의 LSFM-접종된 zebrafish 애벌레 기생충 순환 시각화 하는 데 사용할 수와 그들의 차 있는 굴곡 운동, 마이그레이션 패턴 및 살아있는 동물의 심장 혈관 시스템의 동적 환경에서 운동 성을 평가 하는 귀중 한 방법입니다.
서문
샤 가스 병은 protozoan 기생충에 의해 발생 T. cruzi. 약 6 7 백만 명이 전세계 T. cruzi와 감염 됩니다. 질병, 라틴 아메리카에서 주로 전송 하지만 미국, 캐나다 그리고 많은 유럽 뿐만 아니라 일부 서 부 태평양 국가, 주로 감염 된 개인1의 이동 때문에 보고 되었습니다. Chagas 이며 주로 벡터 부담 "키스 버그"로 일반적으로 알려진 Triatominae subfamily에 hematophagic 곤충의 배설물과 접촉 하 여 인 간에 게 전송. 그러나, T. cruzi 또한 수혈, 아이, 또는 기생충2오염 된 식품의 섭취로 어머니 로부터 수직 전이 통해 전송할 수 있습니다. 급성 단계 감염과 주로 무 증상 또는 constitutively 증상은 6에서 8 주까지 지속 후 면역 시스템의 약혼 기생충 부하를 제어 하지만 감염3를 완전히 제거 하지는 않습니다. 대부분의 개인 입력 만성 무 증상 단계; 그러나, 거의 30%의 환자는 심장 시스템 빈도가 소화 및 신경 시스템은 손상 된4징후 만성 단계, 개발. 이후 아무 백신을 사용할 수 있으며 샤 가스에 대 한 두 가지 효과적인 약물이 시나리오 질병 치료 및 제어에 대 한 도전 선물 한다: benznidazole 그리고 nifurtimox. 두 치료는 장기간된 관리를 요구 하 고 심각한 부작용2를 할 수 있습니다.
기생 마이그레이션, 세포 부착, 및 호스트; 내에서 침공을 결정 하는 열쇠 이다 vivo에서 동작 T. cruzi 의 동작의 이해를 증가 vivo에서 모델의 부족 소설 치료 접근의 개발을 제한합니다. T. cruzi 감염의 학문 생체 외에서 trypomastigotes의 운동에 바인딩 호스트 세포 막 및 후속 셀룰러 침공5에 대 한 중요 하다는 것으로 나타났습니다. Trypomastigotes 취약 셀 라인 공동 문화에 에너지 고갈 세포 침공6을 줄이기 위해 표시 되었습니다. 흥미롭게도, trypanosomatids에서 flagellar 운동 또한 기생충 특정 항 체7에 대 한 회피 메커니즘으로 특징 되어 있다.
Flagellar 운동 성 광범위 하 게 공부 생체 외에서 Trypanosoma brucei, 아프리카 Trypanosomiasis8원인이 밀접 하 게 관련 된 기생충에에서 되었습니다. 이러한 trypanosomes의 운동 성의 생체 외에서 연구 보여주었다 혈액 이나 체액, 점도 등 혈액 세포의 장애물의 존재의 조건의 시뮬레이션 기생충 전진 운동9에 대 한 중요 한 . 로 서 아직 그것은 되지 않았습니다 vivo에서혈 류 량에서 기생충의 움직임을 시각화 수 없습니다.
Zebrafish 애벌레는 호스트 병원 체 상호 작용 비보를 공부 하는 강력한 모델입니다. 그들은 작은, 저렴 한, 그리고 인상 Chagas 질병에 대 한 다른 설립된 척추 모델에 비해 상대적으로 쉽게입니다. Zebrafish는 타고 난 및 적응형 면역 시스템, 인 간에 게 유사한 하지만 그들의 적합 한 면역 계통 4 일 게시물 수정 (dpf)에서 개발 하기 시작 하 고 다른 몇 주10에 대 한 성숙 하지 않습니다. 초기 개발 하는 동안 때만 세포, 즉각적인 면역 간섭10없이 기생충 행동 공부에 대 한 큰 창이 있다. 그러나, 병원 체 행동을 공부 하 고 대 척추 동물 모델로 zebrafish 애벌레를 활용의 가장 큰 장점은 현미경 검사 및11이미징에 대 한 의무가 그들을 만드는 그들의 광학 투명도에 있다. 또한, 물고기 유전자를 조작 하 여러 도구가 있습니다. 예를 들어 캐스퍼 부담 없이 착 색을 완전히 투명 하 고 개별 장기의 시각화 및 삽입 된 셀12의 실시간 추적 유용 동물 만들기와 제 브라의 돌연변이 라인입니다.
라이브 zebrafish confocal 사용 하 여 또는 epifluorescence 현미경 검사 법에 신속 하 게 움직이는 기생충의 종 적 관찰의 주요 제한 높은 수집 속도 및 큰 침투 깊이 좋은 이미지 품질 및 이미지의 불가능성에서 속 인 다 photodamage의 위험입니다. 밝은 시트 형광 micsroscopy (LSFM)이이 관측을 허용 하도록 이러한 한계를 극복 하는 새로운 이미징 기술입니다. 형광 및만 탐지 목표의 초점 평면 조명 두 번째 직교 조명 목표를 검출 하기 위하여 하나의 목표를 사용 하 여 고해상도 광학 섹션 confocal 현미경, 하지만 함께 하는 크게 감소 photodamage, 심지어 epifluorescence 현미경 검사 법13에 관하여. 여기에 사용 되는 LSFM 기술은 단일 평면 조명 현미경 (SPIM), 빛의 얇은 시트 zebrafish 애벌레 내 단일 면을 조명 이라고 합니다.
이 방법론의 목적은 애벌레 zebrafish T. cruzi 운동 성 및 비보에관련된 동작을 이해 하기 위한 실행 가능한 비 감염 모델 구축 하는 것입니다. 이 위해 우리는 투명 zebrafish 애벌레 붙일 레이블된 trypomastigotes, 세포 형태, 인간의 감염에 대 한 책임을 주사 하 고 zebrafish의 심혈 관 순환에 T. cruzi 의 움직임을 확인 LSFM를 사용 하 여.
프로토콜
는 다음 프로토콜 기관 동물 관리 및 사용 위원회의 로스 안데스 대학 (CICUAL)에 의해 승인 했다. Biosafety 수준 2 (BSL-2) 병원 체와 오염을 방지 하기 위해 지침을 엄격 하 게 따라야 한다 T. cruzi.
참고: 동물 관리 및 유지 보수: 캐스퍼 zebrafish, zebrafish의 유전자 변형된 변형 (Danio rerio) 모든 발달 단계에 그들의 귀중 한 광 투명성 때문이 프로토콜에 사용 됩니다. 물고기는 최적의 치료 조건을 종 14, 14 h 빛-10 h 어두운 사이클에서 28 ± 1 ° C, pH (7.0-7.4)에 대 한 제어 멀티 탱크 반복 물 시스템 사용 하 여 조작 됩니다. 동물 라이브 소금물 새우 (Artemia 살 리 나)와 함께 하루에 두 번 먹이 이며 음식 양육과 풍부한. 모든 프로토콜 대학 데 로스 안데스 (C.FUA_14-017)에서 CICUAL에 의해 승인 했다.
1. 계란 물 준비
- 준비 0.6 g/L 수족관 소금에 역삼 투 (RO) 또는 이온된 (DI) 물과 0.01 mg/L methylene 청색을 솔루션에 추가.
참고: 측정된 전도도 해야 400-500 µS/c m의 pH 7.2 7.9에서 수준. 낮은 pH, 몇 시간 동안 달걀 물 aerate.
2. Tricaine 재고 솔루션의 준비
97.9 증 류 물 (ddH 2 O)에서 400 mg tricaine (MS-222)을 용 해 하 여- 준비 0.4 %tricaine 재고 솔루션. 가루는 완전히 해산 후 7.0 2.1 mL 1 M를 사용 하 여 pH 조정 트리 (pH 9.0)과 솔루션을 냉장 보관.
3. 준비 1.0%의 저 융 점 Agarose
1.0%의 최종 농도에- 디졸브 낮은 녹는 포인트 agarose 분말 달걀에 물. 전자 레인지에 또는 연속 교 반 agarose 솔루션 유형이 나타날 때까지 함께 뜨거운 접시에 혼합물을가 열.
- 주 보다는 더 이상에 대 한 4 ° C에서 aliquots 저장.
4. 분석 결과 및 배아 컬렉션 짝짓기
- 주사 3 일전 matings 사육 탱크에서 남성과 여성의 물고기의 건강 한 쌍을 사용 하 여 설정. 유리 구슬 및 인공 식물 농축 산란을 향상 시킵니다. Matings를 오후 동안 설정 해야 하며 하룻밤 왼쪽.
- 다음날 아침, 스 트레이너를 통해 탱크를 배수 하 고 계란 물으로 계란을 세척 하 여 생성 된 달걀을 수집 합니다. 여과기를 반전 하 고 페 트리 접시에는 스 트레이너를 통해 계란 물을 붓는 의해 모든 계란을 제거 합니다. 태아의 건강을 유지에 어떤 파편 및 전송 플라스틱 피 펫으로 죽은 태아를 제거 하 여 그들의 물을 청소.
- 는 Zebrafish 준비 표준 15에 따라 배아의 개발을 허용 하도록 28.5 ° C의 안정적인 온도에서 인큐베이터에 배아를 전송. 하루에 두 번 배아를 검사 하 고 폐기 inviable 계란 클러치의 건강을 유지 하.
5. 태아 Dechorionation
참고: 배아는 하지 주입의 때에 부 화 하는 경우이 절차는 필요. 이 절차에서는 " 애벌레 " 48 h에서 자신의 chorion 중 동물 게시물 수정 (hpf) 이후는.
- 실험 당일 해 stereoscope 아래 건강 한 배아를 포함 하는 페 트리 접시를 놓고.
- 잡아는 chorion의 반대 끝 두 날카로운 집게 (Dumont #5), 하 고 부드럽게 눈물과 풀은 chorion를 엽니다. 약 5-6의 애벌레는 한 번에 주입 하 고 일반적으로 3-4 군데.
- 는 chorions 전송 피 펫을 사용 하 여 물에서 제거.
6. 사출 재료 준비
- 준비 1.0 m m 얇은 벽 유리 모 세관 및 micropipette 끌어당기는 장치를 사용 하 여 다음 설정을 가진 바늘: 2 가벼운 무게 + 1 무거운 무게, 2 mm 최고 풀 + 5mm 아래쪽 풀, 75.9 ° C (1 단계) + 78.2 ° C ( 단계 2)입니다. 클레이 모델링의 스트립에 페 트리 접시에 바늘을 저장 합니다. 이상적인 바늘 T. cruzi로 좁은 팁 있어야 약 20 x 1-3 µ m를 측정 하 고 쉽게 바늘을 통해 전달 합니다. 팁의 길이 다를 수 있습니다: 긴 팁 깊은 구조를 도달 하는 데 유용 하지만 짧은 팁 사용자에 대 한 주입을 쉽게 더 엄격한 됩니다.
참고: 바늘 끝 크기 사용 온도에 따라 달라 집니다: 2 단계에 대 한 더 높은 온도 결과 길고 미세한 팁. - 는 DdH 2 O에서에서 1.5 %agarose 솔루션을 준비 하 고 10 cm 배양 접시에 부 어. 약 1.0 cm의 깊이 커버.
- 조립식된 microinjection 몰드는 agarose 위에 놓고 그것을 강화 하기 위해 허용.
- 조립식된 microinjection 금형 밖으로 리프트 및 4 ° c.에 달걀 물 저장을 위해 추가 그러면 밖으로 건조에서 agarose.
- 4 150 mg/l. 저장소의 최종 농도에 tricaine 재고 솔루션을 추가 달걀 물 ° c.
7. 기생충의 성장 세포 배양
- 기생충 바르 가스-Zambrano 외에 설명 된 방법을 사용 하 여 인간의 astrocytoma 셀 라인 (CRL-1718)에 유지 됩니다 16
- T25 문화 플라스 크에 인간 세포의 문화를 시작 (면적 = 25 cm 2) 2 x 10 5 또는 4 x 10 5 셀 송아지 태아 혈 청 (FCS)의 10%와 RPMI 1640 매체의 4 mL의 조밀도에 보충 2 mM L-글루타민, 4.5 g/L 포도 당, 10 mM HEPES, 1 mM pyruvate, 및 1% 페니실린-스 (라고 " 미디어 완료 "). 5% CO 2 환경에서 37 ° C에서 astrocytoma 문화를 품 어.
- 는 단층 confluent 일단 3 분에서 37 ° C. 시각적으로 표 셀 분리, 배양에 의해 트립 신-EDTA의 0.25%의 2 개 mL를 사용 하 여 셀을 분리 하 고 15 mL 튜브에 10% fcs RPMI 1640의 3 mL를 사용 하 여 트립 신 솔루션 차단.
- 분리기 1350 x g.에서 5 분 동안 세포 현 탁 액
- 15 mL 튜브에 1350 x g 22에서 5 분 동안 원심 분리기 DMEM 매체에 결과 세포 펠 릿을 세척 ° c.
- Neubauer 챔버와 40 X 확대 가벼운 현미경에 생존 확인에 수동으로 셀.
- 부드럽게 다시 일시 중단 세포 완전 한 미디어의 4 ml에서 작은 고 그것을 사용 하 여 새로운 세포 배양 T25 문화 플라스 크 당 2 × 10 5 셀을 사용 하 여 만들려고.
8. T. cruzi 문화 및 라벨링
- 기생충은 원래는 감염 된 인간에서 얻은 고 T. cruzi 다 스트레인 (MHOM/CO/01/다)로 변형 유전자 개별 입력 단위 (DTU) TcI 16. 인간의 astrocytoma 셀 문화 상쾌한 1350 x g.에서 5 분 동안 원심 분리기에서 움직이는 기생충을 수집 하는 경작의 3 또는 4 일 후 폐기 매체.
참고: 완전 한 매체에서 기생충 다시 astrocytoma 셀 T25 문화 플라스 크와 1:1 비율에 문화에 대 한 사용할 수 있습니다. - 부드럽게 다시 10 ml 살 균 1 인산 염 버퍼 식 염 수 (PBS) 0.1 %FCS 5 분 동안 원심 분리기 x 1350 x g.에서 펠 릿 일시 중단
- 는 상쾌한 삭제 하 고 다시 1 mL의 PBS에 일시 중지. 받아 Neubauer 챔버에 free-swimming 기생충 카운팅을 위한 10 µ L.
- 다시 일시 중단 된 기생충 (990 µ L)의 나머지를가지고 고 Carboxyfluorescein Diacetate Succinimi의 1 µ L을 추가dyl 에스테 르 (CFSE), 최종 농도 5.0 µ M. 실 온에서 10 분 동안 품.
참고:에서 5mm CFSE 주식 해야 한다 aliquoted 유지-20에 ° c. - 작은 기생충 (1350 x g, 5 분). 튜브를 터치 하 여 기생충 펠 릿을 다시 구성 하 고 10 ml 1 x PBS-0.1% FCS (1350 x g, 5 분) 이후 스핀 뒤의 세척.
- 는 상쾌한 취소 및 약의 최종 농도 얻기 위해 적절 한 볼륨 1 X PBS에 부드럽게 다시 중단 레이블이 기생충 펠 릿 주사에 대 한 10-20 기생충/nL.
- 작은 볼륨을 사용 (∼ 10 µ L, 1 x 10 4-2 × 10 4 기생충 약)의 생존 능력을 평가 라벨 trypomastigotes. 거꾸로 형광 현미경 기생충의 직접적인 시각화를 위해 사용할 수 있습니다. 전송된 빛 모드에서 기생충 이동 확인 하십시오. 형광 모드를 사용 하 여 Fluorescein Isothiocyanate (FITC) 필터 기생충 라벨 평가.
9. Zebrafish 애벌레 주입
- 기생충 로드
- 물의 resuspension (100 µ L)에서 기생충의 10 µ L을 10 µ L microloader 피 펫 팁을 사용 하 여 밀봉된 유리 바늘에 그들을 로드.
- 는 micromanipulator의 바늘 홀더 유리 바늘 삽입, 마그네틱 스탠드를 사용 하 여 및 배치는 stereoscope 옆.
- 무딘 오픈 만드는 바늘을 잘라 stereoscope 아래 좋은 집게를 사용 하 여 종료 하 고 1 양의 주사를 놓기 크기 측정 nL (이것이 미네랄 오일 17에서 측정 시에 m m 0.12 0.13의 구슬 지름에 해당). 더 팁은 바늘 구조에 도달할 수 있도록 선호는 조직 손상 없이 물고기 깊숙한. 이 프로토콜에 무뚝뚝한 바늘은 사용 하지만, 경사진된 바늘 뿐만 사용할 수 있습니다.
- 장착
- 48의 애벌레 Anesthetize hpf, 150 mg/L tricaine와 함께. 터치, 응답 하지 않는 확인 하지만 심장 박동 확인.
- Microinjection agarose 형 가로 위치에 있는 애벌레를 배치.
- 는 stereoscope 옆 바늘 홀더 놓고는 바늘의 팁 보기의 필드의 중앙에는 micromanipulator를 조정 합니다. 바늘 팁 애벌레 노 른 자는 단계 6.2-6.4에서에서 준비 하는 페 트리 접시를 이동 합니다. 심장 박동을 계속 유 충의 상태를 확인 하십시오.
- 다음과 같이 microinjector 값을 설정: 사출 9.6 파운드 당 인치 (psi) 압력, 압력 개최: 20 psi; 게이팅의 100 밀리초 범위 1.9 (10.9 ms에 해당)의 기간 값. 주사의 볼륨 1-3 nL, 약 10-20 기생충/nL과 사이 여야 합니다.
10. 기생충의 주입
- 넣기 어의 덕트에 노른자위의 우수한 앞쪽 부분에 물고기. 이 단계는 주입 후 동물 생존을 위해 연습 한다. 성공적으로 5-6 애벌레를 주사를 약 10 분 걸립니다.
- 컨트롤, 1-2 애벌레 같은 차량 볼륨 (1 x PBS) 주입.
- 신선한 계란 물에 유 충을 즉시 전송.
11. LSFM 장착의 주입 애벌레
- 빈 페 트리 접시에 기생충을 주입 하는 유 충을 전송 하 고 주변 물 플라스틱 피 펫과 흡수 성 종이 조심 스럽게 제거. 낮은 용 해 점 agarose preheated 1.0%의 100 µ L를 즉시 추가 (agarose 준비를 위한 3 단계를 참조) 유 충을 커버. agarose 40 아니다 보장 ° c.
- 1.0 m m 유리 모 세관 내부 직선 와이어를 삽입 하 고 수직 위치에서 유 충을 빨 플런저로 그것을 사용 합니다. 유 충의 위 agarose의 작은 금액을 두고 있는지 확인 하십시오. (이것은 몇 분 필요) 유 충을 노출 하기 전에 agarose 굳은 때까지 기다립니다. 필요한 경우 유 충 아래 초과 agarose를 밀어 하 고 끄고 잘라
- 는 현미경 샘플 홀더에 모 세관을 배치 하 고는 모 세관에서 무료로 응답 될 때까지 유 충을 포함 하는 끝에 밖으로 밀어. 표본 실 tricaine 솔루션 (150 mg/L)와 28에 설정 온도 가득 한다 ° c.
- 위치는 XYZ micromanipulator 시스템을 사용 하 여 검색 목표의 눈동자 앞 유 충. 세로 축에 대해 회전, 대 회전 무대를 사용 합니다. 유 충의 위치에서 이루어져야 한다 애벌레 구조를 명확 하 게 식별 하기 위해 전송된 빛 모드.
12. LSFM 이미징의 주입 기생충
- 형광 하
- 변경 모드 조명 강도 photodamage 감소 및 시간 분해능을 최적화 노출 시간 조정 하 고. 이러한 특정 실험에 대 한 샘플 2.8-3.0 mW의 힘을 사용 하 고 200 ms 6.45 µ m 픽셀와 검출 파장에서 ~ 70%의 양자 효율을 카메라를 사용 하 여 각 프레임을 노출. 이러한 설정은 약 5 프레임/s의 높은 가능한 숫자 조리개와 목표를 사용 해야 적절 하 게 노출 된 이미지에 발생 한다.
- 는 관심이 (ROI)의 비디오 수집을 시작합니다. 우리의 경우에, 기생충은 관찰 밸브에 연결 된 자유롭게 움직이는 심장 주변. 그것은 시간, 단일 면의 비디오를 하거나 micromanipulator 또는 piezo galvo 시스템 기생충 이동 하는 동안 다른 비행기에 초점을 사용 하 것이 좋습니다.
참고:이 절차는 짧은 수집 시간 최대 2 시간으로 유용 합니다. 장기 수집에 대 한 애벌레 거치 되어야 한다 사용 하 여 대체 방법을 20.
13. 이미지 처리 및 인수 데이터 분석
참고: 이미지 처리 2.90 g h z 프로세서, 8.00 GB의 메모리, 그리고 1.00 GB의 메모리와 비디오 카드는 개인용 컴퓨터에서 수행 되었다.
- 데이터 집합 이미지 프로세싱 소프트웨어 선택의. 오픈 소프트웨어 피지 LSFM 데이터 처리 및 분석 21 좋습니다.
- 이미지 분석 소프트웨어에는 이미지를 향상 시키기 위해 밝기 및 대비 레벨을 조정.
참고: 고정 된 매개 변수는이 경우에 사용 하지만 선택 된 " 자동 " 옵션은 초기 향상을 얻기 위해 유용할 수 있습니다. - ROI 선택.
참고: 개별 기생충을 추적, 피지는 모두 수동 및 자동 추적 플러그인을 사용할 수.
14. 몇 군데 애벌레 복구
- agarose를 사용 하 여에서 신중 하 게 유 충 제거 미세 집게와 머리 루프 도구. 15 분 28 ± 0.5 ° c.에 인큐베이터에 유 충을 반환 후 신선한 계란 물과 복구에 대 한 확인을 다시 물고기를 전송
- 또는 tricaine의 과다와 군데 애벌레를 안락사를 진행 합니다. 그런 다음, 염소의 솔루션에 애벌레를 소개 (6.15 %NaClO) 기생충을 죽 일 분. 기관에 따라 처분 ' s 표준 프로토콜.
결과
주입에 대 한 최적의 조건:
Zebrafish 애벌레의 그룹 24, 48, 72, 96, 및 120에 주입 했다 hpf, 다른 해 부 사이트에서 그리고 그들의 생존은 5 일 동안 매일 시험 되었다. 배아 24에 주입 후 5 일 포스트 주입, hpf 했다 6.25% (2/32) 생존, 95% (38/40) 48에 주입 하는 애벌레의 hpf 살아남은 반면. 컨트롤, 애벌레는 1 x PBS와 차량으로 주입 했다. 차량 주입 하 고 기생충을 주입 애벌레, 물고기의 생존 율에 더 종속 기생 효과 나타내는 사이 생존에 차이가 있었다 (p = 0.08). 72-120 hpf 사이 주입 애벌레 지속적인 주입 볼륨에서 48 hpf 주입 애벌레에 비해 생존 율을 했다. 여기에 제시 된 모든 절차에 대 한 48 hpf 애벌레는 조작 하는 데 개발 기관과 분명 손상 없이 쉽게 꿰 뚫을 수 피부 주입 후의 그들의 용이성으로 인해 사용 되었다.
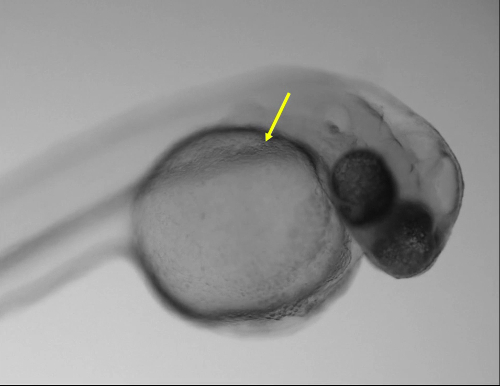
48에 주입 하는 애벌레 hpf 했다 근육, hindbrain 심, otic 소포, notochord, 및 노 른 자 삭에서 어의 덕트 꼬리 pericardial 공간에 주입. 다른 해 부 사이트에 주입 하는 애벌레의 생존에 차이가 있었다. 그러나, 주입 하는 빠르고 쉬운 지역 어의 덕트 (그림 1, 영화 1) 노 른 자 골목의 앞쪽 부분에 위치한 했다. 해당 사이트에 주입 수 중요 한 구조에 상해의 더 낮은 위험과 높은 볼륨의 소개. 또한, 24-72 hpf, 사이이 지역 개발 맥 관 구조 및 심장11에 직접 액세스 하는 최적의 사이트입니다.
LSFM를 사용 하 여 기생충 시각화:
8-10 분에 어 덕트 T. cruzi 의 주입 다음, 내 기생충 zebrafish 애벌레 LSFM를 사용 하 여 그들의 CFSE 형광 신호 및 애벌레의 광학 투명도에 확인 되었다. 접종, 이후 기생충 순환 시스템 또는 혈액의 흐름 (그림 2, 그림 3)의 방향으로 여행 주위 벽에 준수도 관찰 되었다. 그것은 심장 수축, 기생충의 준수에 대 한 분자 메커니즘 (영화 2, 영화 3 우리의 척추 동물 모델에서 더 효과적일 수도 있습니다 나타내는 함께 진동 하는 기생충 같은 것 밸브, 심장 구조에 연결 된 때 추가 동영상 1). 또한 T. cruzi 나중 reabsorbed 되며 zebrafish 내장22의 일부가 되는 구조 ( 그림 2, 영화 2) 애벌레 노 른 골목의 벽에 준수 됩니다. 이것 수 있습니다 감염 된 인간, 만성 질환 단계 동안 발생 하는 유사한 cardiomyocytes와 소화 신경23,24에서 기생충을 발견 하는. 하지 때, 기생충 적혈구 ( 그림 3, 영화 4)과 같은 방향으로 혈액의 흐름을 통해 떠내려. 기생충, 물고기의 다른 크기의 혈관에서 관찰 될 수 있었다 그러나 pericardial 공간 및 혈액 흐름 ( 그림 2, 그림 3, 보충 영화 2)를 포함 하는 인접 한 노른자위 지역에서 더 풍부 했다.
10 분 포스트 주입에 그것은 더 어려운 자리 단일 형태의 맥 관 구조, 그리고 신속 하 게 화면 다른 해 부 사이트 (40 X 확대에서 LSFM의 제한 된 시야 때문에 물고기의 무 능력에 따라 그들의 유통으로 인해 기생충 ). 24 시간 후 분사 (hpi)을 게시, CFSE 신호 개발 소장 (보충 그림 1) 근처 지역에서 축적 시작 합니다.

그림 1: 최적의 주입 사이트. (A) 이미지 애벌레 48의 hpf 일반 stereoscope를 사용 하 여 어 (노란색 화살표)의 덕트에 최적의 주입 사이트를 보여주는. (B) 확대의 상자를 보여주는 어 (노란색 화살표)의 덕트에 볼. 눈금 막대 = 200 µ m (A), 50 µ m (B). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
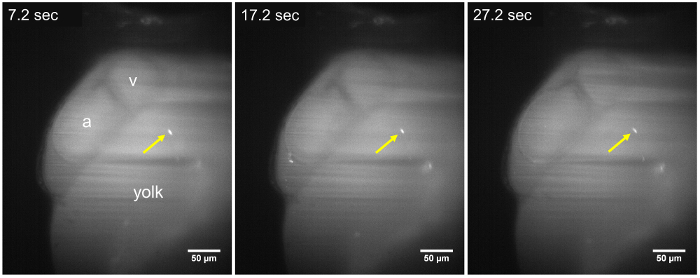
그림 2: 48 hpf 애벌레에 정적 기생충의 LSFM 이미지. T. cruzi 기생충 (노란색 화살표) 남아 시간 경과 시퀀스에 걸쳐 노 른 골목의 벽에 준수 (7.2 s, 17.2 s 및 27.2 s), 기생충 주입 후 약 ~ 15 분. 기생충의 위치에 변화는 적어도 30의 수집 기간 동안 관찰 한, 아 트리 움; 미 v, 심입니다. 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
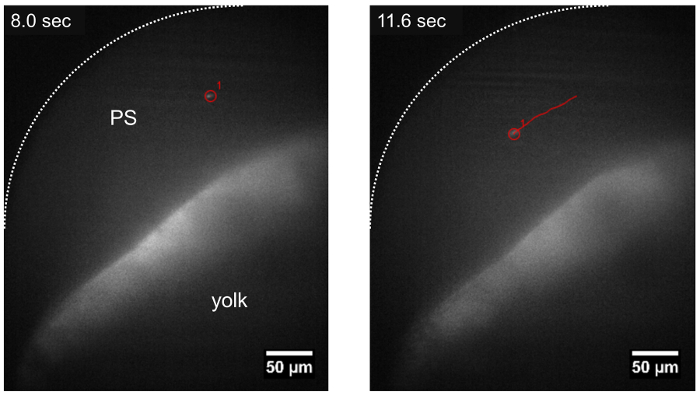
그림 3: LSFM를 사용 하 여 pericardial 공간에서 여행 하는 기생충의 궤적. T. cruzi 기생충 혈 (트랙 빨간색으로 표시)의 방향에 따라 pericardial 공간 (PS)에서 표류 하는 동안 추적할 수 있습니다 기생충 주입 후 약 ~ 15 분. 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
영화 1: 48 유 충에 노른자위의 혈액 순환 밸리 hpf. 영화 48 유 충의 hpf 혈액 순환 밸리 또는 일반 stereoscope를 사용 하 여 어의 덕트를 보여주는. 다른 지역 비디오는 덕트를 통해 순환 적혈구를 표시를 하는 동안 집중 된다. 노란색 화살표는 최적의 주입 사이트를 보여 줍니다. 영화 기록 했다 기생충 주입 후 약 10-15 분. 비디오를 다운로드 하려면 여기를 클릭 하십시오.
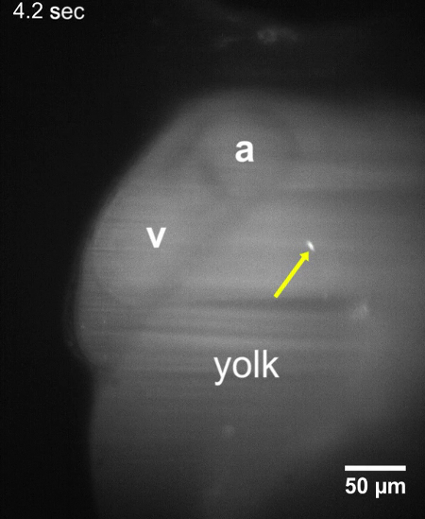
영화 2: T. cruzi 기생충 른 골목의 벽에 부착. LSFM 기생충 주사 후 T. cruzi 기생충 남아 노른자위 sac 약 10-15 분에 준수 애벌레 48 hpf 보여주는 영화. 기생충의 위치에 변화는 적어도 30의 수집 기간 동안 관찰 되었다 s. a, 아 트리 움; v, 심입니다. 비디오를 다운로드 하려면 여기를 클릭 하십시오.

영화 3: T. cruzi 기생충 심장의 벽에 부착. LSFM 영화 48 유 충의 hpf는 T. cruzi 기생충 비를 보여주는n 강한 심장 수축에도 불구 하 고 심장 혈관 벽에 붙어 기생충 주입 후 약 10-15 분. 적혈구 검은 둥근된 그림자로 관찰 될 수 있다. 비디오를 다운로드 하려면 여기를 클릭 하십시오.

영화 4: 기생충 pericardial 공간에서 이동. LSFM pericardial 공간에 떠도는 애벌레 48 hpf 보여주는 T. cruzi 기생충의 영화. 2 기생충 다른 시간 지점 (빨간색 동그라미와 노란색 원에 ID 2: ID 1)에서 비슷한 궤적을 따라 추적할 수 있습니다. 영화 기록 했다 기생충 주입 후 약 10-15 분. 비디오를 다운로드 하려면 여기를 클릭 하십시오.
보충 그림 1: 노 른 자에서 축적의 CFSE 형광 신호. 48에서 주입 wildtype 유 충의 stereoscope 이미지 hpf 어 덕트에서. CFSE 형광 신호 2 일 포스트 주입 (48 hpi) 후 노 른 자에 점차적으로 축적. 눈금 막대 = 500 µ m. 는 그림을 다운로드 하려면 여기를 클릭 하십시오.
보충 영화 1: 벽과 순환 시스템의 밸브에 부착 된 기생충. 48에서 주입 야생 유형 유 충의 stereoscope 시간 시리즈 이미지 hpf. T. cruzi 기생충 것 밸브에서 심장 근육 수축으로 synchrony에서 이동 캡처 0.2 s 간격으로 이미지를 가져옵니다. 영화는 기생충 주입 후 약 30 분을 기록 했다. 비디오를 다운로드 하려면 여기를 클릭 하십시오.
보충 영화 2: 이동 및 준수 기생충 뇌 공간에 노 른 자. LSFM는 애벌레 48 hpf 보여주는 T. cruzi 기생충 표류 또는 pericardial 공간 또는 노른자위에 준수의 영화. 첫 번째 5 전송된 빛 보기 관찰 되었다 s. 형광 볼 5.2 25.8 s에서 관찰 되었다. 영화 기록 했다 기생충 주입 후 약 10-15 분. 비디오를 다운로드 하려면 여기를 클릭 하십시오.
토론
이 연구는 병원 체 행동에서 vivo에서공부에 대 한 동물 모델 zebrafish의 장점 강조 표시 합니다. 특히,이 연구 병원 체 T. cruzi 그것의 자연 환경에서 시각화 하는 방법을 제안: hematic 순환. 물고기에 순환 microenvironment의 환경, 포유류의 비교 이며 trypanosomatids 여행, 면역 시스템을 회피 한 그 환경25에 감염에 대 한 셀에 연결 하기 위한 메커니즘을 진화 했다. 이 프로토콜은 T. cruzi 는 인간 세포 선에서의 문화와 flagellar 형태의 형광 라벨에 대 한 후속 격리에 대 한 최적의 절차의 설명을 제공합니다. 다음 나중에 장착 하 고 LSFM를 사용 하 여 시각화에 대 한 투명 한 zebrafish에 기생충의 성공적인 주입에 대 한 적절 한 설정을 보여 줍니다. 마지막으로,이 프로토콜 기생충 위치 및 LSFM를 사용 하 여 순환에서 운동의 효율적이 고 효과적인 vivo에서 화상 진 찰에 대 한 제안을 제공 합니다.
Trypanosomes의 편 셀 시체에서 흐르는 그 후부 지역에서 나온다 및 정지 유기 체26의 앞쪽 부분에 있습니다. T. cruzi 는 기생충의 전신 undulates 몸, 앞 편 쳐서 자체 추진력을 얻습니다. Flagellar 움직임은 뿐만 아니라 기생충 운동 성, T. brucei27 (아프리카 trypanosomiasis의 원인이 대리인)의 경우에 대 한 필수적인 하지만 그것은 또한 사용 세포 감염, T. cruzi5에서에서 입증 되었습니다. ,28. Zebrafish T. cruzi의 자연 호스트 하지 않더라도, 기생충의 운동 성 여기 설명 된 프로토콜을 사용 하 여 개발 심혈 관 순환 시스템에 공부 될 수 있다. 또한, cyprinids, zebrafish, T. carassii , T. borreli25. 등의 클래스를 감염 trypanosomes 종이 있다 이러한 기생충 종의 움직임 및 이러한 trypanosomatids;의 첨부 파일 메커니즘 실시간으로 공부 하는 데 사용할 수 있습니다. 이러한 연구는 포유류 세포 감염 과정에 대 한 통찰력을 빌려 수 있습니다.
이 연구에서는 운동 T. cruzi 주입 기생충 접종된 물고기의 심장 혈관 순환을 통해 관찰 여행, 불투명 한 적혈구, 함께 이동 그리고 심장 혈관 시스템 벽에 구조를 준수 했다. 우리 긴 작동 거리 10 색 X 집 만든 LSFM를 사용 공기 목표 (17.6 mm) 0.25의 숫자 조리개와 조명 팔. 0.8의 숫자 조리개와 3.5 m m의 작동 거리 apochromatic 물 침수 목표 X 40 감지 팔 사용 되었다. 조명 목표 챔버 외부 동안 검출 목적 샘플 챔버에 몰두 했다. 챔버는 coverslip로 밀봉 및 광학 접착제 로렌조 외. 에서처럼 조명 빔 챔버, 입력에 대 한 허용 포트 18 조명, 우리 50 mW DPSS 레이저 시 사용 488 nm 인 전원 Acousto 광학 가변 필터에 의해 변조 했다. 검색 경로 사용 필터 녹색 형광 단백질 (GFP) 또는 FITC와 호환 됩니다. (이상적으로 자동된 회전)와 모 세관 샘플 홀더를 샘플 챔버의 온도 제어를 갖춘 빛 시트 현미경이 응용이 프로그램에 적합 해야 합니다. 현미경 정렬 하 고 필요한 경우 제조업체의 지침 또는 수집 하기 전에 사용자의 실험실 표준 프로토콜에 따라 보정 해야 합니다. 이 프로토콜에서 우리 SPIM 소프트웨어19를 사용 하 여 현미경 제어.
Zebrafish의 순환에 애벌레 기생 첨부는 효과가 중요 하다. 추기경 맥락에서 기생충 남아 몇 분;에 대 한 연결 에, 그들은 밸브와 벽, 심장 수축과 진동 개최. T. cruzi 혈액 흐름의 방향으로 드리프트 흐르는 적혈구와 상호 작용 하는 여부를 명료 하 게 하기 위해 추가 연구가 남아 있다. 이전 체 외에서 연구 것으로 나타났습니다 (즉, 혈액 세포), 단단한 구조의 존재 또는 생체 외에서혈액을 모방 하는 액체의 증가 된 점도, 운동 성 및 기생충의 속도에 중요 한 영향 9.
Amastigotes phagocytic 세포, 처음 감염 된 세포 유형29탈출 후 인간에서 T. cruzi 의 감염의 과정에 관한 많은 질문이 있다. 예를 들어, 그들이 어떻게 그들의 표적 기관에 도착 합니까? 기본 장기, 심장, 소화, 및 중앙 신경 시스템에 차 있는 굴곡 운동에 대 한 메커니즘은 무엇입니까? 흥미롭게도,이 연구는 기생충 했다 처음 몇 군데 마음에 기생충의 높은 밀도의 사이트 때문에. 그러나, CFSE 신호 이후 축적 된 개발 소장에 7 일 게시물 주입. 물고기와 포유류의 해부학은 다른,이 연구의 결과 기생충 전시 organismal 차이도 불구 하 고 알려진된 선호 대상 기관으로 차 있는 굴곡 운동 관찰로 차 있는 굴곡 운동의 형태를 보여줍니다. 이 연구의 1 개의 중요 한 한계는 실험에 사용 되는 온도 염려 한다. Zebrafish 애벌레 전체 절차 동안 약 28 °C에 보관 한다. 이 온도 벡터 호스트 (Triatominae subfamily의 곤충)에 비슷한 수 있습니다, 하지만 그것은 매우 최종 호스트 (약 37 ° C)를 구성 하는 온 혈 포유류 다릅니다. T. cruzi 는 두 호스트; flagellar 생활 양식 있는 알려져 있다 그러나, 곰 염두에 두고이 요소에 비보동물 행동에 영향을 미칠 수 있습니다 중요 하다.
Fish´s 적응형 면역 시스템은 아니지만 성숙 4 주 게시물 수정 될 때까지, 타고 난 면역 계통은 초기 개발10에 활성화 됩니다. 빠르면 48 또는 96 hpf, phagocytic 세포 trypanosomes (데이터 표시 되지 않음) 표시 잠겼습니다 데 관찰 되었다. 이 기생충의 시각화를 위한 시간 창을 제한합니다. 그러나, 연구는 fish´s 면역 반응을 평가에 초점을, 나중 단계에서 주입 권장 수 있습니다. 또한, 레이블이 지정 된 대 식 세포와 유전자 변형 물고기 라인으로 기생충의 주입 또는 면역 시스템의 다른 셀 기생충 첨부 파일 및 가능한 endocytosis 메커니즘을 공부 하는 데 유용 수 있습니다. 그것은 기생충 CFSE 표시 됩니다, 유전자 변형 셀 라벨 해서는 안됩니다 GFP, 스펙트럼의 노란색 또는 빨간색 끝에 마커 필요한 경우 유의 해야 합니다.
기생충 운동의 상세한 방향을 평가 하기 위해 3 차원 (3D) 그들의 궤적을 따라 유용할 수 있습니다. 3D 시각화 및 프로세스의 재건, 대 한 고속 시스템 필요 하다. 이 프로토콜에 사용 되는 장비와 함께 하나의 평면에 기생충을 시각화 수는 만입니다. 이 경우에, 우리가 우선 기생충 운동 동안 초점면 안정성을 유지 하 고 한 평면에서의 궤적을 기록.
여기에 제안 된 방법론 추가 심혈 관 순환에 기생충 행동을 조사 하는 방법은 불법 체류자. 요약 하자면, zebrafish 애벌레 내부 라이브 형광 기생충 이미징 필수 단계는:(i)의 사용 초기 빗금된 배아 (24-48 hpf) 또는 애벌레, 또는 아무 염색으로 72 96 hpf 사이 동물 그렇게 그들은 투명 하 고 쉽게 주사; (ii) 이미지 애벌레 phagocytic 세포; 기생충 정리를 피하기 위해 주입 후 즉시 그리고 (iii) LSFM (예를 들어, pericardial 지역)의 사이트에 집중 하 고 초점을 유지. 이 새로운 절차 수 있습니다 trypomastigotes의 시각화를 환경에서 처음으로 제공 하는 살아있는 유기 체에서 T. cruzi 공부 가능성, 그것의 자연 감염 틈새에 비해.
공개
저자는 공개 없다.
감사의 말
이 작품은 Vicerrectoría 드 Investigaciones 드 라 대학 데 로스 안데스 산맥, 그리고 졌는 지 연구와 혁신 친목 프로그램에서 Convocatoria Interfacultades 에 의해 지원 되었다. 우리 물고기 유지 보수 및 지원에 대 한 후안 라파엘 뷔 타고와 Yeferzon Ardila 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Micropipette | Fisherbrand | 21-377-815 | |
| Agarose RA | Amresco | N605 | Regular |
| Agarose SFR | Amresco | J234 | Low Melting point |
| Aquarium salt | Instant ocean | SS15-10 | |
| Cell Count chamber | Boeco | Neubauer | |
| Cell culture flasks | Corning | 430639 | |
| Centrifuge | Sorvall | Legend RT | |
| CFSE | ThermoFisher | C34554 | |
| Detection objective | Nikon 40x 0.8NA | 40x CFI APO NIR | |
| DMEM medium | Sigma-Aldrich | D5648 | |
| Dumont #5 fine forceps | World precision Instruments | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Fetal calf serum (FCS) | Eurobio | CVFSVF00-01 | |
| Filter | Chroma | ET-525/50M | |
| Glass capillaries for embryo mounting | Vitrez Medical | 160215 | |
| Glass capillaries for pulling needles | World precision instruments | TW100-4 | |
| Glucose | Gibco | A2494001 | |
| HEPES | Gibco | 156300-80 | |
| Incubator | Thermo Corporation | Revco | |
| Larval microinjection mold | Adaptive Science Tools | I-34 | |
| Laser | Crystalaser | DL488-050 | |
| L-glutamine | Gibco | 250300-81 | |
| Methylene blue | Albor Químicos | 12223 | |
| Micromanipulator | Narishige | MN-153 | |
| Micromanipulator system | Sutter Instrument | MP-200 | For LSFM |
| Micropipette puller device | Narishige | PC-10 | |
| Microscope | Olympus | CX31 | |
| Microscope (inverted) | Olympus | CKX41 | |
| Multipurpose microscope | Nikon | AZ100M | |
| Neubauer counting chamber | Boeco Germany | ||
| Penicillin-streptomycin | Gibco | 15140-163 | |
| Petri dish 94x16 | Greiner bio-one | 633181 | |
| Plastic pasteur pipette | Fisherbrand | 11577722 | |
| Rotation stage | Newport | CONEX-PR50CC | |
| RPMI-1640 medium | Sigma-Aldrich | R4130 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Stereoscope | Nikon | C-LEDS | |
| Tricaine (MS-222) | Sigma-Aldrich | 886-86-2 | |
| TRIS | Amresco | M151 | |
| Trypsin-EDTA (0.25%) | Gibco | R-001-100 | |
| Tubes 15 ml | Corning | 05-527-90 |
참고문헌
- Bern, C. Chagas's Disease. New England Journal of Medicine. 373 (5), 456-466 (2015).
- Sosa Estani, S., Segura, E. L., Ruiz, A. M., Velazquez, E., Porcel, B. M., Yampotis, C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. The American Journal of Tropical Medicine and Hygiene. 59 (4), 526-529 (1998).
- Rosas, F., Roa, N., Cucunuba, Z. M., Cuellar, A., Gonzalez, J. M., Puerta, J. C. Chagasic Cardiomyopathy. Cardiomyopathies - From Basic Research to Clinical Management. , (2012).
- Finkelsztein, E. J., et al. Altering the motility of Trypanosoma cruzi with rabbit polyclonal anti-peptide antibodies reduces infection to susceptible mammalian cells. Experimental Parasitology. 150, 36-43 (2015).
- Martins, R. M., Covarrubias, C., Rojas, R. G., Silber, A. M., Yoshida, N. Use of L-Proline and ATP Production by Trypanosoma cruzi Metacyclic Forms as Requirements for Host Cell Invasion. Infection and Immunity. 77 (7), 3023-3032 (2009).
- Engstler, M., et al. Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. 131 (3), 505-515 (2007).
- Uppaluri, S., et al. Impact of Microscopic Motility on the Swimming Behavior of Parasites: Straighter Trypanosomes are More Directional. PLoS Computational Biology. 7 (6), e1002058 (2011).
- Heddergott, N., et al. Trypanosome Motion Represents an Adaptation to the Crowded Environment of the Vertebrate Bloodstream. PLoS Pathogens. 8 (11), e1003023 (2012).
- Gratacap, R. L., Wheeler, R. T. Utilization of zebrafish for intravital study of eukaryotic pathogen–host interactions. Developmental & Comparative Immunology. 46 (1), 108-115 (2014).
- Meijer, A. H., Spaink, H. P. Host-Pathogen Interactions Made Transparent with the Zebrafish Model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Huisken, J. Slicing embryos gently with laser light sheets. BioEssays. 34 (5), 406-411 (2012).
- Westerfield, M. . The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Vargas-Zambrano, J. C., Lasso, P., Cuellar, A., Puerta, C. J., González, J. M. A human astrocytoma cell line is highly susceptible to infection with Trypanosoma cruzi. Memórias do Instituto Oswaldo Cruz. 108 (2), 212-219 (2013).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. JoVE (Journal of Visualized Experiments). (25), e1115-e1115 (2009).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6, 22 (2011).
- Edelstein, A. D., Tsuchida, M. A., Amodaj, N., Pinkard, H., Vale, R. D., Stuurman, N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 1 (2), e10 (2014).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer Mounting for Long-term Light Sheet Microscopy of Zebrafish. Journal of Visualized Experiments. (84), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ng, A. N. Y., et al. Formation of the digestive system in zebrafish: III. Intestinal epithelium morphogenesis. Developmental Biology. 286 (1), 114-135 (2005).
- Higuchi, M. D. L., et al. Correlation between Trypanosoma cruzi parasitism and myocardial inflammatory infiltrate in human chronic chagasic myocarditis: Light microscopy and immunohistochemical findings. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 2 (2), 101-106 (1993).
- Vago, A. R., Silva, D. M., Adad, S. J., Correa-Oliveira, R., d'Avila Reis, D. Chronic Chagas disease: presence of parasite DNA in the oesophagus of patients without megaoesophagus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 97 (3), 308-309 (2003).
- Wiegertjes, G. F., Forlenza, M., Joerink, M., Scharsack, J. P. Parasite infections revisited. Developmental & Comparative Immunology. 29 (9), 749-758 (2005).
- De Souza, W. Basic cell biology of Trypanosoma cruzi. Current Pharmaceutical Design. 8 (4), 269-285 (2002).
- Langousis, G., Hill, K. L. Motility and more: the flagellum of Trypanosoma brucei. Nature Reviews. Microbiology. 12 (7), 505-518 (2014).
- Johnson, C. A., et al. Cellular response to Trypanosoma cruzi infection induces secretion of defensin α-1, which damages the flagellum, neutralizes trypanosome motility, and inhibits infection. Infection and Immunity. 81 (11), 4139-4148 (2013).
- Magalhães, L. M. D., Viana, A., Chiari, E., Galvão, L. M. C., Gollob, K. J., Dutra, W. O. Differential Activation of Human Monocytes and Lymphocytes by Distinct Strains of Trypanosoma cruzi. PLoS neglected tropical diseases. 9 (7), e0003816 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유